PSF蛋白抑制剂、药物组合物及其应用
psf蛋白抑制剂、药物组合物及其应用
技术领域
1.本发明涉及药物生产领域,具体提供一种psf蛋白抑制剂、药物组合物及其应用。
背景技术:
2.据2019年世界卫生组织统计,癌症是目前112个国家的第一或第二大死因,以及23个国家人口的第三或第四大死因。传统的癌症治疗方式主要以手术、放疗和化疗为主。自上世纪90年代末以来,人们逐渐认识到对经典细胞毒性药物的微调已经不能提高生存率。与传统的化疗药物相比,针对肿瘤的特异性靶点设计的抗肿瘤药物具有特异性强、疗效明显、对正常组织损伤少等优点。时至今日,癌症靶向药物已经成为癌症治疗的主要药物,寻找新的靶向蛋白及相关抑制剂也是抗癌药物领域最重要的研究方向之一。
3.多聚嘧啶束结合蛋白相关剪接因子(psf ptb-associated splicing factor,也称为sfpq splicing factor proline-and glutamine-rich),是一种包含串联特异性dna和rna结合域的蛋白质,参与多种核过程。在多种细胞中可对基因表达、选择性剪接、dna修复、mrna和端粒稳定性以及核酸代谢的其他过程发挥关键作用。因为其与多种疾病紧密相关,近年来研究逐渐增多,在肿瘤学领域也是被认为最有希望成为抗癌靶点的蛋白之一。
4.由于在哺乳动物各种细胞中psf广泛存在,甚至可能存在于细胞的不同部位,所以完整系统的研究其与癌症的关系是困难的。尽管尚未有统一的理论产生,但有2点实验事实是公认的。第一,游离的psf蛋白在癌细胞中的浓度明显高于正常细胞。第二,阻止psf蛋白与rna的结合可以治疗癌症。基于这2点实验事实,psf蛋白选择性抑制剂至少具有3大明显优势,首先正常细胞游离的psf蛋白很少,故此psf蛋白选择性抑制剂对正常细胞影响很小,对癌细胞的抑制作用具有选择性。其次游离的psf 蛋白在多种癌细胞中普遍存在,抑制剂大概率具有较广的抗癌谱,对多种癌症尤其是对现阶段无特效药的癌症的治疗带来新的希望。再次,psf蛋白选择性抑制剂与现有的癌症治疗方法其机制完全不同,可以与其他癌症治疗方法联合使用增强治疗效果。故此针对癌细胞中的psf蛋白,设计选择性抑制剂阻止psf蛋白与rna的结合作为一种全新的靶向治疗方法对治疗癌症具有重要意义。
5.目前没有psf蛋白抑制剂的相关专利,本发明化合物有助于满足此类需要。
技术实现要素:
6.本发明是针对上述现有技术的不足,提供一种psf蛋白抑制剂、药物组合物及其应用。
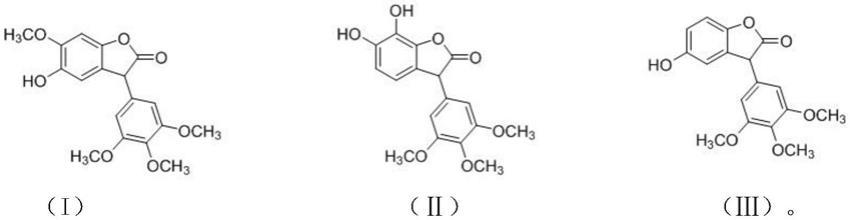
7.本发明解决其技术问题所采用的技术方案是:psf蛋白抑制剂,包括结构式(i) 和/或结构式(ⅱ)和/或结构式(ⅲ)所示的3-芳基苯并呋喃酮类化合物:
[0008][0009]
申请人发现,式(i)、式(ⅱ)、式(ⅲ)化合物均能够抑制psf蛋白与rna 结构域结合,可制备psf蛋白抑制剂,用于抑制癌细胞生长,还可用于在过表达psf 蛋白的细胞中抑制细胞生长。
[0010]
进一步的,式(i)、式(ⅱ)、式(ⅲ)化合物还可以应用于制备预防和/或治疗哺乳动物癌症的药物。所述癌症包括前列腺癌、乳腺癌、神经母细胞瘤、肠癌诸如直肠癌、结肠癌、家族性腺瘤性息肉癌及遗传性非息肉性结肠直肠癌、食道癌、唇癌、喉癌、下咽癌、舌癌、唾液腺癌、胃癌、腺癌、甲状腺髓样癌、乳头状甲状腺癌、肾癌、肾实质癌、卵巢癌、子宫颈癌、子宫体癌、子宫内膜癌、绒毛膜癌、胰腺癌、睪丸癌、泌尿系统癌、黑素瘤、脑瘤诸如胶质母细胞瘤、星形细胞瘤、脑膜瘤、髓母细胞瘤及周围神经外胚层瘤、霍奇金淋巴瘤、非霍奇金淋巴瘤、伯基特淋巴瘤、急性淋巴性白血病(all)、慢性淋巴性白血病(cll)、急性髓性白血病(aml)、慢性髓性白血病(cml)、成人t-细胞白血病淋巴瘤、肝细胞癌、胆囊癌、支气管癌、小细胞肺癌、非小细胞肺癌、多发性骨髓瘤、基底细胞瘤、畸胎瘤、视网膜母细胞瘤、脉络膜黑素瘤、精原细胞瘤、横纹肌肉瘤、颅咽瘤、骨肉瘤、软骨肉瘤、肌肉瘤、脂肪肉瘤、纤维肉瘤、尤因肉瘤及浆细胞瘤。
[0011]
进一步的,所述药物组合物,含有治疗有效量的结构式(i)和/或结构式(ⅱ) 和/或结构式(ⅲ)所示化合物、或其可药用的盐,以及药学上可接受的辅料。
[0012]
结构式(i)和/或结构式(ⅱ)和/或结构式(ⅲ)所示化合物在所述药物组合物中的剂量为0.01~1000mg/kg,优选为1~100mg/kg。
[0013]
所述辅料包括一种或多种药学上可以接受的载体。所述载体包括药学领域常规的稀释剂、赋形剂、填充剂、黏合剂、润湿剂、崩解剂、助流剂、吸收促进剂、表面活性剂、吸附载体、润滑剂、矫味剂、包合材料、吸附材料等。
[0014]
所述药物组合物可以经口服或非口服等形式使用,如可通过注射、喷射、滴鼻、滴眼、渗透、吸收、物理或化学介导的方法导入机体如肌肉、皮内、皮下、静脉、粘膜组织;或是被其他物质混合或包裹后导入机体。
[0015]
用于口服时,可以将其制成常规的固体制剂,如颗粒剂、散剂、片剂、胶囊剂、丸剂、口服液、汤剂、滴丸剂等。
[0016]
与现有技术相比,本发明的psf蛋白抑制剂,具有较好的psf蛋白抑制活性及良好的药代动力学性质,有望开发为新一代高效低毒的psf蛋白抑制剂。
具体实施方式
[0017]
下面结合具体实施例对本发明作进一步说明,但不作为对本发明的限定。
[0018]
如无特别说明,下述所用各成分的含量为质量百分比含量。
[0019]
本发明实施例中涉及的化合物编号及结构式如下:
[0020][0021]
实施例1.分子对接研究
[0022]
使用ds(discovery studio)将化合物分别与psf蛋白精准对接,根据对接得分结果筛选出活性较好的化合物。
[0023]
(1)蛋白的准备
[0024]
所需蛋白结构从pdb网站下载(4wii),预处理对接所需蛋白采用ds内置的 clean protein和prepare protein方法,该操作可除去蛋白的多种构象、补充非完整的氨基酸残基以及为蛋白加氢等。保留蛋白结合口袋中的水以及内源性配体,其他参数设置均为默认参数。经过预处理的的化合物小分子作为配体,经过预处理且定义好活性位点的蛋白结构作为受体,其余设置保持默认。
[0025]
(2)小分子的准备
[0026]
采用ds内置的prepare ligands方法,设置不生成互变异构与同分异构体,质子化ph值设置为7,其余参数均为默认参数。
[0027]
(3)分子对接
[0028]
使用accelrys discovery studio 2019(ds,accelrys software inc.,san diego, ca,usa)libdocker对接规程进行表一所示化合物的对接。
[0029]
通过discovery studio对接psf蛋白与小分子,进行对比,式(ⅰ)、(ⅱ)和(ⅲ)化合物得分均高于4-(4
’‑
甲氧基苯基)-1,8-二羟基香豆素。
[0030]
表一:化合物与psf蛋白对接得分
[0031][0032]
实施例2.rnapull-down实验
[0033]
将带有荧光标记的psf质粒导入大肠杆菌细胞,培养大肠杆菌,等待psf蛋白过表达后,粉碎细胞,取细胞裂解液,与化合物混合孵育5小时,用westblot检测psf 蛋白与ctbp1-as探针结合情况。如果检测psf蛋白颜色较浅证明先导化合物抑制有效。
[0034]
1.步骤
[0035]
(1)质粒转化:取感受态细菌80μl,加入1.5miep管中,用10μl枪头沾取质粒加入上述ep管中,混匀,冰上静置30min。42℃热休克90-120s,迅速移至冰上静置 2min。在超净台内,于上述ep管中加入50μl lb培养基(amp-),37℃,160rpm摇床1h。菌液4,000rpm离心10min,弃大部分上清将沉淀重悬,菌液全部加入lb平板 (amp+)上,涂布均匀,37℃倒置培养(过夜12-15h)。
[0036]
(2)裂解细胞:用细胞刮将细胞刮下来,在1500rpm,4℃离心5min收集细胞;加入1ml细胞裂解液与式(ⅰ)、(ⅱ)和(ⅲ)化合物混合孵育5小时,使用前每毫升裂解液加入10ul蛋白酶抑制剂,吹打均匀后于4℃冰箱翻转裂解1-2h,通过12000rpm离心15min。
[0037]
(3)磁珠与探针孵育:重悬磁珠,标记实验所需的无rna酶1.5ml ep管,包括目的探针正反义链组,空磁珠组(分组:target
+
,target-,beads);吸取50ul重悬后的磁珠悬液去上清,每管中加入500ul,涡旋振荡10s清洗磁珠,短暂离心后置于磁力架上;用500ul的结合液重悬磁珠,加入1-2ug探针于相应ep管中,封口后置于4℃冰箱翻转孵育6-8小时。
[0038]
(4)磁珠探针与裂解液孵育:将磁珠探针混合物短暂离心后置于磁力架上待液体澄清后去上清,用500ul结合液清洗磁珠,然后依次加入试剂;加入细胞裂解液(beads 组不加裂解液),封口置于4℃冰箱翻转孵育过夜,剩余裂解液作为input组;过夜孵育的混合物短暂离心后置于磁力架上,待液体澄清后去上清,加入1ml洗涤液清洗磁珠。
[0039]
(5)蛋白产物洗脱:于每组(包括input组和beads组)中分别加入30-40ul洗涤液和 10ul 6x加样缓冲液于100℃煮10min,短暂离心后置于磁力架上,取上清至新的 ep管中,进行wb检测。
[0040]
2.结果
[0041]
用westblot检测出的psf蛋白颜色较浅,证明证明式(ⅰ)、式(ⅱ)或式(ⅲ)所示的化合物可以抑制psf蛋白与rna结合。
[0042]
实施例3.药理活性实验
[0043]
检测本发明化合物对人肺癌细胞株h1299细胞活性的抑制效应
[0044]
1.实验方法:
[0045]
使用mtt法检测式(ⅰ)、(ⅱ)和(ⅲ)化合物对h1299细胞存活率的影响,检测原理为活细胞能使外源性mtt还原为蓝紫色结晶甲瓒并沉积在细胞中,而死细胞无此功能,dmso能溶解细胞中的甲瓒,用酶标仪在490nm波长处测定其吸光度值,在一定细胞数范围内,mtt结晶形成的量与细胞数成正比,根据测得的吸光度值,来判断活细胞数量,吸光度值越大,细胞活性越强,表示药物抑制作用越小。
[0046]
2.耗材及试剂:
[0047]
rpmi-1640培养基(gibco)、胎牛血清(gibco)、抗生素(青霉素-链霉素),人肺癌细胞株h1299(在包含有10%热灭活胎牛血清的1640培养基中培养),96孔透明平底细胞培养板,pbs,dmso,mtt溶液。
[0048]
3.步骤
[0049]
(1)胰酶消化对数期细胞,终止后离心收集,制成细胞悬液,细胞计数调整其浓度至7
×
104/ml。
[0050]
(2)制备细胞板:将细胞悬液制备好后,轻轻混匀,加入96孔板中,每孔加入100μl,这样待测细胞的密度为7000/孔(边缘孔用无菌pbs填充)。将接种好的细胞培养板放入培养箱中培养12h.
[0051]
(3)制备被测的式(ⅰ)、式(ⅱ)和式(ⅲ)化合物溶液:用dmso溶解被测化合物制成 0.1mol/l的母液,并用含有5%fbs的培养基进行2倍梯度稀释,6个化合物浓度,设置四复孔实验,平行重复实验3次。化合物起始浓度为100μm。
[0052]
(4)化合物处理细胞:将各浓度的化合物转移到细胞板中。并在5%co2,37℃培养箱中孵育48小时,显微镜下观察药物的作用效果。
[0053]
(5)配制mtt溶液(终浓度为5mg/ml,用pbs做溶剂),配制和保存的过程中避光且保持无菌,现用现配。向细胞板中每孔加入mtt试剂10μl,孵育4h。
[0054]
(6)终止培养,溶解结晶:将上清去掉,每孔加入150ul二甲基亚砜,置摇床上低速振荡10min,使结晶物充分溶解。使用酶标仪测量在490nm处的吸光值,并根据公式计算出细胞抑制率。
[0055]
计算公式:抑制率(%)=1-加药组od值/对照组od值
[0056]
(7)采用分析软件ibm spss从而得出化合物对细胞抑制的ic50值,测试结果见表 2。
[0057]
表2:化合物对细胞抑制的ic50值
[0058]
化合物ic50(μmol/l),h1299)
式(ⅰ)35.512
±
0.6式(ⅱ)46.124
±
1.185式(ⅲ)32.504
±
0.557
[0059]
由以上实施例可知,式(ⅰ)、(ⅱ)和(ⅲ)化合物对h1299有很强的抑制活性,通过抑制psf蛋白与rna结合等多种途径发挥作用,可以作为治疗肿瘤的药物。
[0060]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1