一种具有抗肿瘤活性化合物及其制备方法与应用
1.本发明涉及药物化学领域,特别是一种具有抗肿瘤活性化合物及其制备方法与应用。
背景技术:
2.癌症又称为恶性肿瘤,是一种严重威胁人类健康的恶性和常见疾病,已成为继心血管疾病后威胁人类健康的“第二大杀手”。
3.现有抗癌药物存在一些对正常细胞毒性强,选择性差,易产生耐药性等问题。例如,著名的抗癌药物多柔比星和紫杉醇对肝癌细胞和正常肝细胞的选择性指数被报道仅在2以下;多种乳腺癌细胞对抗乳腺癌药物他莫西芬耐药等,这些问题都成为了化疗的阻碍。
4.人工通道是化学家基于对天然膜通道的模拟开发的一类化合物。因人工通道作用于细胞膜,赋予了其不宜产生耐药性、广谱抗癌活性强等特点。我们基于针对上述抗癌药物的缺点结合胆酸具有肝肠靶向性等特点,拟开发一类具有高选择性和高抗癌活性的人工通道。
技术实现要素:
5.为此,需要提供一种具有抗肿瘤活性化合物及其制备方法与应用,解决现有肿瘤药毒副作用明显,选择性差,易产生耐药性的问题。
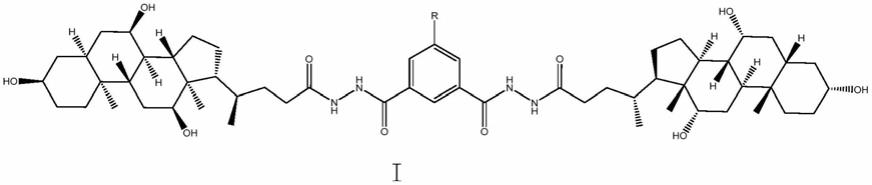
6.为实现上述目的,本发明提供了一种具有抗肿瘤活性化合物,化学结构如结构式i所示:
[0007][0008]
或该化合物的立体异构体、其前药、其药学上可接受的盐或其药学上可接受的溶剂合物;
[0009]
其中,r1选自:-o(ch2ch2o)
n-h,-oc
nh2n+1
,-oh,-nh2,-h,-f,-cl,-br,
ꢀ‑
i,-sh,-nr2,-coor。
[0010]
本发明还公开了上述抗肿瘤活性化合物的制备方法。
[0011]
本发明还公开了上述抗肿瘤活性化合物在抗肿瘤药物的应用。
[0012]
上述技术方案具有以下有益效果:
[0013]
本发明公开了一类抗肿瘤活性化合物,具有较高的生物活性,能够有效抑制肿瘤细胞增殖,具有重大的药物研发潜力,可作为先导化合物用于抗癌药物的开发。测试了化合物的通道活性和离子传输性能,发现该类化合物均具有较好的人工通道活性。细胞增殖抑制实验发现,目标化合物显示出较好的抗肝癌活性和对肿瘤细胞的高活性、高选择性,对正
常肝细胞的选择性指数可达18以上,对红细胞的选择性指数可达38以上,对正常肾细胞的选择性指数大于130。后续的抗癌机制研究发现,这类化合物在体外实验中,可以明显增强癌细胞通透性,破坏细胞膜的完整性;这类化合物亦可促进凋亡启动子的表达升高,抑制抗凋亡蛋白的表达。
附图说明
[0014]
图1为化合物(左一)在胆固醇(左二)协助下能自组装形成人工通道的结果图,包括侧视图(右一)和俯视图(右二);
[0015]
图2为通道分子(8μm)诱导的荧光染料(λ
ex
=492nm,λ
em
=517nm)的荧光强度随胆固醇含量变化示意图;
[0016]
图3为化合物诱导的cf染料荧光强度随时间变化图。
[0017]
图4为激光共聚焦显微镜拍摄的荧光图像。
[0018]
图5为不同浓度的化合物对hepg2细胞中凋亡相关蛋白水平的影响。
具体实施方式
[0019]
为详细说明技术方案的技术内容、构造特征、所实现目的及效果,以下结合具体实施例并配合附图详予说明。
[0020]
一种具有抗肿瘤活性化合物,化学结构如结构式i所示:
[0021][0022]
或该化合物的立体异构体、其前药、其药学上可接受的盐或其药学上可接受的溶剂合物;
[0023]
其中,r1选自:-o(ch2ch2o)
n-h,-oc
nh2n+1
,-oh,-nh2,-h,-f,-cl,-br,
ꢀ‑
i,-sh,-nr2,-coor。
[0024]
进一步,r1选自-oc
nh2n+1
时,优选的n为1、2、4、6、或8,具体制备过程如下:
[0025][0026]
实施例1
[0027]
制备目标产物ch-c1
[0028]
(1)中间体5-甲氧基间苯二甲酸二甲酯(a1)的合成
[0029][0030]
将5-羟基间苯二甲酸二甲酯(312mg,2.0mmol)、碘甲烷(0.25ml,4.0 mmol)和碳酸钾(414mg,3.0mmol)在dmf(20ml)中的悬浮液在85℃下加热12小时。真空除去溶剂得到粗产物,将其溶解在二氯甲烷(50ml)中,用水(50ml
×
3)洗涤并通过硅胶柱(乙酸乙酯:正己烷=1:8)纯化以提供纯的产物 a1为白色固体。产率:381mg,85%。
[0031]1h nmr(400mhz,cdcl3)δ8.26(t,j=1.4hz,1h),7.74(d,j= 1.3hz,2h),3.93(s,6h),3.88(s,3h).
13
c nmr(100mhz,cdcl3)δ 166.19,159.67,131.75,122.96,119.29,55.81,52.47.ms-esi: calculated for[m+h]
+
(c11h13o5):m/z 225.08,found:m/z 225.22.
[0032]
(2)中间产物b1
[0033][0034]
将5-甲氧基间苯二甲酸二甲酯(a1)(90mg,0.4mmol)溶解在热甲醇(15 ml)中向其中加入水合肼(0.4ml)。将反应混合物加热回流8小时。真空除去溶剂得到粗产物b1,其无需进一步纯化直接使用
[0035]
(3)目标化合物ch-c1的合成
[0036][0037]
步骤(2)中b1其无需进一步纯化直接使用。将b1(0.4mmol)、胆酸(327 mg,0.8mmol)和bop(389mg,0.88mmol)溶解在dmf(10ml)中,向其中加入diea(0.31ml,1.8mmol)。使反应在室温下搅拌14小时。真空除去有机溶剂后,加入乙腈(100ml)以沉淀出粗产物,将其通过制备型hplc进一步纯化,得到呈白色固体状的纯产物ch-cl。产量:26mg,6.2%。1h nmr(400mhz,dmso-d6) δ10.41(s,2h),9.92(s,2h),7.97(s,1h),7.59(d,j=1.3hz,2h), 4.36(d,j=4.3hz,2h),4.16(d,j=3.4hz,2h),4.05(d,j=3.3 hz,2h),3.88(s,3h),3.81(d,j=2.7hz,2h),3.63(s,2h),3.19 (dd,j=15.2,10.7hz,2h),2.28
–
1.94(m,10h),1.86
–
1.59(m, 12h),1.52
–
1.17(m,23h),0.98(d,j=6.4hz,7h),0.86
–
0.76 (m,8h),0.62(s,6h).
13
c nmr(100mhz,dmso-d6)δ172.46,165.11, 159.58,134.64,119.70,116.28,71.48,70.90,66.70,56.18,46.62, 46.23,41.97,41.86,35.78,35.61,35.35,34.86,31.98,30.86,29.03, 27.80,26.67,23.31,23.11,17.55,12.87.ms-esi:calculated for[m+h]
+ (c
57h89o11
n4):m/z 1005.65,found:m/z 1005.85.
[0038]
ch-c2-ch-c8,ch-h的制备与ch-c1类似。
[0039]
ch-c2:1h nmr(400mhz,dmso-d6)δ10.40(s,2h),9.92(s,2h), 7.96(s,1h),7.57(d,j=1.2hz,2h),4.18
–
4.12(m,2h),3.81(s, 4h),3.61(t,j=9.4hz,8h),2.29
–
1.97(m,10h),1.86
–
1.62(m, 12h),1.46
–
1.19(m,26h),1.04
–
0.91(m,7h),0.87
–
0.78(m, 8h),0.62(s,6h).
13
c nmr(100mhz,dmso-d6)δ170.30,162.98,156.70, 132.48,117.47,114.57,69.33,68.75,64.56,62.07,46.93,44.48,44.08, 39.83,39.72,33.63,33.46,33.21,32.72,29.84,28.71,26.88,25.65, 24.53,21.16,20.97,15.40,12.88,10.72.ms-esi:calculated for[m+h]
+ (c
58h91o11
n4):m/z 1019.67,found:m/z 1019.87.
[0040]
ch-c4:1h nmr(400 mhz,dmso-d6)δ10.40(s,2h),9.92(s,2h),7.96 (s,1h),7.58(s,2h),4.09(t,j=6.1 hz,2h),3.82(s,4h),3.63 (s,8h),2.21
–
1.97(m,10h),1.81
–
1.65(m,12h),1.49
–
1.22 (m,26h),0.97(dd,j=9.4,6.8 hz,11h),0.84(d,j=10.7 hz,8h), 0.62(s,6h).13c nmr(100 mhz,dmso-d6)δ172.45,165.12,159.01, 134.61,119.65,116.74,71.48,70.90,68.25,66.71,49.07,46.62,46.23, 41.98,41.86,35.78,35.61,35.35,34.86,31.98,31.07,30.86,29.03, 27.80,26.67,23.31,23.11,19.17,17.55,14.17,12.87.ms-esi: calculated for[m+h]
+
(c
60h95o11
n4):m/z 1047.70,found:m/z 1047.96.
[0041]
ch-c6:1h nmr(400 mhz,dmso-d6)δ10.41(s,2h),9.93(s,2h),7.97 (s,1h),7.59(d,j=1.2 hz,2h),4.09(d,j=6.4 hz,2h),3.83(s, 2h),3.64(s,2h),3.49(br,6h),3.25
–
3.19(m,2h),2.26
–
1.97 (m,10h),1.85-1.65(m,14h),1.45-1.20(m,27h),1.01
–
0.80(m, 20h),0.62(s,6h).
13
c nmr(100 mhz,dmso-d6)δ172.45,165.11,159.01, 134.60,119.64,116.73,71.48,70.90,68.53,66.71,46.62,46.23,41.98, 41.86,35.78,35.61,35.36,34.86,31.98,31.43,30.86,29.03,28.98, 27.80,26.67,25.61,23.31,23.11,22.58,17.55,14.41,12.87.ms-esi: calculated for[m+h]+(c
62h99o11
n4):m/z 1075.73,found:m/z 1075.98.
[0042]
ch-c8:1h nmr(400 mhz,dmso-d6)δ10.41(s,2h),9.93(s,2h), 7.97(s,1h),7.59(s,2h),4.10(t,j=6.2 hz,2h),3.83(s,2h), 3.64(s,2h),3.52(br,6h),3.26
–
3.16(m,2h),2.26-2.01(m,10h), 1.85-1.66(m,14h),1.45
–
1.23(m,31h),1.03
–
0.81(m,20h), 0.63(s,6h).13c nmr(100 mhz,dmso-d6)δ172.45,165.11,159.01, 134.60,119.64,116.73,71.48,70.90,68.53,66.71,46.63,46.23,41.98, 41.86,35.78,35.60,35.35,34.86,31.98,31.72,30.86,29.19,29.17, 29.02,27.80,26.67,25.94,23.31,23.11,22.58,17.55,14.46,12.87. ms-esi:calculated for[m+h]
+
(c
64h103o11
n4):m/z 1103.76,found:m/z 1104.07.
[0043]
实施例2
[0044]
目标化合物ch-o1的结构式如下:
[0045][0046]
将a1中甲基侧链改为乙二醇侧链取代,向其中加入水合肼(0.5ml)。将反应混合物加热回流8小时。真空除去溶剂得到粗产物,其不经进一步纯化直接使用。将肼解产物(0.5mmol)、胆酸(409mg,1mmol)和bop(486mg,1.1mmol) 溶解在dmf(10ml)中,向其中加入diea(0.38ml,2.2mmol)。使反应在室温下搅拌14小时。真空除去有机溶剂后,加入乙腈(100ml)以沉淀出粗产物,将其通过制备型hplc进一步纯化,得到呈白色固体状的纯产物ch-o1。
[0047]
产率:42mg,8.1%。1h nmr(400mhz,dmso-d6)δ10.41(s,2h),9.92 (s,2h),7.96(s,1h),7.59(d,j=1.2hz,2h),4.11(t,j=4.8hz, 2h),3.81(s,2h),3.78
–
3.75(m,2h),3.62(s,4h),3.48(s,4h), 3.23
–
3.15(m,2h),2.24
–
1.95(m,10h),1.83
–
1.62(m,12h), 1.46
–
1.15(m,24h),0.99-0.93(m,7h),0.86
–
0.80(m,8h),0.62 (s,6h).
13
c nmr(100mhz,dmso-d6)δ172.45,165.12,159.04,134.62, 119.70,116.84,71.48,70.90,66.70,59.89,46.62,46.23,41.97,41.86, 35.78,35.61,35.35,34.86,31.98,30.86,29.03,27.80,26.67,23.30, 23.11,17.55,12.87.ms-esi:calculated for[m+h]
+
(c
58h91o12
n4):m/z 1035.66,found:m/z 1035.89.
[0048]
同系列化合物r1为-o(ch2ch2o)
n-h的合成与上述ch-o1类似。
[0049]
实施例3
[0050]
化合物的通道活性检测
[0051]
1)基于hpts分析的离子传输研究
[0052]
将蛋黄l-α-磷脂酰胆碱(eypc,0.6ml,25mg/ml的chcl3,avanti polarlipids,美国)和胆固醇(0、1.9、3.8、5.7或7.6mg)溶解在chcl3(10ml) 中。在35℃减压除去chcl3。在室温下在高真空下干燥所得薄膜过夜后,将薄膜与含有ph敏感hpts染料(0.1mm)的hepes缓冲溶液(1.5ml,10mm hepes, 100mm nacl,ph=7.0)水合37℃摇床培养2小时,得到乳状悬浮液。然后将混合物进行8次冻融循环:在液氮中冷冻30秒,然后在37℃下加热1.5分钟。囊泡悬浮液通过聚碳酸酯膜(0.1μm)挤出,以产生直径约140nm的luvs 均匀悬浮液,hpts封装在其中。使用透析膜(mwco=10,000)对相同的hepes 缓冲溶液(300ml,不含hpts)在温和搅拌
(300r/min,4℃)下将luv的悬浮液透析16小时,以去除未封装的hpts以产生浓度为13mm的脂质的luv。
[0053]
将含有hpts的luv悬浮液(30μl,13mm在含有100mm nacl的10mm hepes 缓冲液中,ph=7.0)添加到hepes缓冲溶液(1.75ml,10mm hepes,100mm nacl, ph=8.0)中为离子传输研究创建ph梯度。然后在温和搅拌下将通道在dmso 中的溶液注入悬浮液中。添加相关化合物后,立即在510nm处监测hpts的发射,使用荧光分光光度计同时记录460和403nm的激发,持续300秒。在300 秒后,立即加入triton x-100的水溶液(20μl,20%v/v)以诱导荧光染料发射的最大变化。最终的传输轨迹是作为i460/i403的比率值获得的,并基于i460/i403的比率值在添加氚之后使用方程s1进行归一化。s1方程为:
[0054]
if=[(i
t-i0)/(i
1-i0)]
[0055]
其中,if=分数发射强度,i
t
=时间t的荧光强度,i1=添加triton x-100 后的荧光强度,i0=初始荧光强度。
[0056]
化合物在细胞膜上胆固醇协助下能自组装形成人工通道,通道的立体结构(侧视图和俯视图)如下图1所示
[0057]
实验结果如附图2所示。实验结果表明这类化合物具有离子传输能力,且传输能力受膜上胆固醇含量调节,胆固醇含量为50%时效果最优。
[0058]
实施例4
[0059]
自淬灭cf染料渗漏检测
[0060]
蛋黄l-α-磷脂酰胆碱(eypc,0.6ml,25mg/ml的chcl3,avanti polarlipids,美国)和胆固醇(3.8mg)溶解在chcl3(10ml)中。在35℃减压除去 chcl3。在室温下在高真空下干燥所得薄膜过夜后,将薄膜与含有5(6)-荧光素(cf,50mm)的hepes缓冲溶液(1.5ml,10mm hepes,100mm nacl,ph=7.5) 在恒温摇床-培养箱中37℃培养2小时,得到乳状悬浮液。然后将混合物进行 8次冻融循环:在液氮中冷冻30秒,在37℃下加热1.5分钟。囊泡悬浮液通过聚碳酸酯膜(0.1μm)挤出,以产生直径约140nm的大单层囊泡(luv)的均匀悬浮液,其中包封有cf染料。使用透析膜(mwco=10,000)对相同的hepes 缓冲溶液(300ml,无cf染料)在温和搅拌(300r/min,4℃)下将luv的悬浮液透析16小时,以去除未包封的染料以产生浓度为13mm的脂质的luv。
[0061]
将含cf的luv悬浮液(30μl,13mm,用10mm hepes缓冲液配制,含100mm nacl,ph=7.5)添加到hepes缓冲溶液(1.75ml,10mm hepes,100 mm nacl,ph=7.5)为cf染料流出研究创建浓度梯度。然后在轻轻搅拌下将不同浓度的通道在dmso中的溶液注入悬浮液中。添加相关化合物后,立即使用荧光分光光度计在517nm处监测cf的发射,在492nm处激发300秒。在t =300s时,立即加入triton x-100的水溶液(20μl,20%v/v)以实现最大的染料流出。最终的传输轨迹是通过使用方程s2对荧光强度进行归一化来获得的。s2方程如下:
[0062]
f=[(f
t-f0)/(f
1-f0)]
[0063]
其中,f=分数发射强度,f
t
=时间t的荧光强度,f1=添加triton x-100 后的荧光强度,f0=初始荧光强度。
[0064]
通过加入triton之前的归一化荧光强度计算每条曲线的分数变化r,参考空白的比率为0,triton的比率为1。使用希尔方程s3给出了希尔系数n 和ec
50
值。希尔方程s3如下
[0065]
y=1/(1+(ec
50
/[c])n)
[0066]
实验结果如附图3所示,实验结果发现这类化合物可以增加cf染料从囊泡中泄漏,说明这类化合物可以增加磷脂膜的通透性。
[0067]
实施例5
[0068]
化合物的抗肿瘤活性评估
[0069]
1.肿瘤细胞增殖抑制试验及选择性实验
[0070]
精密称定目标化合物,分别稀释至浓度为500μmol/l作为母液,过滤除菌,4℃密封保存备用。
[0071]
预先培养各种肿瘤细胞(hepg2、u87-mg或正常细胞(lo2)生长至对数生长期,再把对数生长期的贴壁细胞用胰蛋白酶消化液消化后(悬浮细胞不需要消化),每孔100μl细胞悬浮液,每孔1000-10000个细胞,接种于96孔板中,周围一圈孔加入100μl的pbs缓冲液;
[0072]
37℃细胞培养箱(5%co2,90%h2o)中培养至细胞贴壁;之后加入含待测目标化合物的培养液,实验组加入按浓度梯度稀释的待测化合物(终浓度为 0.25-500μm),每孔加入100μl的待测样品,每个浓度均设置三个平行对照孔;阳性对照组加入同体积同浓度梯度的5-fu溶液,空白对照组加入100μ l培养液,继续培养72h;
[0073]
每孔加入10μl的mtt溶液,继续培养4h;之后终止培养,吸去孔内培养液;
[0074]
每孔加入150μl的dmso,震荡使结晶甲瓒充分溶解(悬浮细胞用三联液溶解,放置12h左右);
[0075]
置于酶标仪中570nm下测定吸光度值,根据公式计算出目标化合物的抑制率,再用软件计算出ic
50
的值,部分结果见表1。
[0076]
表1.化合物对u87-mg和hepg2细胞的ic
50
值
[0077][0078]
根据表1可知。抗癌活性最强化合物为ch-c1,测试ch-c1对正常肝细胞 lo2、nrk293t细胞的选择性及对红细胞的溶血活性,计算了选择性指数(si)。结果如下表2所示,由此表明化合物ch-c1对肝癌细胞具有高选择性。
[0079]
表2.化合物ch-c1对正常细胞的ic50值、红细胞溶血指数及选择性指数 (si)
[0080] ic
50
(μm)or hc
50
(μm)silo270.2618.49293t》500》130红细胞127.438.50
[0081]
本发明制备的化合物还可以应用于bgc-823、sgc-7901、ags、a549、mcf-7、 hgc-27、hct116、hl-60的肿瘤细胞增殖抑制试验。
[0082]
2.细胞膜完整性实验
[0083]
hepg2细胞接种于48孔板中,预置圆形细胞板,细胞密度为2
×
104个细胞/孔。37℃、5%co2培养箱中培养12h后,48孔板上清液更换为不同浓度梯度的ch-c1离子通道溶液,设置空白溶液组,再培养细胞12小时。将t11 细胞染料(bestbio)用染料稀释剂稀释50倍,混合均匀,置于37℃水浴锅中预热。用预热的t11细胞染料稀释剂代替48孔板的上清液。随后在培养箱中孵育10分钟,用pbs洗涤细胞两次,然后用4%多聚甲醛在4℃下固定10 分钟。将片剂用含40,60-二脒基-2-苯基吲哚(dapi)的细胞密封片(yeasen) 密封,在黑暗中自然干燥,并通过激光共聚焦显微镜(lsm5 exciter,zeiss) 拍摄荧光图像。结果发现化合物ch-c1可以浓度依赖性的方式破坏癌细胞的细胞膜完整性,增强细胞的通透性。
[0084]
(3)western blot法测定蛋白表达
[0085]
制样:hepg2细胞接种于6孔板中,37℃、5%co2培养箱中培养过夜后,用化合物(5、10、20μmol
·
l-1
)作用24h之后用pbs洗细胞2次,使用索莱宝高效ripa裂解液300μl于冰上裂解10min,收集样品,样品液加sds-page 蛋白上样缓冲液(5
×
),涡旋混匀后于95℃水浴中变性10min,冷却后置于
ꢀ‑
20℃待测。
[0086]
制胶:用保鲜膜密封凝胶玻璃板,根据待测蛋白分子量大小配制相应浓度的sds-page分离胶和浓缩胶,之后插入梳子,向上垂直放置并静置数分钟,充分凝固后拆去保鲜膜和梳子。
[0087]
上样:将制好的胶板插入电泳槽,每个上样孔加入等体积的样品和 marker。在梯度电泳条件下跑电泳。
[0088]
转印:电泳结束后,剥离凝胶,将0.45μm pvdf膜于甲醇中活化5min,使用湿转转印法电泳槽将分离后的蛋白样品转印至活化后的pvdf膜上。
[0089]
封闭:待转印结束,将pvdf膜置于5%脱脂奶粉的tbst封闭液中室温封闭1.5h。用tbst缓冲液洗膜3次,各10min。
[0090]
一抗孵育:将pvdf膜置于适当比例稀释的相应一抗中,于4℃孵育过夜。
[0091]
二抗孵育:用tbst缓冲液洗膜3次,各10min。加入适当比例稀释的hrp 标记的igg二抗,室温摇床孵育1.5h。
[0092]
化学发光:抗体孵育结束后,再次用tbst缓冲液洗膜3次,10min每次。加入ecl化学发光液,采用天能多功能成像仪化学发光模块成像,结果见图 5,所选化合物呈浓度依赖性地抑制full parp,bcl-2蛋白的表达和降低 caspase-9的表达。
[0093]
需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖
非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者终端设备不仅包括那些要素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者终端设备所固有的要素。在没有更多限制的情况下,由语句“包括
……”
或“包含
……”
限定的要素,并不排除在包括所述要素的过程、方法、物品或者终端设备中还存在另外的要素。此外,在本文中,“大于”、“小于”、“超过”等理解为不包括本数;“以上”、“以下”、“以内”等理解为包括本数。
[0094]
尽管已经对上述各实施例进行了描述,但本领域内的技术人员一旦得知了基本创造性概念,则可对这些实施例做出另外的变更和修改,所以以上所述仅为本发明的实施例,并非因此限制本发明的专利保护范围,凡是利用本发明说明书及附图内容所作的等效结构或等效流程变换,或直接或间接运用在其他相关的技术领域,均同理包括在本发明的专利保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1