靶向AFP肽/MHC复合体的构建体及其用途的制作方法
靶向afp肽/mhc复合体的构建体及其用途
1.本技术是申请日为2016年4月1日、申请号为201680004899.1、发明名称为“靶向afp肽/mhc复合体的构建体及其用途”的发明专利申请的分案申请。
2.相关申请的交叉引用
3.本技术主张2015年4月3日申请的美国临时申请第62/142,958号、2015年10月21日申请的美国临时申请第62/244,653号及2016年3月7日申请的美国临时申请第62/304,915号的优先权,其全部特此以全文引用的方式并入。
技术领域
4.本发明涉及特异性结合与afp肽复合的mhc分子的抗体构建体,及其用途,包括治疗及诊断疾病。
5.以ascii文本文档形式提交序列表
6.以ascii文本文档提交的以下内容以全文引用的方式并入本文中:计算机可读形式(crf)的序列表(文件名称:750042000141seqlist.txt,记录日期:2016年4月1日,大小:65kb)。
背景技术:
7.细胞表面蛋白质仅构成细胞蛋白质的一小部分且这些蛋白质通常并非肿瘤特异性的。由于不能容易地穿透细胞,销售的治疗单克隆抗体(mab)识别这些细胞表面蛋白质,其中的大部分为谱系或分化抗原(milenic,e.d.,curr.pharm.des.8:1794-1764,2002;grillo-lopez,a.j.,expert rev.anticancer ther.2(3):323-329,2002;jones,k.l.及buzdat,a.u.,lancet oncol.10(12):1179-1187,2009)。相比之下,突变或致癌肿瘤相关蛋白质通常为细胞核、细胞质或分泌的,其当前藉由小分子药物最佳解决,或在分泌蛋白质的情况下,作为抗癌药物标靶几乎不解决(reddy等人,expert opin.ther.targets 3:313-324,2012;takeuchi,k.及ito,f.,biol.pharm.bull.34(12):1774-1780;roychowdhury,s.及talpaz,m.,blood rev.6:279-290,2011)。然而,大部分胞内蛋白质由于在藉由t细胞受体(tcr)识别的mhc分子的背景下的t细胞肽表位而可藉由细胞表面上的mhc分子以蛋白酶体的方式(proteosomally)降解、加工及呈递(morris等人,blood rev.20:61-69,2006;konnig,r.,curr.opin.immunol.14(1):75-83,2002)。因此,产生在细胞表面上识别分泌或胞内肿瘤抗原衍生肽/mhc复合体的治疗mab将利用mab提供的经增强的特异性及治疗效能。使用噬菌体展示来产生mab的近来发展已使得可能选择对于来自大抗体谱系的限定表位具有精致特异性的药剂。在hla-a01及hla-a02的情况下对实体肿瘤抗原具有特异性的多种此类mab已成功地选自噬菌体展示文库(noy等人,expert rev.anticancer ther.5(3):523-536,2005;chames等人,proc.natl.acad.sci.usa 97:7969-7974,2000;held等人,eur.j.immunol.34:2919-2929,2004;lev等人,cancer res.62:3184-3194,2002;klechevsky等人,cancer res.68(15):6360-6367,2008)。最近,已显示对人类wt1/hla-a02复合体具有特异性的人类mab(充分描述的t细胞表位)经由fc介导的效应细胞功能在细胞
分析及体内模型中抑制多种癌细胞系及原发癌细胞(dao等人,sci.transl.med.5:176ra33,2013;veomett等人,clin.cancer res.doi:10.1158/1078-0432,2014)。
8.α-胎蛋白(afp)为在卵黄囊及胎肝中产生且分泌至循环中的69kd糖蛋白。afp的合成在出生之后显著减少且仅痕量存在于成人肝脏中。在正常成人血清中,afp浓度通常低至5-7ng/ml(terentiev,a.a.及moldogazieva,n.t.,tumour biol.34(4):2075-2091,2013)。然而,afp基因的表达在肝脏再生、致肝癌作用、生殖细胞肿瘤期间或在一些病毒感染(hbv/hcv)情况下在成人中再活化。因此,血清afp的测量在诊断及监测对于afp阳性癌症的处理的反应中起重要作用。当前,afp被视为肿瘤特异性分子生物标记物质的“黄金标准”。然而,由于afp并非细胞表面蛋白质,靶向afp尚未成为抗癌抗体药物开发中非常的活跃领域。
9.原发性肝癌为全世界第五常见的癌症形式,且为癌症相关死亡的第二常见病因。在2012年,在全球范围内存在约782,000个新癌症病例,及约746,000例肝癌相关死亡(http://globocan.iarc.fr/pages/fact_sheets_cancer.aspx)。90-95%的肝癌为肝细胞癌(hcc)。如由慢性肝炎、肝硬化及脂肪肝病引起的慢性肝损伤与hcc的出现紧密相关。肝炎病毒感染(例如hbv、hcv)、黄霉毒素b暴露、酒精摄入及其他代谢疾病(例如肥胖及糖尿病)为hcc的熟知风险因素。由于hbv及hcv在东亚及非洲国家的盛行,hcc的发生率在这些区域较高(shibata,t.及aburatani,h.,nat.rev.gastroenterol.hepatol.11(6):340-349,2014)。然而,感染hcv的患者数量已在西方国家,尤其在美国快速增加,在美国,病毒肝炎感染部分经由药物滥用介导。同时,由非酒精性脂肪变性肝炎(nash)及肥胖所致的肝硬化的发病率亦在西方国家增加。在美国,hcc为第9常见的癌症(vallanueva等人,nat.rev.gastroenterol.hepatol.10(1):34-42)。
10.hcc患者的平均存活期为距诊断3个月。然而,这与肿瘤阶段及潜在肝病程度紧密相关。由于仅少数hcc患者在诊断时被认为适合于切除及移植,大多数hcc患者的治疗主要为姑息性的。已显示非手术治疗,如经动脉化疗栓塞(tace/tae)、射频消融及全身性靶向剂(如索拉非尼(sorafenib))减少肿瘤负荷且提高存活率,但是这些治疗不根除癌细胞且患者频繁复发。因此,开发更有效疗法仍为迫切研究领域(behboudi等人,liver int.30(4):521-526,2010)。
11.afp表达在大致80%hcc中再活化。旨在产生藉由mhc i类蛋白质识别hcc癌细胞表面上呈递的肽的afp特异性细胞毒性cd8 t细胞反应的免疫疗法研究已报导许多作为t细胞表位的人类afp肽(butterfield等人,j.immunol.166:5300-5308,2001;pardee,a.d.及butterfield,l.h.,oncoimmunol.1:48-55,2012;butterfield等人,j.trans.med.12:86,2014;liu等人,j.immunol.177(1):712-721,2006;mizukoshi等人,int.j.cancer 118(5):1194-1204,2006)。在这些肽中,fmnkfiyei(afp158)为藉由hla-a*02:01限制的免疫显性t细胞表位。afp/hla-a*02:01复合体在活体外诱导来自正常hla-a*02:01供体的肽特异性t细胞。这些afp158特异性t细胞在细胞毒性分析以及ifnγelispot分析中识别hla-a*02:01阳性及afp阳性肿瘤细胞。afp158藉由来自hla-a*02:01阳性hcc细胞系hepg2,但不来自hla-a*02:01阴性癌细胞系hep3b的表面肽的质谱分析鉴别(butterfield等人,j.immunol.166:5300-5308,2001)。这些资料支持afp158实际上藉由afp阳性癌细胞组织hla-a*02:01分子加工及呈递。因此,afp158/hla-a*02:01为mab癌症药物开发的良好目标候选物。
12.使用afp作为治疗过表达afp的癌症的治疗标靶的传统方法依赖于使用靶向afp蛋白质的抗体或用各种afp肽的疫苗接种。针对afp蛋白质的抗体具有极小疗效,因为afp并非细胞表面蛋白质,且可以高循环水平存在,因此减少了抗体对表达afp的细胞的任何特异性靶向。尽管已观测到疫苗接种各种mhc限制afp肽及其变体导致afp特异性t细胞的活化及增加的体外afp呈递细胞细胞毒性,临床显著治疗效益仍有待观测。
13.本文所提及之所有公开、专利、专利申请及公布专利申请揭示的内容特此以全文引用的方式并入本文中。
技术实现要素:
14.在一方面中,本技术提供结合至包含afp肽及mhc i类蛋白质的复合体(在本文中称为“afp/mhc i类复合体”或“amc”)的构建体(如经分离构建体)。在一些实施方案中,构建体(“抗amc构建体”包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分(在本文中称为“抗amc抗体部分”)。
15.因此,在一些实施方案中,提供包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分的抗amc构建体(如经分离抗amc构建体)。在一些实施方案中,afp/mhc i类复合体存在于细胞表面上。在一些实施方案中,afp/mhc i类复合体存在于癌细胞表面上。
16.在一些实施方案中,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中mhc i类蛋白质为hla-a。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a02等位基因之hla-a*02:01亚型。
17.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中抗体部分与包含afp肽及第二mhc i类蛋白质(具有与mhc i类蛋白质不同的hla等位基因)的复合体交叉反应。在一些实施方案中,抗体部分与包含afp肽的种间变体及mhc i类蛋白质的复合体交叉反应。在一些实施方案中,抗体部分与包含含一个氨基酸取代(如保守氨基酸取代)的afp肽的变体及mhc i类蛋白质的复合体交叉反应。
18.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中afp肽长度为约8至约12(如约8、9、10、11或12中的任一项)个氨基酸。在一些实施方案中,afp肽衍生自人类afp。在一些实施方案中,afp肽具有选自由seq id no:3-13及16组成的组的氨基酸序列。在一些实施方案中,afp肽具有氨基酸序列fmnkfiyei(seq id no:4)。
19.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中抗体部分为全长抗体、fab、fab'、(fab')2、fv或单链fv(scfv)。在一些实施方案中,抗体部分为全人类抗体部分、具有人类抗体框架区的半合成抗体部分或人源化抗体部分。
20.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中抗体部分以在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)的平衡解离常数(kd)结合至afp/mhc i类复合体。在一些实施方案中,经分离抗amc构建体以在约0.1pm至约
500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)的kd结合至afp/mhc i类复合体。
21.在一些实施方案中,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中抗体部分包含:i)重链可变域,其包含重链互补决定区(hc-cdr)1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含轻链互补决定区(lc-cdr)1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,其中x可为任何氨基酸。
22.在一些实施方案中,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中抗体部分包含:i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体(且在一些实施方案中由其组成),hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体(且在一些实施方案中由其组成),及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体(且在一些实施方案中由其组成);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体(且在一些实施方案中由其组成),lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体(且在一些实施方案中由其组成),及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体(且在一些实施方案中由其组成)。
23.在一些实施方案中,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中抗体部分包含:i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列(且在一些实施方案中由其组成);hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列(且在一些实施方案中由其组成);及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr区中的氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列(且在一些实施方案中由其组成);lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列(且在一些实施方案中由其组成);及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr区中的氨基酸取代的变体。
24.在一些实施方案中,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中抗体部分包含a)重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列或其与seq id no:17-26中的任一项具有至少约95%(如至少约95%、96%、97%、98%或99%中的任一项)序列同一性的变体(且在一些实施方案中由其组成);及b)轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列或其与seq id no:27-36中的任一项具有至少约95%(如至少约95%、96%、97%、98%或99%中的任一项)序列同一性的变体(且在一些实施方案中由其组成)。在一些实施方案中,抗体部分包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列(且在一些实施方案中由其组成),及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列(且在一些实施方案中由其组成)。
25.在一些实施方案中,抗amc构建体包含与根据上文所述的抗体部分中的任一项的第二抗体部分竞争结合至靶afp/mhc i类复合体的第一抗体部分。在一些实施方案中,第一抗体部分与第二抗体部分结合至相同或大体上相同的表位。在一些实施方案中,第一抗体部分与靶afp/mhc i类复合体的结合抑制第二抗体部分与靶afp/mhc i类复合体的结合至少约70%(如至少约75%、80%、85%、90%、95%、98%或99%中的任一项),或反之亦然。在一些实施方案中,第一抗体部分及第二抗体部分交叉竞争结合至靶afp/mhc i类复合体,即第一及第二抗体部分中的每一者彼此竞争结合至靶afp/mhc i类复合体。
26.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,经分离抗amc构建体为全长抗体。在一些实施方案中,经分离抗amc构建体为单特异性的。在一些实施方案中,经分离抗amc构建体为多特异性的。在一些实施方案中,经分离抗amc构建体为双特异性的。在一些实施方案中,经分离抗amc分子为串联scfv、双功能抗体(db)、单链双功能抗体(scdb)、双亲和力再靶向(dart)抗体、双可变域(dvd)抗体、杵-臼(kih)抗体、坞锁(dock and lock)(dnl)抗体、化学交联抗体、异多聚体抗体或异结合物抗体。在一些实施方案中,经分离抗amc构建体为包含两个藉由肽接头连接的scfv的串联scfv。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。
27.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中经分离抗amc构建体进一步包含特异性结合第二抗原的第二抗原结合部分。在一些实施方案中,第二抗原结合部分为抗体部分。在一些实施方案中,第二抗原为t细胞表面上的抗原。在一些实施方案中,t细胞选自由以下组成的组:细胞毒性t细胞、辅助t细胞及自然杀手t细胞。在一些实施方案中,第二抗原选自由以下组成的组:cd3γ、cd3δ、cd3ε、cd3ζ、cd28、ox40、gitr、cd137、cd27、cd40l及hvem。在一些实施方案中,第二抗原为cd3ε,且经分离抗amc构建体为包含对afp/mhc i类复合体具有特异性的n端scfv及对cd3ε具有特异性的c端scfv的串联scfv。在一些实施方案中,第二抗原为自然杀手细胞、中性粒细胞、单核细胞、巨噬细胞或树突状细胞表面上的抗原。
28.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中经分离抗amc构建体为嵌合抗原受体。在一些实施方案中,嵌合抗原受体包含含抗体部分的细胞外域、跨膜域及胞内信号传导域。在一些实施方案中,胞内信号传导域包含cd3ζ胞内信号传导序列及共刺激信号传导序列。在一些实施方案中,共刺激信号传导序列为cd28胞内
信号传导序列。
29.在一些实施方案中,根据上文所述的抗amc构建体(如经分离抗amc构建体)中的任一项,抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,其中经分离抗amc构建体为包含抗体部分及效应分子的免疫缀合物。在一些实施方案中,效应分子为选自由以下组成的组的治疗剂:药物、毒素、放射性同位素、蛋白质、肽及核酸。在一些实施方案中,治疗剂为药物或毒素。在一些实施方案中,效应分子为标记。
30.在其他实施方案中,提供包含根据上文所述的实施方案中任一项的抗amc构建体(如经分离抗amc构建体)的药物组合物。在一些实施方案中,药物组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,提供表达抗amc构建体或其多肽组分或与其相关的宿主细胞。在一些实施方案中,提供编码抗amc构建体或其多肽组分的核酸。在一些实施方案中,提供包含核酸的载体。在一些实施方案中,提供表达抗amc构建体或与其相关的效应细胞。在一些实施方案中,效应细胞为t细胞。
31.在一些实施方案中,提供检测在表面上呈递包含afp肽及mhc i类蛋白质的复合体的细胞的方法,其包含实细胞与根据上文所述的实施方案中任一项的抗amc构建体(如经分离抗amc构建体)接触,该抗amc构建体包含a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分,及b)标记,及检测细胞上的标记的存在。
32.在一些实施方案中,提供治疗患有afp阳性疾病的个体的方法,其包含项个体施用有效量的包含根据上文所述的实施方案中任一项的抗amc构建体(如经分离抗amc构建体)的药物组合物。在一些实施方案中,药物组合物进一步包含与经分离抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,提供治疗患有afp阳性疾病的个体的方法,其包含项个体施用有效量的表达上文所述的抗amc car中的任一项的效应细胞。在一些实施方案中,效应细胞为t细胞。在一些实施方案中,施用是向个体中的第一疾病位点远端的注射位点。在一些实施方案中,注射位点为第一疾病位点远端的第一肿瘤。在一些实施方案中,第一疾病位点为afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为肝细胞癌或生殖细胞肿瘤。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且癌转移得到抑制。在一些实施方案中,癌症为转移性肝细胞癌。
33.在一些实施方案中,提供诊断患有afp阳性疾病的个体的方法,其包含:a)向个体施用有效量的根据上文所述的实施方案中任一项的经分离抗amc构建体;及b)测定个体中的标记含量,其中标记的水平高于阈值水平指示个体患有afp阳性疾病。在一些实施方案中,提供诊断患有afp阳性疾病的个体的方法,其包含:a)使衍生自个体的样品与根据上文所述的实施方案中任一项的经分离抗amc构建体接触;及b)测定与样品中的经分离抗amc构建体结合的细胞的数量,其中与经分离抗amc构建体结合的细胞的数量值高于阈值水平指示个体患有afp阳性疾病。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为肝细胞癌或生殖细胞肿瘤。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且癌转移得到抑制。在一些实施方案中,癌症为转移性肝细胞癌。
34.还提供制造本文所述的构建体中的任一项的方法、适合于本文所描述的方法的制品及试剂盒。
附图说明
35.图1显示藉由超滤浓缩之后的afp158肽/hla-a*02:01复合体的尺寸排外层析法(sec)层析图。恰当折叠的肽/mhc复合体单体:212.49ml;错误折叠的聚集体:111.27ml;游离β2m:267.21ml。
36.图2显示测定在sec之后经分离的afp158/hla-a*02:01复合体的纯度的还原sds-page分析。主带对应于hla-a*02:01及β2m亚基。
37.图3显示关于生物素标记afp158肽/hla-a*02:01(bio-afp158)相对于生物素标记对照肽/hla-a*02:01(bio-对照)的特异性结合的噬菌体克隆elisa结果。
38.图4显示关于β2m负载、β2m/afp158肽负载及β2m/htert肽负载t2细胞的结合的噬菌体克隆facs结合分析结果。
39.图5显示关于相对于β2m负载t2细胞的与β2m/人类afp158肽负载t2细胞及β2m/小鼠afp158肽负载t2细胞的交叉反应性的噬菌体克隆facs结合分析结果。
40.图6显示负载有在不同位置具有单一丙氨酸取代的afp158肽的t2细胞的噬菌体克隆#52facs结合分析的结果。
41.图7显示β2m afp158肽负载的t2细胞、负载有β2m的t2细胞及衍生自通常表达的内源性蛋白质的肽或β2m负载的t2细胞的混合物的结合的噬菌体克隆facs结合分析的结果。
42.图8显示用于纯化抗afp158/mhc双特异性抗体之分子测量定的sds-page分析。
43.图9显示用于评估聚集含量的例示性纯化afp158双特异性抗体的sec层析图。抗afp158/mhc双特异性抗体单体:约15.8ml。
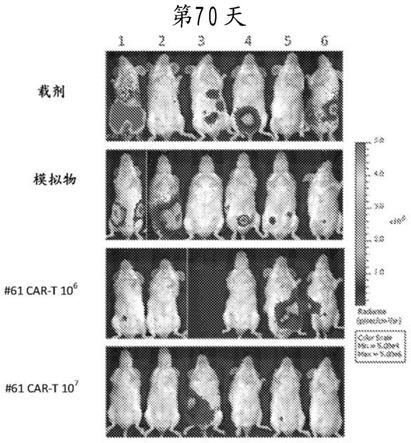
44.图10显示藉由改变浓度下的抗afp158/mhc双特异性抗体(bsab)介导的多个癌细胞系的t细胞杀死。对于各浓度,从左往右的条表示hepg2、sk-hep1、hela、hep3b、raji、jurkat、daudi及k562细胞系。
45.图11显示嵌合抗原受体构建体的示意性图示。
46.图12显示藉由表达一组抗afp158/mhc car的t细胞介导的hepg2、sk-hep1及sk-hep1-minig细胞系杀死。
47.图13显示藉由表达例示性抗afp158/mhc car的t细胞介导的对于afp158及hla-a*02:01呈阳性或阴性的一组癌细胞系的杀死。各细胞系来源的组织、afp/afp158肽表达及细胞是否表达hla-a02等位基因指定于表中。
48.图14a显示在共培育afp158 car转导的t细胞或模拟转导的t细胞与对于afp158及hla-a*02:01呈阳性或阴性的癌细胞系之后的il-2、il-4、il-6及il-8的释放。
49.图14b显示在共培育afp158 car转导的t细胞或模拟转导的t细胞与对于afp158及hla-a*02:01呈阳性或阴性的癌细胞系之后的il-10、gm-csf、ifn-γ及tnf-α的释放。
50.图15a显示用静脉内注射模拟转导的t细胞或afp158 car转导的t细胞处理,或保持未处理的hepg2皮下异种移植小鼠中的肿瘤生长。
51.图15b显示用肿瘤内注射模拟转导t细胞或afp158 car转导的t细胞处理,或保持未处理的hepg2皮下异种移植小鼠中的肿瘤生长。
52.图16a显示在藉由腹膜内注射模拟转导的t细胞或afp158 car转导的t细胞处理后第70天或无处理的来自萤光素酶标记hepg2(hepg2-luc2)腹膜内异种移植小鼠的光子发射变化。
53.图16b显示第70天的hepg2-luc2肿瘤携带小鼠的光子发射影像。
54.图17显示用静脉内或肿瘤内注射afp158 car转导的t细胞或静脉内注射模拟转导的t细胞处理的sk-hep1-minig皮下异种移植小鼠中的肿瘤生长。
55.图18显示用于测定全长抗afp158/mhc小鼠嵌合igg1抗体纯度的sds-page分析。
56.图19显示与呈递afp158/hla-a*02:01的sk-hep1-minig细胞的全长抗afp158/mhc小鼠嵌合igg1(黑线)或阴性对照(单独的二级抗体,灰线)结合的facs分析。
57.图20显示与afp158/hla-a*02:01复合体、重组afp蛋白质或游离afp158肽的全长抗afp158/mhc小鼠嵌合igg1结合的elisa结果。左图:全长抗afp158/mhc小鼠嵌合igg1的剂量依赖性曲线;右侧:关于afp158肽/mhc(mhc)、afp蛋白质(afp)及afp158肽(肽)在100ng/ml下的抗体结合的od450。
58.图21显示肿瘤内注射afp158 car-t细胞或对照物的小鼠随时间推移(直至第1剂量后35天)的体重测量结果。
59.图22显示用静脉内或肿瘤内注射afp158 car转导的t细胞、肿瘤内注射afp158 car转导的t细胞以及apc,或肿瘤内注射模拟转导的t细胞处理的两侧sk-hep1-minig皮下异种移植小鼠中的肿瘤生长动力学。肿瘤内注射喷射至右侧腹肿瘤中。
60.图23显示来自用肿瘤内注射至右侧腹肿瘤中的afp158 car转导的t细胞以及apc处理的两侧sk-hep1-minig皮下异种移植小鼠的肿瘤截面中的人类cd3的免疫组织化学染色。l,左侧肿瘤;r,右侧肿瘤。
61.图24显示afp158 car转导的外周血淋巴细胞的流式细胞术分析;细胞经afp158/hla-a*02:01四聚物染色且与抗cd3抗体、抗cd4抗体或抗cd8抗体共染色。模拟转导的细胞及未经染色的细胞将包括为对照。
62.图25显示在与靶细胞(hepg2、sk-hep-1或sk-hep1-minig)共培养之后的afp158 car转导的t细胞之脱粒的流式细胞术分析;转导的t细胞关于car及cd8表达闸控且关于抗cd107a染色。
63.图26显示在经转导以表达代表性afp158 car的细胞中的car细胞表面分布;细胞经afp158/hla-a*02:01四聚物-pe染色。
64.发明详述
65.本技术提供包含特异性结合包含afp肽及mhc i类蛋白质的复合体(在本文中称为“afp/mhc i类复合体”或“amc”)的抗体部分(在本文中称为“抗amc抗体部分”)的经分离构建体(在本文中称为“抗amc构建体”)。与循环afp蛋白质或游离afp肽相对,抗amc构建体特异性识别afp/mhc i类复合物(如表达afp的细胞表面上的mhc呈递的afp肽)。当以抗cd3双特异性抗体形式武装或存在于由t细胞表达的嵌合抗原受体(car)中时,抗amc抗体部分特异性重定向人类t细胞以杀死amc呈递靶细胞,如amc呈递癌细胞。此策略提供优于使用针对afp蛋白质的抗体的显著技术优势,使用该等抗体无法特异性靶向amc呈递细胞(亦即在表面上呈递结合至mhc i类分子的afp肽的细胞)。此外,当融合至可检测部分时,抗amc抗体部分允许以对于amc呈递细胞的数目及分布变化(比循环afp含量潜在更相关的疾病进展量度)的高灵敏度对afp阳性疾病或病症进行诊断及预后。
66.使用噬菌体展示技术,我们产生了多种针对人类afp158肽/hla-a*02:01复合体,以及在hla-a02等位基因的其他亚型情形下形成的afp158/mhc复合体具特异性及高亲和力
的单克隆抗体。流式细胞术及t细胞介导的细胞毒性分析展示抗体以afp及hla-a*02:01限制的方式识别afp肽脉冲的t2细胞及amc呈递癌细胞系。当以抗cd3双特异性抗体或car t细胞形式武装时,抗体重定向人类t细胞以杀死afp阳性及hla-a*02:01阳性靶癌细胞。本文中呈现的资料展示hla复合体的情形下针对分泌癌症抗原的抗体可为癌症适应症(如实体肿瘤适应症)的有效治疗剂。
67.本技术因此提供包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分的构建体(如经分离构建体)。构建体可例如为全长抗amc抗体、多特异性抗amc分子(如双特异性抗amc抗体)、抗amc嵌合抗原受体(“car”)或抗amc免疫缀合物。
68.在另一方面中,提供编码抗amc构建体或构建体的抗amc抗体部分部分(anti-amc antibody moiety portion)的核酸。
69.在另一方面中,提供包含抗amc构建体的组合物,该构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗体部分。组合物可为包含抗amc构建体或表达抗amc构建体或与其相关的效应细胞(例如表达抗amc car的t细胞)的药物组合物。
70.还提供出于治疗或诊断目的制造及使用抗amc构建体(或表达抗amc构建体或与其相关的细胞)的方法,以及适用于此类方法的试剂盒及制品。
71.定义
72.如本文所用,“治疗(treatment/treating)”为用于获得有益或期望结果(包括临床结果)的方法。出于本发明的目的,有益或期望临床结果包括(但不限于)以下中的一项或多项:缓解一种或多种产生于疾病的症状、降低疾病程度、使疾病稳定化(例如预防或延迟疾病恶化)、预防或延迟疾病扩散(例如转移)、预防或延迟疾病复发、延迟或减缓疾病进展、改善疾病病况、提供疾病缓解(部分或完全)、减少治疗疾病所需的一种或多种其他药物的剂量、延迟疾病进展、增加或改善生活品质、增加体重增长及/或延长存活期。“治疗”亦涵盖癌症的病理性结果(诸如肿瘤体积)降低。本发明的方法涵盖治疗的这些方面中的任何一项或多项。
73.术语“复发(recurrence/relapse/relapsed)”指癌症或疾病在疾病消失的临床评估之后的恢复。远端癌转移或局部复发的诊断可视为复发。
74.术语“难治性”或“耐受性”指不回应于治疗的癌症或疾病。
75.如关于t细胞在本文所用的“活化”指已经充分刺激而诱导可检测细胞增殖的t细胞状态。活化也可与诱导的细胞激素产生及可检测效应功能相关联。
76.术语“抗体部分”包括全长抗体及其抗原结合片段。全长抗体包含两个重链及两个轻链。轻链及重链的可变区对抗原结合负责。两种链中的可变区一般均含有三个称作互补决定区(cdr)的高度可变环(轻链(lc)cdr包括lc-cdr1、lc-cdr2及lc-cdr3,重链(hc)cdr包括hc-cdr1、hc-cdr2及hc-cdr3)。本文所揭示的抗体及抗原结合片段的cdr边界可藉由kabat、chothia或al-lazikani公约(al-lazikani 1997;chothia 1985;chothia 1987;chothia 1989;kabat 1987;kabat 1991)限定或鉴别。重链或轻链的三个cdr插入于称为框架区(fr)的侧接伸长部之间,所述侧接伸长部比cdr更高度保守且形成支撑高变环的架构。重链及轻链的恒定区不参与抗原结合,但展现各种效应功能。抗体基于其重链的恒定区氨基酸序列分配至各种类别。五种主要类别或同型的抗体为iga、igd、ige、igg及igm,其特征为分别存在α、δ、ε、γ及μ重链。若干主要抗体类别分成子类,如igg1(γ1重链)、igg2(γ2重
链)、igg3(γ3重链)、igg4(γ4重链)、iga1(α1重链)或iga2(α2重链)。
77.如本文所用的术语“抗原结合片段”指抗体片段,包括例如双功能抗体、fab、fab'、f(ab')2、fv片段、二硫键稳定性fv片段(dsfv)、(dsfv)2、双特异性dsfv(dsfv-dsfv')、二硫键稳定性双功能抗体(ds双功能抗体)、单链抗体分子(scfv)、scfv二聚体(二价双功能抗体)、由包含一个或多个cdr的抗体的一部分形成的多特异性抗体、骆驼的单域抗体、纳米抗体、域抗体、二价域抗体或结合至抗原但不包含完整抗体结构的任何其他抗体片段。抗原结合片段能够结合至与亲本抗体或亲本抗体片段(例如亲本scfv)所结合相同的抗原。在一些实施方案中,抗原结合片段可包含来自特定人类抗体之一种或多种cdr,其接枝至来自一种或多种不同人类抗体的框架区。
78.如本文所用的术语“表位”指抗体或抗体部分所结合的抗原上的特定原子或氨基酸群。若两个抗体或抗体部分展现对于抗原的竞争性结合,则其可结合抗原内的相同表位。
79.如本文所用,当第一抗体部分在等摩尔浓度的第一抗体部分存在下抑制第二抗体部分的靶amc结合至少约50%(如至少约55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%中的任一项)时,第一抗体部分与第二抗体部分”竞争”结合至靶amc,或反之亦然。基于抗体的交叉竞争而将其“装箱”的高通量方法描述于pct公开第wo 03/48731号中。
80.如本文中所用,术语“特异性结合”或“对......具有特异性”指可测量及可再现相互作用,如标靶与抗体或抗体部分之间的结合,其在非均质分子(包括生物分子)群体存在下决定标靶的存在。举例而言,特异性结合标靶(其可为表位)的抗体或抗体部分为以相比于其结合至其他标靶更大的亲和力、亲合力、更容易及/或以较长持续时间结合此标靶的抗体或抗体部分。在一些实施方案中,特异性结合抗原的抗体或抗体部分以至少为其对于其他标靶的结合亲和力约10倍的结合亲和力与抗原(例如afp肽/mhc i类蛋白质复合体)的一种或多种抗原决定子(antigenic determinant)反应。
81.如本文所用的“经分离”抗amc构建体指(1)不与自然界中发现的蛋白质相关,(2)不含来自相同来源的其他蛋白质,(3)由来自不同物种的细胞表达,或(4)不存在于自然界中的抗amc构建体。
82.如本文所用的术语“经分离核酸”欲意意指基因组、cdna或合成来源或其一些组合的核酸,藉助于其来源,“经分离核酸”(1)不与“经分离核酸”发现于自然界中的所有或一部分多核苷酸相关联,(2)可操作地连接于自然界中不与其连接的多核苷酸,或(3)在自然界中不作为较大序列的部分存在。
83.如本文所用,术语“cdr”或“互补决定区”欲意意指重链与轻链多肽的可变区内存在的非邻接抗原组合位点。这些特定区域已由kabat等人,j.biol.chem.252:6609-6616(1977);kabat等人,美国健康及人类服务部(u.s.dept.of health and human services),“sequences of proteins of immunological interest”(1991);chothia等人,j.mol.biol.196:901-917(1987);及maccallum等人,j.mol.biol.262:732-745(1996)描述,其中定义包括氨基酸残基相对于彼此比较时的重叠或亚群。尽管如此,使用任一定义来提及抗体或接枝抗体或其变体的cdr意欲属于如本文所定义及使用的术语的范畴。包涵以上所引用参考文献中之每一篇所定义的cdr的氨基酸残基如下阐述于表1中作为对比物。
84.表1:cdr定义
[0085][0086]1残基编号遵循kabat等人(前述)的命名法
[0087]2残基编号遵循chothia等人(前述)的命名法
[0088]3残基编号遵循maccallum等人(前述)的命名法
[0089]
术语“嵌合抗体”指如下抗体:其中重链及/或轻链的一部分与衍生自特定物种或属于特定抗体类别或子类别的抗体中的对应序列相同或同源,而链的其余部分与衍生自另一物种或属于另一抗体类别或子类别的抗体中的对应序列相同或同源;以及此类抗体的片段,只要其展现本发明的生物活性即可(参见美国专利第4,816,567号;及morrison等人,proc.natl.acad.sci.usa,81:6851-6855(1984))。
[0090]
关于抗体或抗体部分的术语“半合成”意指抗体或抗体部分具有一个或多个天然存在的序列及一个或多个非天然存在的(亦即合成)序列。
[0091]“fv”为含有完整抗原识别及结合位点的最小抗体片段。此片段由紧密、非共价缔合的一个重链可变区域及一个轻链可变区域的二聚体组成。自此两个域的折叠发出六个高变环(各来自重链及轻链的3个环),其促进氨基酸残基的抗原结合且向抗体赋予抗原结合特异性。然而,即使单一可变域(或仅包含三个特异性针对抗原的cdr的fv的一半)能够识别及结合抗原,但亲和力比整个结合位点低。
[0092]“单链fv”(亦缩写为”sfv”或”scfv”)为包含连接至单一多肽链中的vh及vl抗体域的抗体片段。在一些实施方案中,scfv多肽在vh与vl域之间进一步包含多肽连接体,其使得scfv能够形成用于抗原结合的所需结构。关于scfv的综述,参见pluckthun,the pharmacology of monoclonal antibodies,第113卷,rosenburg及moore编springer-verlag,new york,第269-315页(1994)。
[0093]
术语“双功能抗体”指小抗体片段,其藉由在vh及vl域之间构筑通常具有短接头(如约5至约10个残基)的scfv片段(参见前述段落),使得实现v域的链间而非链内配对,产生二价片段,即具有两个抗原结合位点的片段而制备。双特异性双功能抗体为两个“交叉”scfv片段的杂二聚体,其中两个抗体的vh及vl域存在于不同多肽链上。双功能抗体更充分描述于例如ep 404,097;wo 93/11161;及hollinger等人,proc.natl.acad.sci.usa,90:6444-6448(1993)中。
[0094]
非人类(例如啮齿动物)抗体的“人源化”形式为含有源自非人类抗体的最小序列的嵌合抗体。在极大程度上,人源化抗体为人类免疫球蛋白(接受者抗体),其中来自接受者的高变区(hvr)的残基经来自诸如具有所需特异性、亲和力及能力的小鼠、大鼠、家兔或非人类灵长类动物的非人类物种(供体抗体)的高变区的残基置换。在一些情况下,人类免疫
球蛋白的框架区(fr)残基置换为相应非人类残基。此外,人源化抗体可包含在接受者抗体或供体抗体中未发现的残基。进行这些修饰以进一步改进抗体效能。一般而言,人源化抗体将包含大体上全部至少一个且通常两个可变域,其中全部或大体上全部高变环与非人类免疫球蛋白的那些区域相对应且全部或大体上全部fr为人类免疫球蛋白序列的那些区。人源化抗体视情况还将包含免疫球蛋白恒定区(fc)的至少一部分,通常,人类免疫球蛋白的恒定区的至少一部分。关于其他细节,参见jones等人,nature 321:522-525(1986);riechmann等人,nature 332:323-329(1988);及presta,curr.op.struct.biol.2:593-596(1992)。
[0095]
关于本文中鉴别的多肽及抗体序列的“氨基酸序列同一性百分比(%)”或“同源性”定义为在序列比对后,在考虑任何保守取代作为序列同一性的一部分的情况下,候选序列中与所比较多肽中氨基酸残基一致的氨基酸残基的百分比。出于测定氨基酸序列同一性百分比目的的比对可以此项技术中的技能范围内的各种方式达成,例如使用公开可获得的电脑软件,如blast、blast-2、align、megalign(dnastar)或muscle软件。本领域技术人员可确定用于测量比对的适当参数,包括用于达成所比较序列的全长内的最大比对所需的任何算法。然而,出于本文的目的,使用序列比较电脑程序muscle产生氨基酸序列同一性%值(edgar,r.c.,nucleic acids research 32(5):1792-1797,2004;edgar,r.c.,bmc bioinformatics 5(1):113,2004)。
[0096]
术语“fc受体”或“fcr”用于描述结合至抗体的fc区的受体。在一些实施方案中,本发明的fcr为结合igg抗体(γ受体)且包括fcγri、fcγrii及fcγriii子类的受体(包括这些受体的等位基因变体及交替剪接形式)的fcr。fcγrii受体包括fcγriia(“活化受体”)及fcγriib(“抑制受体”),两者具有主要在其细胞质域方面不同的类似氨基酸序列。活化受体fcγriia在其细胞质域中含有基于免疫受体酪氨酸的活化基序(itam)。抑制受体fcγriib在其细胞质域中含有基于免疫受体酪氨酸的抑制基序(itim)(参见综述m.,annu.rev.immunol.15:203-234(1997))。该术语包括同种异型,如fcγriiia同种异型:fcγriiia-phe158、fcγriiia-val158、fcγriia-r131及/或fcγriia-h131。fcr综述于ravetch及kinet,annu.rev.immunol 9:457-92(1991);capel等人,immunomethods 4:25-34(1994);及de haas等人,j.lab.clin.med.126:330-41(1995)中。其他fcr包括将来鉴别的fcr,由本文术语”fcr”涵盖。该术语亦包括新生儿受体fcrn,其负责输送母体igg至胎儿(guyer等人,j.immunol.117:587(1976)及kim等人,j.immunol.24:249(1994))。
[0097]
术语“fcrn”指新生儿fc受体(fcrn)。fcrn结构上类似于主要组织相容性复合体(mhc)且由非共价结合β2-微球蛋白的α链组成。新生儿fc受体fcrn的多种功能评述于ghetie及ward(2000)annu.rev.immunol.18,739-766中。fcrn在自母体向幼体被动传递免疫球蛋白igg及血清igg含量调节中起作用。fcrn可充当救助受体,其在细胞内与跨越细胞结合且输送完整形式的经胞饮igg,且将其自预设降解路径挽救。
[0098]
人类igg fc区的“ch1域”(亦称为“h1”域的“c1”)通常自约氨基酸118延伸至约氨基酸215(eu编号系统)。
[0099]“铰链区”通常定义为自人类igg1的glu216延伸至pro230(burton,molec.immunol.22:161-206(1985))。其他igg同型的铰链区可以藉由将形成重链间s-s键的第一个及最后一个半胱氨酸残基置放在相同位置而与igg1序列对齐。
[0100]
人类igg fc区的“ch2域”(亦称为“h2”域的“c2”)通常自约氨基酸231延伸至约氨基酸340。ch2域独特之处在于其不与另一域紧密配对。实际上,两个n-连接分支链碳水化合物链插入于完整天然igg分子的两个ch2域之间。已推测碳水化合物可为域-域配对提供替代品且帮助ch2域稳定化。burton,molec immunol.22:161-206(1985)。
[0101]“ch3域”(亦称为“c2”或“h3”域)包含fc区中的残基c端至ch2域(亦即抗体序列的约氨基酸残基341至c端,通常在igg的氨基酸残基446或447处)的序列段(stretch)。
[0102]“功能性fc片段”具有天然序列fc区的“效应功能”。例示性“效应功能”包括c1q结合;补体依赖性细胞毒性(cdc);fc受体结合;抗体依赖性细胞介导的细胞毒性(adcc);吞噬作用;下调细胞表面受体(例如b细胞受体;bcr)等。此类效应功能一般需要fc区与结合域(例如抗体可变域)组合且可使用本领域已知的各种分析评估。
[0103]
具有“经改变”fcr结合亲和力或adcc活性的变体igg fc的抗体为相比于亲本多肽或包含天然序列fc区的多肽,具有增强或减弱的fcr结合活性(例如fcγr或fcrn)及/或adcc活性的抗体。“展现”与fcr的“增加结合”的变体fc以相比于亲本多肽或天然序列igg fc较高的亲和力(例如较低表观kd或ic50值)结合至少一个fcr。根据一些实施方案,相比于亲本多肽的结合提高为约3倍(如约5、10、25、50、60、100、150、200或至多500倍中的任一项,或约25%至1000%)结合提高。“展现”与fcr的“减少结合”的多肽变体以相比于亲本多肽较低的亲和力(例如较高表观kd或较高ic50值)结合至少一个fcr。相比于亲本多肽的结合减少可为约40%或40%以上的结合减少。
[0104]“抗体依赖性细胞介导的细胞毒性”或”adcc”指某种形式的细胞毒性,其中所分泌的ig结合至存在于某些细胞毒性细胞(例如自然杀手(nk)细胞、嗜中性白血球及巨噬细胞)上的fc受体(fcr),使得这些细胞毒性效应细胞能够特异性结合至携带抗原的靶细胞且随后用细胞毒素杀死靶细胞。抗体“武装”细胞毒性细胞且对于此类杀死为绝对需要的。用于介导adcc的初级细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri、fcγrii及fcγriii。fcr在造血细胞上的表达概述于ravetch及kinet,annu.rev.immunol.9:457-92(1991)第464页的表3中。为了评估相关分子的adcc活性,可进行体外adcc分析,诸如美国专利第5,500,362号或5,821,337号中描述的分析。适用于此类分析的效应细胞包括周边血液单核细胞(pbmc)及天然杀手(nk)细胞。或者或另外,所关注的分子的adcc活性可在体内评估,例如在如揭示于clynes等人pnas(usa)95:652-656(1998)中的动物模型中。
[0105]
包含“展现增加的adcc”或在人类效应细胞存在下比具有野生型igg fc的多肽或亲本多肽有效地介导抗体依赖性细胞介导的细胞毒性(adcc)的变异fc区的多肽为在分析中具有变异fc区的多肽与具有野生型fc区的多肽(或亲本多肽)的量基本上相同时体外或体内实质上更有效调节adcc的多肽。一般而言,此类变体将使用本领域已知的任何体外adcc分析鉴别,如用于测定adcc活性的分析或方法,例如在动物模型中等。在一些实施方案中,变体比野生型fc(或亲本多肽)约5倍至约100倍(例如约25至约50倍)有效地调节adcc。
[0106]“补体依赖性细胞毒性”或“cdc”指靶细胞在补体存在下溶解。经典补体路径的活化藉由补体系统(c1q)的第一组分结合至(适当子类的)抗体起始,所述抗体结合至其同源抗原。为了评估补体活化,可进行cdc分析,例如如gazzano-santoro等人,j.immunol.methods 202:163(1996)中所述。具有改变的fc区氨基酸序列及增加或减少的c1q结合能力的多肽变体描述于美国专利第6,194,551b1号及wo99/51642中。那些专利公开
案的内容以引用的方式特别并入本文中。亦参见idusogie等人j.immunol.164:4178-4184(2000)。
[0107]
除非另外规定,否则“编码氨基酸序列的核苷酸序列”包括为彼此的简并形式且编码相同氨基酸序列的所有核苷酸序列。短语编码蛋白质或rna的核苷酸序列亦可包括内含子,其达到编码蛋白质的核苷酸序列可在一些型式中含有内含子的程度。
[0108]
术语“可操作地连接”指调节序列与异源核酸序列之间的功能键,其导致后者的表达。举例而言,当第一核酸序列与第二核酸序列处于功能性关系时,第一核酸序列可操作地连接第二核酸序列。举例而言,若启动子影响编码序列的转录或表达,则启动子可操作地连接于编码序列。一般而言,可操作地连接的dna序列为连续的,且当必需接合两个蛋白质编码区时,在相同阅读框架中。
[0109]“同源”指两个多肽之间或两个核酸分子之间的序列相似性或序列同一性。当两个比较序列中的一个位置由相同碱基或氨基酸单体亚基占据时,例如若两个dna分子中的每一者中的一个位置由腺嘌呤占据,则所述分子在该位置处同源。两个序列之间的同源性%为两个序列共用的匹配或同源位置的数量除以所比较位置的数量乘以100的函数。举例而言,若两个序列中的6/10个位置匹配或同源,则两个序列为60%同源。举例而言,dna序列attgcc及tatggc共有50%同源性。一般而言,当两个序列经对准以产生最大百分比同源时进行比较。
[0110]
如本文中所揭示的抗amc构建体或组合物的“有效量”为足以进行特定陈述目的的量。”有效量”可凭经验及藉由与所述目的相关的已知方法确定。
[0111]
术语“治疗有效量”指有效“治疗”个体中的疾病或病症的如本文中所揭示的抗amc构建体或组合物的量。在癌症的情形下,如本文所揭示的抗amc构建体或组合物或组合物的治疗有效量可减少癌细胞数目;减少肿瘤尺寸或重量;抑制(亦即在一定程度上减缓且优选终止)癌细胞浸润至周边器官中;抑制(亦即在一定程度上减缓或终止)肿瘤转移;在一定程度上抑制肿瘤生长;及/或在一定程度上减少一种或多种与癌症相关的症状。在如本文中所揭示的抗amc构建体或组合物可阻止生长及/或杀死现有癌细胞的程度上,其可为细胞生长抑制及/或细胞毒性的。在一些实施方案中,治疗有效量为生长抑制量。在一些实施方案中,治疗有效量为延长患者存活期的量。在一些实施方案中,治疗有效量为改良患者的无进展存活期的量。
[0112]
如本文所使用,“医药学上可接受”或“药理学上相容”意指不为生物学上或其他方面不适宜的物质,亦即,该物质可并入施用患者的药物组合物中而不会引起任何显著不当生物学作用或以有害方式与含有其的组合物的任何其他组分相互作用。医药学上可接受的载剂或赋形剂优选满足毒理学及制造测试的所要求标准及/或包括于美国食品药物管理局(u.s.food and drug administration)制定的非活性成分导引(inactive ingredient guide)中。
[0113]
术语“标记”当在本文中使用时指可直接或间接结合至抗amc抗体部分的可检测化合物或组合物。标记可自身可检测(例如放射性同位素标记或萤光标记),或在酶标记的情况下,可催化底物化合物或组合物的化学改变,此改变为可检测的。
[0114]
应了解,本文所述的本发明实施方案包括“由”实施方案“组成”及/或“基本上由”实施方案“组成”。
[0115]
本文中提及“约”包括(且描述)针对该值或参数本身的变化。举例而言,提及“约x”的描述包括“x”的描述。
[0116]
如本文所用,提及“不为”一值或参数一般意指及描述“除”一值或参数“以外”。举例而言,方法不用于治疗x型癌症意指方法用于治疗除x以外的类型的癌症。
[0117]
除非上下文另外明确指示,否则如本文中及所附申请专利范围中所使用,单数形式”一(a/an)”及”该”包括复数个指示物。
[0118]
抗amc构建体
[0119]
在一方面中,本发明提供afp/mhc i类复合体特异性构建体(抗amc构建体),其包含特异性结合包含afp肽及mhc i类蛋白质的复合体(“afp/mhc i类复合体”或“amc”)的抗体部分。抗amc构建体的特异性来源于特异性结合amc的抗amc抗体部分,如全长抗体或其抗原结合片段。在一些实施方案中,提及特异性结合包含afp肽及mhc i类蛋白质的复合体的部分(如抗体部分)意指该部分在如下情况下结合至amc:a)为其对于全长afp、游离afp肽、不结合至肽的mhc i类蛋白质及结合至非afp肽的mhc i类蛋白质中的每一种的结合亲和力的至少约10(包括例如至少约10、20、30、40、50、75、100、200、300、400、500、750、1000或1000以上中的任一项)倍的亲和力;或b)不超过其结合至全长afp、游离afp肽、不结合至肽的mhc i类蛋白质及结合至非afp肽的mhc i类蛋白质中每一种的kd的约1/10(如不超过约1/10、1/20、1/30、1/40、1/50、1/75、1/100、1/200、1/300、1/400、1/500、1/750、1/1000或1/1000以下中的任一项)倍的kd。结合亲和力可藉由本领域已知的方法,如elis荧光活化细胞分选(facs)分析或放射免疫沉淀分析(ria)测定。kd可藉由本领域已知的方法,如利用例如biacore仪器的表面等离子共振(spr)分析,或利用例如sapidyne仪器的动力学排除分析(kinexa)测定。
[0120]
预期的抗amc构建体包括例如全长抗amc抗体、多特异性(如双特异性)抗amc分子、抗amc嵌合抗原受体(car)及抗amc免疫缀合物。
[0121]
举例而言,在一些实施方案中,提供抗amc构建体(如经分离抗amc构建体),其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01(genbank登录号:aao20853)。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,抗amc构建体结合amc,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4、5或6个中的任一项)包含mhc i类蛋白质及具有一个氨基酸取代(如保守氨基酸取代)的afp肽的变体的复合体交叉反应。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4或5个中的任一项)包含afp肽及mhc i类蛋白质的不同亚型的复合体交叉反应。
[0122]
在一些实施方案中,提供抗amc构建体,其包含特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的抗amc抗体部分。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体
为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,抗amc构建体结合amc,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4、5或6个中的任一项)包含mhc i类蛋白质及具有一个氨基酸取代(如保守氨基酸取代)的afp肽的变体的复合体交叉反应。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4或5个中的任一项)包含afp肽及mhc i类蛋白质的不同亚型的复合体交叉反应。
[0123]
在一些实施方案中,提供包含以下的抗amc构建体:特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,抗amc构建体结合amc,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4、5或6个中的任一项)包含mhc i类蛋白质及具有一个氨基酸取代(如保守氨基酸取代)的afp肽的变体的复合体交叉反应。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4或5个中的任一项)包含afp肽及mhc i类蛋白质之不同亚型的复合体交叉反应。
[0124]
在一些实施方案中,提供包含以下的抗amc构建体:特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,其中抗amc抗体部分包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域序列,包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列
(且在一些实施方案中由其组成);或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,抗amc构建体结合amc,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4、5或6个中的任一项)包含mhc i类蛋白质及具有一个氨基酸取代(如保守氨基酸取代)的afp肽的变体的复合体交叉反应。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4或5个中的任一项)包含afp肽及mhc i类蛋白质的不同亚型的复合体交叉反应。
[0125]
在一些实施方案中,提供包含以下的抗amc构建体:特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,其中抗amc抗体部分包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列(且在一些实施方案中由其组成);hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列(且在一些实施方案中由其组成);及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(例如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列(且在一些实施方案中由其组成);lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列(且在一些实施方案中由其组成);及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列(且在一些实施方案中由其组成);或其包含至多约5(例如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,抗amc构建体结合amc,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4、5或6个中的任一项)包含mhc i类蛋白质及具有一个氨基酸取代(如保守氨基酸取代)的afp肽的变体的复合体交叉反应。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4或5个中的任一项)包含afp肽及mhc i类蛋白质之不同亚型的复合体交叉反应。
[0126]
在一些实施方案中,提供包含以下的抗amc构建体:特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,其中抗amc抗体部分包含:重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列(且在一些实施方案中由其组成),或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列(且在一些实施方案中由其组成),或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在
一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,抗amc构建体结合amc,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4、5或6个中的任一项)包含mhc i类蛋白质及具有一个氨基酸取代(如保守氨基酸取代)的afp肽的变体的复合体交叉反应。在一些实施方案中,抗amc构建体与至少一个(如至少2、3、4或5个中的任一项)包含afp肽及mhc i类蛋白质的不同亚型的复合体交叉反应。
[0127]
在一些实施方案中,提供抗amc构建体,其包含与根据本文所述的抗amc抗体部分中的任一项的第二抗amc抗体部分竞争结合至靶afp/mhc i类复合体的第一抗amc抗体部分。在一些实施方案中,第一抗amc抗体部分与第二抗amc抗体部分结合至相同,或大体上相同的表位。在一些实施方案中,第一抗amc抗体部分与靶afp/mhc i类复合体的结合抑制第二抗amc抗体部分与靶afp/mhc i类复合体的结合至少约70%(如至少约75%、80%、85%、90%、95%、98%或99%中的任一项),或反之亦然。在一些实施方案中,第一抗amc抗体部分及第二抗amc抗体部分交叉竞争结合至靶afp/mhc i类复合体,即第一及第二抗体部分中的每一种彼此竞争结合至靶afp/mhc i类复合体。
[0128]
不同方面更详细地论述于下文各部分中。
[0129]
抗amc抗体部分
[0130]
抗amc构建体包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分。
[0131]
在一些实施方案中,抗amc抗体部分特异性结合存在于细胞表面上的amc。在一些实施方案中,细胞在其表面上存在异常高含量的afp。在一些实施方案中,该细胞为癌细胞。在一些实施方案中,癌细胞系在实体肿瘤中。在一些实施方案中,癌细胞为转移性癌细胞。
[0132]
在一些实施方案中,afp肽为mhc i类限制肽。在一些实施方案中,afp肽的长度为约8至约12(如约8、9、10、11或12中的任一项)个氨基酸。在一些实施方案中,afp肽衍生自人类afp(hafp)、小鼠afp(mafp)或大鼠afp(rafp)。
[0133]
在一些实施方案中,afp肽衍生自hafp。在一些实施方案中,afp肽包含以下各项的序列(且在一些实施方案中由其组成):hafp的氨基酸137-145(plfqvpepv,seq id no:3)、hafp的氨基酸158-166(fmnkfiyei,seq id no:4,在本文中亦称为“afp158”)、hafp的氨基酸325-334(glspnlnrfl,seq id no:5),或hafp的氨基酸542-50(gvalqtmkq,seq id no:6)。
[0134]
在一些实施方案中,afp肽衍生自mafp。在一些实施方案中,afp肽包含mafp的氨基酸154-162的序列(fmnrfiyev,seq id no:16)。
[0135]
在一些实施方案中,mhc i类蛋白质为hla-a、hla-b、hla-c、hla-e、hla-f或hla-g。在一些实施方案中,mhc i类蛋白质为hla-a。在一些实施方案中,hla-a为hla-a02。在一些实施方案中,hla-a02为hla-a*02:01。
[0136]
在一些实施方案中,抗amc抗体部分为全长抗体。在一些实施方案中,抗amc抗体部分为抗原结合片段,例如选自由以下组成的组的抗原结合片段:fab、fab'、f(ab')2、fv片段、二硫键稳定性fv片段(dsfv)及单链抗体分子(scfv)。在一些实施方案中,抗amc抗体部
i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体。在一些实施方案中,抗amc抗体部分另外结合至以下中的至少一项(包括至少约2、3、4、5、6或7项中的任一情形):包含seq id no:7的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:8的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:9的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:10的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:11的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:12的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;及包含seq id no:13的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体。
[0144]
在一些实施方案中,抗amc抗体部分特异性结合:包含seq id no:4的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:10的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:11的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:12的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;及包含seq id no:13的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体。
[0145]
在一些实施方案中,抗amc抗体部分特异性结合:包含seq id no:4的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:7的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:8的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体。
[0146]
在一些实施方案中,抗amc抗体部分特异性结合:包含seq id no:4的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:8的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:10的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:11的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:12的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;及包含seq id no:13的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体。
[0147]
在一些实施方案中,抗amc抗体部分特异性结合:包含seq id no:4的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:7的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:13的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体。
[0148]
在一些实施方案中,抗amc抗体部分特异性结合:包含seq id no:4的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:7的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:9的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;包含seq id no:11的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体;及包含seq id no:13的afp肽及mhc i类蛋白质(如hla-a02,例如hla-a*02:01)的复合体。
[0149]
在一些实施方案中,抗amc抗体部分特异性结合包含afp158(seq id no:4)及hla-a*02:01的复合体。在一些实施方案中,抗amc抗体部分与以下中的至少一项(包括至少约2、3、4、5或6项中的任一情形)交叉反应:包含afp158(seq id no:4)及hla-a*02:02(genbank
登录号:afl91480)的复合体、包含afp158(seq id no:4)及hla-a*02:03(genbank登录号:aaa03604)的复合体、包含afp158(seq id no:4)及hla-a*02:05(genbank登录号:aaa03603)的复合体、包含afp158(seq id no:4)及hla-a*02:06(genbank登录号:ccb78868)的复合体、包含afp158(seq id no:4)及hla-a*02:07(genbank登录号:acr55712)的复合体、及包含afp158(seq id no:4)及hla-a*02:11(genbank登录号:cab56609)的复合体。在一些实施方案中,抗amc抗体部分与以下中的每一种交叉反应:包含afp158(seq id no:4)及hla-a*02:02的复合体、包含afp158(seq id no:4)及hla-a*02:03的复合体及包含afp158(seq id no:4)及hla-a*02:11的复合体。在一些实施方案中,抗amc抗体部分与以下中的每一种交叉反应:包含afp158(seq id no:4)及hla-a*02:02的复合体、包含afp158(seq id no:4)及hla-a*02:05的复合体、包含afp158(seq id no:4)及hla-a*02:06的复合体、包含afp158(seq id no:4)及hla-a*02:07的复合体、及包含afp158(seq id no:4)及hla-a*02:11的复合体。
[0150]
在一些实施方案中,抗amc抗体部分为包含全人类序列及一个或多个合成区的半合成抗体部分。在一些实施方案中,抗amc抗体部分为包含全人类轻链可变域及半合成重链可变域的半合成抗体部分,该半合成重链可变域包含全人类fr1、hc-cdr1、fr2、hc-cdr2、fr3及fr4区及合成hc-cdr3。在一些实施方案中,半合成重链可变域包含全合成hc-cdr3,其具有长度为约5至约25(如约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25中的任一项)个氨基酸的序列。在一些实施方案中,半合成重链可变域或合成hc-cdr3获自半合成库(如半合成人类库),其包含具有长度为约5至约25(如约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或25中的任一项)个氨基酸的序列的全合成hc-cdr3,其中序列中的各氨基酸随机选自标准人类氨基酸,减去半胱氨酸。在一些实施方案中,合成hc-cdr3的长度为约10至约19(如约10、11、12、13、14、15、16、17、18或19中的任一项)个氨基酸。
[0151]
在一些实施方案中,抗amc抗体部分包含特定序列或此类序列的某些变体。在一些实施方案中,变异序列中的氨基酸取代不大体上减弱抗amc抗体部分结合amc的能力。举例而言,可进行不大体上减弱amc结合亲和力的改变。亦涵盖大体上改良amc结合亲和力或影响一些其他特性,如特异性及/或与amc的相关变体的交叉反应性的改变。
[0152]
在一些实施方案中,抗amc抗体部分包含i)重链可变域,其包含hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸。
[0153]
在一些实施方案中,抗amc抗体部分包含i)重链可变域,其包含hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸。
[0154]
在一些实施方案中,抗amc抗体部分包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序
cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0161]
在一些实施方案中,抗amc抗体部分包含i)重链可变域,其包含hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域,其包含lc-cd3,包含seq id no:110-119中的任一项的氨基酸序列。
[0162]
在一些实施方案中,抗amc抗体部分包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0163]
在一些实施方案中,抗amc抗体部分包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或包含至多约3(如1、2或3中的任一项)个氨基酸取代之其变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列。
[0164]
在一些实施方案中,抗amc抗体部分包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0165]
在一些实施方案中,抗amc抗体部分包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,其
中氨基酸取代系在hc-cdr1或hc-cdr2中;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,其中氨基酸取代系在hc-cdr1或hc-cdr2中。
[0166]
在一些实施方案中,抗amc抗体部分包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列。本文中提及的hc-cdr的序列提供于下表3中且本文中提及的lc-cdr提供于下表4中。
[0167]
表3
[0168][0169]
表4
[0170][0171][0172]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:17-26中
的任一项的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%(包括例如至少96%、97%、98%或99%中的任一项)序列同一性的变体。
[0173]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列。
[0174]
重链及轻链可变域可以各种成对组合来组合以产生多种抗amc抗体部分。
[0175]
举例而言,在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:67的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:77的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:90的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:100的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:110的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0176]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:67的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:77的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:100的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:110的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0177]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:67的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:77的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:100的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:110的氨基酸序列。
[0178]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:58的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:68的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:78的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:91的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:101的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:111的氨基酸序列,或其包含至多约5(如约1、2、
no:80的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:93的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:103的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:113的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0185]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:60的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:70的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:80的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:93的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:103的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:113的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0186]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:60的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:70的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:80的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:93的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:103的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:113的氨基酸序列。
[0187]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:61的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:71的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:81的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:94的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:104的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:114的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0188]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:61的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:71的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:81的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:94的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:104的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:114的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0189]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:61的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:71的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:81的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:94的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:104的氨基
酸序列,及lc-cdr3,该lc-cdr3包含seq id no:114的氨基酸序列。
[0190]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:62的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:72的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:82的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:95的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:105的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:115的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0191]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:62的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:72的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:82的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:95的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:105的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:115的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0192]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:62的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:72的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:82的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:95的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:105的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:115的氨基酸序列。
[0193]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:63的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:73的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:83的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:96的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:106的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:116的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0194]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:63的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:73的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:83的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:96的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:106的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:116的氨基酸序列,或其包含至多约5(如约1、2、
3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0195]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:63的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:73的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:83的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:96的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:106的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:116的氨基酸序列。
[0196]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:64的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:74的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:84的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:97的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:107的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:117的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0197]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:64的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:74的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:84的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:97的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:107的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:117的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0198]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:64的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:74的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:84的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:97的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:107的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:117的氨基酸序列。
[0199]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:65的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:75的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:85的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:98的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:108的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:118的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0200]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1
包含seq id no:65的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:75的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:85的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:98的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:108的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:118的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0201]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:65的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:75的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:85的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:98的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:108的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:118的氨基酸序列。
[0202]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:66的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:76的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:86的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及轻链可变域,包含lc-cdr1,该lc-cdr1包含seq id no:99的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:109的氨基酸序列,或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:119的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。
[0203]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:66的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:76的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:86的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:99的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:109的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:119的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。
[0204]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:66的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:76的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:86的氨基酸序列;及轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:99的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:109的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:119的氨基酸序列。
[0205]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:17中所阐述的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:17中所阐述的氨基酸序列,及轻链可变域,包含seq id no:27中所阐述的氨基酸序列。
[0206]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:18中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:28中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:18中所阐述的氨基酸序列,及轻链可变域,包含seq id no:28中所阐述的氨基酸序列。
[0207]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:19中所阐述的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:29中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:19中所阐述的氨基酸序列,及轻链可变域,包含seq id no:29中所阐述的氨基酸序列。
[0208]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:20中所阐述的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:30中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:20中所阐述的氨基酸序列,及轻链可变域,包含seq id no:30中所阐述的氨基酸序列。
[0209]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:21中所阐述的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:31中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:21中所阐述的氨基酸序列,及轻链可变域,包含seq id no:31中所阐述的氨基酸序列。
[0210]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:22中所阐述的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:32中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:22中所阐述的氨基酸序列,及轻链可变域,包含seq id no:32中所阐述的氨基酸序列。
[0211]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:23中所阐述的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:33中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:23中所阐述的氨基酸序列,及轻链可变域,包含seq id no:33中所阐述的氨基酸序列。
[0212]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:24中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:34中所阐述的氨基酸序列,或其
具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:24中所阐述的氨基酸序列,及轻链可变域,包含seq id no:34中所阐述的氨基酸序列。
[0213]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:25中所阐述的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:35中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:25中所阐述的氨基酸序列,及轻链可变域,包含seq id no:35中所阐述的氨基酸序列。
[0214]
在一些实施方案中,抗amc抗体部分包含重链可变域,其包含seq id no:26中所阐述的氨基酸序列,或其具有至少约95%(包括例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:36中所阐述的氨基酸序列,或其具有至少约95%序列同一性的变体。在一些实施方案中,抗amc抗体部分包含重链可变域,包含seq id no:26中所阐述的氨基酸序列,及轻链可变域,包含seq id no:36中所阐述的氨基酸序列。
[0215]
在一些实施方案中,抗amc抗体部分与根据本文所述的抗amc抗体部分中的任一项的第二抗amc抗体部分竞争结合至靶afp/mhc i类复合体。在一些实施方案中,抗amc抗体部分与第二抗amc抗体部分结合至相同,或大体上相同的表位。在一些实施方案中,抗amc抗体部分与靶afp/mhc i类复合体的结合抑制第二抗amc抗体部分与靶afp/mhc i类复合体的结合至少约70%(如至少约75%、80%、85%、90%、95%、98%或99%中的任一项),或反之亦然。在一些实施方案中,抗amc抗体部分及第二抗amc抗体部分交叉竞争结合至靶afp/mhc i类复合体,即抗体部分中的每一种与另一者竞争结合至靶afp/mhc i类复合体。
[0216]
全长抗amc抗体
[0217]
在一些实施方案中,抗amc构建体为包含抗amc抗体部分的全长抗体(在本文中亦称为“全长抗amc抗体”)。在一些实施方案中,全长抗体为单克隆抗体。
[0218]
在一些实施方案中,全长抗amc抗体包含来自免疫球蛋白,如iga、igd、ige、igg及igm的fc序列。在一些实施方案中,全长抗amc抗体包含igg,如igg1、igg2、igg3或igg4中的任一项的fc序列。在一些实施方案中,全长抗amc抗体包含人类免疫球蛋白的fc序列。在一些实施方案中,全长抗amc抗体包含小鼠免疫球蛋白的fc序列。在一些实施方案中,全长抗amc抗体包含已经变更或另外改变以使其具有增强的抗体依赖性细胞毒性(adcc)或补体依赖性细胞毒性(cdc)效应功能的fc序列。
[0219]
因此,举例而言,在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)fc区。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的抗amc抗体部分,及b)fc区。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0220]
在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp肽及
mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,及b)fc区。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0221]
在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,及b)fc区。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0222]
在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0223]
在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项
的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体;及b)fc区。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0224]
在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;及b)fc区。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0225]
在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%序列同一性的变体;及b)fc区。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0226]
在一些实施方案中,提供包含以下的全长抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列;及b)fc区。在一些实施方案中,fc区包含igg1 fc序列。在一些实施方案中,fc区包含人类igg1 fc序列。在一些实施方案中,fc区包含小鼠igg1 fc序列。
[0227]
在一些实施方案中,全长抗amc抗体结合至包含afp肽及mhc i类蛋白质的复合体,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,全长抗amc抗体结合至包含afp肽及mhc i类蛋白质的复合体,结合的kd在约1pm至约250pm之间(如约1、10、25、50、75、100、150、200或250pm中的任一项,包括这些值之间的任何范围)。
[0228]
多特异性抗amc分子
[0229]
在一些实施方案中,抗amc构建体包含多特异性抗amc分子,其包含抗amc抗体部分及第二结合部分(如第二抗原结合部分)。在一些实施方案中,多特异性抗amc分子包含抗amc抗体部分及第二抗原结合部分。
[0230]
多特异性分子为对于至少两种不同抗原或表位具有结合特异性的分子(例如双特
异性抗体对两种抗原或表位具有结合特异性)。亦涵盖具有超过两个价及/或特异性的多特异性分子。举例而言,可制备三特异性抗体。tutt等人j.immunol.147:60(1991)。应了解,本领域技术人员可选择本文所述的个别多特异性分子的适当特征以彼此组合而形成本发明的多特异性抗amc分子。
[0231]
因此,举例而言,在一些实施方案中,提供包含以下的多特异性(例如双特异性)抗amc分子:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)第二结合部分(如抗原结合部分)。在一些实施方案中,第二结合部分特异性结合包含结合至mhc i类蛋白质的不同afp肽的复合体。在一些实施方案中,第二scfv特异性结合包含结合至不同mhc i类蛋白质的afp肽的复合体。在一些实施方案中,第二结合部分特异性结合包含结合至mhc i类蛋白质的afp肽的复合体上的不同表位。在一些实施方案中,第二结合部分特异性结合不同抗原。在一些实施方案中,第二结合部分特异性结合细胞,如细胞毒性细胞表面上的抗原。在一些实施方案中,第二结合部分特异性结合淋巴细胞,如t细胞、nk细胞、中性粒细胞、单核细胞、巨噬细胞或树突状细胞表面上的抗原。在一些实施方案中,第二结合部分特异性结合效应t细胞,如细胞毒性t细胞(亦称为细胞毒性t淋巴细胞(ctl)或t杀手细胞)。
[0232]
在一些实施方案中,提供包含以下的多特异性抗amc分子:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)特异性结合cd3的第二抗原结合部分。在一些实施方案中,第二抗原结合部分特异性结合cd3ε。在一些实施方案中,第二抗原结合部分特异性结合cd3ε的激动表位(agonistic epitope)。如本文所用,术语“激动表位”意指(a)当结合多特异性分子时,视情况当结合相同细胞上的若干多特异性分子时,允许所述多特异性分子活化tcr信号传导且诱导t细胞活化的表位,及/或(b)仅由cd3之ε链的氨基酸残基组成且当以自然情境呈现于t细胞上(亦即由tcr、cd3γ链等围绕)时,对于经多特异性分子结合为可及的表位,及/或(c)当结合多特异性分子时,不导致cd3ε相对于cd3γ的空间位置稳定化的表位。
[0233]
在一些实施方案中,提供包含以下的多特异性抗amc分子:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)特异性结合效应细胞,包括例如cd3γ、cd3δ、cd3ε、cd3ζ、cd28、cd16a、cd56、cd68及gds2d表面上的抗原的第二抗原结合部分。
[0234]
在一些实施方案中,提供包含以下的多特异性抗amc分子:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)特异性结合补体系统的组分,如c1q的第二抗原结合部分。c1q为活化血清补体系统之c1酶复合体的亚基。
[0235]
在一些实施方案中,第二抗原结合部分特异性结合fc受体。在一些实施方案中,第二抗原结合部分特异性结合fcγ受体(fcγr)。fcγr可为存在于自然杀手(nk)细胞表面上的fcγriii或存在于巨噬细胞、单核细胞、嗜中性白血球及/或树突状细胞表面上的fcγri、fcγriia、fcγriibi、fcγriib2及fcγriiib中的一种。在一些实施方案中,第二抗原结合部分为fc区或其功能片段。如在此上下文中所使用的“功能片段”指仍能够以足够特异性及亲和力结合至fcr,特定言之fcγr以允许携带fcγr的效应细胞,特定言之巨噬细胞、单核细胞、中性粒细胞及/或树突状细胞藉由细胞毒性溶解或噬菌作用杀死靶细胞的抗体fc区片段。功能性fc片段能够竞争性地抑制初始、全长fc部分与诸如活化fcγri的fcr的结合。在一些实施方案中,功能性fc片段保持至少30%、40%、50%、60%、70%、80%、90%或
95%其与活化fcγr的亲和力。在一些实施方案中,fc区或其功能片段为增强型fc区或其功能片段。如本文所用,术语“增强型fc区”指经修饰以增强fc受体介导的效应功能,特定言之抗体依赖性细胞介导的细胞毒性(adcc)、补体依赖性细胞毒性(cdc)及抗体介导的噬菌作用的fc区。这可如本领域已知地实现,例如藉由以导致活化受体(例如表达于自然杀手(nk)细胞上的fcγriiia(cd16a))增加的亲和力及/或与抑制受体(例如fcγriib1/b2(cd32b))减少的结合的方式更改fc区。在其他实施方案中,第二抗原结合部分为抗体或其抗原结合片段,其以足够特异性及亲和力特异性结合fcr,尤其结合fcγr以允许携有fcγr的效应细胞,特定言之巨噬细胞、单核细胞、中性粒细胞及/或树突状细胞藉由细胞毒性溶解或噬菌作用杀死靶细胞。
[0236]
在一些实施方案中,多特异性抗amc分子允许杀死amc呈递靶细胞及/或可有效地重定向ctl以溶解amc呈递靶细胞。在一些实施方案中,本发明的多特异性(例如双特异性)抗amc分子显示介于10至500ng/ml范围内的体外ec50,且能够在约1:1至约50:1(如约1:1至约15:1,或约2:1至约10:1)的ctl与靶细胞之比下经由ctl诱导约50%靶细胞的重定向溶解。
[0237]
在一些实施方案中,多特异性(例如双特异性)抗amc分子能够交联经刺激或未刺激的ctl及靶细胞,以此方式使得靶细胞溶解。此提供如下优势:不产生靶特异性t细胞克隆或不需要藉由树突状细胞的共同抗原呈递以使得多特异性抗amc分子发挥其所需活性。在一些实施方案中,本发明的多特异性抗amc分子能够重定向ctl以在不存在其他活化信号的情况下溶解靶细胞。在一些实施方案中,多特异性抗amc分子的第二抗原结合部分特异性结合cd3(例如特异性结合cd3ε),且不需要经由cd28及/或il-2的信号传导来重定向ctl以溶解靶细胞。
[0238]
测量多特异性抗amc分子同时结合至两个抗原(例如两种不同细胞上的抗原)的偏好的方法在本领域技术人员的正常能力内。举例而言,当第二结合部分特异性结合cd3时,多特异性抗amc分子可与cd3+/afp-细胞及cd3-/afp+细胞的混合物接触。多特异性抗amc分子阳性单细胞的数量及藉由多特异性抗amc分子交联的细胞的数量可接着藉由本领域已知的显微术或荧光活化细胞分选(facs)评估。
[0239]
举例而言,在一些实施方案中,提供包含以下的多特异性抗amc分子:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)第二抗原结合部分。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,第二抗原结合部分特异性结合包含结合至mhc i类蛋白质的不同afp肽的复合体。在一些实施方案中,第二抗原结合部分特异性结合包含结合至不同mhc i类蛋白质的afp肽的复合体。在一些实施方案中,第二抗原结合部分特异性结合包含结合至mhc i类蛋白质的afp肽的复合体上的不同表位。在一些实施方案中,第二抗原结合部分特异性结合另一抗原。在一些实施方案中,第二抗原结合部分特异性结合细胞,如amc呈递细胞表面上的抗原。在一些实施方案中,第二抗原结合部分特异性结合不表达afp的细胞表面上的抗原。在一些实施方案中,第二抗原结合部分特异性结合细胞毒性细胞表面上的抗原。在一些实施方案中,第二抗原结合部分特异性结合淋巴细胞,如t细胞、nk细胞、中性粒细胞、单核细胞、巨噬细胞或树突状细胞表面上的抗原。在一些实施方案中,第二抗原结合部分特异性结合效应t细胞,如细胞毒性t细
cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及b)第二抗原结合部分。
[0244]
在一些实施方案中,提供包含以下的多特异性抗amc分子:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体;及b)第二抗原结合部分。
[0245]
在一些实施方案中,提供包含以下的多特异性抗amc分子:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;及b)第二抗原结合部分。
[0246]
在一些实施方案中,提供包含以下的多特异性抗amc分子:a)抗amc抗体部分,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%序列同一性的变体;及b)第二scfv。
[0247]
在一些实施方案中,提供包含以下的多特异性抗amc分子:a)抗amc抗体部分,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列;及b)第二抗原结合部分。
[0248]
在一些实施方案中,多特异性抗amc分子为例如双功能抗体(db)、单链双功能抗体(scdb)、串联scdb(tandab)、线性二聚scdb(ld-scdb)、圆形二聚scdb(cd-scdb)、二-双功能抗体、串联scfv、串联二-scfv(例如双特异性t细胞接合分子)、串联三-scfv、三功能抗体、双特异性fab2、二-微型抗体、四功能抗体、scfv-fc-scfv融合体、双亲和力再靶向(dart)抗体、双可变域(dvd)抗体、igg-scfab、scfab-ds-scfv、fv2-fc、igg-scfv融合体、坞锁(dock and lock;dnl)抗体、杵-臼(knob-into-hole;kih)抗体(藉由kih技术制备的双特异性igg)、duobody(藉由duobody技术制备的双特异性igg)、异多聚体抗体或异结合物抗体。在一些实施方案中,多特异性抗amc分子为串联scfv(例如串联二-scfv,如双特异性t细胞接合分子)。
[0249]
串联scfv
[0250]
在一些实施方案中,多特异性抗amc分子为串联scfv,其包含含抗amc抗体部分的
id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,及b)第二scfv。
[0255]
在一些实施方案中,提供包含以下的串联scfv多特异性(例如双特异性)抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及b)第二scfv。
[0256]
在一些实施方案中,提供包含以下的串联scfv多特异性(例如双特异性)抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体;及b)第二scfv。
[0257]
在一些实施方案中,提供包含以下的串联scfv多特异性(例如双特异性)抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;及b)第二scfv。
[0258]
在一些实施方案中,提供包含以下的串联scfv多特异性(例如双特异性)抗amc抗体:a)第一scfv,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%序列同一
性的变体;及b)第二scfv。
[0259]
在一些实施方案中,提供包含以下的串联scfv多特异性(例如双特异性)抗amc抗体:a)第一scfv,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列;及b)第二scfv。
[0260]
在一些实施方案中,提供包含以下的串联scfv多特异性(例如双特异性)抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,及b)第二scfv,其中串联scfv多特异性抗amc抗体为串联二-scfv或串联三-scfv。在一些实施方案中,串联scfv多特异性抗amc抗体为串联二-scfv。在一些实施方案中,串联scfv多特异性抗amc抗体为双特异性t细胞接合分子。
[0261]
举例而言,在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,及b)特异性结合t细胞表面上的抗原的第二scfv。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,第二scfv特异性结合效应t细胞,如细胞毒性t细胞表面上的抗原。在一些实施方案中,第二scfv特异性结合选自例如由以下组成的组的抗原:cd3γ、cd3δ、cd3ε、cd3ζ、cd28、ox40、gitr、cd137、cd27、cd40l及hvem。在一些实施方案中,第二scfv特异性结合t细胞表面上的抗原上之激动表位,其中第二scfv与抗原的结合增强t细胞活化。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0262]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的第一scfv,及b)特异性结合t细胞表面上的抗原的第二scfv。
[0263]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,及b)特异性结合t细胞表面上的抗原的第二scfv。
[0264]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,
其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,及b)特异性结合t细胞表面上的抗原的第二scfv。
[0265]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及b)特异性结合t细胞表面上的抗原的第二scfv。
[0266]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体,及b)特异性结合t细胞表面上的抗原的第二scfv。
[0267]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;及b)特异性结合t细胞表面上的抗原的第二scfv。
[0268]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)第一scfv,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%、99%中的任一项)序列同一性的变体,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及b)特异性结合t细胞表面上的抗原的
第二scfv。
[0269]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)第一scfv,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列,及b)特异性结合t细胞表面上的抗原的第二scfv。
[0270]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,第一scfv经由与肽接头之键联融合至第二scfv。在一些实施方案中,肽接头之长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0271]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的第一scfv,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头之键联融合至第二scfv。在一些实施方案中,肽接头之长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0272]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头的键联融合至第二scfv。在一些实施方案中,肽接头之长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0273]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头的键联融合至第二scfv。在一些实施方案中,肽接头之长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0274]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头的键联融合至第二scfv。在一些实施方案中,肽接头的长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0275]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序
列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头的键联融合至第二scfv。在一些实施方案中,肽接头的长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0276]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的第一scfv,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头的键联融合至第二scfv。在一些实施方案中,肽接头的长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0277]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)第一scfv,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%、99%中的任一项)序列同一性的变体,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头的键联融合至第二scfv。在一些实施方案中,肽接头的长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合成的。
[0278]
在一些实施方案中,提供包含以下的串联二-scfv双特异性抗amc抗体:a)第一scfv,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列,及b)特异性结合cd3ε的第二scfv。在一些实施方案中,第一scfv经由与肽接头的键联融合至第二scfv。在一些实施方案中,肽接头的长度在约5至约20(如约5、10、15或20中的任一项,包括这些值之间的任何范围)个氨基酸之间。在一些实施方案中,肽接头包含氨基酸序列ggggs(且在一些实施方案中由其组成)。在一些实施方案中,第一scfv为人类、人源化或半合成的。在一些实施方案中,第二scfv为人类、人源化或半合成的。在一些实施方案中,第一scfv及第二scfv均为人类、人源化或半合
成的。
[0279]
在一些实施方案中,串联二-scfv双特异性抗amc抗体结合至包含afp肽及mhc i类蛋白质的复合体,结合的kd在约0.1pm至约500nm之间(如约0.1pm、1.0pm、10pm、50pm、100pm、500pm、1nm、10nm、50nm、100nm或500nm中的任一项,包括这些值之间的任何范围)。在一些实施方案中,串联二-scfv双特异性抗amc抗体结合至包含afp肽及mhc i类蛋白质的复合体,结合的kd在约1nm至约500nm之间(如约1、10、25、50、75、100、150、200、250、300、350、400、450或500nm中的任一项,包括这些值之间的任何范围)。
[0280]
嵌合抗原受体(car)及car效应细胞
[0281]
在一些实施方案中,抗amc构建体为包含抗amc抗体部分的嵌合抗原受体(car)(在本文中亦称为“抗amc car”)。亦提供包含含抗amc抗体部分的car的car效应细胞(例如t细胞)(在本文中亦称为“抗amc car效应细胞”,例如,“抗amc car t细胞”)。
[0282]
抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)胞内信号传导域。跨膜域可存在于细胞外域与细胞内域之间。
[0283]
在抗amc car的细胞外域与跨膜域之间,或在抗amc car的细胞内域与跨膜域之间,可存在间隔域。间隔域可为用于将多肽链中的跨膜域连接至细胞外域或细胞内域的任何寡肽或多肽。间隔域可包含至多约300个氨基酸,包括例如约10至约100,或约25至约50个氨基酸。
[0284]
跨膜域可来源于天然来源或合成来源。在来源为天然时,该域可来源于任何膜结合蛋白或跨膜蛋白。特定用于本发明中的跨膜区可衍生自t细胞受体cd28、cd3ε、cd3ζ、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137或cd154的δ、β、δ或γ链(亦即至少包含其跨膜区)。在一些实施方案中,跨膜域可为合成的,在此情况下,其可主要包含疏水性残基,如亮氨酸及缬氨酸。在一些实施方案中,在合成跨膜域的各端可发现苯丙氨酸、色氨酸及缬氨酸的三联体。在一些实施方案中,具有例如长度在约2与约10(如约2、3、4、5、6、7、8、9或10中的任一项)个氨基酸之间的长度之短寡肽或多肽接头可在抗amc car的跨膜域与胞内信号传导域之间形成键。在一些实施方案中,接头为基于甘氨酸-丝氨酸二联体。
[0285]
在一些实施方案中,使用自然地与抗amc car的细胞内域中的序列中的一者相关的跨膜域(例如若抗amc car细胞内域包含cd28共刺激序列,则抗amc car的跨膜域衍生自cd28跨膜域)。在一些实施方案中,跨膜域可藉由氨基酸取代选择或修饰以避免此类域与相同或不同表面膜蛋白质的跨膜结构域结合以使得与受体复合体的其他成员的相互作用最小化。
[0286]
抗amc car的胞内信号传导域造成免疫细胞(其中已置入抗amc car)的正常效应功能中的至少一项的激活。t细胞的效应功能例如可为细胞溶解活性或辅助活性,包括分泌细胞因子。因此,术语“胞内信号传导结构域”指转导效应功能信号及引导细胞执行特异性功能的蛋白质部分。尽管通常可采用全部胞内信号传导结构域,但在多数情况下,不必使用整条链。至于使用胞内信号传导结构域的截短部分的程度,此类截短部分只要转导效应功能信号即可用于替代完整链。术语“胞内信号传导序列”因此意欲包括足以转导效应功能信号的胞内信号传导域的任何截短部分。
[0287]
用于本发明的抗amc car中的胞内信号传导域的实例包括共同起在抗原受体接合
之后起始信号转导作用的t细胞受体(tcr)及共受体的细胞质序列,以及这些序列的任何衍生物或变体及具有相同功能能力的任何合成序列。
[0288]
已知经由单独的tcr产生的信号不足以完全活化t细胞且还需要二级或共刺激信号。因此,t细胞活化可称为藉由两种相异类别的胞内信号传导序列介导:经由tcr起始抗原依赖性一级活化的那些(一级信号传导序列)及以抗原独立方式起作用以提供二级或共刺激信号的那些(共刺激信号传导序列)。
[0289]
一级信号传导序列以刺激方式或抑制方式调节tcr复合体的一级活化。以刺激方式起作用的一级信号传导序列可含有信号传导基序,称为基于免疫受体酪氨酸的活化基序或itam。在一些实施方案中,抗amc car构建体包含一种或多种itam。
[0290]
特定用于本发明中的含有itam的一级信号传导序列的实例包括衍生自tcrζ、fcrγ、fcrβ、cd3γ、cd3δ、cd3ε、cd5、cd22、cd79a、cd79b及cd66d的那些。
[0291]
在一些实施方案中,抗amc car包含衍生自cd3ζ的一级信号传导序列。举例而言,car的胞内信号传导域可包含cd3ζ胞内信号传导序列本身或与适用于本发明的抗amc car之情形下的任何其他所需胞内信号传导序列组合。举例而言,抗amc car的细胞内域可包含cd3ζ胞内信号传导序列及共刺激信号传导序列。共刺激信号传导序列可共刺激分子的细胞内域的一部分,该共刺激分子包括例如cd27、cd28、4-1bb(cd137)、ox40、cd30、cd40、pd-1、icos、淋巴细胞功能相关抗原-1(lfa-1)、cd2、cd7、light、nkg2c、b7-h3、特异性结合cd83的配体及其类似物。
[0292]
在一些实施方案中,抗amc car的胞内信号传导域包含cd3ζ的胞内信号传导序列及cd28的胞内信号传导序列。在一些实施方案中,抗amc car的胞内信号传导域包含cd3ζ的胞内信号传导序列及4-1bb的胞内信号传导序列。在一些实施方案中,抗amc car的胞内信号传导域包含cd3ζ的胞内信号传导序列及cd28及4-1bb的胞内信号传导序列。
[0293]
因此,举例而言,在一些实施方案中,提供包含以下的抗amc car:a)包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分的细胞外域,b)跨膜域,及c)胞内信号传导域。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0294]
在一些实施方案中,提供包含以下的抗amc car:a)包含特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的抗amc抗体部分的细胞外域,b)跨膜域,及c)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0295]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该
hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,b)跨膜域,及c)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0296]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);b)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0297]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;b)跨膜域,及c)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号
传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0298]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体,b)跨膜域,及c)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0299]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;及b)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0300]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%序列同一性的变体;b)跨膜域,及c)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导
序列。
[0301]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列;b)胞内信号传导域。在一些实施方案中,胞内信号传导域能够活化免疫细胞。在一些实施方案中,胞内信号传导域包含一级信号传导序列及共刺激信号传导序列。在一些实施方案中,一级信号传导序列包含cd3ζ胞内信号传导序列。在一些实施方案中,共刺激信号传导序列包含cd28胞内信号传导序列。在一些实施方案中,细胞内域包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列。
[0302]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。
[0303]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的抗amc抗体部分,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0304]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0305]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0306]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0307]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0308]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0309]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%序列同一性的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0310]
在一些实施方案中,提供包含以下的抗amc car:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0311]
本文亦提供表达抗amc car的效应细胞(如淋巴细胞,例如t细胞)。
[0312]
亦提供产生表达抗amc car的效应细胞的方法,该方法包含将包含编码抗amc car的核酸的载体引入至效应细胞中。在一些实施方案中,将载体引入至效应细胞中包含藉由载体转导效应细胞。在一些实施方案中,将载体引入至效应细胞中包含藉由载体转染效应细胞。载体转导或转染至效应细胞中可使用本领域已知的任何方法进行。
[0313]
免疫缀合物
[0314]
在一些实施方案中,抗amc构建体包含含附接至效应分子的抗amc抗体部分的免疫缀合物(在本文中亦称为“抗amc免疫缀合物”)。在一些实施方案中,效应分子为治疗剂,如癌症治疗剂,其为细胞毒性的、细胞生长抑制的或以其他方式提供一些治疗效益。在一些实施方案中,效应分子为标记,其可直接或间接产生可检测信号。
[0315]
在一些实施方案中,提供包含抗amc抗体部分及治疗剂的抗amc免疫缀合物(在本文中亦称为“抗体-药物缀合物”或”adc”)。在一些实施方案中,治疗剂为毒素,其为细胞毒性的、细胞生长抑制的或以其他方式阻止或降低靶细胞分裂的能力。使用adc局部传递细胞毒性剂或细胞生长抑制剂,即在癌症治疗中杀死或抑制肿瘤细胞的药物(syrigos及epenetos,anticancer research 19:605-614(1999);niculescu-duvaz及springer,adv.drg.del.rev.26:151-172(1997);美国专利第4,975,278号)允许药物部分靶向传递至靶细胞,及在其中的胞内积聚,其中全身性施用这些非结合治疗剂可对于正常细胞以及设法消除的靶细胞产生不可接受的毒性含量(baldwin等人,lancet(1986年3月15日):603-605(1986);thorpe,(1985)“antibody carriers of cytotoxic agents in cancer therapy:a review”,monoclonal antibodies'84:biological and clinical applications,a.pinchera等人(编),第475-506页)。进而寻求具有最小毒性的最大功效。重要的是,由于大部分正常细胞不在其表面上呈现amc,其无法结合抗amc免疫缀合物,且受保护免于毒素或其他治疗剂的杀死效应。
[0316]
用于抗amc免疫缀合物中的治疗剂包括例如道诺霉素、阿霉素、甲氨蝶呤及长春地辛(rowland等人,cancer immunol.immunother.21:183-187(1986))。用于抗amc免疫缀合物中的毒素包括细菌毒素,如白喉毒素;植物毒素,如蓖麻毒素;小分子毒素,如格尔德霉素(geldanamycin)(mandler等人,j.nat.cancer inst.92(19):1573-1581(2000);mandler等人,bioorganic&med.chem.letters 10:1025-1028(2000);mandler等人,bioconjugate chem.13:786-791(2002))、类美登素(ep 1391213;liu等人,proc.natl.acad.sci.usa 93:8618-8623(1996))及卡奇霉素(calicheamicin)(lode等人,cancer res.58:2928(1998);hinman等人,cancer res.53:3336-3342(1993))。毒素可藉由包括微管蛋白结合、dna结合或拓扑异构酶抑制的机制发挥其细胞毒性及细胞生长抑制效应。一些细胞毒性药物倾向于在结合至较大抗体或蛋白质受体配体时为非活性的或弱活性的。
[0317]
可使用的酶活性毒素及其片段包括例如白喉a链、白喉毒素的非结合活性片段、外
毒素a链(来自绿脓假单胞菌(pseudomonas aeruginosa))、篦麻毒素a链、相思子毒素a链、莫迪素a链、α-帚曲菌素(α-sarcin)、油桐(aleurites fordii)蛋白、康乃馨蛋白、美洲商陆(phytolaca americana)蛋白(papi、papii及pap-s)、苦瓜(momordica charantia)抑制剂、麻疯树毒蛋白(curcin)、巴豆毒素(crotin)、肥皂草(sapaonaria officinalis)抑制剂、白树素(gelonin)、有丝分裂素(mitogellin)、局限曲菌素(restrictocin)、酚霉素、伊诺霉素(enomycin)及霉菌毒素(tricothecene)。参见例如1993年10月28日公布的wo 93/21232。
[0318]
本文中亦涵盖抗amc抗体部分及一种或多种小分子毒素,如卡奇霉素、类美登素、海兔毒素(dolastatin)、奥瑞他汀(aurostatin)、新月毒素及cc1065,及具有毒素活性的这些毒素的衍生物的抗amc免疫缀合物。
[0319]
在一些实施方案中,提供包含具有胞内活性的治疗剂的抗amc免疫缀合物。在一些实施方案中,抗amc免疫缀合物经内化且治疗剂为阻断细胞的蛋白质合成,在其中导致细胞死亡的细胞毒素。在一些实施方案中,治疗剂为包含具有核糖体不活化活性的多肽的细胞毒素,包括例如白树素、波甘宁(bouganin)、沙泊宁(saporin)、蓖麻毒素、蓖麻毒素a链、榄香胶素、白喉毒素、局限曲菌素、绿脓杆菌外毒素a及其变体。在一些实施方案中,当治疗剂为包含具有核糖体不活化活性的多肽的细胞毒素时,抗amc免疫缀合物必须在结合至靶细胞时经内化以使蛋白质对于细胞为细胞毒性的。
[0320]
在一些实施方案中,提供包含其破坏dna作用的治疗剂的抗amc免疫缀合物。在一些实施方案中,起破坏dna作用的治疗剂例如选自由以下组成的组:烯二炔(例如卡奇霉素及埃斯培拉霉素)及非烯二炔小分子剂(例如博莱霉素甲锭丙基-edta-fe(ii))。根据本技术适用的其他癌症治疗剂包括(但不限于)道诺霉素、阿霉素、偏端霉素a、顺铂、丝裂霉素c、海鞘素、倍癌霉素(duocarmycin)/cc-1065及博莱霉素/派莱霉素。
[0321]
本发明另外涵盖形成于抗amc抗体部分与具有核分解活性的化合物(例如核糖核酸酶或dna核酸内切酶,如去氧核糖核酸酶;dna酶)之间的抗amc免疫缀合物。
[0322]
在一些实施方案中,抗amc免疫缀合物包含起破坏微管蛋白作用的药剂。此类药剂可包括例如根瘤菌素/美登素、太平洋紫杉醇、长春新碱及长春碱、秋水仙碱、奥瑞他汀海兔毒素10mmae及peloruside a。
[0323]
在一些实施方案中,抗amc免疫缀合物包含烷基化剂,包括例如asaley nsc 167780、azq nsc 182986、bcnu nsc 409962、白消安nsc 750、羧基邻苯二甲酸铂nsc 271674、cbdca nsc 241240、ccnu nsc 79037、chip nsc 256927、苯丁酸氮芥nsc 3088、氯脲菌素nsc 178248、顺铂nsc 119875、氯乙矾nsc 338947、氰基(n-吗啉基)阿霉素nsc 357704、塞迪逊(cyclodisone)nsc 348948、卫康醇nsc 132313、氟多潘nsc 73754、海普法姆(hepsulfam)nsc 329680、羟胺硫蒽酮nsc 142982、美法仑nsc 8806、甲基ccnu nsc 95441、丝裂霉素c nsc 26980、米托唑酰胺nsc 353451、氮芥nsc 762、pcnu nsc 95466、哌嗪nsc 344007、哌嗪二酮nsc 135758、哌泊溴烷nsc 25154、泊非罗霉素nsc 56410、螺乙内酰脲芥nsc 172112、替罗昔隆(teroxirone)nsc 296934、四铂nsc 363812、噻替派nsc 6396、三亚乙基三聚氰胺nsc 9706、尿嘧啶氮芥nsc 34462及yoshi-864 nsc 102627。
[0324]
在一些实施方案中,本技术的抗amc免疫缀合物的癌症治疗剂部分可包含抗有丝分裂剂,包括(但不限于)别秋水仙碱nsc 406042、软海绵素b nsc 609395、秋水仙碱nsc 757、秋水仙碱衍生物nsc 33410、海兔毒素10 nsc 376128(ng-奥瑞他汀衍生物)、美登素
nsc 153858、根瘤菌素nsc 332598、紫杉醇nsc 125973、紫杉醇衍生物nsc 608832、硫代秋水仙碱nsc 361792、三苯甲基半胱氨酸nsc 83265、硫酸长春碱nsc 49842及硫酸长春新碱nsc 67574。
[0325]
在一些实施方案中,抗amc免疫缀合物包含拓扑异构酶i抑制剂,包括(但不限于)喜树碱nsc 94600、喜树碱、na盐nsc 100880、氨基喜树碱nsc 603071、喜树碱衍生物nsc 95382、喜树碱衍生物nsc 107124、喜树碱衍生物nsc 643833、喜树碱衍生物nsc 629971、喜树碱衍生物nsc 295500、喜树碱衍生物nsc 249910、喜树碱衍生物nsc 606985、喜树碱衍生物nsc 374028、喜树碱衍生物nsc 176323、喜树碱衍生物nsc 295501、喜树碱衍生物nsc 606172、喜树碱衍生物nsc 606173、喜树碱衍生物nsc 610458、喜树碱衍生物nsc 618939、喜树碱衍生物nsc 610457、喜树碱衍生物nsc 610459、喜树碱衍生物nsc 606499、喜树碱衍生物nsc 610456、喜树碱衍生物nsc 364830、喜树碱衍生物nsc 606497及吗啉基阿霉素nsc 354646。
[0326]
在一些实施方案中,抗amc免疫缀合物包含拓扑异构酶ii抑制剂,包括(但不限于)阿霉素nsc 123127、氨萘非特(amonafide)nsc 308847、m-amsa nsc 249992、蒽吡唑衍生物nsc 355644、派拉瑞丁(pyrazoloacridine)nsc 366140、比生群(bisantrene)hcl nsc 337766、道诺霉素nsc 82151、脱氧阿霉素nsc 267469、米托蒽醌nsc 301739、美诺立尔(menogaril)nsc 269148、n,n-二苯甲基道诺霉素nsc 268242、oxanthrazole nsc 349174、道诺霉素苯腙nsc 164011、vm-26nsc 122819及vp-16nsc 141540。
[0327]
在一些实施方案中,抗amc免疫缀合物包含rna或dna抗代谢物,包括(但不限于)l-丙氨菌素nsc 153353、5-氮胞苷nsc 102816、5-氟尿嘧啶nsc 19893、阿西维辛(acivicin)nsc 163501、氨基喋呤衍生物nsc 132483、氨基喋呤衍生物nsc 184692、氨基喋呤衍生物nsc 134033、抗叶酸剂nsc 633713、抗叶酸剂nsc 623017、贝氏(baker's)可溶抗叶酸剂nsc 139105、二氯烯丙基指甲花醌nsc 126771、布喹那(brequinar)nsc 368390、替加氟(前药)nsc 148958、5,6-二氢-5-氮胞苷nsc 264880、甲氨蝶呤nsc 740、甲氨蝶呤衍生物nsc 174121、n-(膦酰乙酰基)-l-天冬氨酸(pala)nsc 224131、吡唑呋喃菌素nsc 143095、曲美沙特(trimetrexate)nsc 352122、3-hp nsc 95678、2'-去氧-5-氟尿苷nsc 27640、5-hp nsc 107392、α-tgdr nsc 71851、甘氨酸阿非迪霉素nsc 303812、阿糖胞苷nsc 63878、5-氮杂-2'-脱氧胞苷nsc 127716、β-tgdr nsc 71261、环胞苷nsc 145668、胍唑nsc 1895、羟基脲nsc 32065、肌苷乙醇醛nsc 118994、麦克菌素il nsc 330500、吡唑并咪唑nsc 51143、硫鸟嘌呤nsc 752及硫代嘌呤nsc 755。
[0328]
在一些实施方案中,抗amc免疫缀合物包含高度放射性原子。多种放射性同位素可用于产生放射性结合的抗体。实例包括211at、131i、125i、90y、186re、188re、153sm、212bi、32p、212pb及lu的放射性同位素。
[0329]
在一些实施方案中,抗amc抗体部分可结合至“受体”(诸如抗生蛋白链菌素),以用于肿瘤预先靶向中,其中向患者施用抗体-受体缀合物,随后使用清除剂将未结合的缀合物自循环中移除,且随后施用结合至细胞毒性剂(例如放射性核苷酸)的“配体”(例如抗生素蛋白)。
[0330]
在一些实施方案中,抗amc免疫缀合物可包含结合至前药活化酶的抗amc抗体部分。在一些此类实施方案中,前药活化酶将前药(例如肽基化学治疗剂,参见wo 81/01145)
转化为活性药物,诸如抗癌药物。在一些实施方案中,此类抗amc免疫缀合物适用于抗体依赖性酶介导的前药疗法(“adept”)。可结合至抗体的酶包括(但不限于)碱性磷酸酶,其适用于将含磷酸酯基的前药转变成游离药物;芳基硫酸酯酶,其适用于将含硫酸酯基的前药转变成游离药物;胞嘧啶脱胺酶,其适用于将无毒5-氟胞嘧啶转变成抗癌药物5-氟尿嘧啶;蛋白酶,诸如沙雷菌属蛋白酶、嗜热菌蛋白酶、枯草杆菌蛋白酶、羧基肽酶及组织蛋白酶(诸如组织蛋白酶b及l),其适用于将含肽前药转变成游离药物;d-丙胺酰基羧基肽酶,其适用于转变含有d-氨基酸取代基之前药;碳水化合物裂解酶,诸如β-半乳糖及神经氨酸苷酶,其适用于将糖基化前药转变成游离药物;β-内酰胺酶,其适用于将经β-内酰胺衍生的药物转变成游离药物;以及青霉素酰胺酶,诸如青霉素v酰胺酶及青霉素g酰胺酶,其适用于将分别在胺氮经苯氧基乙酰基或苯乙基衍生的药物转变成游离药物。在一些实施方案中,酶可藉由本领域熟知的重组dna技术共价结合抗体部分。参见例如neuberger等人,nature 312:604-608(1984)。
[0331]
在一些实施方案中,抗amc免疫缀合物的治疗部分可为核酸。可使用的核酸包括(但不限于)反义rna、基因或其他多核苷酸,包括核酸类似物,如硫鸟嘌呤及硫代嘌呤。
[0332]
本技术另外提供包含附接至效应分子的抗amc抗体部分的抗amc免疫缀合物,其中效应分子为标记,其可间接或直接产生可检测信号。这些抗amc免疫缀合物可用于研究或诊断应用,如用于癌症的体内检测。标记优选能够直接或间接产生可检测信号。举例而言,标记可为射线不透的或放射性同位素,如3h、14c、32p、35s、123i、125i、131i;荧光(荧光团)或化学发光(发色团)化合物,如荧光异硫氰酸盐、罗丹明或荧光素;酶,如碱性磷酸酶、β-半乳糖或辣根过氧化酶;显影剂;或金属离子。在一些实施方案中,标记为用于闪烁摄影研究的放射性原子,例如99tc或123i,或用于核磁共振(nmr)成像(亦称为磁共振成像,mri)的自旋标记,如锆-89、碘-123、碘-131、铟-111、氟-19、碳-13、氮-15、氧-17、钆、锰或铁。锆-89可与各种金属螯合剂络合且结合至抗体,例如用于pet成像(wo 2011/056983)。
[0333]
在一些实施方案中,可间接检测抗amc免疫缀合物。举例而言,对抗amc免疫缀合物具有特异性且含有可检测标记的二级抗体可用于检测抗amc免疫缀合物。
[0334]
因此,举例而言,在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,及b)效应分子。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,效应分子共价连接于抗amc抗体部分。在一些实施方案中,效应分子为选自例如由以下组成的组的治疗剂:药物、毒素、放射性同位素、蛋白质、肽及核酸。在一些实施方案中,效应分子为癌症治疗剂。在一些实施方案中,癌症治疗剂为化学治疗剂。在一些实施方案中,癌症治疗剂为选自例如由以下组成的组的高度放射性原子:211at、131i、125i、90y、186re、188re、153sm、212bi、32p及212pb。在一些实施方案中,效应分子为标记,其可直接或间接产生可检测信号。在一些实施方案中,标记为选自例如由以下组成的组的放射性同位素:3h、14c、32p、35s、123i、125i及131i。在一些实施方案中,抗amc抗体部分为scfv。在一些实施方案中,抗amc抗体部分为人类、人源化或半合成的。
[0335]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的抗amc抗体部分,及b)效应分子。在一些实施方
案中,效应分子共价连接于抗amc抗体部分。在一些实施方案中,效应分子为选自例如由以下组成的组的治疗剂:药物、毒素、放射性同位素、蛋白质、肽及核酸。在一些实施方案中,效应分子为癌症治疗剂。在一些实施方案中,癌症治疗剂为化学治疗剂。在一些实施方案中,癌症治疗剂为选自例如由以下组成的组的高度放射性原子:211at、131i、125i、90y、186re、188re、153sm、212bi、32p及212pb。在一些实施方案中,效应分子为标记,其可直接或间接产生可检测信号。在一些实施方案中,标记为选自例如由以下组成的组的放射性同位素:3h、14c、32p、35s、123i、125i及131i。在一些实施方案中,抗amc抗体部分为scfv。在一些实施方案中,抗amc抗体部分为人类、人源化或半合成的。
[0336]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,及b)效应分子。
[0337]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,及b)效应分子。
[0338]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如
约1、2、3、4或5中的任一项)个氨基酸取代的变体,及b)效应分子。
[0339]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体;及b)效应分子。
[0340]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;及b)效应分子。
[0341]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及b)效应分子。
[0342]
在一些实施方案中,提供包含以下的抗amc免疫缀合物:a)特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,其包含重链可变域,包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,包含seq id no:27-36中的任一项的氨基酸序列;及b)效应分子。
[0343]
核酸
[0344]
亦涵盖编码抗amc构建体或抗amc抗体部分的核酸分子。在一些实施方案中,提供编码全长抗amc抗体的核酸(或核酸集合)。在一些实施方案中,提供编码多特异性抗amc分子(例如多特异性抗amc抗体、双特异性抗amc抗体或双特异性t细胞接合分子抗amc抗体)或其多肽部分的核酸(或核酸集合)。在一些实施方案中,提供编码抗amc car的核酸(或核酸集合)。在一些实施方案中,提供编码抗amc免疫缀合物,或其多肽部分的核酸(或核酸集合)。
[0345]
本技术亦包括这些核酸序列的变体。举例而言,变体包括在适度严格杂交条件下杂交至编码本技术的抗amc构建体或抗amc抗体部分的核酸序列的核苷酸序列。
[0346]
本发明亦提供插入有本发明的核酸的载体。
[0347]
简单概括而言,藉由编码抗amc构建体或其多肽部分的天然或合成核酸表达抗amc构建体(例如抗amc car)或其多肽部分可藉由将核酸插入至适当表达载体中,使得核酸可操作地连接于5'及3'调节元件,包括例如启动子(例如淋巴细胞特异性启动子)及3'非翻译区(utr)而实现。载体可适合于真核宿主细胞中的复制及整合。典型克隆及表达载体含有转录及翻译终止子、起始序列及适用于调节所要核酸序列表达的启动子。
[0348]
本发明的核酸亦可用于使用标准基因递送方案的核酸免疫接种及基因疗法。基因递送方法为本领域已知。参见例如美国专利第5,399,346号、第5,580,859号、第5,589,466号,其以全文引用的方式并入本文中。在一些实施方案中,本发明提供基因疗法载体。
[0349]
核酸可克隆至多种类型的载体中。举例而言,核酸可克隆至载体中,包括(但不限于)质体、噬菌粒、噬菌体衍生物、动物病毒及黏质体。尤其受关注的载体包括表达载体、复制载体、探针产生载体及定序载体。
[0350]
此外,表达载体可以病毒载体形式提供给细胞。病毒载体技术为本领域熟知的且描述于例如sambrook等人(2001,molecular cloning:a laboratory manual,cold spring harbor laboratory,new york)及其他病毒学及分子生物学手册中。适用作载体的病毒包括(但不限于)反转录病毒、腺病毒、腺相关病毒、疱疹病毒及慢病毒。一般而言,适合载体含有在至少一种有机体、启动子序列、方便的限制核酸内切酶位点及一种或多种可选标记物中有作用的复制起点(参见例如wo 01/96584;wo 01/29058;及美国专利第6,326,193号)。
[0351]
已针对基因转移至哺乳动物细胞中开发出多个基于病毒的系统。举例而言,反转录病毒提供基因递送系统的适宜平台。所选基因可插入至中载体中且使用本领域已知的技术封装于反转录病毒粒子中。重组病毒可随后经分离且体内或离体传递至个体的细胞中。多个反转录病毒系统为本领域已知。在一些实施方案中,使用腺病毒载体。多个腺病毒载体为本领域已知。在一些实施方案中,使用慢病毒载体。来源于反转录病毒(诸如慢病毒)的载体为实现长期基因转移的适合工具,因为其允许长期稳定整合转基因及其在子细胞中之传播。慢病毒载体具有优于来源于癌-反转录病毒(onco-retrovirus)(诸如鼠类白血病病毒)的载体的额外优势,因为其可转导非增殖性细胞,诸如肝细胞。其亦具有低免疫原性的额外优势。
[0352]
额外启动子元素(例如,增强子)调节转录起始频率。通常,这些元素定位于起始位点上游30-110bp区中,尽管多个启动子最近已展示还含有在起始位点下游的功能性元素。启动子元素之间的间距通常为灵活的,使得当元素倒置或相对于彼此移动时时保留启动子功能。在胸苷激酶(tk)启动子中,启动子元素之间的间距在活性开始减退之前可增加至相隔50bp。
[0353]
适合启动子的一个实例为即刻早期巨细胞病毒(cmv)启动子序列。此启动子序列为能够驱使高程度表达任何可操作地连接至其上的多核苷酸序列的强组成型启动子序列。适合启动子之、的另一实例为延伸生长因子-1α(ef-1α)。然而,亦可使用其他组成型启动子序列,包括(但不限于)猴病毒40(sv40)早期启动子、小鼠乳房肿瘤病毒(mmtv)、人类免疫缺乏病毒(hiv)长末端重复序列(ltr)启动子、momulv启动子、禽类白血病病毒启动子、埃-巴二氏病毒即刻早期启动子、劳斯肉瘤病毒启动子(rous sarcoma virus promoter),以及人类基因启动子,诸如(但不限于)肌动蛋白启动子、肌球蛋白启动子、血红蛋白启动子及肌酸激酶启动子。此外,本发明应不限于组成型启动子的使用。亦涵盖诱导型启动子作为本发明
的部分。诱导型启动子的使用提供分子开关,该分子开关能够在需要此类表达时打开其可操作地连接的多核苷酸序列表达或在不需要表达时关闭表达。诱导型启动子的实例包括(但不限于)金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子及四环素启动子。
[0354]
为了评估多肽或其部分的表达,待引入细胞中的表达载体亦可含有可选标记基因或报导基因或两者以促进自设法经病毒载体转染或感染的细胞群体鉴别及选择表达细胞。在其他方面中,可选标记物可携载于独立dna段上且用于共转染程序。可选标记物及报导体基因皆可侧接适当调节序列以使能够在宿主细胞中表达。适用可选标记物包括例如耐抗生素基因,诸如neo及其类似物。
[0355]
报导基因用于鉴别潜在经转染细胞及评估调节序列功能。一般而言,报导基因为接受生物体或组织中不存在或表达且编码表达藉由一些容易检测的特性(例如酶促活性)显现的多肽的基因。在dna已引入受体细胞中之后的适合时间分析报导基因的表达。适合报告基因可包括编码荧光素酶、β-半乳糖、氯霉素乙酰基转移酶、分泌碱性磷酸酶或绿色荧光蛋白基因的基因(例如ui-tel等人,2000febs letters 479:79-82)。适合表达系统为熟知的且可使用已知技术制备或商业购买。一般而言,具有展示报导基因最高表达量的最小5'侧接区的构建体鉴别为启动子。此类启动子区域可连接至报导基因且用于评估调节启动子驱动的转录能力的试剂。
[0356]
向细胞中引入及表达基因的方法为本领域已知。在表达载体的情况下,载体可易于藉由本领域的任何方法引入宿主细胞(例如,哺乳动物、细菌、酵母或昆虫细胞)中。举例而言,表达载体可藉由物理、化学或生物方式转移至宿主细胞中。
[0357]
用于将多核苷酸引入至宿主细胞中的物理方法包括磷酸钙沉淀、脂质体转染、粒子轰击、显微注射、电穿孔及其类似方法。用于制造包含载体及/或外源性核酸的细胞的方法为本领域熟知的。参见例如sambrook等人(2001,molecular cloning:a laboratory manual,cold spring harbor laboratory,new york)。在一些实施方案中,藉由磷酸钙转染进行将多核苷酸引入至宿主细胞中。
[0358]
将所关注的多核苷酸引入宿主细胞中的生物方法包括使用dna及rna载体。病毒载体及尤其反转录病毒载体已成为将基因插入哺乳动物(例如,人类)细胞中的最常用方法。其他病毒载体可来源于慢病毒、痘病毒、1型单纯疱疹病毒病毒、腺病毒及腺相关病毒及其类似病毒。参见例如美国专利第5,350,674号及第5,585,362号。
[0359]
用于将多核苷酸引入至宿主细胞中的化学方式包括胶体分散系统,诸如大分子复合物、纳米胶囊、微球、珠粒及基于脂质的系统,包括水包油乳液、微胞、混合微胞及脂质体。用作体外及体内传送媒剂的例示性胶体系统为脂质体(例如人工膜泡)。
[0360]
在利用非病毒传递系统的情况下,例示性传递媒剂为脂质体。预期使用脂质配制剂将核酸引入至宿主细胞(体外、离体或体内)。在另一方面中,核酸可与脂质有关。与脂质相关联的核酸可囊封于脂质体的水性内部中,穿插于脂质体的脂质双层内,经由与脂质体及寡核苷酸相关联的连接分子附接至脂质体、包覆于脂质体中,与脂质体复合,分散于含有脂质的溶液中,与脂质混合,与脂质组合,以悬浮液形式含于脂质中,含有微胞或与微胞复合,或以其他方式与脂质相关联。与组合物相关联的脂质、脂质/dna或脂质/表达载体不限于溶液中的任何特定结构。举例而言,其可存在于双层结构中,呈微胞形式或具有“塌陷”结构。其亦可简单地穿插于溶液中,可能形成大小或形状不均匀的聚集物。脂质为可为天然存
在脂质或合成脂质的脂肪物质。举例而言,脂质包括细胞质中天然存在的脂肪滴以及含有长链脂族烃及其衍生物的化合物类别(诸如脂肪酸、醇、胺、氨基醇及醛)。
[0361]
不管用于将外源性核酸引入宿主细胞或以其他方式使细胞暴露于本发明的抑制剂的方法,为了确认宿主细胞中重组dna序列的存在,可进行多种分析。此类分析法包括例如本领域技术人员熟知的“分子生物”分析法,诸如南方及northen印迹、rt-pcr及pcr;“生物化学”分析法,诸如检测特定肽的存在或不存在,例如藉由免疫方式(elisa及西方印迹)或藉由本文所述的分析法鉴别在本发明的范畴内的试剂。
[0362]
afp及mhc i类蛋白质
[0363]
α-胎蛋白(afp,α-胎蛋白;亦称为α-1-胎蛋白、α-胎儿球蛋白或α胎儿蛋白)为在人体中由afp基因编码的591氨基酸糖蛋白。afp基因位于染色体4的q臂(4q25)上。afp为在胚胎发育期间由卵黄囊及肝脏产生的主要血浆蛋白质。将其视为血清白蛋白的胚胎形式。afp结合至铜、镍、脂肪酸及胆红素,且以单体、二聚及三聚形式发现。afp为人类胎儿中发现的最丰富血浆蛋白质。血浆含量在出生之后快速减少但在前三个月结束时起始开始产前地减少。正常成人含量通常在8至12个月龄实现。成年人类中的afp的功能为未知的;然而,在啮齿动物中,其结合雌二醇以防止此激素跨越胎盘运输至胎儿。其主要功能为预防雌性胎儿的雄性化。由于人类afp不结合雌激素,其在人类中的功能较不明晰。
[0364]
个体中的afp将较高之一些疾病包括例如肝细胞癌/肝癌、生殖细胞肿瘤、转移性肝癌、脐膨出、神经管缺陷、卵黄囊肿瘤及共济失调毛细血管扩张症。
[0365]
mhc i类蛋白质为两种主要类别的主要组织相容性复合体(mhc)分子中的一者(另一者为mhc ii类)且发现于身体的几乎每一成核细胞上。其功能为显示细胞内至t细胞的蛋白质片段;将忽略健康细胞,而含有外来蛋白质的细胞将被免疫系统攻击。由于mhc i类蛋白质呈递衍生自胞溶质蛋白质的肽,mhc i类呈递路径通常称作胞溶质或内源性路径。i类mhc分子结合主要产生自胞溶质蛋白质的降解(藉由蛋白酶体)的肽。mhc i:肽复合体接着插入至细胞之质膜中。肽结合至i类mhc分子的细胞外部分。因此,i类mhc的功能为将胞内蛋白质呈现至细胞毒性t细胞(ctl)。然而,i类mhc也可在称为交叉呈递的方法中呈递产生自外源蛋白质的肽。
[0366]
mhc i类蛋白质由两个多肽链,α及β2-微球蛋白(β2m)组成。两个链经由b2m及α3域的相互作用非共价连接。仅α链为多晶型且由hla基因编码,而b2m亚基并非多晶型且由β-2微球蛋白基因编码。α3域跨越质膜且与t细胞的cd8共受体相互作用。α3-cd8相互作用将mhc i分子保持在适当的位置,而细胞毒性t细胞表面上的t细胞受体(tcr)结合其α1-α2异质二聚体配体,且检查偶合肽的抗原性。α1及α2域折叠而构成凹槽,用于肽结合。mhc i类蛋白质结合长度为8-10个氨基酸的肽。
[0367]
人类白血球抗原(hla)基因为mhc基因的人类型式。人体中的三种主要mhc i类蛋白质为hla-a、hla-b及hla-c,而3种次要mhc i类蛋白质为hla-e、hla-f及hla-g。hla-a位列人体中具有最快演进编码序列的基因中。截至2013年12月,存在2432种编码1740种活性蛋白质及117种剔除式蛋白质(null protein)的已知hla-a等位基因。hla-a基因位于染色体6的短臂上且编码hla-a的较大α链成分。hla-aα-链的变化对于hla功能至关重要。此变化促进群体中的基因多样性。由于各hla对于某些结构的肽具有不同亲和力,较多种hla意指较多种抗原
‘
呈递’于细胞表面上,增加群体亚组将对任何给定外来侵入物具抗性的可能性。
synthesis,john morrow stewart及martin等人application of almez-mediated amidation reactions to solution phase peptide synthesis,tetrahedron letters第39卷,第1517-1520页,1998)。
[0372]
候选afp肽的结合活性可使用抗原处理缺陷t2细胞系测试,该细胞系当藉由抗原呈递凹槽中的肽稳定化时增加hla-a表达。t2细胞经候选肽脉冲足以使细胞表面上的hla-a表达稳定化的时间,其可使用本领域已知的任何方法测量,如藉由用对hla-a具有特异性的荧光标记单克隆抗体(例如bb7.2)免疫染色,接着进行荧光活化细胞分选(facs)分析。
[0373]
制备抗amc抗体及抗amc抗体部分
[0374]
在一些实施方案中,抗amc抗体或抗amc抗体部分为单克隆抗体。单克隆抗体可例如使用杂交瘤方法,如kohler及milstein,nature,256:495(1975)及sergeeva等人,blood,117(16):4262-4272描述的方法,使用本文及下文实例中所述的噬菌体展示方法,或使用重组dna方法(参见例如美国专利第4,816,567号)制备。
[0375]
在杂交瘤方法中,仓鼠、小鼠或其他适当宿主动物通常用免疫剂免疫以产生淋巴细胞,其产生或能够产生将特异性结合免疫剂的抗体。或者,淋巴细胞可在体外免疫。免疫剂可包括所关注的蛋白质的多肽或融合蛋白,或包含至少两个分子的复合体,如包含afp肽及mhc i类蛋白质的复合体。通常,若需要人类来源的细胞,则使用末梢血液淋巴细胞(“pbl”);或若需要非人类哺乳动物来源,则使用脾细胞或淋巴结细胞。淋巴细胞接着使用适合融合剂(如聚乙二醇)经永生化细胞系融合以形成杂交瘤细胞。参见例如goding,monoclonal antibodies:principles and practice(new york:academic press,1986),第59-103页。永生化细胞系通常为经转化哺乳动物细胞,特定言之啮齿动物、牛类及人类来源的骨髓瘤细胞。通常采用大鼠或小鼠骨髓瘤细胞系。杂交瘤细胞可在优选含有一种或多种抑制未融合、永生化细胞的生长或存活的物质的适合培养基中培养。举例而言,若亲本细胞缺乏酶次黄嘌呤-鸟嘌呤磷酸核糖基转移酶(hgprt或hprt),则用于杂交瘤的培养基通常将包括次黄嘌呤、氨基蝶呤及胸苷(“hat培养基”),其阻止缺乏hgprt的细胞生长。
[0376]
在一些实施方案中,永生化细胞系有效融合,藉由所选产抗体细胞支持抗体之稳定高含量表达且对于如hat培养基的培养基敏感。在一些实施方案中,永生化细胞系为鼠类骨髓瘤细胞系,其可例如获自salk institute cell distribution center,san diego,california及american type culture collection,manassas,virginia。已描述用于产生人类单克隆抗体的人类骨髓瘤及小鼠-人类杂骨髓瘤细胞系。kozbor,j.immunol.,133:3001(1984);brodeur等人monoclonal antibody production techniques and applications(marcel dekker,inc.:new york,1987)第51-63页。
[0377]
接着可针对单克隆抗体的存在来分析其中培养杂交瘤细胞的培养基,所述单克隆抗体系针对多肽。可藉由免疫沉淀或藉由体外结合分析(诸如放射免疫分析(ria)或酶联免疫吸附分析(elisa))测定由杂交瘤细胞产生的单克隆抗体的结合特异性。所述技术及分析法为本领域已知。单克隆抗体的结合亲和力可例如藉由munson及pollard,anal.biochem.,107:220(1980)之scatchard分析测定。
[0378]
在鉴别所需杂交瘤细胞之后,克隆可藉由限制稀释程序亚克隆且藉由标准方法生长。goding,前述。出于此目的的适合培养基包括例如杜尔贝科氏改良伊格尔培养基(dulbecco's modified eagle's medium)及rpmi-1640培养基。或者,杂交瘤细胞可以腹水
形式体内生长于哺乳动物中。
[0379]
亚克隆所分泌的单克隆抗体可藉由已知免疫球蛋白纯化程序(诸如蛋白a-琼脂糖、羟磷灰石层析、凝胶电泳、透析或亲和层析)自培养基或腹水液分离或纯化。
[0380]
抗amc抗体或抗体部分亦可藉由针对具有一种或多种所需活性的抗体筛选组合文库而鉴别。举例而言,本领域已知多种方法用于产生噬菌体展示库及针对具有所需结合特征的抗体筛选此类文库。此类方法综述于例如hoogenboom等人,methods in molecular biology 178:1-37(o'brien等人编,human press,totowa,nj,2001)中,且进一步描述于例如mccafferty等人,nature 348:552-554;clackson等人,nature 352:624-628(1991);marks等人,j.mol.biol.222:581-597(1992);marks及bradbury,methods in molecular biology 248:161-175(lo编,human press,totowa,nj,2003);sidhu等人,j.mol.biol.338(2):299-310(2004);lee等人,j.mol.biol.340(5):1073-1093(2004);fellouse,proc.natl.acad.sci.usa 101(34):12467-12472(2004);及lee等人,j.immunol.methods 284(1-2):119-132(2004)中。
[0381]
在某些噬菌体展示方法中,vh及vl基因的谱系分别藉由聚合酶链反应(pcr)克隆且在噬菌体库中随机重组,接着可如winter等人,ann.rev.immunol.12:433-455(1994)中所述,针对抗原结合噬菌体进行筛选。噬菌体通常呈现抗体片段,呈单链fv(scfv)片段形式或呈fab片段形式。来自免疫来源的文库提供抗免疫原的高亲和力抗体而无需构筑杂交瘤。或者,可克隆原始谱系(例如来自人类)以提供针对广泛范围的非自体抗原以及自体抗原的单一抗体来源而无需任何免疫接种,如griffiths等人,embo j,12:725-734(1993)所述。最后,原始文库亦可以合成方式如下制备:自干细胞克隆未重排v基因区段,且使用含有随机序列以编码高度可变cdr3区及实现体外重排的pcr引物,如hoogenboom及winter,j.mol.biol.,227:381-388(1992)所述。描述人类抗体噬菌体文库的专利公开案包括例如:美国专利第5,750,373号及美国专利公开案第2005/0079574号、第2005/0119455号、第2005/0266000号、第2007/0117126号、第2007/0160598号、第2007/0237764号、第2007/0292936号及第2009/0002360号。
[0382]
抗体或其抗原结合片段可使用噬菌体展示制备以针对特异于包含afp肽及mhc i类蛋白质的复合体的抗体筛选文库。文库可为具有至少1
×
109(如至少约1
×
109、2.5
×
109、5
×
109、7.5
×
109、1
×
10
10
、2.5
×
10
10
、5
×
10
10
、7.5
×
10
10
或1
×
10
11
中的任一项)个独特人类抗体片段的多样性的人类scfv噬菌体展示文库。在一些实施方案中,文库为构筑自dna的未处理人类文库,该dna从来自健康供体的人类pmbc及脾提取,包涵所有人类重链及轻链亚科。在一些实施方案中,文库为构筑自dna的未处理人类文库,该dna从患有各种疾病的患者,如患有自体免疫疾病的患者、癌症患者及患有感染性疾病的患者分离的pbmc提取。在一些实施方案中,文库为半合成人类文库,其中重链cdr3为完全随机化的,所有氨基酸(除半胱氨酸之外)同等地可能存在于任何给定位置(参见例如hoet,r.m.等人,nat.biotechnol.23(3):344-348,2005)。在一些实施方案中,半合成人类文库的重链cdr3的长度为约5至约24(如约5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24中的任一项)个氨基酸。在一些实施方案中,文库为非人类噬菌体展示文库。
[0383]
以高亲和力结合至amc的噬菌体克隆可如下选择:藉由将噬菌体反复结合至amc,该amc结合至固体载体(如用于溶液水平移动的珠粒或用于细胞水平移动的哺乳动物细
胞),接着移除非结合噬菌体及藉由特异性结合噬菌体的洗脱。在溶液水平移动之实例中,amc可经生物素标记以固定至固体载体。生物素标记的amc与噬菌体文库及固体载体,如抗生蛋白链菌素结合之戴诺珠粒m-280混合,且接着amc-噬菌体-珠粒复合体经分离。结合噬菌体克隆接着经洗脱且用于感染适当宿主细胞,如大肠杆菌xl1-blue,用于表达及纯化。在细胞水平移动的实例中,负载有amc的afp肽的t2细胞(tap缺陷、hla-a*02:01+淋巴母细胞细胞系)与噬菌体文库混合,其后收集细胞且结合克隆经洗脱且用于感染适当宿主细胞(用于表达及纯化)。水平移动可藉由溶液水平移动、细胞水平移动或两者的组合进行多个(如约2、3、4、5、6或6以上中的任一项)回合以富集特异性结合至amc的噬菌体克隆。可藉由本领域已知的任何方法,包括例如elisa及facs测试富集的噬菌体克隆与amc的特异性结合。
[0384]
单克隆抗体亦可藉由重组dna方法,如美国专利第4,816,567号中所述的那些制得。编码本发明的单克隆抗体的dna可使用已知程序(例如藉由使用能够特异性结合至编码鼠类抗体的重链及轻链的基因的寡核苷酸探针)容易地分离及测序。如上文所述的杂交瘤细胞或本发明的amc特异性噬菌体可充当此类dna的来源。分离后,可将dna置于表达载体中,接着转染于宿主细胞(诸如猴cos细胞、中国仓鼠卵巢(cho)细胞或骨髓瘤细胞)中(否则所述宿主细胞不会产生免疫球蛋白),获得重组宿主细胞中单克隆抗体的合成。dna亦可例如藉由用人类重链及轻链恒定域及/或框架区的编码序列取代同源非人类序列(美国专利第4,816,567号;莫里森等人,前述)或藉由将非免疫球蛋白多肽的全部或部分编码序列共价接合至免疫球蛋白编码序列而修饰。此类非免疫球蛋白多肽可取代本发明抗体的恒定域,或可取代本发明抗体的一个抗原组合位点的可变域以产生嵌合二价抗体。
[0385]
抗体可为单价抗体。用于制备单价抗体的方法为本领域已知。举例而言,一种方法涉及免疫球蛋白轻链及经修饰的重链的重组表达。通常在fc区中的任一点截短重链以防止重链交联。或者,相关半胱氨酸残基经另一氨基酸残基取代或经缺失以防止交联。
[0386]
体外方法亦适合于制备单价抗体。可使用本领域已知的任何方法实现抗体的消化以产生其片段,特定言之fab片段。
[0387]
具有所需结合特异性的抗体可变域(抗体-抗原组合位点)可融合至免疫球蛋白恒定域序列。优选与包含至少部分的铰链、ch2及ch3区的免疫球蛋白重链恒定域进行融合。在一些实施方案中,含有轻链结合所需的位点的第一重链恒定区(ch1)存在于融合物中的至少一项中。将编码免疫球蛋白重链融合物及(若需要)免疫球蛋白轻链的dna插入独立表达载体中,且共转染至合适宿主生物体中。对于产生双特异性抗体的其他细节,参见例如suresh等人,methods in enzymology,121:210(1986)。
[0388]
人类及人源化抗体
[0389]
抗amc抗体或抗体部分可为人源化抗体或人类抗体。人源化形式的非人类(例如鼠类)抗体为嵌合免疫球蛋白、免疫球蛋白链或其片段(如fv、fab、fab'、f(ab')2、scfv或抗体的其他抗原结合子序列),通常含有衍生自非人类免疫球蛋白的最小序列。人源化抗体包括人类免疫球蛋白(接受者抗体),其中接受者cdr的残基由具有所要特异性、亲和力及能力的非人类物种(诸如小鼠、大鼠或兔)的cdr(供体抗体)的残基替代。在一些情况下,人类免疫球蛋白的fv构架残基置换为相应非人类残基。人源化抗体亦可包含在接受者抗体中及在所引入的cdr或构架序列中均不存在的残基。一般而言,人源化抗体可包含基本上所有,至少一个且通常两个可变域,其中所有或基本上所有cdr区对应于非人类免疫球蛋白的那些cdr
区且所有或基本上所有fr区为人类免疫球蛋白共有序列的那些fr区。在一些实施方案中,人源化抗体将包含免疫球蛋白恒定区(fc)的至少一部分,通常为人类免疫球蛋白的至少一部分。参见例如jones等人,nature,321:522-525(1986);riechmann等人,nature,332:323-329(1988);presta,curr.op.struct.biol.,2:593-596(1992)。
[0390]
一般而言,人源化抗体具有一个或多个自非人类来源引入至其中的氨基酸残基。这些非人类氨基酸残基通常称为“输入”残基,其通常取自“输入”可变域。根据一些实施方案,人源化可基本上遵循winter及同事的方法(jones等人,nature,321:522-525(1986);riechmann等人,nature,332:323-327(1988);verhoeyen等人,science,239:1534-1536(1988)),藉由用人类抗体的对应序列取代啮齿动物cdr或cdr序列进行。因此,此类“人源化”抗体为抗体(美国专利第4,816,567号),其中基本上小于完整人类可变域已经来自非人类物种的对应序列取代。实际上,人源化抗体通常为一些cdr残基及可能一些fr残基经来自啮齿动物抗体中之类似位点的残基取代的人类抗体。
[0391]
作为人源化的替代方案,可产生人类抗体。举例而言,现在可能产生在免疫接种后能够在不存在内源性免疫球蛋白产生的情况下产生人类抗体的完全谱系的转基因动物(例如小鼠)。举例而言,已描述嵌合及生殖系突变小鼠中的抗体重链接合区(jh)基因的同型接合缺失导致完全抑制内源性抗体产生。将人类生殖系免疫球蛋白基因阵列转移至此类生殖系突变小鼠中将导致在抗原攻击时产生人类抗体。参见例如jakobovits等人,pnas usa,90:2551(1993);jakobovits等人,nature,362:255-258(1993);bruggemann等人,year in immunol.,7:33(1993);美国专利第5,545,806号、第5,569,825号、第5,591,669号;第5,545,807号;及wo 97/17852。或者,可藉由将人类免疫球蛋白基因座引入转基因动物(例如内源免疫球蛋白基因已部分或完全不活化的小鼠)中来制备人类抗体。在攻击之后,观察人类抗体产生,其在所有方面与在人类中所见极其类似,包括基因重排、组装及抗体谱系。此方法描述于例如美国专利第5,545,807号;第5,545,806号;第5,569,825号;第5,625,126号;第5,633,425号;及第5,661,016号,及marks等人,bio/technology,10:779-783(1992);lonberg等人,nature,368:856-859(1994);morrison,nature,368:812-813(1994);fishwild等人,nature biotechnology,14:845-851(1996);neuberger,nature biotechnology,14:826(1996);lonberg及huszar,intern.rev.immunol.,13:65-93(1995)中。
[0392]
人类抗体亦可藉由体外活化b细胞(参见美国专利5,567,610及5,229,275)或藉由使用本领域已知的各种技术,包括噬菌体展示文库产生。hoogenboom及winter,j.mol.biol.,227:381(1991);marks等人,j.mol.biol.,222:581(1991)。cole等人及boerner等人之技术亦可用于制备人类单克隆抗体。cole等人,monoclonal antibodies and cancer therapy,alan r.liss,第77页(1985)及boerner等人,j.immunol.,147(1):86-95(1991)。
[0393]
多特异性抗体
[0394]
在一些实施方案中,抗amc构建体为多特异性抗体。制造多特异性(例如双特异性)抗体的适合方法为本领域熟知的。举例而言,双特异性抗体的产生可基于两个免疫球蛋白重链/轻链对的共表达,其中两对各具有不同特异性,且在缔合后产生杂二聚体抗体(参见例如milstein及cuello,nature,305:537-539(1983);wo 93/08829,及traunecker等人,
embo j.10:3655(1991))。由于免疫球蛋白重链及轻链的随机分类,这些杂交瘤(四源杂交瘤)产生十种不同抗体分子的潜在混合物,其中仅一种具有适当双特异性结构。适当分子的纯化通常藉由亲和层析步骤实现。类似程序揭示于wo 93/08829中及traunecker等人,embo,10:3655-3659(1991)中。或者,重链及轻链的组合可藉由利用物种受限配对定向(参见例如lindhofer等人,j.immunol.,155:219-225(1995))且重链的配对可藉由使用ch3域之“杵-臼”工程改造定向(参见例如美国专利第5,731,168号;ridgway等人,protein eng.,9(7):617-621(1996))。多特异性抗体亦可藉由工程改造静电转向效应以制造抗体fc-杂二聚体分子而制得(参见例如wo 2009/089004a1)。在另一方法中,稳定双特异性抗体可由受控fab臂交换产生,其中具有相异抗原特异性及ch3域中之匹配点突变的两个亲本抗体在还原条件下混合以允许分离、重组及再氧化而形成高度纯双特异性抗体。labrigin等人,proc.natl.acad.sci.,110(13):5145-5150(2013)。包含重链/轻链对的混合物的此类抗体在本文中亦称为“异多聚体抗体”。
[0395]
具有不同特异性的抗体或其抗原结合片段亦可经化学交联以产生多特异性异缀合物抗体。举例而言,各对于不同抗原具有特异性的两个f(ab')2分子可经化学连接。pullarkat等人,trends biotechnol.,48:9-21(1999)。已提出此类抗体可例如使免疫系统细胞靶向非所需细胞(美国专利第4,676,980号)且用于治疗hiv感染。wo 91/00360;wo 92/200373;ep 03089。预期抗体可使用合成蛋白质化学中的已知方法(包括涉及交联剂的方法)在体外制备。举例而言,免疫毒素可使用二硫键交换反应或藉由形成硫醚键来构筑。出于此目的的适合试剂的实例包括亚氨基硫醇酯及4-巯基丁酰亚胺甲酯及揭示于例如美国专利第4,676,980号中的那些。
[0396]
在一些实施方案中,多特异性抗体可使用重组dna技术制备。举例而言,双特异性抗体可藉由融合两个scfv,如藉由经肽接头将其融合,产生串联scfv而工程改造。串联scfv的一个实例为双特异性t细胞接合分子。双特异性t细胞接合分子系藉由将抗cd3 scfv连接至对靶细胞的表面抗原,如肿瘤相关抗原(taa)具有特异性的scfv,导致t细胞重定向至靶细胞而制得。mack等人,proc.natl.acad.sci.,92:7021-7025(1995);brischwein等人,mol.immunol.,43(8):1129-1143(2006)。藉由缩短两个可变域之间的肽接头长度,其可防止自装配且强制与第二多肽上之域配对,产生称作双功能抗体(db)的紧凑型双特异性抗体。holliger等人,proc.natl.acad.sci.,90:6444-6448(1993)。db之两个多肽各自包含藉由太短而无法允许相同链上的两个域之间的配对的接头连接至vl的vh。因此,一个多肽的vh及vl域被强制与另一多肽的互补vl及vh域配对,进而形成两个抗原结合位点。以此型式的修饰,两个多肽藉由另一肽接头连接,产生单链双功能抗体(scdb)。在db型式的另一修饰中,双亲和力再靶向(dart)双特异性抗体可由在各多肽的c端处的半胱氨酸残基之间引入二硫键,视情况包括驱动所需杂二聚体结构的组装的c端半胱氨酸残基之前的域而产生。veri等人,arthritis rheum.,62(7):1933-1943(2010)。本领域亦已知双可变域免疫球蛋白(dvd-igtm),其中两个单克隆抗体的标靶结合可变域经由天然存在的接头组合以产生四价、双特异性抗体。gu及ghayur,methods enzymol.,502:25-41(2012)。在另一型式中,藉由利用藉由衍生自人类a激酶锚定蛋白(akap)的锚定域的肽(ad2)对衍生自人类camp依赖性蛋白激酶(pka)的调节亚基的肽(ddd2)进行二聚化制备坞锁(dnl)、双特异性抗体。rossi等人,proc.natl.acad.sci.,103:6841-6846(2006)。
[0397]
亦描述直接自重组细胞培养物制造及分离双特异性抗体片段的各种技术。举例而言,已使用亮氨酸拉链产生双特异性抗体。kostelny等人,j.immunol.,148(5):1547-1553(1992)。此方法亦可用于产生抗体同型二聚体。
[0398]
抗amc变体
[0399]
在一些实施方案中,涵盖本文所提供的抗体的氨基酸序列变体。举例而言,可能需要改进抗体的结合亲和力及/或其他生物特性。抗体的氨基酸序列变体可藉由将适当修饰引入编码该抗体的核苷酸序列中或藉由肽合成制备。此类修饰包括例如在抗体的氨基酸序列内的残基的缺失及/或插入及/或取代。可进行缺失、插入及取代的任何组合以获得最终构建体,其限制条件为最终构建体具有所要特征,例如抗原结合。
[0400]
在一些实施方案中,提供具有一个或多个氨基酸取代的抗体变体。用于取代型突变诱发的相关位点包括hvr及fr。氨基酸取代可引入至相关抗体中且针对所需活性筛选产物,例如保留/提高的抗原结合、降低的免疫原性或改善的adcc或cdc的产物。
[0401]
保守取代显示于下表5中。
[0402]
表5:保守取代
[0403]
[0404][0405]
氨基酸可根据共同侧链特性分组为不同类别:
[0406]
a.疏水性:正亮氨酸、met、ala、val、leu、ile;
[0407]
b.中性亲水性:cys、ser、thr、asn、gln;
[0408]
c.酸性:asp、glu;
[0409]
d.碱性:his、lys、arg;
[0410]
e.影响链定向的残基:gly、pro;
[0411]
f.芳族:trp、tyr、phe。
[0412]
非保守取代将必然伴有将这些类别中的一种的成员换成另一个类别。
[0413]
例示性取代型变体为亲和力成熟抗体,其可例如,使用基于噬菌体展示的亲和力成熟技术便利地产生。简言之,使一个或多个cdr残基突变且在噬菌体上呈现变异抗体且针对特定生物活性(例如结合亲和力)筛选。改变(例如取代)可在hvr中进行以例如提高抗体亲和力。此类改变可在hvr“热点”(亦即由在体细胞成熟过程期间经历高频率突变的密码子
所编码的残基(参见例如chowdhury,methods mol.biol.207:179-196(2008)),及/或特异性决定残基(sdr))中进行,其中测试所得变体vh或vl的结合亲和力。藉由构筑二级文库及自二级文库再选择来达成亲和力成熟已描述于hoogenboom等人的methods in molecular biology 178:1-37(o'brien等人编,human press,totowa,nj,(2001))中。
[0414]
在亲和力成熟的一些实施方案中,藉由多种方法(例如易错pcr、链改组或寡核苷酸引导的突变诱发)中的任一种将多样性引入经选择用于成熟的可变基因中。随后产生二级库。随后筛选该库以鉴别具有所需亲和力的任何抗体变体。引入多样性的另一方法涉及hvr引导途径,其中将若干hvr残基(例如一次4-6个残基)随机分组。涉及抗原结合的hvr残基可特定鉴别,例如使用丙氨酸扫描突变诱发或模型化来鉴别。特定言之,通常靶向cdr-h3及cdr-l3。
[0415]
在一些实施方案中,取代、插入或缺失可发生在一个或多个hvr内,只要这些改变不实质上降低抗体结合抗原的能力即可。举例而言,可在hvr中进行不实质上降低结合亲和力的保守改变(例如如本文所提供的保守取代)。此类改变可在hvr“热点”或sdr外。在上文所提供之变异vh及vl序列之某些实施方案中,各hvr未改变或含有不超过一个、两个或三个氨基酸取代。
[0416]
可靶向突变诱发的用于鉴别抗体的残基或区域的适用方法称为“丙氨酸扫描突变诱发”,如由cunningham及wells(1989)science,244:1081-1085所描述。在此方法中,鉴别残基或目标残基(例如带电残基,诸如arg、asp、his、lys及glu)的群且由中性或带负电氨基酸(例如丙氨酸或聚丙氨酸)置换以测定抗体与抗原的相互相用是否受到影响。可在对初始取代显示功能敏感性的氨基酸位置处引入其他取代。或者或另外,抗原-抗体复合体的晶体结构可经测定以鉴别抗体与抗原之间的接触点。此类接触残基及邻近残基可作为取代候选物之标靶或排除在取代候选物之外。可筛选变体以判定其是否含有所需特性。
[0417]
氨基酸序列插入包括在一个残基至含有一百个或一百个以上残基的多肽长度范围内的氨基及/或羧基端融合物,以及具有单个或多个氨基酸残基的序列内插入。末端插入的实例包括具有n末端甲硫胺酰基残基的抗体。抗体分子的其他插入变体包括抗体的n端或c端与酶(例如对于adept而言)或延长抗体的血清半衰期的多肽的融合物。
[0418]
fc区变体
[0419]
在一些实施方案中,一个或多个氨基酸修饰可引入至本文所提供的全长抗amc抗体的fc区中,进而产生fc区变体。在一些实施方案中,fc区变体具有增强的抗体依赖性细胞毒性(adcc)效应功能,其通常与结合至fc受体(fcr)相关。在一些实施方案中,fc区变体具有降低的adcc效应功能。存在可改变效应功能的fc序列的变化或突变的多个实例。举例而言,wo 00/42072及shields等人j biol.chem.9(2):6591-6604(2001)描述具有提高或下降的与fcr的结合的抗体变体。这些出版物的内容以引用的方式特别并入本文中。
[0420]
抗体依赖性细胞介导的细胞毒性(adcc)为治疗性抗体对肿瘤细胞的作用机制。adcc为细胞介导的免疫防御,藉此免疫系统的效应细胞活跃地溶解靶细胞(例如癌细胞),该细胞的膜表面抗原已与特异性抗体(例如抗amc抗体)结合。典型adcc涉及nk细胞藉由抗体的活化。nk细胞表达为fc受体的cd16。此受体识别结合至靶细胞表面的抗体的fc部分,且结合至该fc部分。nk细胞表面上最常见的fc受体称作cd16或fcγriii。fc受体与抗体的fc区的结合导致nk细胞活化、溶细胞颗粒的释放及随之而来的靶细胞凋亡。adcc对肿瘤细胞
杀死的贡献可藉由使用已经高亲和力fcr转染的nk-92细胞的特异性测试测量。结果相比于不表达fcr的野生型nk-92细胞。
[0421]
在一些实施方案中,本发明涵盖包含具有一些但并非所有效应功能的fc区的抗amc构建体变体,此使得其为抗amc构建体体内半衰期重要,而某些效应功能(如cdc及adcc)不必要或有害的应用的所需候选物。可进行体外及/或体内细胞毒性分析以证实cdc及/或adcc活性的降低/消除。举例而言,可进行fc受体(fcr)结合分析以确保抗体缺乏fcγr结合(因此可能缺乏adcc活性),但保留fcrn结合能力。用于介导adcc的初级细胞nk细胞仅表达fcγriii,而单核细胞表达fcγri、fcγrii及fcγriii。fcr在造血细胞上的表达概述于ravetch及kinet,annu.rev.immunol.9:457-492(1991)的第464页的表3中。评估所关注的分子的adcc活性之体外分析的非限制性实例描述于美国专利第5,500,362号(参见例如hellstrom,i.等人proc.nat'l acad.sci.usa 83:7059-7063(1986))及hellstrom,i等人,proc.nat'l acad.sci.usa 82:1499-1502(1985);美国专利第5,821,337号(参见bruggemann,m.等人,j.exp.med.166:1351-1361(1987))中。或者,可采用非放射性分析方法(参见例如用于流式细胞术的actitm非放射性细胞毒性分析(celltechnology,inc.mountain view,calif.;及cytotox非放射性细胞毒性分析(promega,madison,wis.)。适用于此类分析的效应细胞包括周边血液单核细胞(pbmc)及天然杀手(nk)细胞。或者或另外,所关注的分子的adcc活性可体内评估,例如在如揭示于clynes等人proc.nat'l acad.sci.usa 95:652-656(1998)中的动物模型中。亦可进行c1q结合分析以确认抗体不能结合c1q且因此缺乏cdc活性。参见例如,wo 2006/029879及wo 2005/100402中的c1q及c3c结合elisa。为了评估补体活化,可进行cdc分析(参见例如gazzano-santoro等人,j.immunol.methods 202:163(1996);cragg,m.s.等人,blood 101:1045-1052(2003);及cragg,m.s.及m.j.glennie,blood 103:2738-2743(2004))。亦可使用本领域已知的方法(参见例如petkova,s.b.等人,int'l.immunol.18(12):1759-1769(2006))进行fcrn结合及体内清除率/半衰期测定。
[0422]
具有降低的效应功能的抗体包括具有fc区残基238、265、269、270、297、327及329中的一项或多项的取代的那些(美国专利第6,737,056号)。此类fc突变体包括在氨基酸位置265、269、270、297及327中之两者或两者以上处具有取代之fc突变体,包括残基265及297取代为丙氨酸之所谓的“dana”fc突变体(美国专利第7,332,581号)。
[0423]
描述具有提高或降低的与fcr的结合的某些抗体变体。(参见例如,美国专利第6,737,056号;wo 2004/056312,及shields等人,j.biol.chem.9(2):6591-6604(2001))。
[0424]
在一些实施方案中,提供包含含一个或多个提高adcc的氨基酸取代的变异fc区的抗amc构建体(例如全长抗amc抗体)变体。在一些实施方案中,变异fc区包含一个或多个提高adcc的氨基酸取代,其中取代系在变异fc区之位置298、333及/或334(残基的eu编号)处。在一些实施方案中,抗amc构建体(例如全长抗amc抗体)变体包含其变异fc区中的以下氨基酸取代:s298a、e333a及k334a。
[0425]
在一些实施方案中,在fc区中进行导致改变(亦即提高或降低)的c1q结合及/或补体依赖性细胞毒性(cdc)的改变,例如如美国专利第6,194,551号、wo 99/51642及idusogie等人,j.immunol.164:4178-4184(2000)中所述。
[0426]
在一些实施方案中,提供包含含一个或多个氨基酸取代的变异fc区的抗amc构建
2005/035586;wo 2005/035778;wo2005/053742;wo2002/031140;okazaki等人j.mol.biol.336:1239-1249(2004);yamane-ohnuki等人biotech.bioeng.87:614(2004)。能够产生去海藻糖基化抗体的细胞系的实例包括缺乏蛋白质海藻糖基化的lec13 cho细胞(ripka等人,arch.biochem.biophys.249:533-545(1986);美国专利申请第us 2003/0157108 a1号,presta,l;以及wo 2004/056312 a1,adams等人,尤其实例11),及基因剔除细胞系,诸如α-1,6-海藻糖基转移酶基因、fut8、基因剔除cho细胞(参见例如yamane-ohnuki等人,biotech.bioeng.87:614(2004);kanda,y.等人,biotechnol.bioeng.,94(4):680-688(2006);以及wo2003/085107)。
[0433]
抗amc构建体(如全长抗amc抗体)变体另外具有平分寡糖(bisected oligosaccharide),例如其中附接至抗amc构建体的fc区之二触角寡糖藉由glcnac平分。此类抗amc构建体(如全长抗amc抗体)变体可具有减少的海藻糖基化及/或改良的adcc功能。此类抗体变体的实例描述于例如wo 2003/011878(jean-mairet等人);美国专利第6,602,684号(umana等人);us 2005/0123546(umana等人)及ferrara等人,biotechnology and bioengineering,93(5):851-861(2006)中。亦提供在附接至fc区之寡糖中具有至少一个半乳糖残基的抗amc构建体(如全长抗amc抗体)变体。此类抗amc构建体变体可具有改良的cdc功能。此类抗体变体描述于例如wo 1997/30087(patel等人);wo 1998/58964(raju,s.);及wo 1999/22764(raju,s.)中。
[0434]
在一些实施方案中,包含fc区的抗amc构建体(如全长抗amc抗体)变体能够结合至fcγriii。在一些实施方案中,包含fc区的抗amc构建体(如全长抗amc抗体)变体在人类效应细胞存在下具有adcc活性或相比于包含人类野生型igg1fc区的另外相同抗构建体(如全长抗amc抗体)在人类效应细胞存在下具有增加的adcc活性。
[0435]
半胱氨酸工程改造变体
[0436]
在一些实施方案中,可能需要产生半胱氨酸工程改造抗amc构建体(如全长抗amc抗体),其中一个或多个氨基酸残基经半胱氨酸残基取代。在一些实施方案中,经取代的残基存在于抗amc构建体的可接近位点处。藉由用半胱氨酸取代那些残基,反应性硫醇基进而定位于抗amc构建体的可接近位点处且可用于将抗amc构建体结合至其他部分,如药物部分或接头-药物部分,以产生抗amc免疫缀合物(如本文中进一步描述)。半胱氨酸工程改造抗amc构建体(如全长抗amc抗体)可如例如美国专利第7,521,541号中所描述产生。
[0437]
衍生物
[0438]
在一些实施方案中,本文中所提供的抗amc构建体可经进一步修饰以含有本领域已知且可易于获得的额外非蛋白质部分。适合于抗amc构建体衍生作用的部分包括(但不限于)水溶性聚合物。水溶性聚合物的非限制性实例包括(但不限于)聚乙二醇(peg)、乙二醇/丙二醇共聚物、羧甲基纤维素、聚葡萄糖、聚乙烯醇、聚乙烯吡咯啶酮、聚-1,3-二氧杂环戊烷、聚-1,3,6-三恶烷、乙烯/顺丁烯二酸酐共聚物、聚氨基酸(均聚物或无规共聚物)及聚葡萄糖或聚(n-乙烯吡咯啶酮)聚乙二醇、丙二醇均聚物、聚氧化丙烯/氧化乙烯共聚物、聚氧乙烯多元醇(例如甘油)、聚乙烯醇及其混合物。聚乙二醇丙醛因其于水中之稳定性而可具有制造优势。聚合物可具有任何分子量,且可为分支链或未分支的。连接至抗amc构建体的聚合物的数量可变化,且若连接一种以上聚合物,则其可为相同或不同分子。一般而言,用于衍生作用的聚合物的数目及/或类型可基于包括(但不限于)待改良抗amc构建体的特定
特性或功能、抗amc构建体衍生物是否将用于限定条件下的疗法等考虑因素来确定。
[0439]
在一些实施方案中,提供抗amc构建体与可藉由暴露于辐射选择性地加热的非蛋白质部分的缀合物。在一些实施方案中,非蛋白质部分为碳纳米管(kam等人,proc.natl.acad.sci.usa 102:11600-11605(2005))。辐射可具有任何波长,且包括(但不限于)不损害普通细胞但将非蛋白质部分加热至杀死抗amc构建体-非蛋白质部分近侧的细胞的温度的波长。
[0440]
car效应细胞制备
[0441]
在一方面中,本发明提供表达抗amc car的效应细胞(如淋巴细胞,例如t细胞)。本文提供制备表达抗amc car的效应细胞(如t细胞)(抗amc car效应细胞,如抗amc car t细胞)的例示性方法。
[0442]
在一些实施方案中,抗amc car效应细胞(如t细胞)可由将包含抗amc car(例如包含抗amc抗体部分及cd28及cd3ζ胞内信号传导序列的car)的载体(包括例如慢病毒载体)引入至效应细胞(如t细胞)中产生。在一些实施方案中,本发明的抗amc car效应细胞(如t细胞)能够体内复制,导致可导致afp阳性疾病(如癌症,例如hcc)的持续控制的长期持久性。
[0443]
在一些实施方案中,本发明涉及施用表达抗amc car的遗传修饰t细胞以使用淋巴细胞输注治疗患有afp阳性疾病或处于患有afp阳性疾病风险下的患者。在一些实施方案中,自体淋巴细胞输注用于治疗。自体pbmc收集自需要治疗的患者且t细胞使用本文所描述及本领域已知的方法活化及扩增,且接着输注回患者中。
[0444]
在一些实施方案中,抗amc car t细胞表达包含抗amc抗体部分的抗amc car(在本文中亦称为“抗amc car t细胞”)。在一些实施方案中,抗amc car t细胞表达包含含抗amc抗体部分的细胞外域及包含cd3ζ及cd28的胞内信号传导序列的细胞内域的抗amc car。本发明的抗amc car t细胞可经历稳固体内t细胞扩增且可产生在血液及骨髓中持续延长时间量保持于高含量下的amc特异性记忆细胞。在一些实施方案中,输注至患者中的本发明的抗amc car t细胞可体内消除患有afp阳性疾病的患者中的amc呈递细胞,如amc呈递癌细胞。在一些实施方案中,输注至患者中的本发明的抗amc car t细胞可在患有难以用至少一种已知治疗来治疗的afp阳性疾病的患者中体内消除amc呈递细胞,如amc呈递癌细胞。
[0445]
在一些实施方案中,抗amc car t细胞表达具有均匀细胞表面分布的抗amc car。均匀细胞表面分布可例如藉由具有连续外观及均匀厚度或信号强度的染色模式表征。举例而言,在一些实施方案中,包含抗amc car t细胞的组合物,如药物组合物包含少于约10%(如少于约10%、9%、8%、7%、6%、5%、4%、3%、2%或1%)在细胞表面上具有抗amc car聚集的细胞。聚集可例如藉由具有不均匀厚度或信号强度,或不连续、块状、点状及/或不均匀分布模式的染色模式表征。在一些实施方案中,抗amc car t细胞表达在细胞表面上具有小于约10%(如小于约10%、9%、8%、7%、6%、5%、4%、3%、2%或1%)抗amc car聚集的抗amc car。在一些实施方案中,抗amc car t细胞具有低含量的抗原独立性抗amc car活化。在一些实施方案中,抗amc car t细胞具有低含量的t细胞衰竭。t细胞衰竭在延长的免疫活化条件期间,如在癌症或慢性感染(其中t细胞变得功能异常)情况下自然地发生。t细胞衰竭可藉由相比于功能性效应或记忆t细胞削弱的效应功能、延长的抑制受体表达及/或改变之转录状态表征。肿瘤细胞及感染的最优清除经t细胞衰竭阻止。抗amc car t细胞的t细胞衰竭可藉由本领域已知的任何方法表征,例如藉由测定其功能及/或表达型轮廓
(wherry,e.j.,nature immunology 12(6):492-499,2011;jiang,y.等人,cell death&disease 6(6):e1792,2015)。举例而言,在一些实施方案中,抗amc car t细胞表达低含量的一种或多种t细胞衰竭标记物,包括例如pd-1、lag-3、tim-3、ctla-4、btla及tigit。在一些实施方案中,抗amc car t细胞维持用于il-2产生、tnf-α产生、ifn-γ产生及颗粒酶b产生的非耗尽t细胞的含量特征,及/或维持靶细胞存在下的离体杀死能力,表明抗amc car t细胞不经历自活化及过早衰竭。
[0446]
在t细胞扩增及基因修饰之前,t细胞来源获自个体。t细胞可获自多种来源,包括周边血液单核细胞、骨髓、淋巴结组织、脐带血、胸腺组织、来自感染位点之组织、腹水、肋膜积液、脾组织及肿瘤。在本发明的一些实施方案中,可使用任何数目的本领域可用的t细胞系。在本发明的一些实施方案中,t细胞可获自使用任何数目的本领域技术人员已知的技术(诸如ficolltm分离)自个体收集之血液单元。在一些实施方案中,藉由清除术获得来自个体的循环血液的细胞。清除术产物通常含有淋巴细胞,包括t细胞、单核细胞、粒细胞、b细胞、其他成核白血球、红血球及血小板。在一些实施方案中,藉由清除术收集的细胞可经洗涤以移除血浆部分且将细胞置于适当缓冲液或培养基中以用于后续处理步骤。在一些实施方案中,细胞用磷酸盐缓冲盐水(pbs)洗涤。在一些实施方案中,洗涤溶液缺乏钙且可能缺乏镁或可能缺乏许多(若并非全部)二价阳离子。如一般技术者将容易了解,洗涤步骤可藉由本领域技术人员已知的方法实现,诸如藉由根据制造商说明书使用半自动“流通”离心(例如cobe 2991细胞处理器、baxter cytomate或haemonetics细胞保存器5)。在洗涤之后,细胞可再悬浮于多种生物相容性缓冲剂中,如ca
2+
游离、mg
2+
游离pbs、plasmalyte a或其他具有或不具有缓冲剂的生理盐水溶液。或者,可移除清除术样本的非所要组分且将细胞直接再悬浮于培养基中。
[0447]
在一些实施方案中,藉由溶解红血球及例如藉由经percolltm梯度离心或藉由逆流离心淘析耗尽单核细胞而自周边血液淋巴细胞分离t细胞。t细胞的特异性亚群(诸如cd3+、cd28+、cd4+、cd8+、cd45ra+及cd45ro+t细胞)可藉由正选择或负选择技术进一步分离。举例而言,在一些实施方案中,藉由与抗cd3/抗cd28(亦即3
×
28)结合的珠粒(诸如m-450 cd3/cd28 t)一起培育足以正选择所要t细胞的时间来分离t细胞。在一些实施方案中,时段为约30分钟。在一些实施方案中,时段在30分钟至36小时或更长及其间的所有整数值范围内。在一些实施方案中,时段为至少1、2、3、4、5或6小时。在一些实施方案中,时段为10至24小时。在一些实施方案中,培育时段为24小时。为了自患有白血病的患者分离t细胞,使用较长培育时间(诸如24小时)可提高细胞产量。在相较于其他细胞类型存在很少t细胞的任何情形中可使用较长培育时间分离t细胞,诸如自肿瘤组织或免疫功能不全个体分离肿瘤浸润淋巴细胞(til)。此外,使用较长培育时间可提高捕捉cd8+t细胞之效率。因此,藉由仅缩短或延长允许t细胞结合至cd3/cd28珠粒的时间及/或藉由增加或减小珠粒于t细胞的比率,可对于或针对在培养起始时或方法期间的其他时间点优先选择t细胞亚群。另外,藉由增加或减小珠粒或其他表面上抗cd3及/或抗cd28抗体的比率,对于或针对在培养起始时或在其他所要时间点可优先选择t细胞亚群。本领域技术人员将认识到本发明的上下文中亦可使用多个选择回合。在一些实施方案中,可能需要进行选择程序且在活化及扩增过程中使用“未经选择的”细胞。“未经选择的”细胞亦可进行其他选择回合。
[0448]
藉由负选择增浓t细胞群体可使用针对负选择的细胞所独特的表面标记的抗体的组合来实现。一种方法为经负磁性免疫黏附或流动式细胞测量术分选及/或选择细胞,该负磁性免疫黏附或流动式细胞测量术使用针对负选择细胞上存在的细胞表面标记物的单克隆抗体混合物。举例而言,为了藉由负选择增浓cd4+细胞,单克隆抗体混合液通常包括cd 14、cd20、cd11b、cd16、hla-dr及cd8的抗体。在一些实施方案中,可能需要增浓或正选择调节t细胞,其通常表达cd4+、cd25+、cd62lhi、gitr+及foxp3+。或者,在一些实施方案中,t调节细胞藉由抗cd25结合珠粒或其他类似选择方法耗尽。
[0449]
为了藉由正选择或负选择分离所要细胞群体,细胞浓度及表面(例如粒子,诸如珠粒)可变化。在一些实施方案中,可能需要显著减小珠粒及细胞混合在一起的体积(亦即增加细胞浓度),以确保细胞及珠粒的最大接触。举例而言,在一些实施方案中,使用约20亿个细胞/毫升的浓度。在一些实施方案中,使用约10亿个细胞/毫升的浓度。在一些实施方案中,使用大于约100,000,000个细胞/毫升。在一些实施方案中,使用约10,000,000、15,000,000、20,000,000、25,000,000、30,000,000、35,000,000、40,000,000、45,000,000或50,000,000中的任一项个细胞/毫升的浓度。在一些实施方案中,使用约75,000,000、80,000,000、85,000,000、90,000,000、95,000,000或100,000,000中的任一项个细胞/毫升的浓度。在一些实施方案中,使用约125,000,000或约150,000,000个细胞/毫升的浓度。使用高浓度可导致增加的细胞产量、细胞活化及细胞扩增。此外,使用高细胞浓度使得更有效捕捉可能弱表达所关注目标抗原的细胞(诸如cd28阴性t细胞)或自存在许多肿瘤细胞的样品(亦即白血病血液、肿瘤组织等)更有效捕捉细胞。此类细胞群体可具有治疗价值且将需要获得。举例而言,使用高细胞浓度允许更有效选择通常具有较弱cd28表达之cd8+t细胞。
[0450]
在本发明的一些实施方案中,t细胞直接获自治疗之后的患者。就此而言,已观测到在某些癌症治疗之后,特定言之使用破坏免疫系统的药物治疗之后,在患者通常将自治疗恢复的时段期间治疗之后不久,获得的t细胞品质可最佳或其离体扩增的能力得到改良。同样,在使用本文所描述的方法离体操纵之后,这些细胞的增强移植及体内扩增可呈优选状态。因此,本发明的上下文内涵盖在此恢复阶段期间收集血细胞(包括t细胞)、树突状细胞或造血谱系的其他细胞。此外,在一些实施方案中,移动(例如用gm-csf移动)及调节方案可用于建立个体内的条件,其中尤其在治疗之后的制定时间窗期间宜再增殖、再循环、再生及/或扩增特定细胞类型。说明性细胞类型包括t细胞、b细胞、树突状细胞及免疫系统的其他细胞。
[0451]
无论在基因修饰t细胞以表达所需抗amc car之前或之后,t细胞可一般使用如例如以下各项中所描述的方法活化及扩增:美国专利第6,352,694;6,534,055;6,905,680;6,692,964;5,858,358;6,887,466;6,905,681;7,144,575;7,067,318;7,172,869;7,232,566;7,175,843;5,883,223;6,905,874;6,797,514;6,867,041号;及美国专利申请公开案第20060121005号。
[0452]
一般而言,本发明的t细胞藉由使与其连接的表面与刺激cd3/tcr复合体相关信号的药剂及刺激t细胞表面上的共刺激分子的配体接触而扩增。特定言之,t细胞群体可诸如藉由与抗cd3抗体或其抗原结合片段,或固定于表面上之抗cd2抗体接触,或藉由同与钙离子载体结合的蛋白激酶c活化剂(例如苔藓虫素)接触而刺激。为了共刺激t细胞表面上的辅助分子,使用结合辅助分子的配体。举例而言,t细胞群体可与抗cd3抗体及抗cd28抗体在适
于刺激t细胞增殖的条件下接触。为了刺激cd4+t细胞或cd8+t细胞的增殖,抗cd3抗体及抗cd28抗体。抗cd28抗体的实例包括9.3、b-t3、xr-cd28(diaclone,france),可如本领域通常已知的其他方法一般可使用(berg等人,transplant proc.30(8):3975-3977,1998;haanen等人,j.exp.med.190(9):13191328,1999;garland等人,j.immunol meth.227(1-2):53-63,1999)。
[0453]
免疫缀合物制备
[0454]
抗amc免疫缀合物可使用本领域已知的任何方法制备。参见例如wo 2009/067800、wo 2011/133886及美国专利申请公开案第2014322129号,其以全文引用的方式并入本文中。
[0455]
抗amc免疫缀合物的抗amc抗体部分可藉由任何方法“附接至”效应分子,抗amc抗体部分可藉由该方法与效应分子相关联,或连接至效应分子。举例而言,抗amc免疫缀合物的抗amc抗体部分可藉由化学或重组方法附接至效应分子。制备融合物或缀合物的化学方法为本领域已知且可用于制备抗amc免疫缀合物。用于结合抗amc抗体部分及效应分子的方法必须能够在不干扰结合蛋白结合至靶细胞上的抗原的能力的情况下使结合蛋白与效应分子接合。
[0456]
抗amc免疫缀合物的抗amc抗体部分可间接连接至效应分子。举例而言,抗amc免疫缀合物的抗amc抗体部分可直接连接至含有若干类型中的一者的效应分子的脂质体。效应分子及/或抗amc抗体部分亦可结合至固体表面。
[0457]
在一些实施方案中,抗amc免疫缀合物的抗amc抗体部分及效应分子均为蛋白质且可使用本领域熟知的技术结合。存在数百可结合两种蛋白质的可用交联剂。(参见例如”chemistry of protein conjugation and crosslinking”.1991,shans wong,crc press,ann arbor)。交联剂一般基于可用或插入抗amc抗体部分及/或效应分子上的反应性官能基选择。另外,若不存在反应性基团,则可使用光可活化交联剂。在某些情况下,可能需要在抗amc抗体部分与效应分子之间包括间隔基。此项技术已知的交联剂包括同型双官能药剂:戊二醛、二亚胺代己二酸二甲酯及双(重氮联苯胺)及同种异型双官能药剂:间顺丁烯二酰亚氨基苯甲酰基-n-羟基丁二酰亚胺及磺酸基-间顺丁烯二酰亚氨基苯甲酰基-n-羟基丁二酰亚胺。
[0458]
在一些实施方案中,抗amc免疫缀合物的抗amc抗体部分可经特异性残基工程改造以化学连接效应分子。本领域已知的用于化学连接分子的特异性残基包括离氨酸及半胱氨酸。基于插入抗amc抗体部分上及效应分子上可用的反应性官能基选择交联剂。
[0459]
抗amc免疫缀合物亦可使用重组dna技术制备。在此情况下,编码抗amc抗体部分的dna序列融合至编码效应分子的dna序列,产生嵌合dna分子。嵌合dna序列转染至表达融合蛋白的宿主细胞中。融合蛋白可自细胞培养物回收且使用本领域已知的技术纯化。
[0460]
将效应分子(其为标记)连接至结合蛋白的实例包括hunter等人,nature 144:945(1962);david等人,biochemistry 13:1014(1974);pain等人,j.immunol.meth.40:219(1981);nygren,j.histochem.and cytochem.30:407(1982);wensel及meares,radioimmunoimaging and radioimmunotherapy,elsevier,n.y.(1983);及colcher等人,“use of monoclonal antibodies as radiopharmaceuticals for the localization of human carcinoma xenografts in athymic mice”,meth.enzymol.,121:802-16(1986)中
所述的方法。
[0461]
放射性或其他标记可以已知方式并入免疫缀合物中。举例而言,肽可生物合成或可藉由化学氨基酸合成、使用适合氨基酸前驱体(包括例如氟-19替代氢)而合成。如99tc或123i、186re、188re及111in的标记可经由肽中的半胱氨酸残基连接。钇-90可经由离氨酸残基连接。iodogen方法(fraker等人biochem.biophys.res.commun.80:49-57(1978))可用以并入碘-123。”monoclonal antibodies in immunoscintigraphy”(chatal,crc press 1989)详细描述其他方法。
[0462]
可使用多种双功能蛋白质偶合剂制得抗体部分与细胞毒性剂的免疫缀合物,所述双功能蛋白质偶合剂诸如n-丁二酰亚氨基-3-(2-吡啶基二硫基)丙酸酯(spdp)、丁二酰亚氨基-4-(n-顺丁烯二酰亚氨基甲基)环己烷-1-甲酸酯(smcc)、亚氨基硫杂环戊烷(it)、亚氨基酯之双功能衍生物(诸如二亚胺代己二酸二甲酯hci)、活性酯(诸如辛二酸二丁二酰亚氨基酯)、醛(诸如戊二醛)、双迭氮基化合物(诸如双(对迭氮基苯甲酰基)己二胺)、双重氮衍生物(诸如双(对重氮苯甲酰基)乙二胺)、二异氰酸酯(诸如甲苯2,6-二异氰酸酯)及双活性氟化合物(诸如1,5-二氟-2,4-二硝基苯)。举例而言,蓖麻毒素免疫毒素可如vitetta等人,science 238:1098(1987)中所述来制备。碳14标记的1-异硫氰基苯甲基-3-甲基二亚乙基三胺五乙酸(mx-dtpa)为用于将放射性核苷酸结合抗体的例示性螯合剂。参见例如wo94/11026。接头可为促进细胞中的细胞毒性药物释放之“可裂解接头”。举例而言,可使用酸不稳定接头、肽酶敏感接头、光不稳定性接头、二甲基接头或含二硫键接头(chari等人,cancer research 52:127-131(1992);美国专利第5,208,020号)。
[0463]
本发明的抗amc免疫缀合物明确地涵盖(但不限于)用交联剂试剂制备的adc:bmps、emcs、gmbs、hbvs、lc-smcc、mbs、mpbh、sbap、sia、siab、smcc、smpb、smph、磺基-emcs、磺基-gmbs、磺基-kmus、磺基-mbs、磺基-siab、磺基-smcc及磺基-smpb,及svsb(丁二酰亚氨基-(4-乙烯基砜)苯甲酸酯),其市售可得(例如来自pierce biotechnology,inc.,rockford,il.,u.s.a)。参见第467-498页,2003-2004applications handbook and catalog。
[0464]
药物组合物
[0465]
本文亦提供包含抗amc构建体的组合物(如药物组合物,在本文中亦称为配制剂)。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞,例如t细胞)。在一些实施方案中,提供包含抗amc构建体及医药学上可接受的载剂的药物组合物。在一些实施方案中,药物组合物进一步包含与抗amc构建体相关的细胞(如效应细胞,例如t细胞)。
[0466]
抗amc构建体的适合配制剂藉由将具有所需纯度的抗amc构建体与视情况存在之医药学上可接受的载赋形剂或稳定剂(remington's pharmaceutical sciences第16版,osol,a.编(1980))以冻干配制剂或水溶液形式混合而获得。在所采用的剂量及浓度下,可接受的载剂、赋形剂或稳定剂对接受者无毒,且其包括缓冲剂,诸如磷酸盐、柠檬酸盐及其他有机酸;抗氧化剂,包括抗坏血酸及甲硫氨酸;防腐剂(诸如氯化十八烷基二甲基苯甲基铵;氯化六羟季铵;氯化苯甲烃铵;苄索氯铵;酚;丁醇或苯甲醇;对羟苯甲酸烷酯,诸如对羟基苯甲酸甲酯或对羟基苯甲酸丙酯;儿茶酚;间苯二酚;环己醇;3-戊醇及间甲酚);低分子量(小于约10个残基)多肽;蛋白质,诸如血清白蛋白、明胶或免疫球蛋白;亲水性聚合物,诸
如聚乙烯吡咯啶酮;氨基酸,诸如甘氨酸、麸酰氨酸、天冬酰胺、组氨酸、精氨酸或离氨酸;单糖、双糖及其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合剂,诸如edta;糖,诸如蔗糖、甘露糖醇、海藻糖或山梨糖醇;成盐相对离子,诸如钠;金属络合物(例如,zn-蛋白质复合物);及/或非离子界面活性剂,诸如tweentm、pluronicstm或聚乙二醇(peg)。例示性配制剂描述于wo98/56418中,该专利以引用的方式明确并入本文中。适用于皮下施用之冻干配制剂描述于wo97/04801中。此类冻干配制剂可藉由适合稀释剂复原至高蛋白质浓度且经复原配制剂可皮下施用至本文中之待治疗个体。脂质体(lipofectin/liposome)可用于将本发明的抗amc构建体传递至细胞中。
[0467]
本文中的配制剂亦可含有除抗amc构建体以外的一种或多种活性化合物(视治疗之特定适应症之需要),优选具有不会不利地彼此影响的互补活性的那些。举例而言,可能需要进一步提供除抗amc构建体以外的抗赘生剂、生长抑制剂、细胞毒性剂或化学治疗剂。此类分子宜以对预期目的有效的量存在于组合中。此类其他药剂的有效量视存在于配制剂中的抗amc构建体的量、疾病或病症或治疗的类型及如上文所述的其他因素而定。这些药剂一般以如本文所述的相同剂量及施用途径或迄今为止采用的剂量的约1%至99%使用。
[0468]
亦可例如藉由凝聚技术或藉由界面聚合将抗amc构建体包埋于所制备的微胶囊中,例如羟基甲基纤维素或明胶微胶囊及聚-(甲基丙烯酸甲酯)微胶囊分别包埋于胶状药物传递系统(例如脂质体、白蛋白微球体、微乳液、纳米粒子及纳米胶囊)中或于巨乳液中。此类技术揭示于remington's pharmaceutical sciences第16版,osol,a.编(1980)中。可制备持续释放制剂。
[0469]
可制备抗amc构建体之持续释放制剂。持续释放制剂的适合实例包括含有抗体(或其片段)的固体疏水性聚合物的半渗透基质,所述基质呈成形物品,例如膜或微胶囊形式。持续释放基质的实例包括聚酯、水凝胶(例如,聚(甲基丙烯酸2-羟乙酯)或聚(乙烯醇))、聚乳酸交酯(美国专利第3,773,919号)、l-麸氨酸与乙基-l-麸氨酸的共聚物、不可降解乙烯-乙酸乙烯酯、诸如lupron depot tm(由乳酸-乙醇酸共聚物及亮丙瑞林乙酸盐(leuprolide acetate)构成的可注射微球体)的可降解乳酸-乙醇酸共聚物及聚-d-(-)-3-羟基丁酸。虽然诸如乙烯-乙酸乙烯酯及乳酸-乙醇酸之聚合物允许持续超过100天释放分子,但某些水凝胶持续较短时间段释放蛋白质。若囊封抗体长时间留存于体内,则其可因在37℃下暴露于水分而变性或聚集,引起生物活性损失及可能的免疫原性变化。可取决于相关机制而设计抗amc构建体稳定化的合理策略。举例而言,若发现聚集机制经由硫基-二硫化物互换而形成分子间s-s键,则稳定化可藉由修饰巯基残基、自酸性溶液冻干、控制水分含量、使用适当添加剂及开发特定聚合基质组合物来达成。
[0470]
在一些实施方案中,抗amc构建体调配于包含柠檬酸盐、nacl、乙酸盐、丁二酸盐、甘氨酸、聚山梨醇酯80(tween 80)或前述的任何组合的缓冲液中。在一些实施方案中,抗amc构建体调配于包含约100mm至约150mm甘氨酸的缓冲液中。在一些实施方案中,抗amc构建体调配于包含约50mm至约100mm nacl的缓冲液中。在一些实施方案中,抗amc构建体调配于包含约10mm至约50mm乙酸盐的缓冲液中。在一些实施方案中,抗amc构建体调配于包含约10mm至约50mm丁二酸盐的缓冲液中。在一些实施方案中,抗amc构建体调配于包含约0.005%至约0.02%聚山梨醇酯80的缓冲液中。在一些实施方案中,抗amc构建体调配于ph在约5.1与5.6之间的缓冲液中。在一些实施方案中,抗amc构建体调配于包含10mm柠檬酸
盐、100mm nacl、100mm甘氨酸及0.01%聚山梨醇酯80的缓冲液中,其中配制剂在ph 5.5下。
[0471]
体内施用的配制剂必须为无菌的。此藉由例如经由无菌过滤膜过滤容易地实现。
[0472]
使用抗amc构建体的治疗方法
[0473]
可向个体(例如哺乳动物,如人类)施用本发明的抗amc构建体及/或组合物以治疗涉及异常高afp表达的疾病及/或病症(在本文中亦称为“afp阳性”疾病或病症),包括例如癌症(如肝细胞癌、生殖细胞肿瘤及乳腺癌)。本技术因此在一些实施方案中提供治疗个体中的afp阳性疾病(如癌症)的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体,如本文所述的抗amc构建体中的任一项的组合物(如药物组合物)。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,癌症选自例如由以下组成的组:肝细胞癌、生殖细胞肿瘤及乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0474]
举例而言,在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0475]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0476]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体,其中抗amc抗体部分包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包
含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0477]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体,其中抗amc抗体部分包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0478]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体,其中抗amc抗体部分包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至
多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(例如约1、2、3、4或5中的任一项)个氨基酸取代的变体。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0479]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体,其中抗amc抗体部分包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(例如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(例如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0480]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体,其中抗amc抗体部分包含:i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项
的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0481]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体,其中抗amc抗体部分包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0482]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含含抗amc抗体部分的抗amc构建体的组合物,该抗体部分特异性结合包含afp肽及mhc i类蛋白质的复合体,其中抗amc抗体部分包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,组合物进一步包含与抗amc构建体相关的细胞(如效应细胞)。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0483]
在一些实施方案中,提供治疗个体中的转移性肝细胞癌的方法,其包含向个体施用有效量的包含根据上文所述的实施方案中任一项的抗amc构建体的组合物。在一些实施方案中,个体为人类。
[0484]
在一些实施方案中,提供抑制(如预防)个体中的肝细胞癌转移的方法,其包含向
个体施用有效量的包含根据上文所述的实施方案中任一项的抗amc构建体的组合物。在一些实施方案中,个体为人类。
[0485]
在上文所述的治疗afp阳性疾病的方法中的任一项的一些实施方案中,抗amc构建体在向个体施用之前结合至细胞(如免疫细胞,例如t细胞)。因此,举例而言,提供治疗个体中的afp阳性疾病的方法,其包含a)将本文所述的抗amc构建体中的任一项结合至细胞(如免疫细胞,例如t细胞)以形成抗amc构建体/细胞缀合物,及b)向个体施用有效量的包含抗amc构建体/细胞缀合物的组合物。在一些实施方案中,细胞衍生自个体。在一些实施方案中,细胞不衍生自个体。在一些实施方案中,抗amc构建体藉由共价键联至细胞表面上的分子而结合至细胞。在一些实施方案中,抗amc构建体藉由非共价键联至细胞表面上的分子而结合至细胞。在一些实施方案中,抗amc构建体藉由将一部分抗amc构建体插入至细胞外膜中而结合至细胞。在一些实施方案中,抗amc构建体为非天然存在的。在一些实施方案中,抗amc构建体为全长抗体。在一些实施方案中,抗amc构建体为多特异性(如双特异性)分子。在一些实施方案中,抗amc构建体为嵌合抗原受体。在一些实施方案中,抗amc构建体为免疫缀合物。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0486]
在一些实施方案中,个体为哺乳动物(例如人类、非人类灵长类动物、大鼠、小鼠、母牛、马、猪、绵羊、山羊、狗、猫等)。在一些实施方案中,个体为人类。在一些实施方案中,个体为临床患者、临床试验志愿者、实验动物等。在一些实施方案中,个体年龄小于约60岁(包括例如年龄小于约50、40、30、25、20、15或10岁中的任一项)。在一些实施方案中,个体年龄大于约60岁(包括例如年龄大于约70、80、90或100岁中的任一项)。在一些实施方案中,个体诊断患有或基因上易患本文所述的疾病或病症中的一项或多项(如肝细胞癌、生殖细胞肿瘤及乳腺癌)。在一些实施方案中,个体具有与一种或多种本文所述的疾病或病症相关的一种或多种风险因素。
[0487]
在一些实施方案中,本技术提供将抗amc构建体(如本文所述的抗amc构建体中的任一项)传递至个体中的细胞的方法,该细胞在其表面上呈递包含afp肽及mhc i类蛋白质的复合体,该方法包含向个体施用包含抗amc构建体的组合物。在一些实施方案中,待传递的抗amc构建体与细胞(如效应细胞,例如t细胞)相关。
[0488]
本领域已知用于癌症(如肝细胞癌、生殖细胞肿瘤及乳腺癌)或展现异常afp表达的任何其他疾病的许多诊断方法及那些疾病的临床划定。此类方法包括(但不限于)例如免疫组织化学、pcr及荧光原位杂交(fish)。
[0489]
在一些实施方案中,本发明的抗amc构建体及/或组合物与第二、第三或第四药剂(包括例如抗肿瘤剂、生长抑制剂、细胞毒性剂或化学治疗剂)组合施用以治疗涉及异常afp表达的疾病或病症。在一些实施方案中,抗amc构建体与增加mhc i类蛋白质表达及/或藉由mhc i类蛋白质增强afp肽的表面呈递的药剂组合施用。在一些实施方案中,药剂包括例如ifn受体激动剂、hsp90抑制剂、p53表达增强剂及化学治疗剂。在一些实施方案中,药剂为ifn受体激动剂,包括例如ifnγ、ifnβ及ifnα。在一些实施方案中,药剂为hsp90抑制剂,包括例如坦螺旋霉素(tanespimycin;17-aag)、阿螺旋霉素(alvespimycin;17-dmag)、瑞他霉
素(retaspimycin;ipi-504)、ipi-493、cnf2024/biib021、mpc-3100、debio 0932(cudc-305)、pu-h71、加利特皮(ganetespib;sta-9090)、nvp-auy922(ver-52269)、hsp990、kw-2478、at13387、snx-5422、ds-2248及xl888。在一些实施方案中,药剂为p53表达增强剂,包括例如5-氟尿嘧啶及nutlin-3。在一些实施方案中,药剂为化学治疗剂,包括例如拓朴替康、依托泊苷、顺铂、太平洋紫杉醇及长春碱。
[0490]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其中表达afp的细胞通常不在其表面上呈递,或以相对低含量呈递包含afp蛋白质及mhc i类蛋白质的复合体(如生殖细胞肿瘤细胞),方法包含向个体施用包含抗amc构建体以及增加mhc i类蛋白质的表达及/或藉由mhc i类蛋白质增强afp肽的表面呈递的药剂的组合物。在一些实施方案中,药剂包括例如ifn受体激动剂、hsp90抑制剂、p53表达增强剂及化学治疗剂。在一些实施方案中,药剂为ifn受体激动剂,包括例如ifnγ、ifnβ及ifnα。在一些实施方案中,药剂为hsp90抑制剂,包括例如坦螺旋霉素(17-aag)、阿螺旋霉素(17-dmag)、瑞他霉素(ipi-504)、ipi-493、cnf2024/biib021、mpc-3100、debio 0932(cudc-305)、pu-h71、加利特皮(sta-9090)、nvp-auy922(ver-52269)、hsp990、kw-2478、at13387、snx-5422、ds-2248及xl888。在一些实施方案中,药剂为p53表达增强剂,包括例如5-氟尿嘧啶及nutlin-3。在一些实施方案中,药剂为化学治疗剂,包括例如拓朴替康、依托泊苷、顺铂、太平洋紫杉醇(paclitaxel)及长春碱。
[0491]
癌症治疗可藉由例如,肿瘤消退、肿瘤重量或尺寸收缩、进展时间、存活持续时间、无进展存活期、总反应率、反应持续时间、生活品质蛋白质表达及/或活性评估。可使用确定疗法功效的方法,包括例如经由放射成像测量反应。
[0492]
在一些实施方案中,治疗功效以肿瘤生长抑制百分比(tgi%)形式测量,其使用方程序100-(t/c
×
100)计算,其中t为经治疗肿瘤的平均相对肿瘤体积,且c为未治疗肿瘤的平均相对肿瘤体积。在一些实施方案中,tgi%为约10%、约20%、约30%、约40%、约50%、约60%、约70%、约80%、约90%、约91%、约92%、约93%、约94%、约95%或95%以上。
[0493]
施用抗amc构建体组合物的剂量及方法
[0494]
向个体(如人类)施用的抗amc构建体组合物的剂量可随特定组合物、施用模式及治疗的疾病的类型而变化。在一些实施方案中,组合物的量对于导致目标反应(如部分反应或完全反应)有效。在一些实施方案中,抗amc构建体组合物的量足以导致个体中的完全反应。在一些实施方案中,抗amc构建体组合物的量足以导致个体中的部分反应。在一些实施方案中,施用的抗amc构建体组合物的量(例如当单独施用时)足以在用抗amc构建体组合物治疗的个体群体中产生大于约20%、25%、30%、35%、40%、45%、50%、55%、60%、64%、65%、70%、75%、80%、85%或90%中的任一项的总反应率。个体对本文所描述的方法的治疗的反应可例如基于recist含测量定。
[0495]
在一些实施方案中,组合物的量足以延长个体的无进展存活期。在一些实施方案中,组合物的量足以延长个体的总存活期。在一些实施方案中,组合物的量(例如当单独施用时)足以在用抗amc构建体组合物治疗的个体群体中产生大于约50%、60%、70%或77%中的任一项的临床效益。
[0496]
在一些实施方案中,单独或与第二、第三及/或第四药剂组合的组合物的量为如下量:相比于治疗之前的相同个体中的对应肿瘤尺寸、癌细胞数目或肿瘤生长速率或相比于
未接受治疗的其他个体中的对应活性,足以减小肿瘤尺寸、减少癌细胞数目或降低肿瘤生长速率至少约10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或100%中的任一项。标准方法可用于测量此效应的量值,如藉由纯化酶的体外分析、基于细胞的分析、动物模型或人类测试。
[0497]
在一些实施方案中,组合物中的抗amc构建体(例如全长抗amc抗体、多特异性抗amc分子、抗amc car或抗amc免疫缀合物)的量低于诱发毒理学效应(亦即临床上可接受的毒性含量以上的效应)的含量或处于当向个体施用组合物时,可控制或容许潜在副作用的含量。
[0498]
在一些实施方案中,组合物的量接近遵循相同给药方案的组合物的最大耐受剂量(mtd)。在一些实施方案中,组合物的量大于mtd的约80%、90%、95%或98%中的任一项。
[0499]
在一些实施方案中,组合物中的抗amc构建体(例如全长抗amc抗体、多特异性抗amc分子、抗amc car或抗amc免疫缀合物)的量包括于约0.001μg至约1000μg的范围内。
[0500]
在以上方面中的任一项的一些实施方案中,组合物中的抗amc构建体(例如全长抗amc抗体、多特异性抗amc分子、抗amc car或抗amc免疫缀合物)的有效量在每公斤总体重0.1μg至约100mg范围内。
[0501]
抗amc构建体组合物可经由各种途径向个体(如人类)施用,包括例如静脉内、动脉内、腹膜内、肺内、经口、吸入、囊泡内、肌肉内、气管内、皮下、眼内、鞘内、经黏膜及经皮。在一些实施方案中,可使用组合物的持续连续释放配制剂。在一些实施方案中,组合物经静脉内施用。在一些实施方案中,组合物经门静脉内施用。在一些实施方案中,组合物经动脉内施用。在一些实施方案中,组合物经腹膜内施用。在一些实施方案中,组合物经肝内施用。在一些实施方案中,组合物藉由肝动脉输注施用。
[0502]
抗amc car效应细胞疗法
[0503]
本技术亦提供使用抗amc car将效应细胞(如初生t细胞)的特异性重定向至包含afp肽及mhc i类蛋白质的复合体的方法。因此,本发明亦提供刺激针对哺乳动物中的靶细胞群体或包含amc呈递细胞的组织的效应细胞介导反应(如t细胞介导的免疫反应)的方法,其包含向哺乳动物施用表达抗amc car的效应细胞(如t细胞)的步骤。
[0504]
表达抗amc car的抗amc car效应细胞(如t细胞)可输注至有需要的接受者。输注的细胞能够杀死接受者中的amc呈递细胞。在一些实施方案中,不同于抗体疗法,抗amc car效应细胞(如t细胞)能够体内复制,导致可导致持续肿瘤控制的长期持续性。
[0505]
在一些实施方案中,抗amc car效应细胞为可经历稳固体内t细胞扩增且可保持延长时间量的抗amc car t细胞。在一些实施方案中,本发明的抗amc car t细胞发展为可经再活化以抑制任何额外肿瘤形成或生长的特异性记忆t细胞。
[0506]
本发明的抗amc car t细胞亦可充当用于哺乳动物中的离体免疫接种及/或体内疗法的一种疫苗。在一些实施方案中,哺乳动物为人类。
[0507]
关于离体免疫接种,在向哺乳动物施用细胞之前,体外进行以下中的至少一项:i)扩增细胞,ii)向细胞中引入编码抗amc car的核酸及/或iii)低温保存细胞。
[0508]
离体程序为本领域熟知且在下文中更完全论述。简言之,细胞自哺乳动物(优选人类)分离且经表达本文所揭示的抗amc car的载体遗传修饰(亦即体外转导或转染)。可向哺乳动物接受者施用抗amc car细胞以提供治疗效益。哺乳动物接受者可为人类且抗amc car
细胞关于接受者可为自体的。或者,细胞关于接受者可为同种异体、同系或异种的。
[0509]
用于离体扩增造血干细胞及祖细胞的程序描述于以引用的方式并入本文中的美国专利第5,199,942号中,且可应用于本发明的细胞。其他适合方法为本领域已知,因此本发明不限于任何特定离体扩增细胞的方法。简言之,t细胞之离体培养及扩展包含:(1)藉由周边血液采集或骨髓外植体自哺乳动物收集cd34+造血干细胞及祖细胞;及(2)离体扩增此类细胞。除了美国专利第5,199,942号中描述的细胞生长因子之外,诸如flt3-l、il-1、il-3及c-试剂盒配体的其他因素可用于培养及扩增所述细胞。
[0510]
除了在离体免疫接种方面使用基于细胞的疫苗之外,本发明亦提供用于体内免疫接种以针对患者中的抗原引发免疫反应的组合物及方法。
[0511]
本发明的抗amc car效应细胞(如t细胞)可单独或作为与稀释剂及/或其他组分,如il-2或其他细胞因子或细胞群组合的药物组合物施用。简言之,本发明的药物组合物可包含抗amc car效应细胞(如t细胞),以及一种或多种医药学上或生理学上可接受的载剂、稀释剂或赋形剂。此类组合物可包含缓冲剂,诸如中性缓冲盐水、磷酸盐缓冲盐水及其类似物;碳水化合物,诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露糖醇;蛋白质;多肽或氨基酸,诸如甘氨酸;抗氧化剂;螯合剂,诸如edta或麸胱甘肽;佐剂(例如,氢氧化铝);及防腐剂。在一些实施方案中,抗amc car效应细胞(如t细胞)组合物经调配用于静脉内施用。
[0512]
待施用的本发明的抗amc car效应细胞(如t细胞)组合物的精确量可由医师考虑年龄、体重、肿瘤尺寸、感染或癌转移程度及患者(个体)病况的个体差异而确定。在一些实施方案中,包含抗amc car效应细胞(如t细胞)的药物组合物以每公斤体重约104至约109个细胞,如每公斤体重约104至约105、约105至约106、约106至约107、约107至约108或约108至约109个细胞中的任一项(包括那些范围内的所有整数值)的剂量施用。抗amc car效应细胞(如t细胞)组合物亦可以这些剂量施用多次。细胞可藉由使用免疫疗法中通常已知的输注技术施用(参看例如rosenberg等人,new eng.j.of med.319:1676,1988)。特定患者的最优剂量及治疗方案可由熟习医药技术者藉由监测患者的疾病迹象及相应调节治疗而容易地确定。
[0513]
在一些实施方案中,可能需要向个体施用活化的抗amc car t细胞,且随后根据本发明自其再抽血(或进行清除术)、活化t细胞,且使患者再输注这些活化及扩增的t细胞。此过程可每几周进行多次。在一些实施方案中,t细胞可自10cc至400cc的抽血活化。在一些实施方案中,t细胞自20cc、30cc、40cc、50cc、60cc、70cc、80cc、90cc或100cc的抽血活化。
[0514]
抗amc car效应细胞(如t细胞)的施用可以任何方便的方式进行,包括藉由雾化吸入、注射、摄入、输注、植入或移植。可皮下、皮内、肿瘤内、结节内、髓内、肌肉内、静脉内(i.v.)注射或腹膜内向患者施用本文所描述的组合物。在一些实施方案中,本发明的抗amc car效应细胞(如t细胞)组合物系藉由皮内或皮下注射向患者施用。在一些实施方案中,本发明的抗amc car效应细胞(如t细胞)组合物系藉由静脉内注射施用。抗amc car效应细胞(如t细胞)的组合物可直接注射至肿瘤、淋巴结或感染位点中。
[0515]
因此,举例而言,在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含:a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导
域。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0516]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的抗amc抗体部分,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0517]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0518]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可
变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0519]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0520]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:
100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0521]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0522]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%序列同一性的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0523]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含重链可变
域,其包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0524]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp肽为afp158(seq id no:4)。在一些实施方案中,mhc i类蛋白质为hla-a02。在一些实施方案中,mhc i类蛋白质为hla-a*02:01。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0525]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp158肽(seq id no:4)及hla-a*02:01的复合体的抗amc抗体部分,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0526]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至
多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多约3(例如约1、2或3中的任一项)个氨基酸取代的变体;其中x可为任何氨基酸,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0527]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);其中x可为任何氨基酸,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0528]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基
酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;及ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3(如约1、2或3中的任一项)个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5(如约1、2、3、4或5中的任一项)个氨基酸取代的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,个体为人类。
[0529]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个hc-cdr序列中的氨基酸取代的变体;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5(如约1、2、3、4或5中的任一项)个lc-cdr序列中的氨基酸取代的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0530]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域序列,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列;及hc-cdr3,该hc-cdr3包
含seq id no:77-86中的任一项的氨基酸序列;及ii)轻链可变域序列,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;其中x可为任何氨基酸,b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0531]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含i)重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其具有至少约95%(例如至少约96%、97%、98%或99%中的任一项)序列同一性的变体,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其具有至少约95%序列同一性的变体;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0532]
在一些实施方案中,提供治疗个体中的afp阳性疾病的方法,其包含向个体施用有效量的包含表达抗amc car的效应细胞(如t细胞)的组合物,该抗amc car包含a)细胞外域,其包含特异性结合包含afp肽及mhc i类蛋白质的复合体的抗amc抗体部分,包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列;b)跨膜域,及c)包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域,其中施用包含在afp阳性疾病(如afp阳性肿瘤)位点远端的注射位点处局部注射组合物。在一些实施方案中,注射位点为第一afp阳性肿瘤(亦即施用经由肿瘤内途径)。在一些实施方案中,afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,注射位点为第一afp阳性肿瘤且afp阳性疾病位点为第二afp阳性肿瘤。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为肝细胞癌且治疗包含预防癌症扩散,例如抑制(如预防)癌症转移。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,个体为人类。
[0533]
在一些实施方案中,提供治疗个体中的转移性肝细胞癌的方法,其包含向个体施用有效量的根据上文所述的实施方案中任一项的包含表达抗amc car的效应细胞(如t细胞)的组合物。在一些实施方案中,个体为人类。
[0534]
在一些实施方案中,提供抑制(如预防)个体中的肝细胞癌转移的方法,其包含向个体施用有效量的根据上文所述的实施方案中任一项的包含表达抗amc car的效应细胞(如t细胞)的组合物。在一些实施方案中,个体为人类。
[0535]
在一些实施方案中,提供启动个体中的t细胞的方法,其包含向个体施用有效量的根据上文所述的抗amc car中的任一项的包含表达抗amc car的效应细胞(如t细胞)的组合物。在一些实施方案中,个体患有afp阳性疾病。在一些实施方案中,afp阳性疾病为癌症。在一些实施方案中,癌症为例如肝细胞癌、生殖细胞肿瘤或乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,施用经由静脉内、腹膜内或肿瘤内途径。在一些实施方案中,施用经由静脉内途径。在一些实施方案中,施用经由肿瘤内途径。在一些实施方案中,个体为人类。
[0536]
在一些实施方案中,根据上文所述的方法中的任一项,方法进一步包含向个体施用抗原呈递细胞或apc(如单核细胞或单核细胞分化的树突状细胞)。树突状细胞可经由用特异性细胞因子培养单核细胞而离体产生(palucka及banchereau,nature reviews cancer 12:265-277,2012)。在一些实施方案中,apc与效应细胞组合物同时施用。在一些实施方案中,apc与效应细胞组合物并行施用。在一些实施方案中,apc与效应细胞组合物依序施用。在一些实施方案中,apc经由与效应细胞组合物相同的途径施用。在一些实施方案中,apc施用至与效应细胞组合物相同的位点。在一些实施方案中,效应细胞组合物包含apc。
[0537]
癌症
[0538]
在一些实施方案中,抗amc构建体及抗amc car细胞可适用于治疗癌症。可使用本文所描述的方法中的任一项治疗的癌症包括非血管化,或尚未大体上血管化的肿瘤,以及血管化肿瘤。癌症可包含非实体肿瘤(如血液肿瘤,例如白血病及淋巴瘤)或可包含实体肿瘤。待藉由本发明的抗amc构建体及抗amc car细胞治疗的癌症的类型包括(但不限于)癌瘤、母细胞瘤及肉瘤,及某些白血病或淋巴恶性肿瘤、良性及恶性肿瘤,及恶性病,例如,肉瘤、癌瘤及黑色素瘤。成人肿瘤/癌症及小儿肿瘤/癌症亦包括在内。
[0539]
血液癌为血液或骨髓的癌症。血液(或血性)癌的实例包括白血病,包括急性白血病(如急性淋巴球性白血病、急性骨髓细胞性白血病、急性骨髓性白血病及骨髓母细胞性、前髓细胞性、骨髓单核细胞性、单核细胞性及红白血病)、慢性白血病(如慢性骨髓细胞性(粒细胞性)白血病、慢性骨髓性白血病及慢性淋巴球性白血病)、真性红血球增多症、淋巴瘤、霍奇金氏病(hodgkin's disease)、非霍奇金氏淋巴瘤(顽固性及高级形式)、多发性骨髓瘤、瓦尔登斯特伦氏巨球蛋白血症(waldenstrom's macroglobulinemia)、重链病、骨髓发育不良症候群、毛细胞白血病及骨髓发育不良。
[0540]
实体肿瘤为通常不含有囊肿或液体区域的异常组织块体。实体肿瘤可为良性或恶性的。不同类型的实体肿瘤关于形成其的细胞类型命名(如肉瘤、癌瘤及淋巴瘤)。实体肿瘤(如肉瘤及癌瘤)的实例包括纤维肉瘤、黏液肉瘤、脂肉瘤、软骨肉瘤、骨肉瘤及其他肉瘤、滑膜瘤、间皮瘤、尤文氏肿瘤(ewing's tumor)、平滑肌肉瘤、横纹肌肉瘤、结肠癌瘤、淋巴恶性肿瘤、胰脏癌、乳腺癌、肺癌、卵巢癌、前列腺癌、肝细胞癌、鳞状细胞癌、基底细胞癌、腺癌、
汗腺癌、甲状腺髓样癌、乳头状甲状腺癌、嗜铬细胞瘤皮脂腺癌、乳头状癌、乳头状腺癌、髓性癌、支气管癌、肾细胞癌、肝癌、胆管癌、绒膜癌、威耳姆士肿瘤(wilms'tumor)、子宫颈癌、睪丸肿瘤、精原细胞瘤、气囊癌、黑素瘤及cns肿瘤(如神经胶瘤(如脑干神经胶瘤及混合神经胶质瘤)、神经胶母细胞瘤(亦称为多形性胶质母细胞瘤)星形细胞瘤、cns淋巴瘤、胚细胞瘤、神经管胚细胞瘤、神经鞘瘤颅咽管瘤、室管膜瘤、松果体瘤、血管母细胞瘤、听神经瘤、少突神经胶质瘤、脑膜瘤、神经母细胞瘤、视网膜母细胞瘤及脑转移瘤)。
[0541]
在一些实施方案中,癌症为hcc。在一些实施方案中,hcc为早期hcc、非转移性hcc、原发性hcc、晚期hcc、局部晚期hcc、转移性hcc、处于缓解期的hcc或复发性hcc。在一些实施方案中,hcc为局部可切除的(亦即肿瘤受限于允许完全手术移除的肝脏部分)、局部不可切除的(亦即局部肿瘤可由于牵涉关键血管结构或由于肝脏受损而不可切除)或不可切除的(亦即肿瘤牵涉所有肝叶及/或已扩散而牵涉其他器官(例如肺、淋巴结、骨骼)。在一些实施方案中,根据tnm分类,hcc为i期肿瘤(无血管侵入的单一肿瘤)、ii期肿瘤(具有血管侵入的单一肿瘤,或多个肿瘤,均不大于5cm)、iii期肿瘤(多个肿瘤,均大于5cm,或牵涉门静脉或肝静脉的主要分支的肿瘤)、iv期肿瘤(具有除胆囊以外的相邻器官的直接侵入,或内脏腹膜穿孔的肿瘤)、n1肿瘤(区域淋巴结转移)或m1肿瘤(远端转移)。在一些实施方案中,根据ajcc(美国癌症联合委员会)分期标准,hcc为t1、t2、t3或t4期hcc。在一些实施方案中,hcc为肝细胞癌hcc的纤维板层变体及混合肝细胞胆管癌中的任一项。
[0542]
在一些实施方案中,癌症为生殖细胞肿瘤。
[0543]
癌症治疗可藉由例如,肿瘤消退、肿瘤重量或尺寸收缩、进展时间、存活持续时间、无进展存活期、总反应率、反应持续时间、生活品质蛋白质表达及/或活性评估。可使用确定疗法功效的方法,包括例如经由放射成像测量反应。
[0544]
使用抗amc构建体的诊断及成像方法
[0545]
标记的抗amc抗体部分及其衍生物及类似物(其特异性结合细胞表面上的amc)可用于诊断目的以检测、诊断或监测与afp的表达、异常表达及/或活性相关的疾病及/或病症,包括上文所述的疾病及病症中的任一项,如癌症(例如肝细胞癌、生殖细胞肿瘤或乳腺癌)。举例而言,本发明的抗amc抗体部分可用于原位、体内、离体及体外诊断分析或成像分析中。
[0546]
本发明的其他实施方案包括诊断个体(例如哺乳动物,诸如人类)中与afp的表达或异常表达有关的疾病或病症的方法。方法包含检测个体中的amc呈递细胞。在一些实施方案中,提供诊断个体(例如哺乳动物,如人类)中与afp的表达或异常表达相关的疾病或病症的方法,其包含(a)向个体施用有效量的根据上文所述的实施方案中任一项的标记抗amc抗体部分;及(b)测定个体中的标记含量,使得标记的水平高于阈值水平指示个体患有疾病或病症。阈值水平可藉由各种方法测定,包括例如藉由根据上文所述的诊断方法在患有疾病或病症的第一组个体及不患有疾病或病症的第二组个体中检测标记,及将临限值设定至允许在第一与第二组之间加以区分的含量。在一些实施方案中,阈值水平为零,且方法包含测定个体中的标记的存在或不存在。在一些实施方案中,方法进一步包含在施用步骤(a)之后等待一定时间间隔以准许标记抗amc抗体部分优先在表达amc的个体中的位点处浓缩(及用于清除非结合标记抗amc抗体部分)。在一些实施方案中,方法进一步包含减去标记的背景含量。背景含量可藉由各种方法测定,包括例如在施用标记抗amc抗体部分之前检测个体中
的标记,或藉由根据上文所述的诊断方法检测不患有疾病或病症的个体中的标记。在一些实施方案中,疾病或病症为癌症。在一些实施方案中,癌症选自例如由以下组成的组:肝细胞癌、生殖细胞肿瘤及乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,癌症为转移性肝细胞癌,且方法进一步包含测定个体血液中的标记含量。在一些实施方案中,个体为人类。
[0547]
在一些实施方案中,提供诊断个体(例如哺乳动物,如人类)中的转移性肝细胞癌的方法,其包含(a)向个体施用有效量的根据上文所述的实施方案中任一项的标记抗amc抗体部分;及(b)测定个体血液中的标记含量,使得标记的水平高于阈值水平指示个体患有转移性肝细胞癌。阈值水平可藉由各种方法测定,包括例如藉由根据上文所述的诊断方法在患有转移性肝细胞癌的第一组个体及不患有转移性肝细胞癌的第二组个体中检测标记,及将临限值设定至允许在第一与第二组之间加以区分的含量。在一些实施方案中,阈值水平为零,且方法包含测定个体血液中的标记的存在或不存在。在一些实施方案中,方法进一步包含在施用步骤(a)之后等待一定时间间隔以准许标记抗amc抗体部分优先在表达amc的个体中的位点处浓缩(及用于清除非结合标记抗amc抗体部分)。在一些实施方案中,方法进一步包含减去标记的背景含量。背景含量可藉由各种方法测定,包括例如在施用标记抗amc抗体部分之前检测个体中的标记,或藉由根据上文所述的诊断方法检测不患有转移性肝细胞癌的个体中的标记。在一些实施方案中,个体为人类。
[0548]
在一些实施方案中,提供诊断与个体(例如哺乳动物如人类)中afp的表达或异常表达相关的疾病或病症的方法,其包含(a)使根据上文所述的实施方案中任一项的标记抗amc抗体部分与衍生自个体的样品(如全血或均质化组织)接触;及(b)测定样品中与标记抗amc抗体部分结合的细胞数量,使得与标记抗amc抗体部分结合的细胞数量值高于阈值水平指示个体患有疾病或病症。阈值水平可藉由各种方法测定,包括例如藉由根据上文所述的诊断方法在患有疾病或病症的第一组个体及不患有疾病或病症的第二组个体中测定与标记抗amc抗体部分结合的细胞数量,及将临限值设定至允许在第一与第二组之间加以区分的含量。在一些实施方案中,阈值水平为零,且方法包含测定样品中与标记抗amc抗体部分结合的细胞的存在或不存在。在一些实施方案中,方法进一步包含减去与标记抗amc抗体部分结合的细胞数量的背景含量。背景含量可藉由各种方法测定,包括例如在施用标记抗amc抗体部分之前测定个体中与标记抗amc抗体部分结合的细胞数量,或藉由根据上文所述的诊断方法在不患有疾病或病症的个体中测定与标记抗amc抗体部分结合的细胞数量。在一些实施方案中,疾病或病症为癌症。在一些实施方案中,癌症选自例如由以下组成的组:肝细胞癌、生殖细胞肿瘤及乳腺癌。在一些实施方案中,癌症为肝细胞癌。在一些实施方案中,癌症为转移性肝细胞癌。在一些实施方案中,癌症为转移性肝细胞癌,且样品为血液样品(如全血)。在一些实施方案中,个体为人类。
[0549]
在一些实施方案中,提供诊断个体(例如哺乳动物,如人类)中的转移性肝细胞癌的方法,其包含(a)使根据上文所述的实施方案中任一项的标记抗amc抗体部分与衍生自个体的样品(如全血)接触;及(b)测定样品中与标记抗amc抗体部分结合的细胞数量,使得与标记抗amc抗体部分结合的细胞数量值高于阈值水平指示个体患有转移性肝细胞癌。阈值水平可藉由各种方法测定,包括例如藉由根据上文所述的诊断方法在患有转移性肝细胞癌的第一组个体及不患有转移性肝细胞癌的第二组个体中测定与标记抗amc抗体部分结合的
细胞数量,及将临限值设定至允许在第一与第二组之间加以区分的含量。在一些实施方案中,阈值水平为零,且方法包含测定样品中与标记抗amc抗体部分结合的细胞的存在或不存在。在一些实施方案中,方法进一步包含减去与标记抗amc抗体部分结合的细胞数量的背景含量。背景含量可藉由各种方法测定,包括例如在施用标记抗amc抗体部分之前测定个体中与标记抗amc抗体部分结合的细胞数量,或藉由根据上文所述的诊断方法在不患有转移性肝细胞癌的个体中测定与标记抗amc抗体部分结合的细胞数量。在一些实施方案中,样品为血液(如全血)。在一些实施方案中,个体为人类。
[0550]
本发明的抗amc抗体部分可用于使用本领域技术人员已知的方法分析生物样品中的amc呈递细胞的含量。适合抗体标记为本领域已知且包括酶标记,如葡萄糖氧化酶;放射性同位素,如碘(131i、125i、123i、121i)、碳(14c)、硫(35s)、氚(3h)、铟(115min、113min、112in、111in)、锝(99tc、99mtc)、铊(201ti)、镓(68ga、67ga)、钯(103pd)、钼(99mo)、氙(133xe)、氟(18f)、钐(153sm)、镥(177lu)、钆(159gd)、钷(149pm)、镧(140la)、镱(175yb)、钬(166ho)、钇(90y)、钪(47sc)、铼(186re、188re)、镨(142pr)、铑(105rh)及钌(97ru);鲁米诺(luminol);荧光标记,如荧光素及罗丹明;及生物素。
[0551]
本领域已知的技术可应用于本发明的标记抗amc抗体部分。此类技术包括(但不限于)使用双官能结合剂(参见例如美国专利第5,756,065号;第5,714,631号;第5,696,239号;第5,652,361号;第5,505,931号;第5,489,425号;第5,435,990号;第5,428,139号;第5,342,604号;第5,274,119号;第4,994,560号;及第5,808,003号)。除上述分析以外,本领域技术人员可使用各种体内及离体分析。举例而言,可将个体身体内的细胞暴露至视情况经可检测标记,例如放射性同位素标记的抗amc抗体部分,且可例如藉由外部放射性扫描或藉由分析衍生自先前暴露于抗amc抗体部分的个体的样品(例如生检或其他生物样品)评估抗amc抗体部分与细胞的结合。
[0552]
制品及试剂盒
[0553]
在本发明的一些实施方案中,提供含有适用于治疗afp阳性疾病,如癌症(例如肝细胞癌、生殖细胞肿瘤或乳腺癌)、将抗amc构建体传递至在表面上呈递amc的细胞,或分离或检测个体中的amc呈递细胞的材料的制品。该制品可包含容器及容器上或容器随附的标记或药品说明书。适合的容器包括例如瓶子、小瓶、注射器等。容器可由各种材料形成,诸如玻璃或塑胶。一般来说,容器容纳对于治疗本文所述的疾病或病症有效的组合物,且可具有无菌出入端口(例如容器可为静脉内溶液袋或具有可藉由皮下注射针刺穿的塞子的小瓶)。组合物中的至少一种活性剂为本发明的抗amc构建体。标记或药品说明书指示该组合物用于治疗特定病状。标记或药品说明书将另外包含向患者施用抗amc构建体组合物的说明书。亦涵盖包含本文中描述的组合疗法的制品及试剂盒。
[0554]
药品说明书指市售治疗产品封装中通常所包括的含有关于适应症、使用、剂量、施用、与此类治疗产品的使用有关的禁忌的资讯及/或警告的说明书。在一些实施方案中,药品说明书指示组合物用于治疗癌症(如肝细胞癌、生殖细胞肿瘤或乳腺癌)。
[0555]
另外,制品可进一步包含第二容器,其包含医药学上可接受的缓冲液,诸如抑菌性注射用水(bwfi)、磷酸盐缓冲盐水、林格氏溶液(ringer's solution)及右旋糖溶液。其可进一步包括就商业及使用者观点而言所需的其他物质,包括其他缓冲液、稀释剂、过滤器、针及注射器。
[0556]
亦提供适用于各种目的的试剂盒,例如用于治疗本文所述的afp阳性疾病或病症、将抗amc构建体传递至在表面上呈递amc的细胞,或分离或检测个体中的amc呈递细胞,视情况与制品组合。本发明的试剂盒包括一个或多个容器,其包含抗amc构建体组合物(或单位剂型及/或制品),且在一些实施方案中,另外包含根据本文所描述的方法中的任一项的另一药剂(如本文所述的药剂)及/或使用说明书。试剂盒可进一步包含选择适合于治疗的个体的说明。本发明试剂盒中供应的说明书为通常在标记或药品说明书(例如,试剂盒中包括的纸片)上的书面说明书,但机器可读说明书(例如,磁化或光学储存盘上载有的说明书)亦为可接受的。
[0557]
举例而言,在一些实施方案中,试剂盒包含含抗amc构建体(例如全长抗amc抗体、多特异性抗amc分子(如双特异性抗amc抗体)或抗amc免疫缀合物)的组合物。在一些实施方案中,试剂盒包含a)包含抗amc构建体的组合物,及b)有效量的至少一种其他药剂,其中其他药剂增加mhc i类蛋白质的表达及/或增强afp肽藉由mhc i类蛋白质(例如ifnγ、ifnβ、ifnα或hsp90抑制剂)的表面呈递。在一些实施方案中,试剂盒包含a)包含抗amc构建体的组合物,及b)向个体施用抗amc构建体组合物以治疗afp阳性疾病,如hcc的说明书。在一些实施方案中,试剂盒包含a)包含抗amc构建体的组合物,b)有效量的至少一种其他药剂,其中其他药剂增加mhc i类蛋白质的表达及/或增强afp肽藉由mhc i类蛋白质(例如ifnγ、ifnβ、ifnα或hsp90抑制剂)的表面呈递,及c)向个体施用抗amc构建体组合物及其他药剂以治疗afp阳性疾病,如hcc的说明书。抗amc构建体及其他药剂可存在于独立容器或单一容器中。举例而言,试剂盒可包含一种相异的组合物或两种或两种以上组合物,其中一种组合物包含抗amc构建体且另一组合物包含另一药剂。
[0558]
在一些实施方案中,试剂盒包含a)包含抗amc构建体(例如全长抗amc抗体、多特异性抗amc分子(如双特异性抗amc抗体)或抗amc免疫缀合物)的组合物,及b)组合抗amc构建体与细胞(如衍生自个体的细胞,例如免疫细胞)以形成包含抗amc构建体/细胞缀合物的组合物及向个体施用抗amc构建体/细胞缀合物组合物以治疗afp阳性疾病(如hcc)的说明书。在一些实施方案中,试剂盒包含a)包含抗amc构建体的组合物,及b)细胞(如细胞毒性细胞)。在一些实施方案中,试剂盒包含a)包含抗amc构建体的组合物,b)细胞(如细胞毒性细胞),及c)组合抗amc构建体与细胞以形成包含抗amc构建体/细胞缀合物的组合物及向个体施用抗amc构建体/细胞缀合物组合物以治疗afp阳性疾病(如hcc)的说明书。在一些实施方案中,试剂盒包含含与细胞(如细胞毒性细胞)结合的抗amc构建体的组合物。在一些实施方案中,试剂盒包含a)包含与细胞(如细胞毒性细胞)结合的抗amc构建体的组合物,及b)向个体施用组合物以治疗afp阳性疾病(如hcc)的说明书。在一些实施方案中,结合系藉由抗amc构建体结合至细胞表面上的分子。在一些实施方案中,缔合系藉由将抗amc构建体的一部分插入至细胞外膜中。
[0559]
在一些实施方案中,试剂盒包含编码抗amc构建体(例如全长抗amc抗体、多特异性抗amc分子(如双特异性抗amc抗体)、抗amc car或抗amc免疫缀合物)或其多肽部分的核酸(或核酸集合)。在一些实施方案中,试剂盒包含a)编码抗amc构建体或其多肽部分的核酸(或核酸集合),及b)表达核酸(或核酸集合)的宿主细胞(如效应细胞)。在一些实施方案中,试剂盒包含a)编码抗amc构建体或其多肽部分的核酸(或核酸集合),及b)说明书,其关于i)表达宿主细胞(如效应细胞,例如t细胞)中的抗amc构建体,ii)制备包含抗amc构建体或表
达抗amc构建体的宿主细胞的组合物,及iii)向个体施用包含抗amc构建体或表达抗amc构建体的宿主细胞的组合物以治疗afp阳性疾病,如hcc。在一些实施方案中,宿主细胞衍生自个体。在一些实施方案中,试剂盒包含a)编码抗amc构建体或其多肽部分的核酸(或核酸集合),b)表达核酸(或核酸集合)的宿主细胞(如效应细胞),及c)说明书,其关于i)表达宿主细胞中的抗amc构建体,ii)制备包含抗amc构建体或表达抗amc构建体的宿主细胞的组合物,及iii)向个体施用包含抗amc构建体或表达抗amc构建体的宿主细胞的组合物以治疗afp阳性疾病,如hcc。
[0560]
在一些实施方案中,试剂盒包含编码抗amc car的核酸。在一些实施方案中,试剂盒包含含编码抗amc car的核酸的载体。在一些实施方案中,试剂盒包含a)包含编码抗amc car的核酸的载体,及b)说明书,其关于i)将载体引入至效应细胞,如衍生自个体的t细胞中,ii)制备包含抗amc car效应细胞的组合物,及iii)向个体施用抗amc car效应细胞组合物以治疗afp阳性疾病,如hcc。
[0561]
本发明的试剂盒系在适合的包装中。适合的包装包括(但不限于)小瓶、瓶子、罐、柔性包装(例如密封mylar或塑胶袋)及其类似物。试剂盒可视情况提供诸如缓冲剂的额外组分及说明性资讯。本技术因此亦提供制品,其包括小瓶(诸如密封小瓶)、瓶子、罐、柔性包装及其类似者。
[0562]
与抗amc构建体组合物的使用相关的说明书大体上包括关于所期望治疗的剂量、给药时程及施用途径的资讯。容器可为单位剂量、散装(例如多剂量包装)或次单位剂量。举例而言,可提供试剂盒,其含有足够剂量如本文中所揭示的抗amc构建体(例如全长抗amc抗体、多特异性抗amc分子(如双特异性抗amc抗体)、抗amc car或抗amc免疫缀合物)以持续延长时段,如一周、8天、9天、10天、11天、12天、13天、2周、3周、4周、6周、8周、3个月、4个月、5个月、7个月、8个月、9个月或9个月以上中的任一项提供个体的有效治疗。试剂盒亦可包括多个单位剂量的抗amc构建体及药物组合物及使用说明书且以对于在药房,例如医院药房及配药房中储存及使用而言足够的量包装。
[0563]
本领域技术人员将认识到,在本发明的范畴及精神内,若干实施方案为可能的。现将参照下列非限制性实例来更详细地描述本发明。以下实施方案进一步说明本发明,但当然不应解释为以任何方式限制其范畴。
[0564]
例示性实施方案
[0565]
实施方案1.在一些实施方案中,提供经分离抗amc构建体,其包含特异性结合包含α-胎蛋白(afp)肽及主要组织相容性(mhc)i类蛋白质的复合体(afp/mhc i类复合体,或amc)的抗体部分。
[0566]
实施方案2.在实施方案1的一些其他实施方案中,afp/mhc i类复合体存在于细胞表面上。
[0567]
实施方案3.在实施方案1的一些其他实施方案中,afp/mhc i类复合体存在于癌细胞表面上。
[0568]
实施方案4.在实施方案1至3中任一项的一些其他实施方案中,mhc i类蛋白质为人类白血球抗原(hla)-a。
[0569]
实施方案5.在实施方案4的一些其他实施方案中,mhc i类蛋白质为hla-a02。
[0570]
实施方案6.在实施方案5的一些其他实施方案中,mhc i类蛋白质为hla-a02等位
基因的hla-a*02:01亚型。
[0571]
实施方案7.在实施方案1至6中任一项的一些其他实施方案中,抗体部分与包含afp肽及具有与mhc i类蛋白质不同的hla等位基因的第二mhc i类蛋白质的复合体交叉反应。
[0572]
实施方案8.在实施方案1至7中任一项的一些其他实施方案中,afp肽长度为8至12个氨基酸。
[0573]
实施方案9.在实施方案1至8中任一项的一些其他实施方案中,afp肽衍生自人类afp。
[0574]
实施方案10.在实施方案1至9中任一项的一些其他实施方案中,afp肽具有选自由seq id no:3-13及16组成的组的氨基酸序列。
[0575]
实施方案11.在实施方案9的一些其他实施方案中,afp肽具有fmnkfiyei(seq id no:4)的氨基酸序列。
[0576]
实施方案12.在实施方案1至11中任一项的一些其他实施方案中,经分离抗amc构建体与包含afp肽的种间变体及mhc i类蛋白质的复合体交叉反应。
[0577]
实施方案13.在实施方案1至12中任一项的一些其他实施方案中,抗体部分为人类、人源化或半合成的。
[0578]
实施方案14.在实施方案1至13中任一项的一些其他实施方案中,抗体部分为全长抗体、fab、fab'、(fab')2、fv或单链fv(scfv)。
[0579]
实施方案15.在实施方案1至14中任一项的一些其他实施方案中,抗体部分以约0.1pm至约500nm的平衡解离常数(kd)结合至afp/mhc i类复合体。
[0580]
实施方案16.在实施方案1至15中任一项的一些其他实施方案中,经分离抗amc构建体以约0.1pm至约500nm的kd结合至afp/mhc i类复合体。
[0581]
实施方案17.在实施方案1至16中任一项的一些其他实施方案中,抗体部分包含:
[0582]
i)重链可变域,其包含重链互补决定区(hc-cdr)1,包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89);或其包含至多约3个氨基酸取代的变体;及
[0583]
ii)轻链可变域,其包含轻链互补决定区(lc-cdr)1,包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121);或其包含至多3个氨基酸取代的变体,其中
[0584]
x可为任何氨基酸。
[0585]
实施方案18.在实施方案1至16中任一项的一些其他实施方案中,抗体部分包含:
[0586]
i)重链可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5个氨基酸取代的变体;及
[0587]
ii)轻链可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3个氨基酸取代的变体,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5个氨基酸取代的变体。
[0588]
实施方案19.在实施方案1至16中任一项的一些其他实施方案中,抗体部分包含:
[0589]
i)重链(hc)可变域,其包含hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列;或其包含至多约5个hc-cdr区中的氨基酸取代的变体;及
[0590]
ii)轻链(lc)可变域,其包含lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列;或其包含至多约5个lc-cdr区中的氨基酸取代的变体。
[0591]
实施方案20.在实施方案18或19的一些其他实施方案中,抗体部分包含a)重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其与seq id no:17-26中的任一项具有至少约95%序列同一性的变体;及b)轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其与seq id no:27-36中的任一项具有至少约95%序列同一性的变体。
[0592]
实施方案21.在实施方案20的一些其他实施方案中,抗体部分包含重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,及轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列。
[0593]
实施方案22.在实施方案1至21中任一项的一些其他实施方案中,经分离抗amc构建体为全长抗体。
[0594]
实施方案23.在实施方案1至22中任一项的一些其他实施方案中,经分离抗amc构建体为单特异性的。
[0595]
实施方案24.在实施方案1至22中任一项的一些其他实施方案中,经分离抗amc构建体为多特异性的。
[0596]
实施方案25.在实施方案24的一些其他实施方案中,经分离抗amc构建体为双特异性的。
[0597]
实施方案26.在实施方案24或25的一些其他实施方案中,经分离抗amc构建体为串联scfv、双功能抗体(db)、单链双功能抗体(scdb)、双亲和力再靶向(dart)抗体、双可变域(dvd)抗体、杵-臼(kih)抗体、坞锁(dnl)抗体、化学交联抗体、异多聚体抗体或异缀合物抗体。
[0598]
实施方案27.在实施方案26的一些其他实施方案中,经分离抗amc构建体为包含两个藉由肽接头连接的scfv的串联scfv。
[0599]
实施方案28.在实施方案27的一些其他实施方案中,肽接头包含氨基酸序列ggggs。
[0600]
实施方案29.在实施方案24至28中任一项的一些其他实施方案中,经分离抗amc构
建体进一步包含特异性结合第二抗原的第二抗体部分。
[0601]
实施方案30.在实施方案29的一些其他实施方案中,第二抗原为t细胞表面上的抗原。
[0602]
实施方案31.在实施方案30的一些其他实施方案中,第二抗原选自由以下组成的组:cd3γ、cd3δ、cd3ε、cd3ζ、cd28、ox40、gitr、cd137、cd27、cd40l及hvem。
[0603]
实施方案32.在实施方案30的一些其他实施方案中,第二抗原为cd3ε,且经分离抗amc构建体为包含对afp/mhc i类复合体具有特异性的n端scfv及对cd3ε具有特异性的c端scfv的串联scfv。
[0604]
实施方案33.在实施方案30的一些其他实施方案中,t细胞选自由以下组成的组:细胞毒性t细胞、辅助t细胞及自然杀手t细胞。
[0605]
实施方案34.在实施方案29的一些其他实施方案中,第二抗原为自然杀手细胞、中性粒细胞、单核细胞、巨噬细胞或树突状细胞表面上的抗原。
[0606]
实施方案35.在实施方案1至21中任一项的一些其他实施方案中,经分离抗amc构建体为嵌合抗原受体。
[0607]
实施方案36.在实施方案35的一些其他实施方案中,嵌合抗原受体包含含抗体部分的细胞外域、跨膜域及包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[0608]
实施方案37.在实施方案1至21中任一项的一些其他实施方案中,经分离抗amc构建体为包含抗体部分及效应分子的免疫缀合物。
[0609]
实施方案38.在实施方案36的一些其他实施方案中,效应分子为选自由以下组成的组的治疗剂:药物、毒素、放射性同位素、蛋白质、肽及核酸。
[0610]
实施方案39.在实施方案38的一些其他实施方案中,治疗剂为药物或毒素。
[0611]
实施方案40.在实施方案37的一些其他实施方案中,效应分子为标记。
[0612]
实施方案41.在一些实施方案中,提供包含实施方案1至39中任一项的经分离抗amc构建体的药物组合物。
[0613]
实施方案42.在一些实施方案中,提供表达实施方案1至40中任一项的经分离抗amc构建体的宿主细胞。
[0614]
实施方案43.在一些实施方案中,提供编码实施方案1至40中任一项的经分离抗amc构建体的多肽组分的核酸。
[0615]
实施方案44.在一些实施方案中,提供包含实施方案43的核酸的载体。
[0616]
实施方案45.在一些实施方案中,提供表达实施方案35或36的经分离抗amc构建体的效应细胞。
[0617]
实施方案46.在实施方案45的一些其他实施方案中,效应细胞为t细胞。
[0618]
实施方案47.在一些实施方案中,提供检测在表面上呈递包含afp肽及mhc i类蛋白质的复合体的细胞的方法,其包含使细胞与实施方案40的经分离抗amc构建体接触及检测细胞上的标记的存在。
[0619]
实施方案48.在一些实施方案中,提供治疗患有afp阳性疾病的个体的方法,其包含向个体施用有效量的实施方案41的药物组合物。
[0620]
实施方案49.在一些实施方案中,提供治疗患有afp阳性疾病的个体的方法,其包
含向个体施用有效量的实施方案45或46的效应细胞。
[0621]
实施方案50.在实施方案48或49的一些其他实施方案中,施用经由静脉内途径。
[0622]
实施方案51.在实施方案48或49的一些其他实施方案中,施用经由肿瘤内途径。
[0623]
实施方案52.在实施方案48或49的一些其他实施方案中,施用系向第一疾病位点远端的注射位点。
[0624]
实施方案53.在实施方案52的一些其他实施方案中,注射位点为第一疾病位点远端的第一肿瘤。
[0625]
实施方案54.在实施方案52或53的一些其他实施方案中,第一疾病位点为afp阳性肿瘤。
[0626]
实施方案55.在一些实施方案中,提供诊断患有afp阳性疾病的个体的方法,其包含:
[0627]
a)向个体施用有效量的实施方案40的经分离抗amc构建体;及
[0628]
b)测定个体中的标记含量,其中标记的水平高于阈值水平指示个体患有afp阳性疾病。
[0629]
实施方案56.在一些实施方案中,提供诊断患有afp阳性疾病的个体的方法,其包含:
[0630]
a)使衍生自个体的样品与实施方案40的经分离抗amc构建体接触;及
[0631]
b)测定与样品中的经分离抗amc构建体结合的细胞的数量,其中与经分离抗amc构建体结合的细胞的数量值高于阈值水平指示个体患有afp阳性疾病。
[0632]
实施方案57.在实施方案48至56中任一项的一些其他实施方案中,afp阳性疾病为癌症。
[0633]
实施方案58.在实施方案57的一些其他实施方案中,癌症为肝细胞癌、生殖细胞肿瘤或乳腺癌。
[0634]
实施方案59.在实施方案58的一些其他实施方案中,癌症为肝细胞癌。
[0635]
实施方案60.在实施方案59的一些其他实施方案中,癌症为转移性肝细胞癌。
[0636]
实施方案61.在实施方案48至54中任一项的一些其他实施方案中,afp阳性疾病为肝细胞癌且癌转移得到抑制。
实施例
[0637]
材料
[0638]
细胞样品、细胞系及抗体
[0639]
细胞系hepg2、sk-hep1、mcf7、malme-3m、ca46、thp-1、colo205、aspc1、ovcar3、lncap、a498及hela获自美国典型培养物保藏中心(american type culture collection)。sk-hep1-minig(或sk-hep1 afp mg)、mcf7-minig及hela-minig(或hela-mg)由藉由表达小型基因盒的afp158肽转导各别亲本细胞系产生,其导致sk-hep1及mcf7细胞中的afp158/hla-a*02:01复合体的高细胞表面表达含量。hela为hla-a03及hla-a68阳性及hla*a02:01阴性的,且因此hela-minig充当afp158小型基因,表达除afp158/hla*a02:01阴性对照细胞系以外。细胞系在37℃/5%co2下培养于补充有10%fbs、2mm麸酰氨酸的rpmi 1640中。
[0640]
购买以下抗体:针对结合至fitc或apc的人类hla-a02(克隆bb7.2)的单克隆ab,及
blue细胞。表达于细菌中的噬菌体克隆接着经纯化。藉由溶液水平移动、细胞水平移动或溶液及细胞水平移动的组合进行水平移动3-4回合以富集特异性结合afp158/hla-a*02:01的scfv噬菌体克隆。
[0646]
抗生蛋白链菌素elisa分别盘涂布有生物素标记afp158/hla-a*02:01复合体单体(bio-afp158)或生物素标记对照肽/hla-a*02:01单体(bio-对照)。针对afp158/hla-a*02:01复合体的来自富集噬菌体展示水平淘选池的各别噬菌体克隆在涂布盘中培育。噬菌体克隆的结合藉由hrp结合的抗m13抗体检测且使用hrp底物显影。吸收率在450nm处读取。605个阳性纯经由1260个自噬菌体水平淘选富集的噬菌体克隆的elisa筛选鉴别。图3提供在elisa分析中结合至生物素标记afp158/hla-a*02:01单体的噬菌体克隆的实例。82个独特克隆藉由605个elisa阳性噬菌体克隆的dna测序鉴别。阳性克隆藉由针对生物素标记afp158/hla-a*02:01复合体单体的标准elisa测定。接着,独特抗体纯经由elisa阳性克隆的dna测序鉴别。藉由流式细胞术(facs分析),使用afp158负载的活t2细胞进一步测试特异性及独特克隆与活细胞表面上的hla-a2/肽复合体的结合。负载有不同肽及β2m的t2细胞首先经纯化scfv噬菌体克隆染色,接着经小鼠抗m13 mab染色,且最后经r-pe结合的马抗小鼠igg(来自vector labs)染色。各染色步骤在30-60分钟之间于冰上进行且细胞在染色之间洗涤两次。在82个克隆中,44个特异性识别afp158负载的t2细胞。图4提供经由facs结合至肽负载的t2细胞的afp158/hla-a*02:01特异性噬菌体的实例。噬菌体克隆在hla-a*02:01,或负载有β2m但不负载肽的t2细胞的情况下特异性结合至afp158负载的t2细胞且不识别负载有htert衍生肽ilakflhwl(htert540,seq id no:141)的t2细胞。
[0647]
实施例3.facs阳性afp158特异性噬菌体克隆的表征
[0648]
与小鼠afp158肽的交叉反应性
[0649]
选自针对afp158负载的t2细胞的facs结合分析的克隆藉由facs分析,使用小鼠afp158负载的活t2细胞关于针对活细胞表面上的小鼠afp158肽/hla-a*02:01复合体的交叉反应性进一步表征。小鼠afp158肽在两个氨基酸位置4及位置9不同于人类afp158肽。小鼠afp158肽序列为fmnrfiyev(seq id no:16),而人类afp158肽序列为fmnkfiyei(seq id no:4)。与人类及小鼠afp158肽/mhc复合体均交叉反应的抗体适用于评估hla-a*02:01转基因小鼠中的抗体药物毒性。在测试的噬菌体克隆中,4个克隆(#17、#33、#48及#76)识别人类afp158及小鼠afp158负载的t2细胞两者(图5)。克隆#52及#79亦结合至小鼠afp158负载的t2细胞,但在较小程度上。
[0650]
藉由丙氨酸行走的表位定位
[0651]
为了精确研究表位以用于mab识别,在位置1、3、4、5、6、7及8处具有丙氨酸取代的人类afp158肽(seq id no:7-13)经脉冲至t2细胞上。接着藉由facs分析测试抗体噬菌体克隆于这些肽负载的t2细胞的结合。尽管所有抗体识别由afp158肽及其周围mhcα链残基形成的小构形表位,与不同抗体相互作用的关键肽残基相当不同。举例而言,预测克隆#52结合至afp158肽的n端半部,因为位置1或3处的丙氨酸取代显著减少与肽负载的t2细胞的结合,且位置4处的丙氨酸取代完全消除克隆#52的结合。相比之下,位置5、6、7或8处的丙氨酸取代不改变克隆#52的结合。另一方面,克隆#17-13对位置4处的丙氨酸取代不敏感,但对位置3、5及7处的变化敏感。图6提供facs分析的实例,显示噬菌体克隆#52与负载有各种afp肽的t2细胞的结合。表6概述若干afp158/hla-a*02:01特异性抗体克隆与丙氨酸取代的人类
afp158肽负载的t2细胞的结合。
[0652]
表6
[0653][0654]
针对内源性肽的抗体结合特异性评估
[0655]
平均而言,人体中的各成核细胞表达约50万不同肽/mhc i类复合体。为了将抗肽/mhci复合体抗体开发为具有高特异性及治疗指数的抗癌药物,对抗体至关重要的是特异性识别靶肽/mhci复合体,而非mhci分子自身,或结合至细胞表面上呈递的其他肽的mhci分子。对于当前研究,相关mhci分子为hla-a*02:01。在我们噬菌体水平淘选及筛选的早期阶段期间,我们消除结合至单独的hla-a*02:01分子的抗体(参见例如图3及图4)。亦针对19种内源性hla-a*02:01肽筛选顶部噬菌体克隆,所述肽衍生自通常表达于多种类型的成核人类细胞的蛋白质,如血球蛋白α链、β链、核蛋白p68及其类似物。内源性肽(p19,seq id no:122-140)池负载至t2细胞中且经由facs分析测定抗体结合。如图7中所示,afp158/hla-a*02:01特异性抗体噬菌体克隆结合afp158肽负载的t2细胞,而非负载有内源性肽的t2细胞。我们得出鉴别的抗体特异于afp158肽/hla-a*02:01复合体,且不识别结合至其他测试的hla-a*02:01肽的hla-a*02:01分子的结论。
[0656]
实施例4.工程改造的双特异性抗体
[0657]
使用afp158/hla-a*02:01特异性噬菌体克隆的scfv序列产生双特异性抗体(bsab)。bsab为单链双特异性抗体,其在n端包含afp158/hla-a*02:01特异性噬菌体克隆的scfv序列且在c端包含抗人类cd3ε小鼠单克隆scfv(brischwein,k.等人,mol.immunol.43:1129-1143,2006)。编码afp158 scfv及抗人类cd3εscfv的dna片段系藉由genewiz合成且使用标准dna技术亚克隆至尤里卡(eureka)哺乳动物表达载体pgsn-hyg中。六组胺标签插入c端以用于抗体纯化及检测。中国仓鼠卵巢(cho)细胞经bsab表达载体转染,且接着培养7天以产生bsab抗体。收集含有分泌的afp158 bsab分子的cho细胞上清液。使用histrap hp管柱(ge healthcare)藉由fplc akta系统纯化bsab抗体。简言之,cho细胞培养物经澄清且在低咪唑浓度(20mm)下负载至管柱上,且接着等度高咪唑浓度洗脱缓冲液(500mm)用于洗脱结合bsab蛋白质。纯化afp158 bsab抗体的分子量在非还原条件下藉由凝胶电泳测量。4μg蛋白质与2.5μl nupage lds样品缓冲液(life technologies,np0008)混合且藉由去离子水使其总计达10μl。样品在70℃下加热10分钟,接着负载至凝胶上。在180v下进行凝胶电泳1小时。约50kd带观测为凝胶上的主带(图8)。藉由尺寸排外层析法(sec)评估抗体聚集。50μl样品在由达尔伯克磷酸盐缓冲盐水(fisher scientific,sh30028.fs)及0.2m精氨酸组成的缓冲液(调节至ph 7.0)流动时喷射至sec管柱(agilent,biosec-3,300a,4.6
×
300mm)
中。bsab观测为滞留时间约15.8ml处的主峰(图9)。具有小于10%高分子量聚集的bsab用于进一步表征。
[0658]
实施例5.afp158 bsab抗体的表征
[0659]
afp158 bsab抗体的结合亲和力
[0660]
afp158 bsab抗体与重组afp158/hla-a*02:01复合体的结合亲和力藉由表面电浆共振(biacore)测量。afp158 bsab与afp158/hla-a*02:01复合体之间的结合参数根据用于多循环动力学测量的制造商方案使用his captur试剂盒(ge healthcare,目录号28995056)在biacore x100(ge healthcare)上测量。用于分析的所有蛋白质使用hbs-e缓冲液稀释。简言之,1μg/ml的afp158 bsab藉由使溶液以2μl/min持续2分钟流经流动池2固定至藉由抗组氨酸抗体预官能化的传感器晶片上。朝向afp158/a*02:01复合体的结合在0.19、0.38、7.5、15及30μg/ml处分析,各运行由30μl/min下的3分钟缔合及3分钟解离组成。在循环结束时,表面使用来自his capture试剂盒的再生缓冲液再生。在动力学测量后,表面使用来自试剂盒的再生溶液再生。资料藉由biacore x-100评估软件使用1:1结合位点模式分析。计算结合参数(缔合速率常数ka、解离常数kd及平衡解离常数kd)。单价scfv型式的afp158抗体的结合亲和力落入10-500nm的范围。(实施例提供于表7中)。
[0661]
表7
[0662][0663]
t细胞杀死分析
[0664]
肿瘤细胞毒性藉由ldh细胞毒性分析(promega)来分析。购自allcells的人类t细胞藉由cd3/cd28戴诺珠粒(invitrogen)根据制造商方案活化及扩增。活化t细胞(atc)在具有10%fbs加上100u/ml il-2的rpmi1640培养基中培养及维持,且在第7-14天使用。根据facs分析,t细胞为》99%cd3+。活化t细胞(效应细胞)及靶细胞在不同bsab抗体浓度下以5:1比率共培养16小时。细胞毒性接着藉由在培养物上清液中测量ldh活性而测定。
[0665]
afp158 bsab抗体以afp及hla-a*02:01依赖性方式杀死癌细胞。在所有测试的细胞系中,hepg2(afp及hla-a*02:01阳性)藉由经由afp158bsab重定向的t细胞最有效地杀死。afp阴性或hla-a02阴性或对于两者均呈阴性的其他测试细胞系在相同实验设定下未相同有效地杀死(图10)。
[0666]
afp158 bsab抗体针对多种hla-a02等位基因的交叉反应性
[0667]
人类mhci分子由6类同功同种异型物hla-a、-b、-c、-e、-f及g组成。hla-a、-b及-c重链基因为高度多晶型的。对于来各同功同种异型物,hla基因根据重链序列的相似性另外分组。举例而言,hla-a分成不同等位基因,如hla-a01、-a02、-a03等。对于hla-a02等位基
因,存在多种亚型,如hla-a*02:01、a*02:02等。在hla-a02组的不同亚型之间,序列差异仅限于若干氨基酸。因此在许多情况下,结合至hla-a*02:01分子的肽亦可与hla-a02等位基因的多个亚型形成复合体。如表8(http://www.allelefrequencies.net/)中所示,尽管hla-a*02:01在高加索人群体中为优势hla-a02亚型,在亚洲及非洲,a*02:03、a*02:05、a*02:06、a*02:07及a*02:11亦为常见hla-a02亚型。afp158抗体不仅在hla-a*02:01,但亦在hla-a02的其他亚型的情况下识别afp158肽的能力将使可能能够受益于afp158抗体药物治疗的患者群体变宽。我们因此与hla-a02等位基因的其他亚型产生重组afp158/mhci复合体且测试afp158/hla-a*02:01特异性抗体对于这些其他复合体的结合亲和力。使用fortebio octet qk测定结合亲和力。5μg/ml生物素标记的改变亚型的hla-a02 mhc复合体负载至抗生蛋白链菌素生物传感器上。在洗掉过量抗原之后,bsab抗体在10μg/ml下测试缔合及解离。使用1:1结合位点、部分拟合模型计算结合参数。表9显示若干afp158 bsab对于具有不同亚型的多个afp158/hla-a02复合体的结合亲和力。发现所有测试的抗体识别结合至hla-a02等位基因的多个亚型的afp158。
[0668]
表8
[0669][0670]
表9
[0671][0672]
*低拟合置信度
[0673]
实施例6.产生afp158/hla-a*02:01特异性嵌合抗原受体呈递t细胞(car-t)
[0674]
嵌合抗原受体疗法(car-t疗法)为靶向免疫疗法的新颖形式。其合并单克隆抗体
的精致靶向特异性与藉由细胞毒性t细胞提供的强力细胞毒性及长期持久性。此技术使得t细胞能够独立于内源性tcr采集长期新颖抗原特异性。临床试验已在神经母细胞瘤(louis,c.u.等人,blood 118(23):6050-6,2011)、b-all(maude,s.l.等人,n engl j med.371(16):1507-1517,2014)、cll(brentjens,r.j.等人,blood.118(18):4817-4828,2011)及b细胞淋巴瘤(kochenderfer,j.n.等人,blood.116(20):4099-4102,2010)中显示car-t疗法的临床显著抗肿瘤活性。在一个研究中,报导用cd19-car t疗法治疗的30位患有b-all的患者中的90%完全缓解率(maude等人,前述)。
[0675]
为了进一步探究afp158/hla-a*02:01特异性抗体的效能,我们构筑抗afp158/hla-a*02:01scfv表达car且藉由这些car转导t细胞。afp158/hla-a*02:01特异性car使用慢病毒car表达载体构筑。抗afp158/hla-a*02:01scfv接枝至具有以顺式工程改造的cd28信号传导域及tcrζ的第二代car(mackall,c.l.等人,nat.rev.clin.oncol.11(12):693-703,2014)上以提供胞内t细胞刺激信号且活化t细胞。图11提供抗afp158/hla-a*02:01car构建体的示意性说明。
[0676]
实施例7.afp158 car-t细胞的表征
[0677]
表达于cd4+及cd8+初生t细胞中的afp158 car
[0678]
外周血淋巴细胞自健康供体分离且藉由编码抗afp158/hla-a*02:01结合部分的afp158 car构建体转导。在转导之后五天,afp158 car-t细胞及模拟转导细胞藉由afp158四聚物及cd3、cd4或cd8抗体中的一者共染色且藉由流式细胞术分析。图24显示afp158 car及模拟转染细胞的流式细胞术结果,指示afp158 car可表达于cd4+以及cd8+初生t细胞中。
[0679]
afp158 car在t细胞表面上的均匀分布
[0680]
已展示具有car的均匀细胞表面分布的car-t细胞比具有car的不均匀细胞表面分布的car-t细胞在体外及体内更有效地杀死肿瘤细胞,且其在杀死之后容易得多地排出。car的不均匀分布(如聚集)可导致抗原独立性car活化、过早t细胞衰竭及无体内抗肿瘤活性。因此,car在t细胞表面上的均匀分布为所需的。为了测定表达car的抗afp158/hla-a*02:01scfv在t细胞膜上的分布,我们使用缀合物afp158肽-hla-a2四聚物-pe如上文所述染色afp158 car转导t细胞。初生人类cd3+t细胞首先藉由抗cd3及cd28珠粒活化,且记者藉由afp158 car慢病毒转导。在病毒转导之后第8天,afp158 car转导的t细胞在蛋白质运输抑制剂存在下在室温下藉由2ng/ml下的afp158肽-hla-a2四聚物-pe染色30分钟。使用olympus荧光显微镜获得影像。我们发现afp158 car在t细胞膜上的分布为均匀且平滑的。未观测到点状car分布。代表性影像展示于图26中。
[0681]
afp158 car-t细胞的体外细胞毒性研究
[0682]
含有afp158/hla-a*02:01特异性嵌合抗原受体的慢病毒由藉由car载体转染293t细胞产生。人类t细胞用于在藉由cd3/cd28珠粒(invitrogen)刺激1天之后在100u/ml的介白素-2存在下进行转导。浓缩慢病毒涂覆至含t细胞的retronectin(takara)涂布的6孔盘72小时。使用ldh细胞毒性分析进行转导t细胞(afp158 car-t细胞)的功能评估。使用的效应:标靶比率为5:1。
[0683]
针对靶细胞系hepg2、sk-hep1及sk-hep1-minig测试转导为t细胞的一组afp158 car克隆。藉由afp158 car克隆转导的t细胞特异性杀死afp158/hla*a02:01阳性细胞系hepg2及sk-hep1-minig(图12)。表达afp158 car的t细胞对于大部分测试的抗体克隆以特
异性及高效方式杀死标靶阳性癌细胞。然而,标靶阴性、野生型sk-hep1细胞藉由相同t细胞不佳地识别,除了藉由克隆#44转导的那些,其显示野生型sk-hep1细胞的一些非特异性杀死。
[0684]
关于一大组对于afp158及hla*a02:01呈阳性或阴性的癌细胞系测试藉由afp158 car-t细胞的杀死。对于模拟转导或经afp158 car(编码范例抗afp158/hla*a02:01抗体的car构建体)转导的初生t细胞测试其在5:1的效应:标靶比率下特异性杀死afp158/hla*a02:01阳性癌细胞的能力。如图13中所示,afp158 car-t细胞特异性杀死afp158/hla*a02:01阳性细胞系hepg2及sk-hep1-minig,但其他细胞系中无一者如此,其为afp阴性或hla*a02:01阴性的。重要的是,此资料表明我们的抗体高度特异于afp表达细胞且不介导跨越不表达afp的多个组织类型的一大组hla-a02细胞系的非特异性杀死。
[0685]
在抗原刺激后脱粒的afp158 car转导的t细胞
[0686]
为了进一步表征afp158 car转导的t细胞中的生物活性,我们使用流式细胞术分析来检测cd107a表面表达(作为脱粒活性的量度)。afp158 car转导的t细胞在抗cd107a抗体及蛋白质运输抑制剂混合液的1:200稀释液(ebioscience)存在下与hepg2、sk-hep-1及sk-hep1-minig细胞一起共培育4小时。在与靶细胞一起共培育之后,转导t细胞藉由afp158/hla四聚物及抗cd8染色。四聚物阳性、cd8阳性t细胞中的脱粒显示于图25中。当与sk-hep1-minig,接着与hepg2一起共培育时观测到如藉由cd107a表达所测量的最高含量的脱粒,而在亲本抗原阴性sk-hep-1的情况下未观测到脱粒。此与以上的t细胞介导的细胞溶解资料一致。
[0687]
细胞因子释放
[0688]
亦检查用活化afp158 car-t细胞处理后的细胞因子释放曲线。t细胞经模拟转导或经范例afp158 car转导且与如所指示的靶细胞一起共培育。在16小时之后使用magpix多路系统(luminex)藉由bio-plex pro人类细胞因子8重分析(biorad)测量il-2、il-4、il-6、il-8、il-10、gm-csf、ifn-γ及tnf-α向培养基中的释放。细胞因子浓度在减去来自培养基、单独的靶细胞及单独的afp158 car转导的t细胞的值之后测定自标准曲线。如图14a及图14b中所示,细胞因子释放仅在afp158 car-t细胞与afp158/hla*a02:01阳性细胞sk-hep1-minig、mcf7-minig及hepg2一起共培育时检测到,但在afp158/hla*a02:01阴性细胞sk-hep1及mcf7的情况下未检测到。afp158 car-t细胞minig在其暴露于sk-hep1-minig及mcf7-minig时minig高得多含量的细胞因子。此与afp158小型基因转导的癌细胞相比于hepg2在细胞表面上表较高得多含量的afp158/hla*a02:01一致。模拟转导的t细胞在afp158/hla*a02:01阳性癌细胞存在下仅释放痕量(若存在)细胞因子。在与模拟转导(afp阴性)中的sk-hep1一起共培育之后的il-6释放系由于那些细胞中的内源性il-6表达(基于未示出的资料)。
[0689]
人类hcc异种移植模型中的afp158 car t细胞的体内功效研究
[0690]
afp158 car-t细胞的体内抗肿瘤活性测试于scid灰棕色免疫功能不全小鼠中的若干已确立人类hcc异种移植模型中。hepg2以每只小鼠2.5
×
106个细胞在右侧腹皮下(s.c.)植入。当肿瘤体积达到平均100mm3时,小鼠基于肿瘤体积随机化为四组:1)无处理,2)用模拟转导、供体匹配t细胞静脉内(i.v.)处理(模拟),3)用范例afp158 car转导的t细胞静脉内(i.v.)处理,及4)肿瘤内(i.t.)注射afp158 car转导的t细胞。所有处理以每只小
鼠107个细胞的剂量施用且每2周重复,持续总共3个剂量。
[0691]
对照及afp158 car-t细胞均在给定剂量及排程下耐受良好;研究在期间未观测到处理相关的不良反应。未处理小鼠以及对照t细胞处理小鼠中的肿瘤持续生长直至其达到需要安乐死的尺寸。如图15a中所示,在hepg2肿瘤携带小鼠中静脉内施用afp158 car-t细胞产生在第一剂量之后28天起始的延迟肿瘤生长。在第一剂量后的第35天之后观测到大致25%肿瘤生长抑制(图15a)。相比于静脉内施用的延迟效应,肿瘤内注射afp158 car-t细胞在所有小鼠中引起快速、深远且持久的肿瘤消退,其中80%(6/8)显示完全消退(图15b)。
[0692]
hcc的腹膜传播因此发生于具有极有限治疗选择的患者亚组中。因此,在已建立腹膜内hcc异种移植模型中另外测试afp158 car-t细胞的抗肿瘤活性。在此研究中,荧光素酶标记的hepg2细胞(hepg2-luc2)以每只小鼠2.5x106个细胞腹膜内(i.p.)植入。藉由测量肿瘤衍生的生物发光每周评估肿瘤负荷。肿瘤植入后一周,动物基于总生物发光通量随机化为四组:1)无处理,2)用腹膜内注射107个对照t细胞处理,用腹膜内注射106个afp158 cart细胞处理,及4)用腹膜内注射107个afp158 car-t细胞处理(n=6只小鼠/组)。向各组施用两个剂量的t细胞,相隔两周。
[0693]
如在静脉内及肿瘤内施用途径的情况下所观测,未观测到由腹膜内注射对照或afp158 car-t细胞所致的不良反应的临床症状。如图16a(在处理后第70天自肿瘤携带小鼠光子发射的变化)及16b(在第70天的hepg2-luc2肿瘤携带小鼠的光子发射影像)中所示,对照t细胞处理的动物中的肿瘤负荷未显示与未处理对照组中所观测的差异。相比之下,用afp158 car-t细胞以每只小鼠106或107个细胞处理的小鼠显示稳固肿瘤消退。未观测到剂量依赖性抗肿瘤活性,指示两种剂量均超过此模型中的最大有效剂量。因此,腹膜hcc模型中藉由afp158 car t细胞的腹膜内处理为安全、强力的且有效地根除肿瘤。
[0694]
亦在sk-hep1-minig皮下异种移植模型中评估afp158 car-t细胞的体内活性。sk-hep1-minig以每只小鼠2.5
×
106个细胞在右侧腹皮下(s.c.)植入。当肿瘤体积达到平均100mm3时,小鼠基于肿瘤体积随机化为三组:1)用模拟转导、供体匹配t细胞静脉内(i.v.)处理(模拟),2)用范例afp158 car转导的t细胞静脉内(i.v.)处理,及3)肿瘤内(i.t.)注射相同afp158 car转导的t细胞。所有处理以每只小鼠107个细胞的剂量施用且在第一处理2周之后重复一次。在此肿瘤模型中,静脉内施用afp158 car-t细胞导致立即肿瘤生长抑制,在第一剂量之后第31天减缓肿瘤生长大致28%(图17)。此表明hepg2中的静脉内afp158 car-t细胞施用的经延迟肿瘤生长抑制活性为模型特异性现象。与hepg2肿瘤中获得的结果类似,在sk-hep1-minig小鼠模型中肿瘤内注射afp158 car-t细胞在第一剂量之后不久产生稳固及延长的肿瘤消退(图17)。
[0695]
实施例8.产生及表征全长igg1 afp158抗体
[0696]
所选噬菌体克隆的全长人类igg1在hek293及中国仓鼠卵巢(cho)细胞系中产生,如所描述(tomimatsu,k.等人,biosci.biotechnol.biochem.73(7):1465-1469,2009)(资料未示出)。简言之,将抗体可变区亚克隆至具有相配的人类λ或κ轻链恒定区及人类igg1恒定区序列的哺乳动物表达载体中。应用相同克隆策略,我们亦产生具有小鼠igg1重链及轻链恒定区的嵌合afp158全长抗体。在还原及非还原条件下,藉由电泳测量纯化的全长igg抗体的分子量。进行纯化的afp158小鼠嵌合igg1抗体的sds-page以测定蛋白质纯度。简言之,2μg蛋白质与2.5μl nupage lds样品缓冲液(life technologies,np0008)混合且藉由去离
子水使其总计达10μl。样品在70℃下加热10分钟,接着负载至凝胶上。在180v下进行凝胶电泳1小时。sds-page的实例展示于图18中。
[0697]
藉由流式细胞术测试afp158嵌合igg1抗体与afp158呈递sk-hep1细胞的结合。sk-hep1为hla-a*02:01阳性及afp阴性细胞系。afp158小型基因盒转染至sk-hep1细胞中来产生afp158呈递sk-hep1-minig细胞。10μg/ml抗体持续1小时添加至冰上的细胞。在洗涤之后,添加r-pe结合的抗小鼠igg(h+l)(载体labs#ei-2007)以检测抗体结合。发现afp158抗体结合至小型基因转染的sk-hep1-minig细胞,而单独的二级对照抗体不结合至相同细胞(图19)。藉由fortebio测定小鼠嵌合igg1 afp158抗体的结合亲和力。将抗体自单价bsab转化为二价igg抗体显著增加afp158抗体对于靶抗原的结合亲和力。全长抗体的kd测定为在皮摩尔范围内,相比于bsab型式的100至1000倍增加。表10显示kd资料的实施例。
[0698]
表10
[0699][0700]
在elisa分析中afp158特异性及阴性对照(et901)小鼠嵌合igg1测试于afp158/hla-a*02:01、afp重组蛋白及游离afp158肽的结合。抗体在3
×
连续稀释下测试,从100ng/ml开始,持续总共8个浓度。生物素化afp158/a*02:01mhc以2μg/ml涂布至抗生蛋白链菌素盘上,afp蛋白质以2μg/ml涂布且afp158肽以40ng/ml涂布。确认全长afp158抗体仅在hla-a02的情况下识别afp158肽,且不结合重组afp蛋白质或游离afp158肽(图20)。
[0701]
实施例9.远端sk-hep1-minig皮下异种移植模型中的afp158-cart的功效
[0702]
实施例7显示将afp158 car t细胞肿瘤内施用至皮下(s.c.)肝脏肿瘤模型中显著抑制多个异种移植模型中的经处理肿瘤的生长。此实施例中所述的研究的目标为评估肿瘤内处理是否亦将影响远端皮下肿瘤的生长。
[0703]
在一个代表性研究中,使用以下材料及程序:
[0704]
1.靶肿瘤细胞系sk-hep1-minig(亦称为sk-hep1-mg):表达hla-a*02:01及afp158肽小型基因的人类hcc细胞系sk-hep1。
[0705]
2.动物:scid-灰棕色不携带t及b细胞。具有功能性nk、单核细胞/巨噬细胞、粒细胞及树突状细胞。
[0706]
3.动物研究在研究合同实验室进行。
[0707]
4.cart细胞:人类t细胞在第0天活化;b)活化t细胞在第1天藉由慢病毒转导;c)慢病毒及珠粒在第5天移除;d)car t细胞藉由il-2以100单位/毫升培养及扩增;e)apc细胞藉由自pbmc耗尽cd3+t细胞分离。细胞主要为单核细胞及b细胞。
[0708]
5.动物研究.6-8周龄雌性scid灰棕色小鼠用于此研究中。sk-hep1-minig细胞系
在dmem培养基+10%fbs及1%l-麸酰氨酸中在37℃下在具有5%co2的含湿气氛围中培养。sk-hep1-minig细胞再悬浮于50%pbs加上50%基质胶中且以5
×
106个细胞/100微升/注射位点在右侧腹以及左侧腹处皮下植入至40只小鼠中。
[0709]
当肿瘤达到平均100mm3时,小鼠基于右侧腹的肿瘤尺寸以每组6只小鼠随机化为下文所述的6组,且样品在各小鼠的右侧腹上喷射至肿瘤中。对于afp158-cart组(第4-6组),如上文所述的各种抗体克隆用于各种实验中。来自使用代表性克隆的实验的结果显示如下。其他克隆产生类似结果(资料未示出)。
[0710]
第1组:媒剂(pbs),100微升/小鼠,肿瘤内,至右侧位点皮下肿瘤中,单次剂量。
[0711]
第2组:模拟*t细胞,7百万/100微升/小鼠,肿瘤内,至右侧位点皮下肿瘤中,单次剂量。(模拟t细胞为未经cart转导的t细胞)
[0712]
第3组:伴以apc细胞的模拟,7百万(70%模拟+30%apc)/100微升/小鼠,肿瘤内,至右侧位点皮下肿瘤中,单次剂量。
[0713]
第4组:afp158 car t细胞,7百万/100微升/小鼠,静脉内,经由尾端静脉,单次剂量。
[0714]
第5组:afp158 car t细胞,7百万/100微升/小鼠,肿瘤内,至右侧位点皮下肿瘤中,单次剂量。
[0715]
第6组:伴以apc的afp158 car t细胞,7百万(70%cart+30%apc)/100微升/小鼠,肿瘤内,至右侧位点皮下肿瘤中,单次剂量。
[0716]
afp158-cart在当前剂量/排程下安全
[0717]
在给药之后,密切监测体重及其他临床特性。如图21中所示,为在任一组中观测到体重损失。未观测到药物相关毒性的其他临床症状。
[0718]
单一肿瘤内剂量导致局部肿瘤的消退及远端肿瘤的抑制
[0719]
如图22中所示,仅注射至右侧腹的单一肿瘤内剂量的afp158-cart产生植入右侧腹以及左侧腹(afp158-car t细胞并非直接注射之侧)的肿瘤的显著抑制。藉由曲线下面积的分析反映肿瘤的总生长动力学,显示肿瘤内注射单独的afp158-cart产生右侧腹上的42%肿瘤生长抑制(邓尼特测试(dunnett's test)p《0.01)及左侧腹上的33%肿瘤生长抑制(p》0.05)。
[0720]
两侧中的afp158-cart+apc增强的抗肿瘤活性
[0721]
如图22中所示,肿瘤内注射afp158-cart加上apc引起右侧腹肿瘤的消退,当相比于媒剂治疗组时,总体肿瘤抑制为68%(p《0.001)。a亦观测到相比于各别媒剂治疗组的远端左侧腹肿瘤的较强抑制(47%,p《0.01)。此表明t细胞交叉启动可能参与右侧以及左侧肿瘤的额外抑制。
[0722]
在afp158-cart+apc处理的动物中的右侧以及左侧肿瘤中观测到cd3阳性细胞
[0723]
在研究结束(给药后34天)时,收获肿瘤且进行cd3(t细胞标记物)的组织学染色。如图23中所示,在来自肿瘤内注射afp158-cart加上apc细胞的右侧以及左侧肿瘤中发现cd3阳性细胞。此表明人类t细胞参与肿瘤生长抑制。
[0724]
序列表
[0725]
hafp蛋白质(seq id no:1)
[0726][0727]
hafp cds(seq id no:2)
[0728][0729]
hafp137-145(seq id no:3)
[0730]
plfqvpepv
[0731]
hafp158-166(seq id no:4)
[0732]
fmnkfiyei
[0733]
hafp325-334(seq id no:5)
[0734]
glspnlnrfl
[0735]
hafp542-550(seq id no:6)
[0736]
gvalqtmkq
[0737]
hafp158 a1(seq id no:7)
[0738]
amnkfiyei
[0739]
hafp158 a3(seq id no:8)
[0740]
fmakfiyei
[0741]
hafp158 a4(seq id no:9)
[0742]
fmnafiyei
[0743]
hafp158 a5(seq id no:10)
[0744]
fmnkaiyei
[0745]
hafp158 a6(seq id no:11)
[0746]
fmnkfayei
[0747]
hafp158 a7(seq id no:12)
[0748]
fmnkfiaei
[0749]
hafp158 a8(seq id no:13)
[0750]
fmnkfiyai
[0751]
mafp蛋白质(seq id no:14)
[0752][0753]
mafp cds(seq id no:15)
[0754][0755]
mafp154-162(seq id no:16)
[0756]
fmnrfiyev
[0757]
克隆17重链可变域,蛋白质(seq id no:17)
[0758][0759]
克隆33重链可变域,蛋白质(seq id no:18)
[0760][0761]
克隆44重链可变域,蛋白质(seq id no:19)
[0762][0763]
克隆48重链可变域,蛋白质(seq id no:20)
[0764][0765]
克隆50重链可变域,蛋白质(seq id no:21)
[0766][0767]
克隆52重链可变域,蛋白质(seq id no:22)
[0768][0769]
克隆61重链可变域,蛋白质(seq id no:23)
[0770][0771]
克隆76重链可变域,蛋白质(seq id no:24)
[0772][0773]
克隆79重链可变域,蛋白质(seq id no:25)
[0774][0775]
克隆17-13重链可变域,蛋白质(seq id no:26)
[0776][0777]
克隆17轻链可变域,蛋白质(seq id no:27)
[0778][0779]
克隆33轻链可变域,蛋白质(seq id no:28)
[0780][0781]
克隆44轻链可变域,蛋白质(seq id no:29)
[0782][0783]
克隆48轻链可变域,蛋白质(seq id no:30)
[0784][0785]
克隆50轻链可变域,蛋白质(seq id no:31)
[0786][0787]
克隆52轻链可变域,蛋白质(seq id no:32)
[0788][0789]
克隆61轻链可变域,蛋白质(seq id no:33)
[0790][0791]
克隆76轻链可变域,蛋白质(seq id no:34)
[0792][0793]
克隆79轻链可变域,蛋白质(seq id no:35)
[0794][0795]
克隆17-13轻链可变域,蛋白质(seq id no:36)
[0796][0797]
克隆17重链可变域,核酸(seq id no:37)
[0798][0799]
克隆33重链可变域,核酸(seq id no:38)
[0800][0801]
克隆44重链可变域,核酸(seq id no:39)
[0802][0803]
克隆48重链可变域,核酸(seq id no:40)
[0804][0805]
克隆50重链可变域,核酸(seq id no:41)
[0806][0807]
克隆52重链可变域,核酸(seq id no:42)
[0808][0809]
克隆61重链可变域,核酸(seq id no:43)
[0810][0811]
克隆76重链可变域,核酸(seq id no:44)
[0812][0813]
克隆79重链可变域,核酸(seq id no:45)
[0814][0815]
克隆17-13重链可变域,核酸(seq id no:46)
[0816][0817]
克隆17轻链可变域,核酸(seq id no:47)
[0818][0819]
克隆33轻链可变域,核酸(seq id no:48)
[0820][0821]
克隆44轻链可变域,核酸(seq id no:49)
[0822][0823]
克隆48轻链可变域,核酸(seq id no:50)
[0824][0825]
克隆50轻链可变域,核酸(seq id no:51)
[0826][0827]
克隆52轻链可变域,核酸(seq id no:52)
[0828][0829]
克隆61轻链可变域,核酸(seq id no:53)
[0830][0831]
克隆76轻链可变域,核酸(seq id no:54)
[0832][0833]
克隆79轻链可变域,核酸(seq id no:55)
[0834][0835]
克隆17-13轻链可变域,核酸(seq id no:56)
[0836][0837]
克隆17hcdr1(seq id no:57)
[0838]
gytftsyg
[0839]
克隆33hcdr1(seq id no:58)
[0840]
vssnsaawn
[0841]
克隆44hcdr1(seq id no:59)
[0842]
ggtfssya
[0843]
克隆48hcdr1(seq id no:60)
[0844]
gftfddya
[0845]
克隆50hcdr1(seq id no:61)
[0846]
ggsisssnw
[0847]
克隆52hcdr1(seq id no:62)
[0848]
gytftsyg
[0849]
克隆61hcdr1(seq id no:63)
[0850]
gysfpnyw
[0851]
克隆76hcdr1(seq id no:64)
[0852]
gftfsnaw
[0853]
克隆79hcdr1(seq id no:65)
[0854]
gftfddya
[0855]
克隆17-13hcdr1(seq id no:66)
[0856]
gytftsyg
[0857]
克隆17hcdr2(seq id no:67)
[0858]
isayngnt
[0859]
克隆33hcdr2(seq id no:68)
[0860]
yrskwyn
[0861]
克隆44hcdr2(seq id no:69)
[0862]
iipifgta
[0863]
克隆48hcdr2(seq id no:70)
[0864]
iswnsgri
[0865]
克隆50hcdr2(seq id no:71)
[0866]
iyhsgst
[0867]
克隆52hcdr2(seq id no:72)
[0868]
isayngnt
[0869]
克隆61hcdr2(seq id no:73)
[0870]
idpgdsyt
[0871]
克隆76hcdr2(seq id no:74)
[0872]
irskayggtt
[0873]
克隆79hcdr2(seq id no:75)
[0874]
iswnsgsi
[0875]
克隆17-13hcdr2(seq id no:76)
[0876]
isayngnt
[0877]
克隆17hcdr3(seq id no:77)
[0878]
aryqdwwylgqfdq
[0879]
克隆33hcdr3(seq id no:78)
[0880]
argsyysgryda
[0881]
克隆44hcdr3(seq id no:79)
[0882]
areirgyyyyygmdv
[0883]
克隆48hcdr3(seq id no:80)
[0884]
araddygapyyyygmdv
[0885]
克隆50hcdr3(seq id no:81)
[0886]
atgyggyfdy
[0887]
克隆52hcdr3(seq id no:82)
[0888]
ardsyyyyygmdv
[0889]
克隆61hcdr3(seq id no:83)
[0890]
aryyvslvdi
[0891]
克隆76hcdr3(seq id no:84)
[0892]
ardglyssswydsdy
[0893]
克隆79hcdr3(seq id no:85)
[0894]
akdihsgsyygllyyamdv
[0895]
克隆17-13hcdr3(seq id no:86)
[0896]
arfqdwwylgqfdq
[0897]
hccdr1共有序列(seq id no:87)
[0898]
g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w
[0899]
hccdr2共有序列(seq id no:88)
[0900]
i/s-k/s-x-h/y-x-g-x-t
[0901]
hccdr3共有序列(seq id no:89)
[0902]
a/g-x-w/y-y-x-x-x-f/y-d
[0903]
克隆17lcdr1(seq id no:90)
[0904]
gsdvgvyyy
[0905]
克隆33lcdr1(seq id no:91)
[0906]
sgsiasny
[0907]
克隆44lcdr1(seq id no:92)
[0908]
nigtks
[0909]
克隆48lcdr1(seq id no:93)
[0910]
ssnigagyd
[0911]
克隆50lcdr1(seq id no:94)
[0912]
nigsks
[0913]
克隆52lcdr1(seq id no:95)
[0914]
tgavtsghy
[0915]
克隆61lcdr1(seq id no:96)
[0916]
ssdvggyny
[0917]
克隆76lcdr1(seq id no:97)
[0918]
ssnignny
[0919]
克隆79lcdr1(seq id no:98)
[0920]
ssnigagyd
[0921]
克隆17-13lcdr1(seq id no:99)
[0922]
gsdvgvyyy
[0923]
克隆17lcdr2(seq id no:100)
[0924]
dvg
[0925]
克隆33lcdr2(seq id no:101)
[0926]
edn
[0927]
克隆44lcdr2(seq id no:102)
[0928]
ydt
[0929]
克隆48lcdr2(seq id no:103)
[0930]
gns
[0931]
克隆50lcdr2(seq id no:104)
[0932]
yds
[0933]
克隆52lcdr2(seq id no:105)
[0934]
das
[0935]
克隆61lcdr2(seq id no:106)
[0936]
dvn
[0937]
克隆76lcdr2(seq id no:107)
[0938]
dnn
[0939]
克隆79lcdr2(seq id no:108)
[0940]
gns
[0941]
克隆17-13lcdr2(seq id no:109)
[0942]
dvd
[0943]
克隆17lcdr3(seq id no:110)
[0944]
asytnrnslgyv
[0945]
克隆33lcdr3(seq id no:111)
[0946]
qsydsstvv
[0947]
克隆44lcdr3(seq id no:112)
[0948]
qvwdsssdhpv
[0949]
克隆48lcdr3(seq id no:113)
[0950]
qsydsslsgsv
[0951]
克隆50lcdr3(seq id no:114)
[0952]
qvwdsssdhvv
[0953]
克隆52lcdr3(seq id no:115)
[0954]
llsysdalv
[0955]
克隆61lcdr3(seq id no:116)
[0956]
ssyttgsrav
[0957]
克隆76lcdr3(seq id no:117)
[0958]
gtwdgslytml
[0959]
克隆79lcdr3(seq id no:118)
[0960]
qsydsslsgsgv
[0961]
克隆17-13lcdr3(seq id no:119)
[0962]
asytnrnslgyv
[0963]
lccdr1共有序列(seq id no:120)
[0964]
s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y
[0965]
lccdr3共有序列(seq id no:121)
[0966]
q-s/t-y/w-d/t-s/t-a/s
[0967]
ifi30对照(seq id no:122)
[0968]
lldvptaav
[0969]
btg2对照(seq id no:123)
[0970]
tlwvdpyev
[0971]
bcr对照(seq id no:124)
[0972]
flldhlkrv
[0973]
ifi30对照(seq id no:125)
[0974]
llldvptaav
[0975]
ssr1对照(seq id no:126)
[0976]
vlfrggprgllav
[0977]
ppp2r1b对照(seq id no:127)
[0978]
sllpaivel
[0979]
ddx5对照(seq id no:128)
[0980]
yllpaivhi
[0981]
ctsg对照(seq id no:129)
[0982]
fllptgaea
[0983]
cd247对照(seq id no:130)
[0984]
lldpklcyll
[0985]
dmtn对照(seq id no:131)
[0986]
slphfhhpet
[0987]
calr对照(seq id no:132)
[0988]
mllsvplllg
[0989]
pim1对照(seq id no:133)
[0990]
llydmvcgdip
[0991]
ifi30对照(seq id no:134)
[0992]
llldvptaavq
[0993]
ifi30对照(seq id no:135)
[0994]
llldvptaavqa
[0995]
ssr1对照(seq id no:136)
[0996]
vlfrggprgllava
[0997]
hla-e对照(seq id no:137)
[0998]
mvdgtllll
[0999]
rps6kb1对照(seq id no:138)
[1000]
ymapeilmrs
[1001]
csf2ra对照(seq id no:139)
[1002]
fiynadlmnc
[1003]
il7对照(seq id no:140)
[1004]
kqyesvlmvsi
[1005]
htert540对照(seq id no:141)
[1006]
ilakflhwl
[1007]
更具体地,本技术提供下列各项:
[1008]
1.一种经分离抗amc构建体,其包含特异性结合包含α-胎蛋白(afp)肽及主要组织相容性(mhc)i类蛋白质的复合体(afp/mhc i类复合体,或amc)的抗体部分。
[1009]
2.项1的经分离抗amc构建体,其中该mhc i类蛋白质为hla-a02等位基因的hla-a*02:01亚型。
[1010]
3.项1或2的经分离抗amc构建体,其中该afp肽具有选自由seq id no:3-13及16组成的组的氨基酸序列。
[1011]
4.项3的经分离抗amc构建体,其中该afp肽具有fmnkfiyei(seq id no:4)的氨基酸序列。
[1012]
5.项1至4中任一项的经分离抗amc构建体,其中该抗体部分为全长抗体、fab、fab'、(fab')2、fv或单链fv(scfv)。
[1013]
6.项1至5中任一项的经分离抗amc构建体,其中该经分离抗amc构建体以约0.1pm至约500nm的kd结合至该afp/mhc i类复合体。
[1014]
7.项1至6中任一项的经分离抗amc构建体,其中该抗体部分包含:
[1015]
i)重链可变域,其包含:重链互补决定区(hc-cdr)1,该hc-cdr1包含氨基酸序列g-f/y-s/t-f-d/s/t-d/n/s-y/a-a/g/w(seq id no:87),或其包含至多约3个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含氨基酸序列i/s-k/s-x-h/y-x-g-x-t(seq id no:88),或其包含至多约3个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含氨基酸序列a/g-x-w/y-y-x-x-x-f/y-d(seq id no:89),或其包含至多约3个氨基酸取代的变体;及
[1016]
ii)轻链可变域,其包含:轻链互补决定区(lc-cdr)1,该lc-cdr1包含氨基酸序列s/t-g/s-d/n-i/v-a/g-a/s/v-x-h/y(seq id no:120),或其包含至多约3个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含氨基酸序列q-s/t-y/w-d/t-s/t-a/s(seq id no:121),或其包含至多3个氨基酸取代的变体,其中x可为任何氨基酸。
[1017]
8.项1至6中任一项的经分离抗amc构建体,其中该抗体部分包含:
[1018]
i)重链可变域,其包含:hc-cdr1,该hc-cdr1包含seq id no:57-66中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体;hc-cdr2,该hc-cdr2包含seq id no:67-76中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体;及hc-cdr3,该hc-cdr3包含seq id no:77-86中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体;及
[1019]
ii)轻链可变域,其包含:lc-cdr1,该lc-cdr1包含seq id no:90-99中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体;lc-cdr2,该lc-cdr2包含seq id no:100-109中的任一项的氨基酸序列,或其包含至多约3个氨基酸取代的变体;及lc-cdr3,该lc-cdr3包含seq id no:110-119中的任一项的氨基酸序列,或其包含至多约5个氨基酸取代的变体。
[1020]
9.项8的经分离抗amc构建体,其中该抗体部分包含:a)重链可变域,其包含seq id no:17-26中的任一项的氨基酸序列,或其与seq id no:17-26中的任一项具有至少约95%序列同一性的变体;及b)轻链可变域,其包含seq id no:27-36中的任一项的氨基酸序列,或其与seq id no:27-36中的任一项具有至少约95%序列同一性的变体。
[1021]
10.项1至9中任一项的经分离抗amc构建体,其中该经分离抗amc构建体为多特异性的。
[1022]
11.项10的经分离抗amc构建体,其中该经分离抗amc构建体为串联scfv、双功能抗体(db)、单链双功能抗体(scdb)、双亲和力再靶向(dart)抗体、双可变域(dvd)抗体、杵-臼(knob-into-hole;kih)抗体、坞锁(dock and lock;dnl)抗体、化学交联抗体、异多聚体抗体或异结合物抗体。
[1023]
12.项11的经分离抗amc构建体,其中该经分离抗amc构建体为包含两个藉由肽接头连接的scfv的串联scfv。
[1024]
13.项10至12中任一项的经分离抗amc构建体,其中该经分离抗amc构建体进一步包含特异性结合第二抗原的第二抗体部分。
[1025]
14.项13的经分离抗amc构建体,其中该第二抗原选自由以下组成的组:cd3γ、cd3δ、cd3ε、cd3ζ、cd28、ox40、gitr、cd137、cd27、cd40l及hvem。
[1026]
15.项13的经分离抗amc构建体,其中该第二抗原为cd3ε,且其中该经分离抗amc构建体为包含对该afp/mhc i类复合体具有特异性的n端scfv及对cd3ε具有特异性的c端scfv的串联scfv。
[1027]
16.项1至9中任一项的经分离抗amc构建体,其中该经分离抗amc构建体为嵌合抗原受体,其包含含该抗体部分的细胞外域、跨膜域及包含cd3ζ胞内信号传导序列及cd28胞内信号传导序列的胞内信号传导域。
[1028]
17.项1至9中任一项的经分离抗amc构建体,其中该经分离抗amc构建体为包含该抗体部分及效应分子的免疫缀合物,其中该效应分子为选自由以下组成的组的治疗剂:药物、毒素、放射性同位素、蛋白质、肽及核酸。
[1029]
18.项1至9中任一项的经分离抗amc构建体,其中该经分离抗amc构建体为包含该抗体部分及标记的免疫缀合物。
[1030]
19.一种药物组合物,其包含项1至17中任一项的经分离抗amc构建体。
[1031]
20.一种宿主细胞,其表达项1至18中任一项的经分离抗amc构建体。
[1032]
21.一种核酸,其编码项1至18中任一项的经分离抗amc构建体的多肽组分。
[1033]
22.一种效应细胞,其表达项16的经分离抗amc构建体。
[1034]
23.项22的效应细胞,其中该效应细胞为t细胞。
[1035]
24.一种检测在其表面上呈递包含afp肽及mhc i类蛋白质的复合体的细胞的方法,其包括使该细胞与项18的经分离抗amc构建体接触及检测该细胞上的该标记的存在。
[1036]
25.一种治疗患有afp阳性疾病的个体的方法,其包括向该个体施用
[1037]
a)有效量的项19的药物组合物,或
[1038]
b)有效量的项22或23的效应细胞。
[1039]
26.项25的方法,其中该施用经由静脉内或肿瘤内途径。
[1040]
27.项25的方法,其中该施用是向第一疾病位点远端的注射位点。
[1041]
28.一种诊断患有afp阳性疾病的个体的方法,其包括:
[1042]
a)向该个体施用有效量的项18的经分离抗amc构建体;及
[1043]
b)测定该个体中的该标记的水平,其中该标记的水平高于阈值水平指示该个体患有该afp阳性疾病。
[1044]
29.一种诊断患有afp阳性疾病的个体的方法,其包括:
[1045]
a)使来源于该个体的样品与项18的经分离抗amc构建体接触;及
[1046]
b)测定该样品中与该经分离抗amc构建体结合的细胞的数量,其中与该经分离抗amc构建体结合的细胞的数量值高于阈值水平指示该个体患有该afp阳性疾病。
[1047]
30.项25至29中任一项的方法,其中该afp阳性疾病为癌症。
[1048]
31.项30的方法,其中该癌症为肝细胞癌、生殖细胞肿瘤或乳腺癌。
[1049]
32.项31的方法,其中该癌症为肝细胞癌。
[1050]
33.项32的方法,其中该癌症为转移性肝细胞癌。
[1051]
34.项25至27中任一项的方法,其中该afp阳性疾病为肝细胞癌且癌转移得到抑制。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1