一种适用木薯抗病研究的内参基因的筛选方法及应用
1.本发明涉及植物基因工程技术领域,特别涉及一种适用木薯抗病研究的稳定内参基因的筛选方法及应用。
背景技术:
2.实时荧光定量pcr(quantitative real-time pcr)是一种在dna扩增反应中,以荧光化学物质检测每次聚合酶链式反应(pcr)循环后产物总量的方法。近年来,由于实时荧光定量pcr具有灵敏性、高效性和准确性的特点,被广泛用于分子生物学研究中分析不同基因的表达模式,成为研究基因表达的通用方法,然而实时荧光定量pcr的准确性会受到样品生理状态、样品rna、反转录时cdna的合成效率等因素的影响,因而需要引入内参基因(reference gene) 进行均一化用以消除样本之间的差异,从而获得目的基因的真正特异性表达。
3.在研究基因表达水平时,常用管家基因(house keeper)作为内参基因。管家基因又称看家基因、持家基因,是指不受外部环境影响,在所有条件下均能稳定、大量表达的一类基因,其产物是维持细胞基本生命活动所需的。然而,大量研究结果表明,并没有表达绝对稳定的基因,任何一种管家基因的所谓恒定表达都只是在一定类型的细胞或实验因素作用下“有范围”的恒定。使用不合适的内参基因对目的基因的表达量分析可能会产生极大的影响,一方面使基因表达的微小差异难以发现,另一方面出现错误甚至相反的结论,因此,为了得到更可靠的实验结果,实验中选择较为合适的内参基因进行校正显得尤为重要,稳定的内参是实时荧光定量pcr分析准确性的先决条件,而不同植物对于内参基因的筛选鉴定存在较大的差异。
4.木薯(manihot esculeuta crantz)是热带地区重要的粮食作物,同时也是一种重要的、很有发展潜力的再生能源作物。木薯在生产上的病害,严重影响了木薯产业的健康发展,不断阐明木薯抗病机理、挖掘抗性基因资源是实现木薯产业可持续发展的有效途径。而现有对于木薯相关的内参基因的筛选鉴定的研究则未见报道,针对木薯各器官的不同处理的表达变化分析,筛选鉴定适用于木薯抗病研究的稳定内参基因,为进一步开展木薯的抗病分子生物学研究奠定方法学基础具有重要的实际意义。
技术实现要素:
5.鉴以此,本发明提出一种适用木薯抗病研究的稳定内参基因的筛选方法及应用,本发明筛选了13个木薯候选内参基因,并采用运用genorm、 norm-finder、bestkeeper和δct分析方法,对候选的13个内参基因在不同基因型木薯不同组织、不同激素以及细菌鞭毛蛋白flg22处理下的表达稳定性分析,发现基因manes.05g133600在全部处理条件下是最稳定的内参,可用作实时荧光定量pcr的稳定的内参。
6.本发明的技术方案是这样实现的:
7.一种适用木薯抗病研究的内参基因的筛选方法,包括如下步骤:
8.s1、选取不同品种、不同组织中的木薯转录组原始数据集中的基因,计算 rpkm值作为不同基因的表达量;并根据其表达量,对其基因表达量的变异系数cv值进行排序,筛选出cv值低于0.3的基因,作为候选内参基因;并对其候选内参基因进行实时荧光定量pcr内参基因引物设计;
9.s2、将木薯组培苗分别进行外源激素诱导处理、鞭毛蛋白处理后取样,以及对长势均一的不同品种木薯组培苗的不同组织部位的进行取样,分别作为实验材料,进行rna提取,合成cdna样本;
10.s3、对候选内参基因引物分别采用cdna样本进行qrt-pcr反应,检测表达量,根据其对应ct值判断基因的表达丰度;并分别采用genorm法、normfinder 法和bestkeeper法和δct法,对候选内参基因在外源激素诱导处理、鞭毛蛋白处理后和不同木薯组织部位的表达稳定性分析,根据分析结果,对候选内参基因进行综合稳定性排序,筛选出稳定表达的木薯内参基因。
11.进一步说明,步骤s2中,所述外源激素诱导处理包括采用茉莉酸、水杨酸和乙烯利的三种外源激素诱导处理。
12.进一步说明,所述外源激素诱导处理,具体为:对木薯组培苗分别采用质量浓度为100μmol/l的茉莉酸、水杨酸和乙烯利进行整株喷雾接种,并在不同时间点对其叶片进行取样。
13.进一步说明,步骤s2中,所述鞭毛蛋白处理是采用质量浓度为0.8~1.2μmol/l 的细菌鞭毛蛋白flg22进行处理。
14.进一步说明,所述鞭毛蛋白处理,具体为,取木薯组培苗的幼嫩叶片,制备原生质体,采用1μmol/l的细菌鞭毛蛋白flg22进行接种处理,并在不同时间点对其叶片进行取样。
15.进一步说明,所述木薯原生质体的制备方法,包括如下步骤:
16.(1)将木薯叶片在甘露醇中切成细条,转入酶解液中,26℃40rpm黑暗条件下酶解16h;酶解液为:1.6%纤维素酶,0.8%离析酶,9%甘露醇,0.02 mol/l kcl,0.2mol/l mes,0.1%bsa,0.01mol/l cacl2;
17.(2)采用w5溶液润洗过的纱布过滤酶解产物,弃滤渣,将所得液体室温 100g,离心3min,收集离心管底部的原生质体;w5溶液为:0.45%nacl,0.92% cacl2,2.5mmol/l kcl,0.1mol/l mes;
18.(3)再次加入10ml w5溶液悬浮原生质体,离心力100g,离心3min,重复洗涤2次,即得到木薯原生质体。
19.进一步说明,步骤s2中,所述木薯组培苗的不同组织部位是经过ms培养基60d的木薯根、茎、叶的组织部位。
20.一种根据上述适用木薯抗病研究的稳定内参基因的筛选方法筛选获得的内参基因,包括manes.05g133600、manes.02g183100、manes.14g008100、 manes.05g144500、manes.02g137500和ef1α。
21.更优选的,所述内参基因为manes.05g133600。
22.进一步说明,manes.05g133600、manes.02g183100、manes.14g008100、 manes.05g144500、manes.02g137500和ef1α作为内参基因,用于木薯组织发育及病害胁迫的抗病性分子生物学研究中。
23.与现有技术相比,本发明的有益效果是:
24.本发明运用生物信息学预测,结合组织发育及病害胁迫下表达情况,筛选了候选内参基因的基础上,分别对检测其候选内参基因在不同不品种,不同组织部位(根、茎、叶),以及经水杨酸(sa)、茉莉酸(ja)、乙烯利(eth) 三种激素处理、细菌鞭毛蛋白flg22处理下的表达情况,通过采用genorm法、 normfinder法和bestkeeper法和δct法,对其候选内参基因在木薯各器官及各处理中的表达变化进行比较分析,同时采用实时定量pcr对不同内参基因下目的基因的表达稳定性进行分析,筛选出特定条件下表达稳定的内参基因,为进一步开展木薯的抗病分子生物学研究奠定方法学基础。
25.经分析结果表明,基因manes.05g133600在全部处理特定条件下是最稳定的内参,该基因的鉴定为木薯抗病分子机理研究提供了稳定的内参,其在病原菌下的表达稳定;manes.02g183100、manes.14g008100、manes.05g144500、 manes.02g137500和ef1α具有良好的表达稳定性,可用作一般实时荧光定量 pcr的内参。
附图说明
26.图1为本发明实施例的候选内参基因引物扩增检测的电泳图;其中,图中的第1条带是marker,后面2-14分别对应1-13个内参引物的rt-pcr结果;
27.图2为本发明实施例的候选内参基因对应的木薯rna的检测的电泳图;其中,第1条带是dna marker,后面2-14分别对应图1中提取的rna,说明rna 提取质量好。
28.图3为本发明实施例的13个候选内参基因在不同样本中的ct值分布图;
29.图4为本发明实施例的13个候选内参基因的表达稳定性genorm分析图;
30.图5为本发明实施例的13个候选内参基因的表达稳定性normfinder分析图;
31.图6为本发明实施例的13个候选内参基因的表达稳定性bestkeeper分析图;
32.图7为本发明实施例的13个候选内参基因的表达稳定性δct法分析图;
33.图8为本发明实施例的13个候选内参基因的稳定性综合分析柱状图;
34.图9为本发明实施例的merboha/merbohd基因在不同内参基因不同处理下的表达模式。
具体实施方式
35.为了更好理解本发明技术内容,下面提供具体实施例,对本发明做进一步的说明。
36.本发明实施例所用的实验方法如无特殊说明,均为常规方法。
37.本发明实施例所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
38.实施例-适用木薯抗病研究的内参基因的筛选方法
39.我们运用生物信息学预测筛选了7个新的木薯内参,结合在组织发育及病害胁迫下表达相对较稳定的6个木薯内参,检测其在阿根廷7号(arg7)和华南8号(sc8)两个不品种,根、茎、叶组织,水杨酸(sa)、茉莉酸(ja)、乙烯利(eth)三种激素处理,以及细菌鞭毛蛋白flg22处理下的表达情况,并利用genorm法、normfinder法和bestkeeper法和δct法,对13个内参基因在木薯各器官及各处理中的表达变化进行比较分析,并采用实时定量pcr对不同内参基因下目的基因的表达稳定性进行分析,筛选出特定条件下表达相对最稳定的内参基因。
40.实施例1-木薯内参基因的筛选和引物设计
41.木薯转录组原始数据集及基因组数据下载于ncbi高通量测序数据库sra (sequence read archive),包括转录组原始数据集ssr1298996(w14块根), ssr1298998(w14叶片),ssr1299000(ku50叶片),ssr129001、ssr129002 及ssr129003(ku50块根不同发育阶段),ssr129005、ssr1299006、ssr1299007 (arg7块根不同发育阶段),ssr1299009(arg7叶片),ssr1302047(w14 块根)。
42.为了探究木薯不同品种不同组织中稳定表达的内参基因,采用rpkm值 (reads per kb per million reads)衡量11份木薯转录组原始数据集中的所有基因的表达量,其计算公式如下:(c值代表唯一匹配到某基因的reads 数量;n值代表唯一匹配到所有转录本的reads数量;l值代表匹配到的某基因 cds碱基数量)。
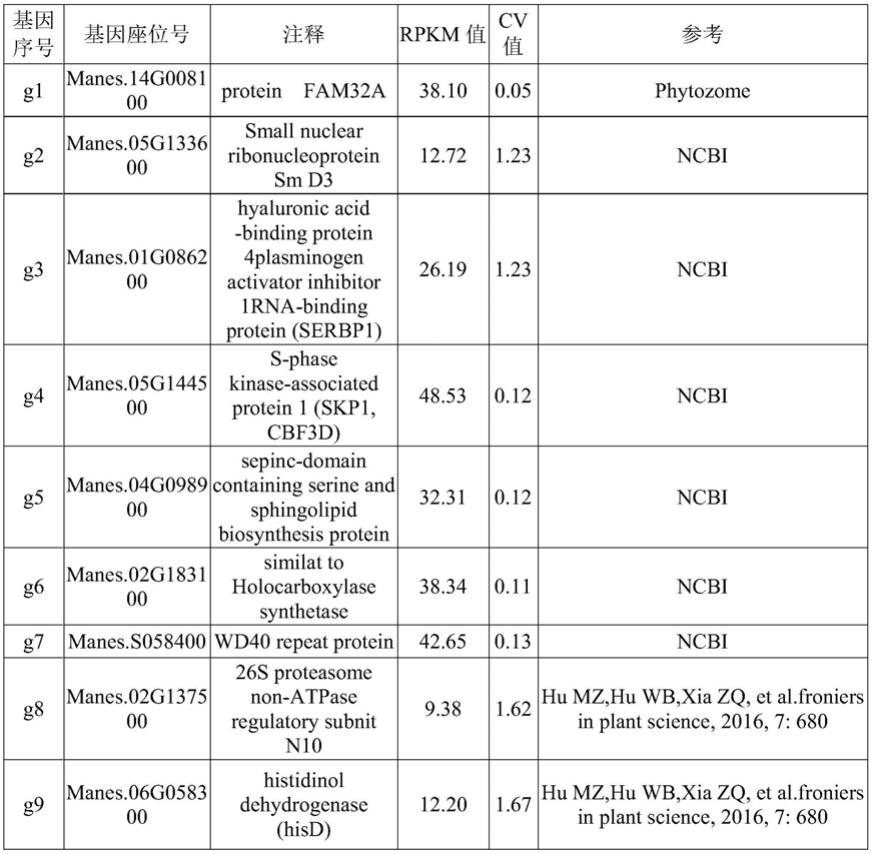
43.本发明通过对不同实验中获得的rpkm值的计算,根据11份转录组数据所得的rpkm计算,得出木薯基因组中每个基因表达量的平均值和标准差 (standard deviation,sd);同时,根据基因表达量的标准差与平均数的比值,得到每个基因表达量的变异系数(coefficient of variance,cv),采用变异系数评价基因表达稳定性,当某个基因表达量的cv值低于0.3时,可以认为该基因在不同品种不同组织中稳定表达。本发明对其基因表达量的变异系数cv值进行排序,筛选出7个cv值低于0.3的基因;并同时结合现有在组织发育及病害胁迫下表达相对较稳定的6个木薯内参基因:ubq10(manes.07g019300)、tub (manes.08g061700)、ef1a(manes.15g054700)等,作为候选内参基因,其信息如表1;并对其候选内参基因进行实时荧光定量pcr内参基因引物设计,其引物序列信息如表2;
44.对这13个基因在病原菌以及抗病相关激素处理下的表达稳定性进行检测,表1。
45.表1候选参考基因的信息
[0046][0047][0048]
表2 13个候选参考基因的引物和扩增
[0049][0050][0051]
实施例2-木薯材料处理与rna提取、cdna合成
[0052]
(1)实验材料获取
[0053]
本发明采用木薯阿根廷7号(arg7)和华南8号(sc8)的组培苗作为原始实验材料,组培苗采用ms培养基于25℃培养室培养2个月,光周期为16h光 /8h暗。
[0054]
将木薯组培苗分别进行外源激素诱导处理、鞭毛蛋白处理后取样,以及对长势均一的不同品种木薯组培苗的不同组织部位的进行取样,作为实验材料;具体如下:
[0055]
a.外源激素诱导处理采用喷雾法:将组培60d的arg7木薯苗,分别采用 100μmol/l的茉莉酸(ja)、水杨酸(sa)及乙烯利(eth)进行整株喷雾接种,每个处理9株,分别在接种前
0min与接种后15min,30min,60min,120min 共5个时间点进行混合采集叶片,每个时间点取3片叶。
[0056]
b.鞭毛蛋白的处理:取arg7木薯苗幼嫩叶片,制备原生质体,采用1μmol/l 的细菌鞭毛蛋白flg22处理,于接种前0min,接种后5min,10min,20min,30min 共5个时间点进行取样。
[0057]
c.取长势均一的sc8和arg7木薯苗各3株,对其根、茎、叶进行混合采样, 样品立即放入液氮中冻存,随后置于-80℃冰箱冷冻保存备用。
[0058]
(2)rna提取与cdna合成
[0059]
木薯原生质体的制备方法:
[0060]
a.将木薯叶片在甘露醇中切成细条(1mm)后转入酶解液(1.6%纤维素酶, 0.8%离析酶,9%甘露醇,0.02mol/l kcl,0.2mol/l mes,0.1%bsa,0.01mol/l cacl2)中,26℃,40rpm黑暗条件下酶解16h。
[0061]
b.用w5溶液(0.45%nacl,0.92%cacl2,2.5mmol/l kcl,0.1mol/l mes) 润洗过的纱布过滤酶解产物,弃滤渣,将所得液体室温100g,离心3min(上升和下降速率均为3),轻柔去除废液,收集离心管底部的原生质体。
[0062]
c.再次加入10ml w5溶液悬浮原生质体,离心力100g,离心3min,重复洗涤2次,即得木薯原生质体,可用于后续rna的提取。
[0063]
各样品参照植物总rna提取试剂盒(tiangen)说明书进行总rna的分离,为除去rna中残留的基因组dna,用dnase i(ambion)对3mg总rna进行消化。取消化后的样品进行cdna第一链的合成,操作参照revertaid first standcdna synthesis(thermo)说明书进行。
[0064]
实施例3-rna质量检测、引物特异性和扩增效率分析
[0065]
rna的质量是保证q-pcr准确性的关键因素,提取的rna样品用nanodrop 2000(thermo scientific)进行了测定,其rna的a260/a280比值均在2.0 左右,电泳结果(图2)显示有完整的28s和18s两条带,说明rna质量和纯度均符合要求。
[0066]
对设计的内参基因引物(表2)进行rt-pcr反应,测定引物的特异性。电泳结果(图1)显示不同的内参基因的引物只有一条特异性条带,该条带与预期条带大小一致,说明本实验所用引物具有高度的特异性。
[0067]
引物的扩增效率(e)由公式e=(10-1/slope)计算可得,在进行qrt-pcr之前,对每对引物的qrt-pcr的扩增效率采用了标准曲线法进行了计算。用于计算引物扩增效率的qrt-pcr的cdna模板来自于各种处理后不同时间点的cdna等比例混合样本作为样本池,并按照梯度稀释。结果表明:不同引物的标准曲线的决定系数(r2)均在0.99以上,引物的扩增效率在94.32%~111.77%之间(表2)。 13对引物的扩增效率都达到了94%以上,均符合qrt-pcr实验对引物扩增效率 (大于90%)的要求。
[0068]
实施例4-实时荧光定量pcr分析
[0069]
25μl rt-pcr反应体系中如下:2.5μl 10
×
pcr buffer、1.5μl 2.5mmol/lmgcl2、0.5μl 10mmol/ldntps、0.5μl 10μmol/lforward primer、0.5μl10μmol/lreverse primer、0.2μl 5u/μltaq和1μl模板,加无菌水补至总体积25 μl。反应条件为:94℃预变性3min;94℃变性30s,62℃退火30s,72℃延伸30s,30个循环;72℃延伸5min。rt-pcr反应结束后,进行1.2%琼脂糖凝胶电泳检测扩增产物。
[0070]
real-time pcr所用仪器为rotor-gene q(qiagen),试剂为sybr premixex taqtm(takara)。根据引物tm值按照takara试剂说明书,real-time pcr 扩增程序为:95℃30s;40个循环95℃5s,55℃30s,72℃30s;72℃延伸10min。每个样品进行3次独立的生物学重复。
[0071]
对13对候选内参基因引物分别采用不同处理后的不同时间点的cdna样本进行了qrt-pcr反应,检测其表达量,得到对应的ct值。ct值与基因的表达丰度呈负相关,即ct值越低,基因的表达丰度越高。根据其对应ct值判断基因的表达丰度,13个内参基因在所有的cdna样本中均有一定丰度的表达,ct值分布在15-27之间(图3);其中g13基因的表达丰度最高,其ct值在检测样本中为15.20~20.47;g12、g4和g11的表达丰度次之,ct值为16.34~24.22;而g9 的表达丰度较低,ct值为20.52~27.30;其他内参基因的ct值在检测样本中为 18.67~26.97;并进行δct分析内参基因稳定性,其结果如图7所示。
[0072]
实施例5-木薯内参基因的稳定性分析
[0073]
分别采用genorm法、normfinder法和bestkeeper法和δct法,对候选内参基因在外源激素诱导处理、鞭毛蛋白处理后和不同木薯组织部位的表达稳定性分析。
[0074]
(1)genorm法分析内参基因稳定性
[0075]
genorm软件研究样品中每个基因相对量比率的变化。基因稳定性的量化值 (m)是由多个内参基因在一组给定样本中的几何平均值和其中任何一个内参基因和所有其他内参基因的平均成对变化值来确定。m值得分越低的内参基因其表达量越稳定,而m值得分越高的内参基因的表达量变化越大,越不稳定。图 4表明,以三种(sa、ja、eth)激素、flg22处理、不同组织部位为样品的内参基因表达稳定性最高的是g7(manes.s058400)和g8(manes.02g137500),最不稳定的g12(manes.08g061700),但是全部内参的m值均低于1.5。
[0076]
(2)normfinder法分析内参基因稳定性
[0077]
normfinder用于基因稳定性分析的算法软件。同genorm软件相似, normfinder是通过稳定值(s)的大小对候选内参基因稳定性进行排序,即s值越高,基因表达越不稳定,s值越低,基因表达越稳定。在所有样品中,13对内参基因引物的s值排序为图5。其中,g2(manes.05g133600)的s值最低为0.304,是表达最稳定的基因;tubulin(g12,manes.08g061700)的s值最大(1.022),最不稳定,这与genorm软件分析结果一致。
[0078]
(3)bestkeeper法分析内参基因稳定性
[0079]
bestkeeper软件是通过比较内参基因的cq值得标准差(sd)与调节系数标准差sd[
±
x-fold]评判各候选内参基因表达稳定性。sd越小,调节系数标准差越小,基因的稳定性就越好。采用bestkeeper软件对木薯13个内参候选基因的表达稳定性进行分析的结果显示(图6),ubq10(g11,manes.07g019300)为最稳定的内参,这与genorm和normfinder软件分析结果相反;manes.s058400为最不稳定的内参。
[0080]
实施例6-综合分析内参基因稳定性
[0081]
根据上述四种基因表达稳定性分析方法的分析结果,对13个木薯候选内参基因进行综合稳定性排序,结果如图8,可以看出,g2(manes.05g133600)基因是最稳定的内参基因,g12(manes.08g061700)是最不稳定的内参基因。
[0082]
实施例7-目的基因的表达分析
[0083]
ros爆发是植物应对外界逆境环境的典型反应,受到病原菌浸染后 rboha、rbohd
会上调表达。为验证本发明所候选的内参基因在均一化其它基因中的作用,选择了ros爆发中的rboha(manes.14g042600.1)和rbohd (manes.09g172500.1)基因分别进行了检测,其结果如图9所示,从目标基因的表达趋势变化来看,采用不同的内参基因均一化,目的基因表达趋势基本一致,其中,g2基因作为内参所获得的qpcr结果更灵敏,在不同处理条件下都能有效的反应目的基因的变化;从不同时间点的稳定性来看g2作为内参目的基因表达量更稳定。
[0084]
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1