SlCYP707A基因作为负调控因子在促进番茄亚低温抗性中的应用
slcyp707a基因作为负调控因子在促进番茄亚低温抗性中的应用
技术领域
1.本发明涉及生物技术领域,尤其涉及slcyp707a基因作为负调控因子在促进番茄亚低温抗性中的应用。
背景技术:
2.番茄是一种喜温蔬菜,在正常条件下,叶片同化作用的最适温度为20℃-25℃,根系生长的最适温度为20℃-22℃。在冬春季节,番茄栽培过程中经常会遇到连续的亚低温(10℃-20℃),番茄在遭遇亚低温时,会表现为植株生长迟缓,茎秆细弱,叶片发黄,根系生长明显受阻,同时也可能加重其它病害的发生,如根腐病,灰霉病等,从而对后期番茄果实的品质和产量造成严重威胁。目前,生产上防治低温危害的措施主要有耐寒品种的培育、低温炼苗、加强栽培管理以及改善棚室的保温能力等。其中,耐寒品种的成功培育可以较大程度地降低其它防治措施的经济成本和人力成本,因此筛选挖掘重要的低温调控基因对于番茄的种质培育和栽培管理都具有十分重要的意义。
3.在亚低温环境下,番茄植株的根系生长受阻,根系吸收水分和营养物质的能力大大降低,进而导致地上部生长发育迟缓,这对植株抗性的产生极为不利。同时,亚低温使光合作用co2同化相关的酶钝化,并进而导致光抑制,使植株受到氧化胁迫。已有研究发现,生长素、细胞分裂素、赤霉素、乙烯、脱落酸等植物激素均参与低温抗性的调控,其中脱落酸(abscisic acid,aba)是一种抑制生长的植物激素,因能使植物叶子脱落而得名。有大量研究表明aba与植物的休眠、促进器官的衰老与脱落、提高植物对非生物逆境的抗性等密切相关。因此aba在调控农作物的生长发育和抗逆育种等方面具有重要的研究意义和应用价值。
4.在高等植物体内,脱落酸的降解途径主要是通过aba的羟基化进行的,首先aba在细胞色素单加氧酶cyp707as的催化作用下生成红花菜豆酸(phaseic acid pa),然后pa会在红花菜豆酸还原酶(phaseic acid reductase,par)的作用下生成不具有生理活性的二氢红花菜豆酸(dihydro phaseic acid,dpa)。
5.crispr/cas9(clustered regularly interspaced short palindromic repeats-associated endonuclease 9)基因编辑技术可以对目标基因进行定点敲除,可以同时编辑多个位点,从而在短时间内将多个有益性状进行叠加,这对农作物的基因功能研究以及品种改良具有巨大的应用价值。
技术实现要素:
6.本发明提供了slcyp707a基因作为负调控因子在提高番茄亚低温抗性中的新用途,为培育抗亚低温的番茄品种提供了依据。
7.具体技术方案如下:
8.本发明提供了slcyp707a基因作为负调控因子在提高番茄亚低温抗性中的应用,所述slcyp707a基因为slcyp707a1基因和slcyp707a2基因中的至少一个;所述slcyp707a1
基因的核苷酸序列如seq id no.1所示,slcyp707a2基因的核苷酸序列如seq id no.2所示。
9.slcyp707a1基因的氨基酸序列如seq id no.3所示;slcyp707a2基因的氨基酸序列如seq id no.4所示。
10.敲除slcyp707a1或slcyp707a2基因对番茄常温(22℃/20℃)的生长表型无明显影响,但在亚低温(16℃/12℃)环境下,两个基因的单突变体根系生长明显强于对照组,而两个基因共同突变后,根系发育则更加旺盛;同时slcyp707a1和slcyp707a2基因单突变体和双突变体在亚低温下的地上部生物量和根冠比也都有明显的增加;亚低温处理后,slcyp707a1和slcyp707a2基因敲除植株抗性显著增强,主要表现为叶片最大光化学效率(fv/fm)提高,叶片相对电解质渗透率降低。
11.进一步地,所述应用的途径为通过敲除slcyp707a1基因或slcyp707a2基因获得单突变体,或者将slcyp707a1基因的单突变体和slcyp707a2基因的单突变体进行杂交获得纯合双突变体,使番茄突变体的亚低温抗性提高。
12.更进一步地,所述应用的途径为通过敲除slcyp707a1基因或slcyp707a2基因获得单突变体,或者将slcyp707a1基因的单突变体和slcyp707a2基因的单突变体进行杂交获得纯合双突变体,降低叶片相对电解质渗透率和/或最大光化学效率,从而提高番茄突变体的亚低温抗性。
13.进一步地,所述敲除的手段为crispr/cas9基因编辑技术。
14.本发明通过实验观察发现,slcyp707a1和slcyp707a2基因的单突变和双突变后,常温下的株高、茎粗、地上部和地下部的生物量无明显变化,但在亚低温处理后,与对照组相比,突变体材料根系生长更好,地上部生物量、地下部生物量以及根冠比均有明显增加,双突变体比单突变体长势更好。
15.本发明还通过抗性表型分析明确了slcyp707a1和slcyp707a2基因的单突变和双突变后植株抗性显著提高,表现为突变体与对照组相比,叶片最大光化学效率(fv/fm)提高,叶片相对电解质渗透率降低,并且双突变体的抗性要强于单突变体。该发现为利用aba降解关键基因cyp707as创制番茄抗低温种质提供了新的思路。
16.进一步地,所述应用包括以下步骤:
17.(1)设计slcyp707a基因的靶序列,构建crispr/cas9载体;
18.所述靶序列sgrna1的核苷酸序列如seq id no.5或seq id no.6所示;
19.(2)构建含步骤(1)所述crispr/cas9载体的农杆菌基因工程菌;
20.(3)将步骤(2)所述基因工程菌转化番茄子叶,获得不含外源cas9蛋白且稳定遗传的纯合单突变体株系。
21.进一步地,还包括步骤(4):将缺失slcyp707a1基因的单突变体和缺失slcyp707a2基因的单突变体进行杂交,获得f1代,自交得到f2代,通过测序技术从f2代分离群体中找到同时缺失slcyp707a1和slcyp707a2基因的纯合双突变体植株。
22.鉴于上述发现,可以以slcyp707a1和slcyp707a2基因的双突变体株系为父本,与性状优良但低温抗性有待改良的品种为母本进行杂交,再与母本进行多代回交后自交,在后代群体中可以筛选综合性状更加优良的品种。
23.与现有技术相比,本发明具有以下有益效果:
24.(1)本发明利用crispr/cas9基因编辑技术对slcyp707a1和slcyp707a2基因分别进行定点敲除构建了单突变体,并利用两个单突变体进行杂交,自交一代后从f2代分离出纯合的slcyp707a1和slcyp707a2双突变体材料,突变体材料在亚低温环境下生长和抗性更强。
25.(2)本发明利用基因编辑技术,获得了slcyp707a1和slcyp707a2基因的单突变体和双突变体,经一系列的生长表型观察和抗性实验验证,亚低温处理后与对照组番茄相比,slcyp707a1和slcyp707a2基因单突变体和双突变体地上部和地下部的生物量明显提高,根冠比增加,抗性增强。本发明不仅有助于深入理解逆境胁迫下aba对植物生长发育的调控功能及作用机制,结合杂交选育也可为亚低温下植株生长加强型番茄种质的培育提供新途径。
26.(3)本发明提供的应用方法可应用于普通番茄的低温抗性育种,具有高效快速,简便易行的优点。
附图说明
27.图1为实施例1中slcyp707a1和slcyp707a2基因在番茄不同组织部位的表达。
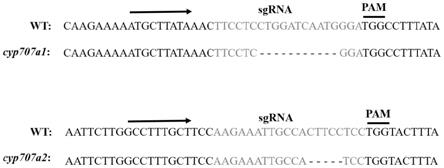
28.图2为crispr介导的slcyp707a1和slcyp707a2基因序列突变;其中,sgrna-slcyp707a1纯合子株系缺失11bp碱基,sgrna-slcyp707a2纯合子株系缺失5bp碱基。
29.图3为slcyp707a1和slcyp707a2基因单突变体和双突变体在常温和亚低温下的植株生长表型;其中,wt为野生型,以野生型番茄wt作为对照,cyp707a1和cyp707a2为单突变体;cyp707a1/a2为双突变体。
30.图4为slcyp707a1和slcyp707a2基因单突变体和双突变体在常温和亚低温下的各生长指标结果;其中,wt为野生型,以野生型番茄wt作为对照,cyp707a1和cyp707a2为单突变体;cyp707a1/a2为双突变体。
31.图5为slcyp707a1和slcyp707a2基因单突变体和双突变体在亚低温处理后的叶片最大光化学效率(fv/fm)和叶片电解质渗透率的结果;其中,以野生型番茄wt作为对照;实验采用随机设计,设置3个重复,每个重复使用6棵苗,数据使用sas软件进行分析,不同处理之间若存在显著差异(p《0.05),以不同的字母标注。
具体实施方式
32.下面结合具体实施例对本发明作进一步描述,以下列举的仅是本发明的具体实施例,但本发明的保护范围不仅限于此。
33.实施例1 qrt-pcr分析slcyp707a1和slcyp707a2基因在番茄不同组织器官中的表达
34.利用qrt-pcr研究slcyp707a1和slcyp707a2基因的表达模式。
35.具体方法如下:
36.利用480ii荧光定量pcr仪(roche,swiss)进行检测。反应体系详见2
×
sybr green supermix(vazyme)说明书。
37.slcyp707a1基因的特异性引物为(slcyp707a1-f:5'-gtccagggaatgaacttgcc-3';slcyp707a1-r:5'-ttgcagctagtccacccaat-3'),slcyp707a2基因的特异性引物为
(slcyp707a2-f:5'-ctcgggtcattcatgggaga-3';slcyp707a2-r:5'-agcagtagtgtctcgagctg-3')利用2-δδct
法计算基因相对表达水平。
38.结果发现:slcyp707a1和slcyp707a2基因在不同组织中均有表达,slcyp707a1在叶中表达量最高,其次为顶芽、侧芽、茎,在根中的表达量最低。slcyp707a2在根中表达量最高,而顶芽、侧芽、叶和茎中的表达量相对较低。
39.实施例2
40.一、slcyp707a1和slcyp707a2基因单突变体和双突变体的获取
41.为明确slcyp707a1和slcyp707a2基因缺失对番茄植株生长和低温抗性的影响,我们分别设计了slcyp707a1和slcyp707a2的靶标序列sgrna1和sgrna2,通过酶切连接构建pcambia1301-u6-26-sgrna1-slcyp707a1/a2-35s-cas9sk载体。上述载体通过遗传转化导入番茄植株,利用crispr/cas9技术分别敲除slcyp707a1和slcyp707a2来研究其功能。
42.具体步骤为:
43.利用crispr-p网站(http://cbi.hzau.edu.cn/cgi-bin/crispr)设计slcyp707a1基因的靶序列sgrna1:5'-ttcctcctggatcaatggga-3'和slcyp707a2基因的靶序列sgrna2:5'-aagaaattgccacttcctcc-3'。
44.将合成的sgrna1和sgrna2序列(单链)进行退火,形成双链sgrna,同时其两端具有bbs i限制性内切酶酶切位点。将形成的sgrna分别与通过bbs i限制性内切酶酶切的atu6-26sk载体进行连接,提取阳性质粒备用,命名u6-26-sgrna1-slcyp 707a1-sk和u6-26-sgrna1-slcyp707a2-sk。利用kpn i与sal i限制性内切酶对u6-26-sgrna1-slcyp707a1/a2-sk和35s-cas9sk载体进行双酶切,将各自酶切产物回收并连接。菌液pcr检测,测序验证阳性克隆,提取阳性质粒备用,命名为u6-26-sgrna1-slcyp707a1/a2-35s-cas9sk。
45.利用kpn i与xba i限制性内切酶对u6-26-sgrna1-slcyp707a1/a2-35s-cas9sk和pcambia1301载体进行双酶切,u6-26-sgrna1-slcyp707a1/a2-35s-cas9sk回收约6kb的条带,连接到酶切过的pcambia1301载体上。连接产物转化大肠杆菌dh5α感受态细胞,挑取单菌落,在含50mg/l卡那霉素(kan)的液体lb培养基中,37℃,200rpm振荡培养过夜。在pcambia1301载体的5’端设计引物进行菌液pcr检测(约550bp)。测序验证阳性克隆,提取阳性质粒,命名为pcambia1301-u6-26-sgrna1-slcyp707a1-35s-cas9sk和pcambia1301-u6-26-sgrna1-slcyp707a2-35s-cas9sk。
46.将上述载体转进gv3101农杆菌侵染普通番茄子叶,通过植物组织培养技术获得转化pcambia1301-u6-26-sgrna1-slcyp707a1/a2-35s-cas9sk敲除载体的抗性芽,生根培养后移栽,自交一代后,分离鉴定slcyp707a1和slcyp707a2基因纯合突变植株。
47.将slcyp707a1和slcyp707a2基因纯合突变植株进行杂交获得f1代,自交得到f2代,从分离群体中通过测序验证同时具有slcyp707a1和slcyp707a2基因纯合突变的植株作为双突变体留种用于后续实验研究。
48.二、slcyp707a1和slcyp707a2基因突变体在常温和亚低温下的生长表型观察和生长指标测定
49.在常温和亚低温下对slcyp707a1和slcyp707a2基因突变体的生长表型进行观察,并测定生长指标;
50.具体操作如下:
51.以普通(野生型,wt)番茄(solanum lycopersicum cv.condine red)和slcyp707a1和slcyp707a2基因单突变体和双突变体为实验材料。将种子浸泡在50℃温水15min,之后放置在28℃恒速摇床(200rpm/min)2天左右,每天换一次水,待种子胚根长至1cm左右时,播种于装有草炭:蛭石=2:1的72孔穴盘中。将穴盘放置于植物生长室,生长条件为:光周期12h/12h,环境温度22℃/20℃,相对湿度为75%左右,平均光强为200μmol m-2
s-1
。营养液为1/2hoagland营养液。待幼苗长到三叶一心时,将其单株移栽到塑料钵中培养,培养条件同上,一周后将移出的番茄苗平均分成两份。其中一批苗按照原来的培养条件,另一批苗转移至人工气候箱,光照,水肥等条件不变,环境温度为16℃/12℃,处理10后,同时对常温和亚低温处理的番茄苗进行观察与统计。
52.生长指标观察与测定方法:从每种材料中挑选长势一致的材料进行统计,株高统计以植株子叶开始,至顶芽的植株高度;茎粗统计利用游标卡尺测量一二叶节间茎的直径;生物量统计以根茎交界处为分割点,称量地上部与地下部的质量;根长的统计以根茎交界处为起始位置,束拢根系,最末端为终点测量长度;每个处理包含6个生物重复。
53.结果:slcyp707a1和slcyp707a2基因敲除番茄突变体常温下生长表型与对照组(wt)无明显差异,但在亚低温处理后表现为:植株地下部生物量,地上部生物量和根冠比增加。
54.三、slcyp707a1和slcyp707a2基因突变体在亚低温处理后的抗性指标观察与测定
55.为了探究亚低温环境对番茄slcyp707a1和slcyp707a2基因敲除突变体光合效率和叶片电解质渗透率的影响,对野生型(wt)和突变体植株进行16℃/12℃的亚低温处理。
56.相对电解质渗透率的测定:将叶片平行主叶脉剪成0.5cm宽的长条,称取0.2g放置在装有20ml ddh2o的50ml离心管中,在28℃恒温摇床(200rpm/min)孵育2h后,用数显电导率仪(dds-11a,杭州奥立龙仪器有限公司)测定其电导率为ec1。然后将装有样品的离心管放置在100℃水浴锅中半个小时,待冷却后再次测定电导率,测定值为ec2;最后计算相对电解质渗透率ec(%)=ec1/ec2
×
100%。
57.叶片最大光化学效率的测定:将番茄植株避光暗处理半个小时,选取从上往下第二、三节位叶片,利用imaging pam荧光成像系统(imag-max/l,germany)进行叶绿素荧光测定,得到最大光化学效率(fv/fm)等叶绿素荧光参数。
58.结果:与对照植株相比,slcyp707a1和slcyp707a2基因敲除突变体抗性明显提高,表现为叶片相对电解质渗透率降低,最大光化学效率(fv/fm)提高,双突变体比单突变体抗性更好。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1