用于检测牛流行热和牛流行热病毒的引物和探针及其应用
id no:1)。
16.优选地,所述探针经修饰后的荧光探针为:
17.cctgctggtgctgtttctaatatagcatga//i6famdt//idsp//ibhq1dt//cccgacatattatgt//ispc3。
18.一种用于检测牛流行热和/或牛流行热病毒的引物探针组合物,包含所述的引物和/或所述的探针。
19.优选地,包含所述的引物和所述的探针。
20.所述的引物和/或所述的探针在制备检测牛流行热和/或牛流行热病毒的试剂盒中的应用。
21.优选地,所述试剂盒为核酸扩增(era)试剂盒。
22.一种检测牛流行热和/或牛流行热病毒的试剂盒,含有所述的引物和/或所述的探针。
23.优选地,所述试剂盒为核酸扩增(era)试剂盒。
24.更优选地,含有激活剂和/或溶解剂。
25.进一步优选地,所述试剂盒的反应温度为38~42℃。
26.进一步更优选地,所述试剂盒的反应温度为42℃。
27.进一步优选地,试剂盒的反应体系:核苷酸序列如seq id no:1所示探针0.24~0.72μl、核苷酸序列如seq id no:8和seq id no:9所示引物各0.84~3.15μl、模板2μl、激活剂1~3μl、溶解剂20μl、ddh2o补足50.0μl。
28.进一步更优选地,核苷酸序列如seqid no:1所示探针0.48μl、核苷酸序列如seq id no:8和seq id no:9所示引物各2.1μl、模板2μl、激活剂2μl、溶解剂20μl、ddh2o补足50.0μl。
29.最优选地,一种检测牛流行热和/或牛流行热病毒的试剂盒,其组成为:
30.核苷酸如seq id no:8~9的上下游引物、核苷酸如seq id no:1的探针、溶解剂、激活剂。
31.探针befv-g-probe:
32.cctgctggtgctgtttctaatatagcatga//i6famdt//idsp//ibhq1dt//cccgacatattatgt//ispc3(seq id no:1);
33.上游引物era-g-f4:caagagggggaatggttaaaaagaatc(seq id no:8);
34.下游引物era-g-r4:tgccatttagggttacattaagcttt(seq id no:9)。
35.二、使用方法
36.反应条件为:
37.反应温度42℃;
38.反应体系:模板2μl、溶解剂20μl,激活剂(25mmol/ml)2μl,上游引物era-g-f4、下游引物era-g-r4溶液(10μmol/ml)各2.1μl,探针befv-g-probe溶液(10μmol/ml)0.48μl,ddh2o加至50μl。
39.三、结果判断
40.若所述样品出峰时间≤15min或ct值《35,判断为阳性,所述样品含有牛流行热病毒;若所述样品出峰时间≥20min或ct值≥35,判断为阴性,所述样品不含有牛流行热病毒。
41.与现有技术相比,本发明具有以下有益效果:
42.本发明利用era技术结合所述引物和探针建立了针对牛流行热病毒进行检测方法和检测试剂盒。扩增阶段搭配使用荧光恒温扩增仪,42℃恒温条件15分钟即可实现对目的片段的有效扩增,具有时间短、灵敏性高、特异性强和重复性好,成本低等优点,最低检测限为1.0
×
102copies/μl,与牛结节性皮肤病病毒(lsdv)、牛病毒性腹泻病毒(bvdv)、牛副流感病毒3型(bpiv3)、牛支原体、仙台病毒(sv)、肺炎克雷菌、沙门氏菌均无交叉反应,可应用于基层实验室环境下短时间高精度的befv的临床检测,具有很好的应用前景。
附图说明
43.图1为dna模版制备。
44.图2为era反应引物的选择。
45.图3为试剂盒的特异性检测结果。
46.图4为试剂盒的灵敏度检测结果。
47.图5为试剂盒的重复性检测结果。
具体实施方式
48.下面结合说明书附图及具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。
49.主要试剂与仪器
50.荧光型核酸扩增试剂盒(era法)购自苏州先达基因科技有限公司。dl2000 plus dna marker、aceq universal u+probe master mix v2购自南京诺唯赞生物科技有限公司。genstar 2
×
taq pcr starmix和loading dye购自广州康润生物公司。hs dna polymerase和pmd18-t vector cloning试剂盒购自takara公司。
51.病毒株与临床样品
52.牛结节性皮肤病病毒(lsdv)、牛病毒性腹泻病毒(bvdv)、牛副流感病毒3型(bpiv3)、牛支原体、仙台病毒(sv)、肺炎克雷菌、沙门氏菌均由本实验室保存。16份befv阳性核酸样品由本实验室保存。
53.实施例1dna标准质粒的制备
54.一、实验方法
55.以befv jm2020病毒cdna为模板,使用hs dna polymerase试剂盒,经过聚合酶链式反应后,获得g基因目的片段。
56.反应体系:5
×
primestar buffer各10μl,dntp mix(10mm)各1μl,primestar hs dna polymerase各0.5μl,上游(g-f)引物(10μmol/l)2.5μl、下游(g-r)引物(10μmol/l)2.5μl,模板30ng,ddh2o补足50μl。
57.g-f:atgttcagggtcctaataat,
58.g-r:ttaatgatcaaagaatctgt。
59.反应程序:98℃ 3min;98℃ 10s、55℃15s、72℃ 2min、35个循环;72℃延伸5min。
60.将纯化后的目的片段连接至pmd-18t载体后,送至生工生物工程(上海)股份有限公司进行测序。测序正确后,按照如下公式换算为拷贝数:
[0061][0062]
二、实验结果
[0063]
扩增获得片段为1872bp的特异性产物。将扩增片段纯化后,克隆到pmd18-t的载体上,进行体外扩增检测得出结果(图1),并测序正确后,命名为pmd18t-befv-g,作为dna标准质粒。
[0064]
实施例2era方法的引物
[0065]
一、实验方法
[0066]
1、探针引物设计
[0067]
收集ncbi上公布的befv全基因组序列,设计era引物和探针(表1),通过blast比对确定引物和探针的特异性,送生工生物工程(上海)股份有限公司合成标记。
[0068]
表1 era引物与探针序列:
[0069][0070]“i6-famdt”为6-fam荧光标记的dt核苷酸,“idsp”指引入dspace基团的碱基缺失,“ibhq1dt”为带有bhq1淬灭基团标记的dt核苷酸,“ispc3”指连接阻断基团c3 spacer。
[0071]
2、era引物的扩增
[0072]
(1)以实施例1构建的构建出的dna标准质粒pmd18t-befv-g为模版,将每对era引物,分别进行普通聚合酶链式反应扩增,比较各era引物对的扩增效果。
[0073]
反应体系:2
×
taq pcr starmix各10μl,上、下游引物(10μmol/l)各0.4μl,模板30ng,ddh2o补足20μl。
[0074]
反应程序:94℃ 2min;94℃ 30s、59℃30s、72℃ 45s、35个循环;72℃延伸5min。
[0075]
(2)以实施例1构建的构建出的dna标准质粒pmd18t-befv-g为模版,将每对era引物,分别进行常规era反应,比较各era引物对的扩增效果。
[0076]
反应体系:溶解剂(buffer)各20μl,上、下游引物(10μmol/l)各2.1μl,探针0.6μl,模板30ng,激活剂各2μl,ddh2o补足50μl。反应程序:37℃30min,每15s收集fam荧光信号。。
[0077]
二、实验结果
[0078]
结果显示(图2),进行普通聚合酶链式反应扩增,发现每对引物都具有良好的特异性;进行常规era反应,对每对era引物进行荧光检测,发现era-g-f4/r4(seq id no:8~9)引物对的扩增荧光强度高,起峰时间短,为最优引物对,进行后续实验。
[0079]
实施例3 era方法的反应条件
[0080]
一、实验方法
[0081]
根据era方法的试剂使用说明,确定温度、探针浓度、引物浓度、激活剂浓度是影响体系的反应的主要因素。为了确定era体系中4个因素中的最佳水平,采用l9(34)的正交方法,设计出方案(表2),其中引物和探针均为10μmol/l。
[0082]
表2 l9(34)实验方案
[0083][0084]
使用实施例2的era-g-f4/r4(seq id no:8~9)引物对和探针(seq id no:1),按照表2实验方案进行era反应后,每个组合重复4次。
[0085]
二、实验结果
[0086]
结果如表3显示,不同组实验结果扩增的效果存在着明显的差异,分析结果得出每个因素的最佳水平,得到最优反应条件为:
[0087]
反应温度42℃
[0088]
反应体系(50.0μl):溶解剂20μl,激活剂(25mmol/ml)2μl,上游、下游引物体积(10μmol/ml)各2.1μl,探针溶液(10μmol/ml)0.48μl,ddh2o加至50μl。
[0089]
表3极差分析表
[0090]
[0091]
实施例4一种era方法检测牛流行热的试剂盒
[0092]
一、组成
[0093]
核苷酸如seq id no:8~9的上下游引物、核苷酸如seq id no:8~9的探针、溶解剂、激活剂。
[0094]
探针befv-g-probe:
[0095]
cctgctggtgctgtttctaatatagcatga//i6famdt//idsp//ibhq1dt//cccgacatattatgt//ispc3(seq id no:1);
[0096]
上游引物era-g-f4:caagagggggaatggttaaaaagaatc(seq id no:8);
[0097]
下游引物era-g-r4:tgccatttagggttacattaagcttt(seq id no:9)。
[0098]
二、使用方法
[0099]
反应条件为:
[0100]
反应温度42℃,
[0101]
反应体系(50.0μl):模板dna 2μl、溶解剂20μl,激活剂(25mmol/ml)2μl,上游、下游引物体积(10μmol/ml)各2.1μl,探针溶液(10μmol/ml)0.48μl,ddh2o加至50μl。
[0102]
三、结果判断
[0103]
若所述样品出峰时间≤15min或ct值《35,判断为阳性,所述样品含有牛流行热病毒;若所述样品出峰时间≥20min或ct值≥35,判断为阴性,所述样品不含有牛流行热病毒。
[0104]
实施例5 era方法检测牛流行热的试剂盒的特异性
[0105]
一、实验方法
[0106]
使用实施例4的试剂盒对lsdv、bvdv、sv、牛支原体、肺炎克雷伯菌的的dna或cdna作为对照,以蒸馏水为空白对照,观察有无扩增曲线,检测方法的特异性。
[0107]
二、实验结果
[0108]
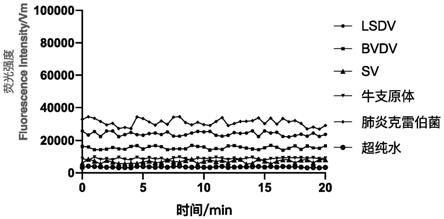
对lsdv、bvdv、sv、牛支原体、肺炎克雷伯菌的dna或cdna进行era方法的检测,ddh2o为阴性对照,使用实施例4的试剂盒进行检测。结果显示(图3),对其他5种牛病的dna或cdna无特异性扩增。可见该方法能够特异性的扩增befv。表明该试剂盒对befv有很好的特异性。
[0109]
实施例5era方法检测牛流行热的试剂盒的灵敏度
[0110]
一、实验方法
[0111]
将实施例1制备得到的pmd18t-befv-g dna标准质粒按10倍梯度稀释至106、105、104、103、102、101和100copies/μl。以各浓度梯度的pmd18t-befv-g为模板,同时加入蒸馏水作为空白对照。使用实施例4的试剂盒进行检测,以测试其灵敏度。
[0112]
二、实验结果
[0113]
以1.0
×
107~1.0
×
100copies/μl浓度梯度的pmd18t-befv-g质粒为模板,使用实施例4的试剂盒进行检测。结果显示检测出现结果所花时间分别为7min内、7.5min内、8min内、8.5min内、9min内、13min、15.5min内,1.0
×
101和1.0
×
100浓度模板未扩增。实施例4的试剂盒对质粒的检测限均为1.0
×
102copies/μl(图4)。
[0114]
实施例5 era方法检测牛流行热的试剂盒的重复性和稳定性
[0115]
一、实验方法
[0116]
将实施例1制备得到的pmd18t-befv-g dna标准质粒按10倍梯度稀释至05、104、和
103copies/μl。以各浓度梯度的pmd18t-befv-g为模板,同时加入蒸馏水作为空白对照。使用实施例4的试剂盒进行检测,每个浓度进行5次重复试验。根据荧光曲线出现的时间计算其变异系数。
[0117]
二、实验结果
[0118]
为了评估上述建立方法的稳定性和重复性,选取4个浓度的质粒模板分别进行5次重复性试验,变异系数结果均小于10%,建立的era方法检测牛流行热的试剂盒具有良好的重复性(图5)。
[0119]
实施例6 era方法检测牛流行热的试剂盒临床样本的检测
[0120]
一、实验方法
[0121]
以15份阳性临床dna样品和5份阴性临床dna样品为模板,使用实施例4的试剂盒进行检测(era-befv),同时使用real-time pcr方法(real-time pcr-befv)检测作为对照,将两种方法结果进行对比分析。
[0122]
real-time pcr的反应体系为:480probes master(2
×
conc)10μl,10μmol/l上游引物、下游引物各1μl,0.5pl探针,ddh2o 5.5μl,模板2μl,总体积20μl。
[0123]
real-time pcr的反应条件为:95℃ 5min;95℃ 20s,53℃ 30s,72℃ 20s,40个循环,53℃收集荧光。
[0124]
real-time pcr的引物为:上游引物:tcattgataagaagatggc,下游引物为:tggttccacaaagatcattc,探针为:(fam)agcttcctcctgctggtgc(bhq1)。
[0125]
二、实验结果
[0126]
结果显示阳性检出率为100%,real-time pcr方法的检出率为100%。era方法与real-time pcr方法检出率保持一致(表4)。
[0127]
表4:
[0128][0129]
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,对于本领域的普通技术人员来说,在上述说明及思路的基础上还可以做出其它不同形式的变化或变动,这里无需也无法对所有的实施方式予以穷举。凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明权利要求的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1