一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法与流程
一种绿叶蔬菜食品加工用
α-淀粉酶制剂的高效纯化方法
技术领域
1.本发明属于食品加工技术领域,具体为一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法。
背景技术:
2.食品加工指直接以农、林、牧、渔业产品为原料进行的谷物磨制、饲料加工、植物油和制糖加工、屠宰及肉类加工、水产品加工,以及蔬菜、水果和坚果等食品的加工活动,是广义农产品加工业的一种类型;近年,我国农副食品加工业有了较快的发展,已成为具有较强发展潜力的产业;而食品加工用的淀粉酶制剂是直链淀粉消化酶的旧称,其主体直链淀粉(amy l oce)的水解酶称为淀粉酶(amy l a-ce);现在这名称往往用于从植物(如麦芽)和微生物(如曲霉)所获得的粗酶制剂,也就是说多用于各种多糖、蛋白质、核酸、脂肪分解的混合物。
3.目前,α-淀粉酶制剂的利用领域非常广泛,主要包括工业生产、食品加工、饲料制备以及医药科技研究等领域,而不同领域对于α-淀粉酶制剂的纯度要求也有所区别,而尽管现有的α-淀粉酶制剂纯化方法很多,且均能够达到符合某需求的纯化效果,但由于现有的α-淀粉酶制剂纯化操作均是由线下实验进行,这样不仅实验效率极低而且实验中的危险隐患以及实验误差均难以避免,而且操作步骤更为繁琐等,因此需要研发一种食品加工用α-淀粉酶制剂的线上高效纯化方法。
技术实现要素:
4.本发明的目的在于提供一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法,以解决上述背景技术中提出的问题。
5.为了实现上述目的,本发明提供如下技术方案:一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法,食品加工用α-淀粉酶制剂的智能化在线高效纯化主要包括有以下步骤:
6.s1.发酵液培养:将提取的地衣芽孢杆菌以及hy-3菌株接种到种子培养基的摇瓶内进行20-24h培养,2%接种量接种至发酵培养基,并设定培养基环境温度为36-39℃,培养32-38h;
7.s2.酶液制备:将上述获取的发酵液在8000r/min状态下离心20分钟,并收集上清液即为粗酶液;
8.s3.固液分离:将上述粗酶液经离心、过滤得到菌体(胞内酶)和液体(胞外酶);
9.s4.纯化提取:再将上述菌体(胞内酶)进行内细胞进行破碎得到混合液,最后将处理后的菌体混合液至于5000-6500r/min环境下离心20min得到液体(胞外酶),该操作相较于现有技术中对于α-淀粉酶制剂的纯化有提高酶液利用率以及酶液纯度的效果,从而不仅使实验人员能够获取更多的胞外酶,从而提高实验对试剂原料的利用率;
10.s5.盐析:将s3和s4中获取的(胞外酶)液体分装至三只相同的烧杯中,每支20ml,
然后加入硫酸铵至上述三只烧杯中,并使其饱和度分别为40%、60%和80%;
11.s6.脱盐浓缩:将上述沉淀用0.2mol/lph6.8pbs缓冲液回溶处理,再将其移入透析袋中,经透析膜袋在20倍量0.02mol/l磷酸缓冲液中进行36h透析脱盐。
12.优选的,在酶的分离纯化过程中s1-s4均需要测定酶的活力以及体积,以便于准确计算酶的总活力和比活力,通过对总活力和比活力的测算可以有利于计算酶活力的回收率以及纯化倍数,以便于监测s1-s4中酶的回收和纯化效果。
13.优选的,s1中发酵培养基至于150-180r/min的离心机内培养,通过将发酵培养基至于离心状态下培养可以促进接种菌种的移动效率,即可提高其活动范围,进而可以进一步促进其活性的增强,从而使其培养效果以及培养效率增强。
14.优选的,s3中对粗酶液进行离心、过滤的具体操作为:首先将s2中获取的粗酶液在5000r/min的离心状态下处理15-20min,再将离心液进行初步过滤;然后将滤液至于3000r/min的离心状态下处理10-15min,最后再利用目数更低的滤网进行过滤即可,该操作可以有效提高过滤效果,从而提高纯度,同时也可以达到进一步提高粗酶提取也的利用率。
15.优选的,s5中需要缓慢加入硫酸铵,而且加注的同时需要不断地轻柔搅拌,该操作可以提高加注硫酸铵后溶解的效率,同时也可以避免硫酸铵加注到烧杯内后由于局部堆而浓度过大而导致酶失活的情况。
16.优选的,s5中制得的三杯混合液需要在25-30℃环境下静置2h,直至出现白色沉淀即可。
17.优选的,s6中进行36h透析脱盐(环境ph为7)时每过6h换一次透析液,取各梯度脱盐沉淀5ml并在6000r/min状态下离心20min,最后取其上清测酶活,按相同时间进行分段处理,可以使得实验过程中透析袋内部环境保持不变,而取各梯度进行操作可以便于实验人员测得酶活性的平均值,同时也可以有效提高测得数据的可靠性。
18.优选的,s6中透析袋使用前的处理包括有以下步骤:
19.a1.在250ml的玻璃烧杯中加入200ml透析袋处理液,并将其至于微波炉内预热;
20.a2.根据实际使用需要将通用透析袋裁剪成合适的尺寸,并将其至于上述预热后的烧杯内,再将烧杯至于电炉上煮沸持续10min;
21.a3.取出用蒸馏水洗净后,再用65-80℃蒸馏水蒸煮10min;
22.a4.冷却后即可使用,或至于ph为7的磷酸缓冲液中保存;
23.a5.最后扎紧透析袋一端,注入清水检查其密封性后再加注低于透析袋体积1/2的透析溶液即可,通过对透析袋的处理可以有效避免污染,同时也有利于后期注入处理后的沉淀物时使其能够快速适应透析袋的环境,从而使其活性更加稳定。
24.优选的,将s1-s6操作步骤以及相关参数均输入计算机系统,需要对α-淀粉酶进行符合实际使用需求的纯度纯化时,运行上述s1-s6的步骤,并输入相关参数值,通过对系统的运行自动进行纯度循环提升,并将每次提升的数值与预期至进行对照,直至纯度达到预期值,通过运行系统自动进行数据测算,不仅可以有效避免各种实验误差,提高实验精准度,同时也极大的提高实验的安全性,而且可以有效提高纯化实验的效率;而实验期间也可以自动对实验数据进行记录,以减少试验期间实验人员手动记录的繁琐,同时也便于实验后实验人员随时对数据进行分析。
25.本发明的有益效果如下:
26.1、本发明通过将纯化步骤输入系统,不仅可以提高各实验步骤的运行效率,从而有效缩短整个实验期间对时间的消耗,而且运行系统进行实验可以有效避免线下实验带来的安全隐患,同时运行线上系统进行实验可以方便对实验参数进行调节,减少实验误差,提高实验精确性,而且可以便于重复实验,从而进一步提高纯化效率。
附图说明
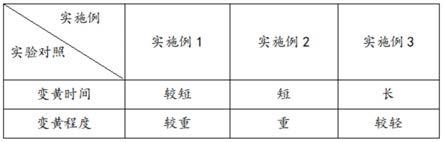
27.图1为本发明实施例的实验结果对照表;
28.根据附图可知:分别取实施例1-3纯化后获得的α-淀粉酶制剂等量,并取三组相同蔬菜进行处理,然后利用三组α-淀粉酶制剂分别对三组处理后的绿叶蔬菜进行处理,一段时间后观察三组蔬菜变化即可得出图1表中的数据,因此通过s1-s6步骤纯化后的α-淀粉酶制剂,在实施例三数据下纯化后的α-淀粉酶制剂后期实际使用效果最佳,说明该状态下纯化效果最佳,且纯化后污染最好,确保α-淀粉酶制剂能够保持较高的活性。
具体实施方式
29.下面将结合本发明实施例以及附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
30.本发明实施例中,一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法,食品加工用α-淀粉酶制剂的智能化在线高效纯化主要包括有以下步骤:
31.s1.发酵液培养:将提取的地衣芽孢杆菌以及hy-3菌株接种到种子培养基的摇瓶内进行20-24h培养,2%接种量接种至发酵培养基,并设定培养基环境温度为36-39℃,培养32-38h;
32.s2.酶液制备:将上述获取的发酵液在8000r/min状态下离心20分钟,并收集上清液即为粗酶液;
33.s3.固液分离:将上述粗酶液经离心、过滤得到菌体(胞内酶)和液体(胞外酶);
34.s4.纯化提取:再将上述菌体(胞内酶)进行内细胞进行破碎得到混合液,最后将处理后的菌体混合液至于5000-6500r/min环境下离心20min得到液体(胞外酶),该操作相较于现有技术中对于α-淀粉酶制剂的纯化有提高酶液利用率以及酶液纯度的效果,从而不仅使实验人员能够获取更多的胞外酶,从而提高实验对试剂原料的利用率;
35.s5.盐析:将s3和s4中获取的(胞外酶)液体分装至三只相同的烧杯中,每支20ml,然后加入硫酸铵至上述三只烧杯中,并使其饱和度分别为40%、60%和80%;
36.s6.脱盐浓缩:将上述沉淀用0.2mol/lph6.8pbs缓冲液回溶处理,再将其移入透析袋中,经透析膜袋在20倍量0.02mol/l磷酸缓冲液中进行36h透析脱盐。
37.其中,在酶的分离纯化过程中s1-s4均需要测定酶的活力以及体积,以便于准确计算酶的总活力和比活力,通过对总活力和比活力的测算可以有利于计算酶活力的回收率以及纯化倍数,以便于监测s1-s4中酶的回收和纯化效果。
38.其中,s1中发酵培养基至于150-180r/min的离心机内培养,通过将发酵培养基至于离心状态下培养可以促进接种菌种的移动效率,即可提高其活动范围,进而可以进一步
促进其活性的增强,从而使其培养效果以及培养效率增强。
39.其中,s3中对粗酶液进行离心、过滤的具体操作为:首先将s2中获取的粗酶液在5000r/min的离心状态下处理15-20min,再将离心液进行初步过滤;然后将滤液至于3000r/min的离心状态下处理10-15min,最后再利用目数更低的滤网进行过滤即可,该操作可以有效提高过滤效果,从而提高纯度,同时也可以达到进一步提高粗酶提取也的利用率。
40.其中,s5中需要缓慢加入硫酸铵,而且加注的同时需要不断地轻柔搅拌,该操作可以提高加注硫酸铵后溶解的效率,同时也可以避免硫酸铵加注到烧杯内后由于局部堆而浓度过大而导致酶失活的情况。
41.其中,s5中制得的三杯混合液需要在25-30℃环境下静置2h,直至出现白色沉淀即可。
42.其中,s6中进行36h透析脱盐(环境ph为7)时每过6h换一次透析液,取各梯度脱盐沉淀5ml并在6000r/min状态下离心20min,最后取其上清测酶活,按相同时间进行分段处理,可以使得实验过程中透析袋内部环境保持不变,而取各梯度进行操作可以便于实验人员测得酶活性的平均值,同时也可以有效提高测得数据的可靠性。
43.其中,s6中透析袋使用前的处理包括有以下步骤:
44.a1.在250ml的玻璃烧杯中加入200ml透析袋处理液,并将其至于微波炉内预热;
45.a2.根据实际使用需要将通用透析袋裁剪成合适的尺寸,并将其至于上述预热后的烧杯内,再将烧杯至于电炉上煮沸持续10min;
46.a3.取出用蒸馏水洗净后,再用65-80℃蒸馏水蒸煮10min;
47.a4.冷却后即可使用,或至于ph为7的磷酸缓冲液中保存;
48.a5.最后扎紧透析袋一端,注入清水检查其密封性后再加注低于透析袋体积1/2的透析溶液即可,通过对透析袋的处理可以有效避免污染,同时也有利于后期注入处理后的沉淀物时使其能够快速适应透析袋的环境,从而使其活性更加稳定。
49.其中,将s1-s6操作步骤以及相关参数均输入计算机系统,需要对α-淀粉酶进行符合实际使用需求的纯度纯化时,运行上述s1-s6的步骤,并输入相关参数值,通过对系统的运行自动进行纯度循环提升,并将每次提升的数值与预期至进行对照,直至纯度达到预期值,通过运行系统自动进行数据测算,不仅可以有效避免各种实验误差,提高实验精准度,同时也极大的提高实验的安全性,而且可以有效提高纯化实验的效率;而实验期间也可以自动对实验数据进行记录,以减少试验期间实验人员手动记录的繁琐,同时也便于实验后实验人员随时对数据进行分析。
50.实施例1
51.一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法,食品加工用α-淀粉酶制剂的智能化在线高效纯化主要包括有以下步骤:
52.s1.发酵液培养:将提取的地衣芽孢杆菌以及hy-3菌株接种到种子培养基的摇瓶内进行21-24h培养,2%接种量接种至发酵培养基,并设定培养基环境温度为37-39℃,培养34-38h;
53.s2.酶液制备:将上述获取的发酵液在8000r/min状态下离心20分钟,并收集上清液即为粗酶液;
54.s3.固液分离:将上述粗酶液经离心、过滤得到菌体(胞内酶)和液体(胞外酶);
55.s4.纯化提取:再将上述菌体(胞内酶)进行内细胞进行破碎得到混合液,最后将处理后的菌体混合液至于5500-6500r/min环境下离心20min得到液体(胞外酶);
56.s5.盐析:将s3和s4中获取的(胞外酶)液体分装至三只相同的烧杯中,每支20ml,然后加入硫酸铵至上述三只烧杯中,并使其饱和度分别为40%、60%和80%;
57.s6.脱盐浓缩:将上述沉淀用0.2mol/lph6.8pbs缓冲液回溶处理,再将其移入透析袋中,经透析膜袋在20倍量0.02mol/l磷酸缓冲液中进行36h透析脱盐。
58.实施例2
59.一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法,食品加工用α-淀粉酶制剂的智能化在线高效纯化主要包括有以下步骤:
60.s1.发酵液培养:将提取的地衣芽孢杆菌以及hy-3菌株接种到种子培养基的摇瓶内进行20-22h培养,2%接种量接种至发酵培养基,并设定培养基环境温度为36-38℃,培养32-36h;
61.s2.酶液制备:将上述获取的发酵液在8000r/min状态下离心20分钟,并收集上清液即为粗酶液;
62.s3.固液分离:将上述粗酶液经离心、过滤得到菌体(胞内酶)和液体(胞外酶);
63.s4.纯化提取:再将上述菌体(胞内酶)进行内细胞进行破碎得到混合液,最后将处理后的菌体混合液至于5000-6200r/min环境下离心20min得到液体(胞外酶);
64.s5.盐析:将s3和s4中获取的(胞外酶)液体分装至三只相同的烧杯中,每支20ml,然后加入硫酸铵至上述三只烧杯中,并使其饱和度分别为40%、60%和80%;
65.s6.脱盐浓缩:将上述沉淀用0.2mol/lph6.8pbs缓冲液回溶处理,再将其移入透析袋中,经透析膜袋在20倍量0.02mol/l磷酸缓冲液中进行36h透析脱盐。
66.实施例3
67.一种绿叶蔬菜食品加工用α-淀粉酶制剂的高效纯化方法,食品加工用α-淀粉酶制剂的智能化在线高效纯化主要包括有以下步骤:
68.s1.发酵液培养:将提取的地衣芽孢杆菌以及hy-3菌株接种到种子培养基的摇瓶内进行23h培养,2%接种量接种至发酵培养基,并设定培养基环境温度为37℃,培养35h;
69.s2.酶液制备:将上述获取的发酵液在8000r/min状态下离心20分钟,并收集上清液即为粗酶液;
70.s3.固液分离:将上述粗酶液经离心、过滤得到菌体(胞内酶)和液体(胞外酶);
71.s4.纯化提取:再将上述菌体(胞内酶)进行内细胞进行破碎得到混合液,最后将处理后的菌体混合液至于5800r/min环境下离心20min得到液体(胞外酶);
72.s5.盐析:将s3和s4中获取的(胞外酶)液体分装至三只相同的烧杯中,每支20ml,然后加入硫酸铵至上述三只烧杯中,并使其饱和度分别为40%、60%和80%;
73.s6.脱盐浓缩:将上述沉淀用0.2mol/lph6.8pbs缓冲液回溶处理,再将其移入透析袋中,经透析膜袋在20倍量0.02mol/l磷酸缓冲液中进行36h透析脱盐。
74.需要说明的是,在本文中,诸如第一和第二等之类的关系术语仅仅用来将一个实体或者操作与另一个实体或操作区分开来,而不一定要求或者暗示这些实体或操作之间存在任何这种实际的关系或者顺序。而且,术语“包括”、“包含”或者其任何其他变体意在涵盖非排他性的包含,从而使得包括一系列要素的过程、方法、物品或者设备不仅包括那些要
素,而且还包括没有明确列出的其他要素,或者是还包括为这种过程、方法、物品或者设备所固有的要素。
75.尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1