一种α-松油醇的合成方法与流程
一种
α-松油醇的合成方法
技术领域
1.本发明属于精细化工技术领域,具体涉及一种α-松油醇的合成方法。
背景技术:
2.松油醇又称萜品醇,可以指至少四种分子式为c
10h18
o的单环萜醇类化合物,分别为α-、β-、γ-和δ-松油醇。松油醇的应用较为广泛。松油醇具有紫丁香味,它的甲酸酯和乙酸酯可用来配制香精,也可用作医药、塑料、肥皂、农药的原料,又可以作为油墨工业中玻璃器皿上色彩的溶剂。纯品为无色透明液体,有不同的特征性气味,是一种日用化工中广泛使用的重要香料,同时在肥皂、医药、塑料、选矿、电讯和仪表工业中也有广泛应用。商品松油醇其实是α-松油醇、β-松油醇和γ-松油醇的混合物,主要以α-松油醇为主。松油醇存在于多种天然精油当中,但含量都不高,靠天然精油分离提纯显然不现实。
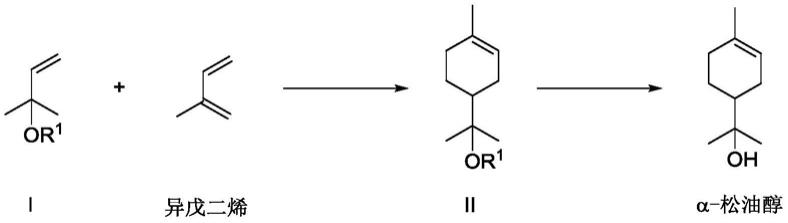
3.目前工业生产松油醇的方法有两种:一是两步法即传统法,以α-蒎烯或松节油为原料,在硫酸催化下经水合反应先制得水合萜二醇,再经硫酸或磷酸等脱水制得,该工艺存在生产周期长、能耗高、液体酸对设备腐蚀较重、生产成本较高等缺点。第二种是一步法,以工业蒎烯或用松节油在酸催化作用下直接水合生成松油醇,由于该法减少生产步骤,反应温度不高,操作方便,成为当前合成松油醇主要方法。
4.一步法中固体酸由于在催化反应中具有制备方法简便、可重复使用、不腐蚀设备和不污染环境等优点被广泛研究,包括无机超强酸、离子交换树脂、分子筛、杂多酸法等常见的固体酸催化剂皆被用于松油醇的合成。但固体酸催化剂普遍存在反应转化率或选择性不高的缺点,通常需要负载氯乙酸、三氯乙酸等活性组分,或者直接使用氯乙酸做辅助催化剂,但是同样还是存在催化剂酸位分布不均匀、活性组分容易流失、循环能力差、热稳定性较差和制备重现性差等缺点。
5.另外虽然一步法的原料松节油我国资源丰富,但是近年来随着人力成本的增高,松节油的价格就出现过较大的波动,从而导致下游α-松油醇成本的增加。综合以上,随着α-松油醇下游行业的快速发展,特别是香料行业的大量需求,对α-松油醇的需求量逐年增长。目前人工合成α-松油醇的路线具有居多缺点,因此使用其他便宜易得原料,开发出新路线来合成α-松油醇具有重要意义。
技术实现要素:
6.本发明提供一种α-松油醇的合成方法,该方法原料便宜易得、反应温度低、操作简单、选择性高、产率高。
7.为实现上述发明目的和达到上述技术效果,本发明的采用的技术方案如下:
8.一种α-松油醇的合成方法,所述方法包含以下步骤:
9.s1:化合物2-甲基-3-丁烯-2-醇酯i和异戊二烯,在路易斯酸和有机磷酸组成的双酸催化剂催化下,进行diels-alder反应得到α-松油醇酯粗品;
10.s2:α-松油醇酯粗品和水在碱作用下发生水解反应生成α-松油醇粗品;
11.任选地,s3:将s2所得α-松油醇粗品通过调节ph、分液、洗涤以及减压精馏得到α-松油醇产品;
[0012][0013]
其中,r1选自为烷基羧酸酰基、烷基碳酸酰基、烷基磺酸酰基、烷基磷酸酰基、苯基羧酸酰基、取代苯基羧酸酰基、苯基碳酸酰基、取代苯基碳酸酰基、苯基磺酸酰基、取代苯基磺酸酰基、苯基磷酸酰基、取代苯基磷酸酰基中的一种,优选三氟甲磺酸酰基。
[0014]
上述反应示意如下:
[0015][0016]
在一种实施方案中,底物i-1在路易斯酸和有机磷酸的双酸催化剂以及其中的拉电子基团的双重作用下被活化,很容易和富电子的底物异戊二烯发生diels alder反应得到α-松油醇三氟甲磺酸酯ii-1的粗品,再通过简单的水解反应即可得到α-松油醇。示例性的,上述方法的反应式为:
[0017][0018]
本发明中,s1所述路易斯酸为氯化钛、氟化钛、氯化锌、氯化镁、碘化镁、溴化镁、三氟甲基磺酸钪、三氟甲基磺酸镱、三氟甲基磺酸铟、三氟甲基磺酸铜、溴化铟、氯化铟和氟化铟中的一种或多种,优选氯化铟和/或氟化铟;优选地,所述路易斯酸与异戊二烯的摩尔比为0.01-0.1:1,优选为0.025-0.05:1。
[0019]
本发明中,s1所述催化剂为式iii的有机磷酸催化剂,优选式iii-1的有机磷酸催化剂:
[0020][0021]
其中,r2、r3、r4、r5为c1-c40的烷基、c3-c12的环烷基、带有取代基的c3-c12环烷基、苯基、取代苯基、苄基、取代苄基、含一个或二个以上氧、硫、氮原子的五元或六元杂环芳香基团、酯基中的一种或多种;
[0022]
其中,带有取代基的c3-c12环烷基、取代苯基、取代苄基的取代基分别为 c1-c40烷基、c1-c40的烷氧基、卤素、硝基、酯基、氰基中的一种或多种;
[0023]
优选地,所述有机磷酸与异戊二烯的摩尔比为0.02-0.2:1,优选为0.04-0.1:1。
[0024]
本发明中,s1所述2-甲基-3-丁烯-2-醇酯i和异戊二烯的摩尔比为0.5-10:1,优选1-1.2:1。
[0025]
本发明中,所述s1的反应温度为30-120℃,优选50-60℃;反应时间为0.5-5h,优选1-2h。
[0026]
本发明中,s1反应后将反应液进行水洗分液,得到α-松油醇酯粗品。
[0027]
本发明中,s2所述碱为三乙胺、叔丁醇钾、koh、naoh、k2co3、na2co3、 nahco3中的一种或多种,优选naoh和/或koh。
[0028]
本发明中,s2所述碱与α-松油醇酯ii的摩尔比为1-5:1,优选为1-2:1。
[0029]
本发明中,s2所述α-松油醇酯ii和水的摩尔比为1-10:1,优选3-5:1。
[0030]
本发明中,所述s2的反应温度为5-60℃,优选25-35℃;反应时间为0.5-2.5h,优选1-1.5h。
[0031]
本发明的另一目的在于提供一种α-松油醇。
[0032]
一种α-松油醇,采用上述的α-松油醇的合成方法制备获得。
[0033]
本发明中,如无特别说明所说压力均为绝压。
[0034]
与现有技术相比较,本发明技术方案积极效果在于:
[0035]
1)目前工业上合成α-松油醇主要以α-蒎烯或松节油为原料,通过一步或者两步来合成,目前主流工艺还是以布朗斯特酸催化剂为主,具有反应速度快而难以控制、选择性差、液体酸对设备腐蚀较重、生产成本较高、废水多等缺点。而通过本发明新的合成路线,可以高转化率(优选条件下达到95%)和高选择性(优选条件下达到95%)的合成α-松油醇,副产物很少,产品的提纯非常简单,并且反应不使用强酸,对反应设备要求低。
[0036]
2)本新路线使用的原料,均是大宗原料,价格便宜,容易获得,而传统路线由于原料松节油是天然来源,容易受到各种因素的影响,导致下游松油醇产品的价格波动较大。
[0037]
具体实施方法
[0038]
以下通过具体实施例对本发明方法做进一步说明,但本发明不限于所列出的实施例,还应包括在本发明的权利要求范围内其他任何公知的改变。
[0039]
分析仪器:
[0040]
1)核磁共振波谱仪型号:bruker advanceⅲ400,400mhz,c6d6或者 cdcl3作溶剂;
[0041]
2)气相色谱仪:agilent7890,db-5分离柱,气化室温度280℃,检测器温度310℃,温度升温程序,起始温度40℃,恒温7min,以3℃/min升温至190℃,以20℃/min升温至310℃,恒温10min。
[0042]
主要原料信息:
[0043]
2-甲基-3-丁烯-2-醇、异戊二烯、n-苯基双(三氟甲磺酰亚胺)、苯甲酰氯、碳酸二甲酯、二甲基磷酰氯,化学纯度≥98%,阿拉丁试剂有限公司;
[0044]
氢化钠,化学纯度60%,分散于矿物油,阿拉丁试剂有限公司;
[0045]
氟化铟、氯化锌、三氟甲基磺酸钪、溴化镁、三乙胺、叔丁醇钾、氢氧化钾、氢氧化钠、松节油,化学纯度≥99%,阿拉丁试剂有限公司;
[0046]
有机膦酸iii-1、iii-2、iii-3、iii-4,化学纯度》99%,百灵威试剂有限公司;
[0047]
二氯甲烷、四氢呋喃、正丙醇,化学纯度》99.5%,阿拉丁试剂有限公司;
[0048]
强酸性阳离子交换树脂,化学纯度》98%,上海南开树脂有限公司。
[0049]
主要合成设备:三口玻璃烧瓶、夹套四口玻璃瓶、加热制冷恒温循环机、恒温油浴锅、schlenk圆底烧瓶、耐压釜。
[0050]
实施例i
[0051]
合成化合物i-1。
[0052][0053]
在烧瓶中加入2-甲基-3-丁烯-2-醇(2.4mol)和700ml四氢呋喃,将体系冷至0℃后,氮气保护下,分批加入nah(60%矿物油,2.4mol),然后将体系缓慢升至室温,继续反应30min,然后缓慢滴加n-苯基双(三氟甲磺酰亚胺)(2.4mol) 和300ml四氢呋喃的混合溶液,滴加完毕后,室温下继续反应2h。然后将混合物冷却至0℃,缓慢加水淬灭反应,使用二氯甲烷萃取,分出有机相,用饱和食盐水洗涤,无水硫酸钠干燥,在50℃、80hpa条件下除去溶剂,最后在100℃、 5hpa条件下通过减压蒸馏进一步提纯得到产物2-甲基-3-丁烯-2-醇三氟甲基磺酸酯i-1(产率98%)。表征结果为:1h nmr(400mhz,c6d6):δ1.33(s,6h), 5.28-5.29(m,2h),5.85(t,1h)。
[0054]
实施例ii
[0055]
合成化合物i-2。
[0056][0057]
在烧瓶中加入2-甲基-3-丁烯-2-醇(2.4mol)、苯甲酰氯(2.4mol)和1000ml 二氯甲烷,将体系冷至0℃后,氮气保护下,缓慢滴加三乙胺(2.4mol)的300ml 二氯甲烷混合溶液,滴加完毕后,升值室温继续反应1h。用饱和食盐水洗涤,无水硫酸钠干燥,在50℃、80hpa条件下除去溶剂,最后在90℃、10hpa条件下通过减压蒸馏进一步提纯得到产物2-甲基-3-丁烯-2-醇苯甲酸酯ii-2(产率96%)。
[0058]
实施例iii
[0059]
合成化合物i-3。
[0060][0061]
在烧瓶中加入2-甲基-3-丁烯-2-醇(2.4mol)和700ml四氢呋喃,将体系冷至0℃后,氮气保护下,分批加入nah(60%矿物油,2.4mol),然后将体系缓慢升至室温,继续反应30min,然后缓慢滴加碳酸二甲酯(2.4mol)和300ml 四氢呋喃的混合溶液,滴加完毕后,室温下继续反应12h。然后将混合物冷却至 0℃,缓慢加水淬灭反应,使用二氯甲烷萃取,分出有机相,用饱和食盐水洗涤,无水硫酸钠干燥,在50℃、80hpa条件下除去溶剂,最后在60℃、20hpa条件下通过减压蒸馏进一步提纯得到产物2-甲基-3-丁烯-2-醇碳酸酯i(产率93%)。
[0062]
实施例iv
[0063]
合成化合物i-4。
[0064][0065]
在烧瓶中加入2-甲基-3-丁烯-2-醇(2.4mol)和700ml四氢呋喃,将体系冷至0℃后,氮气保护下,分批加入nah(60%矿物油,2.4mol),然后将体系缓慢升至室温,继续反应30min,然后缓慢滴加二甲基磷酰氯(2.4mol)和300ml 四氢呋喃的混合溶液,滴加完毕后,室温下继续反应2h。然后将混合物冷却至 0℃,缓慢加水淬灭反应,使用二氯甲烷萃取,分出有机相,用饱和食盐水洗涤,无水硫酸钠干燥,在50℃、80hpa条件下除去溶剂,最后在80℃、10hpa条件下通过减压蒸馏进一步提纯得到产物2-甲基-3-丁烯-2-醇二甲基磷酸酯i-4(产率 91%)。
[0066]
实施例1
[0067]
合成化合物α-松油醇酯ii-1和α-松油醇。
[0068]
氮气保护下,在耐压反应釜中加入金属盐氟化铟(0.03mol,3mol%)、有机磷酸iii-1(0.05mol,5mol%)以及2-甲基-3-丁烯-2-醇三氟甲磺酸酯i-1(1.2mol,1.2equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到55℃继续反应1h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯ii-1的粗品,然后通过气相内标法分析,异戊二烯转化率为97%,选择性为98%。
[0069]
取上述α-松油醇酯ii-1(1mol,1equiv)的粗品和水(4mol,4equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入三乙胺(1.5mol, 1.5equiv),将上述体系加热到30℃继续反应1.5h。停止反应,冷却到室温,使用2mol/l稀盐酸调节体系的ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-1转化率为95%,选择性为96%。所得油相在120℃、10hpa条件下进一步减压蒸馏可得到α-松油醇产品。表征结果为:1h nmr(400mhz,cdcl3):δ1.17(s,3h),1.20(s,3h),1.24
–
1.40(m,2h),1.43
–ꢀ
1.57(m,1h),1.67(d,3h),1.73
–
1.94(m,2h),1.96
–
2.10(m,3h),5.38(s,1h);
13
cnmr(100mhz,cdcl3):δ23.3,23.8,26.2,26.8,27.4,31.0,44.8,72.7,120.5,134.0。
[0070]
实施例2
[0071]
合成化合物α-松油醇酯ii-2和α-松油醇。
[0072]
氮气保护下,在耐压反应釜中加入金属盐氯化锌(0.03mol,3mol%)、有机磷酸iii-2(0.05mol,5mol%)以及2-甲基-3-丁烯-2-醇苯甲酸酯 i-2(1.2mol,1.2equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到55℃继续反应1h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯ii-2的粗品,然后通过气相内标法分析,异戊二烯转化率为94%,选择性为94%。
[0073]
取上述α-松油醇酯ii-2(1mol,1equiv)的粗品和水(4mol,4equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入叔丁醇钾(1.5mol, 1.5equiv),将上述体系加热到30℃继续反应1.5h。停止反应,冷却到室温,使用2mol/l稀盐酸调节体系的
ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-1转化率为99%,选择性为97%。
[0074]
实施例3
[0075]
合成化合物α-松油醇酯ii-3和α-松油醇。
[0076]
氮气保护下,在耐压反应釜中加入金属盐三氟甲基磺酸钪(0.03mol,3mol%)、有机磷酸iii-3(0.05mol,5mol%)以及2-甲基-3-丁烯-2-醇碳酸酯-3(1.2mol,1.2equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到55℃继续反应1h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯ii-3的粗品,然后通过气相内标法分析,异戊二烯转化率为93%,选择性为94%。
[0077]
取上述α-松油醇酯ii-3(1mol,1equiv)的粗品和水(4mol,4equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入氢氧化钾(1.5mol, 1.5equiv),将上述体系加热到30℃继续反应1.5h。停止反应,冷却到室温,使用2mol/l稀盐酸调节体系的ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-3转化率为100%,选择性为98%。
[0078]
实施例4
[0079]
合成化合物α-松油醇酯ii-4和α-松油醇。
[0080]
氮气保护下,在耐压反应釜中加入金属盐溴化镁(0.03mol,3mol%)、有机磷酸iii-4(0.05mol,5mol%)以及2-甲基-3-丁烯-2-醇二甲基磷酸酯i-4(1.2mol,1.2equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到55℃继续反应1h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯ii-4的粗品,然后通过气相内标法分析,异戊二烯转化率为95%,选择性为96%。
[0081]
取上述α-松油醇酯ii-4(1mol,1equiv)的粗品和水(4mol,4equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入氢氧化钠(1.5mol, 1.5equiv),将上述体系加热到30℃继续反应1.5h。停止反应,冷却到室温,使用2mol/l稀盐酸调节体系的ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-1转化率为100%,选择性为99%。
[0082]
实施例5
[0083]
合成化合物α-松油醇酯ii-1和α-松油醇。
[0084]
氮气保护下,在耐压反应釜中加入金属盐氟化铟(0.1mol,10mol%)、有机磷酸
iii-1(0.2mol,20mol%)以及2-甲基-3-丁烯-2-醇三氟甲磺酸酯i-1(0.5mol, 0.5equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到55℃继续反应0.5h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯 ii-1的粗品,然后通过气相内标法分析,2-甲基-3-丁烯-2-醇三氟甲磺酸酯i-1转化率为95%,选择性为97%。
[0085]
取上述α-松油醇酯ii-1(1mol,1equiv)的粗品和水(4mol,4equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入氢氧化钠(1.5mol, 1.5equiv),将上述体系加热到30℃继续反应1.5h。停止反应,冷却到室温,使用2mol/l稀盐酸调节体系的ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-1转化率为100%,选择性为99%。
[0086]
实施例6
[0087]
合成化合物α-松油醇酯ii-1和α-松油醇。
[0088]
氮气保护下,在耐压反应釜中加入金属盐氟化铟(0.01mol,1mol%)、有机磷酸iii-1(0.02mol,2mol%)以及2-甲基-3-丁烯-2-醇三氟甲磺酸酯i-1(10mol, 10equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到50℃继续反应5h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯ii-1 的粗品,然后通过气相内标法分析,异戊二烯转化率为98%,选择性为91%。
[0089]
取上述α-松油醇酯ii-1(1mol,1equiv)的粗品和水(4mol,4equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入氢氧化钠(5mol, 5equiv),将上述体系加热到30℃继续反应0.5h。停止反应,冷却到室温,使用 2mol/l稀盐酸调节体系的ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-1转化率为100%,选择性为98%。
[0090]
实施例7
[0091]
合成化合物α-松油醇酯ii-1和α-松油醇。
[0092]
氮气保护下,在耐压反应釜中加入金属盐氟化铟(0.03mol,3mol%)、有机磷酸iii-1(0.05mol,5mol%)以及2-甲基-3-丁烯-2-醇三氟甲磺酸酯i-1(1.2mol, 1.2equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到30℃继续反应5h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯ii-1 的粗品,然后通过气相内标法分析,异戊二烯转化率为97%,选择性为95%。
[0093]
取上述α-松油醇酯ii-1(1mol,1equiv)的粗品和水(10mol,10equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入氢氧化钠(1mol, 1equiv),将上述体系加热到5℃继续反应2.5h。停止反应,冷却到室温,使用 2mol/l稀盐酸调节体系的ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-1转化率为99%,选择性为99%。
[0094]
实施例8
[0095]
合成化合物α-松油醇酯ii-1和α-松油醇。
[0096]
氮气保护下,在耐压反应釜中加入金属盐氟化铟(0.03mol,3mol%)、有机磷酸iii-1(0.05mol,5mol%)以及2-甲基-3-丁烯-2-醇三氟甲磺酸酯i-1(1.2mol, 1.2equiv),然后通过平流泵打入异戊二烯(1mol,1equiv),将上述体系加热到120℃继续反应0.5h。停止反应,冷却到室温,将反应液水洗分液后得到α-松油醇酯ii-1的粗品,然后通过气相内标
法分析,异戊二烯转化率为99%,选择性为89%。
[0097]
取上述α-松油醇酯ii-1(1mol,1equiv)的粗品和水(1mol,1equiv)加入带夹套的玻璃三口烧瓶中,将体系冷却至5℃,然后分多批次加入氢氧化钠(1.5mol, 1.5equiv),将上述体系加热到60℃继续反应1h。停止反应,冷却到室温,使用 2mol/l稀盐酸调节体系的ph到1-2,然后分出有机相,用水洗涤,所得油相通过气相内标法分析,α-松油醇酯ii-1转化率为98%,选择性为97%。
[0098]
对比例1
[0099]
合成化合物α-松油醇。采用专利cn100357240c中实施例3的方案制备α
‑ꢀ
松油醇。
[0100]
将改性d001强酸阳离子交换树脂280g装入直径为20mm、长度600mm的管式固定床反应器中。在装有回流冷凝器、温度计的1l三口烧瓶张加入300g 松节油(含蒎烯91%,2mol),54g水(3mol)和60g 99%的正丙醇(1mol),加热使蒎烯、水和正丙醇蒸发并控制蒸发量,经冷凝器冷凝后进入管式固定床反应器中进行反应,然后回流进入三口烧瓶,连续循环,维持固定床反应器的温度在90℃左右,反应9h。反应完毕,通过气相内标法分析,α-松油醇转化率为 88%,选择性为67%。
[0101]
通过上述对比例1和和实施例1的对比可以发现,目前工业上通过工业蒎烯或用松节油在负载固体强酸树脂催化作用下直接水合生成α-松油醇存在反应时间长(9h)、选择性低(67%)等特点,而本发明报道的路线反应温度低(30-55℃)、条件温和、能耗非常低、装置简单,并且我们的选择性在优选条件下可达95%,产品进一步提纯非常简单。
[0102]
本领域技术人员可以理解,在本说明书的教导之下,可对本发明做出一些修改或调整。这些修改或调整也应当在本发明权利要求所限定的范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1