一种重组海藻糖酶的制备方法及其应用与流程
1.本发明属于生物工程技术领域,具体涉及一种重组海藻糖酶及其在海藻糖检测中的应用。
背景技术:
2.海藻糖是由两分子葡萄糖以α,α-1,1糖苷键连接的二糖,具有无还原性、化学性质稳定等特点。海藻糖在自然界中分布广泛,细菌、真菌、植物和无脊椎动物如昆虫、线虫、虾等体内均含有海藻糖。研究表明,海藻糖能够保护细胞膜、蛋白质等生物大分子,帮助生物耐受高温、冷冻、高渗透压等恶劣环境,是生物体中的一种应激合成代谢物。海藻糖酶可以将海藻糖分解成两分子葡萄糖,广泛存在于动物、植物和微生物体内。近年来,海藻糖酶在发酵工业上的应用逐渐受到重视。玉米乙醇工业中,海藻糖是发酵残糖的主要成分之一,诺维信公司在2017年2月22日宣布推出具有海藻糖酶活性的葡糖淀粉酶套件,可减少70%的发酵残糖,提高乙醇产率;谷氨酸发酵过程中,发酵后期菌株会合成并积累一定量的海藻糖,导致残糖量的增加,并且影响谷氨酸的提取,韩隽等通过在谷氨酸发酵后期加入海藻糖酶提高了谷氨酸产量和糖酸转化率。
3.生产海藻糖酶的关键是获得产酶微生物,可从自然界中筛选获得产海藻糖酶的微生物,也可通过构建基因工程菌株获得产海藻糖酶的重组菌株。江南大学董琦等从海藻糖驯化的土壤样品中筛选获得了产海藻糖酶的大黄欧文菌(erwinia rhapontici)c2;江南大学于林港等将escherichia coli str.k-12 substr.mg1655的海藻糖酶编码基因在e.coli bl21中进行重组表达;广东溢多利生物科技股份有限公司黄江等将嗜热真菌thermothelomyces的海藻糖酶编码基因进行密码子优化并在毕赤酵母中进行表达;e.coli bl21中同样存在海藻糖酶编码基因trl,该基因与已报道的e.coli str.k-12 substr.mg1655的海藻糖酶编码基因相似度为98.42%,序列中存在26个差异核苷酸,而且编码蛋白中存在一个氨基酸残基差异,目前没有e.coli bl21中海藻糖酶的相关研究和报道。谷氨酸棒杆菌(corynebacterium glutamicum)是一种安全菌株,其蛋白水解酶活性低从而有利于重组蛋白的稳定性;同时其糖水解酶背景少,如与大肠杆菌相比,其胞内乳糖水解酶活性很低。利用谷氨酸棒杆菌表达海藻糖酶可以扩展海藻糖酶的应用范围,如食品添加剂等安全性要求较高的产品的发酵生产。目前,没有利用谷氨酸棒杆菌表达海藻糖酶的相关报道。
4.另一方面,在海藻糖生产过程中,需要对海藻糖浓度进行不间断检测,因此简单快速地海藻糖含量分析方法在生产过程中非常重要。目前,海藻糖检测主要通过hplc进行,如国标gb/t 23529-2009推荐方法,但利用hplc分析海藻糖需要用到有一定毒性的乙腈试剂,而且样品处理要求较高,并受特定设备条件限制。目前,海藻糖生产主要是酶催化法。如利用海藻糖合酶催化麦芽糖转化合成海藻糖,该反应体系中主要存在海藻糖、麦芽糖和葡萄糖。利用麦芽寡糖基海藻糖合成酶与麦芽寡糖基海藻糖水解酶共同作用催化麦芽寡糖合成海藻糖,反应体系中主要存在海藻糖、葡萄糖和麦芽寡糖。因此,利用海藻糖酶将海藻糖水
解成容易检测的葡萄糖具有简单快速地分析海藻糖的应用潜力,而催化活性高、海藻糖水解专一性好、容易制备和保存的海藻糖酶是酶法分析海藻糖的关键。
技术实现要素:
5.本发明的目的在于解决上述现有技术的不足,提供一种重组海藻糖酶的制备方法。
6.技术方案
7.一种重组海藻糖酶的制备方法,将海藻糖酶编码基因插入表达质粒pxmj19,构建pxmj19-trl,将pxmj19-trl质粒电击转化谷氨酸棒杆菌(corynebacterium glutamicum)atcc13032,获得重组谷氨酸棒杆菌,利用重组谷氨酸棒杆菌表达合成重组海藻糖酶。具体方法步骤如下:
8.(1)以大肠杆菌(escherichia coli)bl21基因组为模板,pcr扩增海藻糖酶编码基因trl,获得trl基因片段;所述海藻糖酶编码基因的核苷酸序列如seq id no.1所示;所述pcr扩增的引物如seq id no.2和seq id no.3所示;
9.19-trl-hindiiif:cccaagcttaaaggagggaaatcatgctcaatcagaaaattcaaaacc(seq id no.2);
10.19-trl-ecori:ccggaattcttatggttcgccgtacaaacc(seq id no.3);
11.(2)将trl基因片段和pxmj19质粒采用hindiii和ecori限制性内切酶双酶切并连接,连接产物电击转化e.coli dh5α感受态,获得重组表达质粒pxmj19-trl;
12.(3)采用重组表达质粒pxmj19-trl电击转化谷氨酸棒杆菌atcc13032,获得重组谷氨酸棒杆菌;
13.(4)对重组谷氨酸棒杆菌进行诱导培养,使重组海藻糖酶在细胞中合成并积累,然后收集细胞,破碎并离心,获得含重组海藻糖酶的酶液。
14.进一步,步骤(2)中,所述电击转化的条件为:1800v,5ms。
15.进一步,步骤(4)中,所述诱导培养的条件为:iptg诱导浓度为0.5mm,诱导温度为22-30℃,诱导时间为10-15h。
16.上述方法制备的重组海藻糖酶在海藻糖含量检测中的应用,所述重组海藻糖酶在海藻糖检测中的应用是利用含有重组海藻糖酶的酶液快速检测样品中海藻糖的含量。
17.优选地,所述重组海藻糖酶在海藻糖含量检测中的应用方法为:待测样品稀释至海藻糖浓度为0.125~2g/l,添加海藻糖酶4000u/l,45℃反应5min,通过分析葡萄糖浓度的增加量计算出样品中海藻糖浓度。
18.本发明的有益效果:
19.(1)利用安全菌株谷氨酸棒杆菌表达海藻糖酶,表达效果好、菌株培养条件简单、培养时间短;重组海藻糖酶安全性好可利用范围更广;谷氨酸棒杆菌蛋白水解酶活性低,重组海藻糖酶不用经过纯化即可长时间保存;谷氨酸棒杆菌糖水解酶背景少,重组海藻糖酶不用经过纯化即可专一性催化海藻糖分解成葡萄糖。
20.(2)利用含有重组海藻糖酶的酶液可快速检测样品中海藻糖的含量,样品处理简单,用时少,设备要求低,检测准确度高;而且含有重组海藻糖酶的酶液不用经过纯化即可使用,酶液容易获取,用酶成本低。
21.(3)往本发明制备的含有重组海藻糖酶的酶液加入10%酶液体积的甘油,可-20℃冷冻保存90天酶活无明显降低,5℃冷藏保存5天、20℃存放3天、30℃存放32h酶活均无明显降低,酶液在40℃保存酶活半衰期为1h,在45℃保存酶活半衰期为10min。
22.(4)本发明制备的含有重组海藻糖酶的酶液催化海藻糖水解最适温度为45℃、最适ph为6.6,在30~55℃温度范围和ph5.8~ph7.8范围均能有效催化海藻糖水解。
附图说明
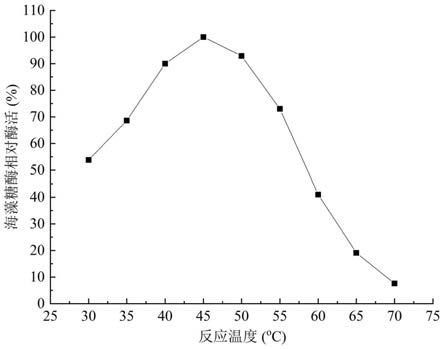
23.图1为实施例1制得的重组海藻糖酶在不同温度下的活性测试结果;
24.图2为实施例1制得的重组海藻糖酶在不同ph下的活性测试结果。
具体实施方式
25.下面结合附图和具体实施例对本发明的技术方案作进一步描述。以下实施例仅用于更加清楚地说明本发明的技术方案,而不能以此来限制本发明的保护范围。
26.下述实施例中,采用的lbg固体培养基的配方为:酵母粉5g/l,蛋白胨10g/l,氯化钠10g/l,葡萄糖5g/l,琼脂粉20g/l,ph7.0;lbg液体培养基配方为:酵母粉5g/l,蛋白胨10g/l,氯化钠10g/l,葡萄糖5g/l,ph7.0。
27.实施例1
28.一种重组海藻糖酶的制备方法,包括如下步骤:
29.(1)以大肠杆菌(escherichia coli)bl21基因组为模板,利用上海生工sanpfu pcr mix试剂盒pcr扩增海藻糖酶编码基因trl,获得trl基因片段;所述海藻糖酶编码基因的核苷酸序列如seq id no.1所示;所述pcr扩增的引物如seq id no.2和seq id no.3所示;
30.19-trl-hindiiif:cccaagcttaaaggagggaaatcatgctcaatcagaaaattcaaaacc(seq id no.2);
31.19-trl-ecori:ccggaattcttatggttcgccgtacaaacc(seq id no.3);
32.(2)将trl基因片段和pxmj19质粒采用hindiii和ecori限制性内切酶双酶(上海生工)切并连接,连接产物转化e.coli dh5α感受态,挑取转化子并提取质粒验证,获得重组表达质粒pxmj19-trl;
33.(3)将重组表达质粒pxmj19-trl电击转化谷氨酸棒杆菌atcc13032,经1800v,5ms电击后涂布于含有氯霉素(10mg/l)的lbg固体培养基平板,30℃培养36h,长出的转化子菌株进行培养并提取质粒验证,验证正确的菌株即为重组谷氨酸棒杆菌,命名为pxmj19-trl/13032;
34.(4)对重组谷氨酸棒杆菌进行诱导培养,使重组海藻糖酶在细胞中合成并积累,具体方法为:将重组谷氨酸棒杆菌pxmj19-trl/13032划线于含有氯霉素(10mg/l)的lbg固体培养基平板,30℃培养36h;利用接种针划取平板上菌苔接种至10ml lbg液体培养基中,30℃、180r/min培养12h,接着取1ml培养液转接入50ml lbg液体培养基中,30℃、180r/min培养3h后加入终浓度为0.5mm的iptg继续22℃、180r/min培养12h。离心收集菌体,利用原培养液体积50%的50mm的ph7.0磷酸钾缓冲液悬浮,冰浴条件下超声破碎细胞,最后离心取上清,得到含重组海藻糖酶的酶液。
35.一.测试实施例1获得的重组海藻糖酶酶液的相关性能
36.1.海藻糖酶酶活检测方法
37.取海藻糖浓度10g/l的溶液5ml加入50μl适当稀释后的实施例1制得的重组海藻糖酶酶液,30℃反应10min后沸水浴5min,利用生物传感分析仪检测生成的葡萄糖浓度。
38.海藻糖酶酶活定义:每分钟水解1μmol海藻糖生成2μmol的葡萄糖所需的酶量定义为一个酶活单位(1u)。
39.实验结果:测得重组海藻糖酶酶液所含海藻糖酶酶活为18.2u/ml(18200u/l)。
40.2.重组海藻糖酶酶液底物选择性研究
41.利用50mm的ph7.0磷酸钾缓冲液配制10g/l的海藻糖、麦芽糖、蔗糖、乳糖、纤维二糖溶液,各取5ml,分别加入50μl实施例1获得的重组海藻糖酶酶液,30℃反应10min后沸水浴5min,利用生物传感分析仪检测生成的葡萄糖浓度。
42.实验结果:加入实施例1的重组海藻糖酶酶液后,测得海藻糖的反应体系中葡萄糖浓度为0.66g/l,麦芽糖、蔗糖、乳糖、纤维二糖的反应体系中葡萄糖浓度为0g/l,这说明重组海藻糖酶酶液仅能催化海藻糖水解产生葡萄糖,不能水解麦芽糖、蔗糖、乳糖和纤维二糖产生葡萄糖,也证明了谷氨酸棒杆菌表达合成海藻糖酶所得的酶液具有较好的底物专一性。
43.3.重组海藻糖酶酶液稳定性研究
44.取实施例1获得的重组海藻糖酶酶液6ml,加入10%酶液体积的甘油后,平均分成6份,分别置于-20℃、5℃、20℃、30℃、40℃和45℃保存,不同时间取样检测海藻糖酶酶活,酶活分析条件为:海藻糖浓度10g/l的溶液5ml加入50μl保存的酶液,30℃反应10min后沸水浴5min,利用生物传感分析仪检测生成的葡萄糖浓度。
45.结果表明:加入甘油的重组海藻糖酶酶液-20℃冷冻保存90天酶活无明显降低,5℃冷藏保存5天、20℃存放3天、30℃存放32h酶活均无明显降低,酶液在40℃保存酶活半衰期为1h,在45℃保存酶活半衰期为10min。
46.4.反应温度对海藻糖酶活性的影响
47.取5ml 10g/l的海藻糖溶液分别在30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃和70℃水浴中预热30min,然后加入25μl 30℃预热30min的实施例1获得的重组海藻糖酶酶液,反应10min后沸水浴5min,利用生物传感分析仪检测生成的葡萄糖浓度。结果见图1。
48.由图1可以看出,含有重组海藻糖酶的酶液催化海藻糖水解最适温度为45℃,在30~55℃温度范围均能有效催化海藻糖水解。
49.5.反应ph对海藻糖酶活性的影响
50.利用ph5.8~7.8的50mm磷酸钾缓冲液溶解海藻糖,配制不同ph的10g/l海藻糖溶液,取5ml不同ph的10g/l海藻糖溶液分别加入25μl实施例1获得的重组海藻糖酶酶液,45℃条件下反应10min后沸水浴5min,利用生物传感分析仪检测生成的葡萄糖浓度。结果见图2。
51.由图2可以看出,结果表明含有重组海藻糖酶的酶液催化海藻糖水解最适ph为6.6,在ph5.8~ph7.8范围均能有效催化海藻糖水解。
52.6.重组海藻糖酶酶液催化海藻糖水解程度研究
53.取50mm ph6.6磷酸钾缓冲液配制好的0.25g/l、0.5g/l、1g/l、2g/l、4g/l海藻糖溶液各0.5ml,加入0.5ml 8000u/l的重组海藻糖酶酶液后,反应体系中海藻糖浓度分别为
0.125g/l、0.25g/l、0.5g/l、1g/l、2g/l,45℃反应5min后沸水浴5min,利用生物传感分析仪检测生成的葡萄糖浓度(备注:反应体系中海藻糖酶活力为4000u/l,理论上每分钟可水解4000μm海藻糖水解产生8000μm葡萄糖,反应体系中每分钟可水解1.368g/l海藻糖产生1.44g/l葡萄糖。因此,反应5min反应体系中海藻糖酶活力是过剩的,这也能保证反应体系中的海藻糖较为彻底地水解)。
54.利用生物传感分析仪检测生成的葡萄糖浓度为g,反应体系原有海藻糖浓度为t。海藻糖水解率计算公式为:100
×
(g
×
342
÷
360
÷
t)%,342为海藻糖分子量,360为海藻糖水解成两分子葡萄糖的分子量。测试结果见表1:
55.表1葡萄糖检测结果与海藻糖水解率
56.海藻糖浓度(g/l)葡萄糖浓度(g/l)海藻糖水解率0.1250.1398.8%0.250.2698.8%0.50.5196.9%11.0397.9%22.0396.4%
57.结果表明,反应体系中海藻糖浓度在0.125~2g/l,海藻糖酶活力为4000u/l,45℃反应5min反应体系中96%以上海藻糖分解成葡萄糖。
58.二.利用实施例1获得的重组海藻糖酶酶液快速分析海藻糖含量
59.利用海藻糖合酶催化麦芽糖转化合成海藻糖,反应体系中主要存在海藻糖、麦芽糖和葡萄糖。配制3组含有海藻糖、麦芽糖和葡萄糖的混合溶液模拟海藻糖合酶催化麦芽糖转化合成海藻糖的过程。3组溶液a、b、c中海藻糖浓度分别为10g/l、50g/l、80g/l。所用试剂麦芽糖中含有一定量的葡萄糖,纯度不高,因此3组溶液a、b、c中麦芽糖、葡萄糖浓度约为150g/l、10g/l;100g/l、15g/l;60g/l、20g/l。将a、b、c 3组溶液利用50mm ph6.6磷酸钾缓冲液稀释n(本实施例中n=40)倍,利用生物传感分析仪检测稀释后溶液中已经存在的葡萄糖浓度g1。同时,取稀释后的溶液各0.5ml加入0.5ml 8000u/l的重组海藻糖酶酶液,45℃反应5min后沸水浴5min,利用生物传感分析仪检测反应后的葡萄糖浓度g2。原溶液中海藻糖浓度为:(2
×n×
g2-n
×
g1)
×
342
÷
360,342为海藻糖分子量,360为海藻糖水解成两分子葡萄糖的分子量。溶液中海藻糖浓度分析结果见表2:
60.表2溶液中海藻糖浓度分析
61.样品g1(g/l)g2(g/l)海藻糖分析结果(g/l)海藻糖检测回收率a0.450.3610.26102.6%b0.500.8948.6497.3%c0.591.3378.6698.3%
62.由表2可知,利用含有重组海藻糖酶的酶液可快速检测样品中海藻糖的含量,样品处理简单,用时少,设备要求低,检测准确度高。而且含有重组海藻糖酶的酶液不用经过纯化即可使用,酶液容易获取,用酶成本低。
63.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变形,这些改进和变形也应视为本发明的保护范围。
64.序列表:
65.seq id no.1
66.大肠杆菌bl21的海藻糖酶编码基因的核苷酸序列
67.atgctcaatcagaaaattcaaaaccctaatccagacgaactgatgatcgaagtcgatctctgctatgagctggacccgtatgaattaaaactggatgagatgatcgaggcagaaccggaacccgagatgattgaagggctgcccgcctctgatgcgctgacgcctgccgatcgctatctcgaactgttcgagcatgttcagtcggcgaaaattttccccgacagtaaaacctttcccgactgcgcacccaaaatggacccgctggatattttaatccgctaccgtaaagtgcgccgtcatcgtgattttgacttgcgcaagtttgttgaaaatcacttctggctgccggaggtctactccagcgagtatgtatcggacccgcaaaattccctgaaagagcatatcgaccagctgtggccggtgctaacccgcgaaccacaggatcacattccgtggtcttctctactggcgctgccgcagtcatatattgtcccgggcggccgttttagcgaaacctactattgggactcctatttcaccatgctggggctggcggaaagtggtcgggaagatttactgaaatgcatggccgataacttcgcctggatgatcgaaaactatggtcacatccccaacggcaaccgcacctattatttgagccgatcgcaaccaccggtttttgcgctgatggtggagttgtttgaagaagatggtgtacgcggtgcgcgccgctatctcgaccaccttaaaatggaatatgccttctggatggacggtgcagaatcgttgatccctaatcaggcctatcgccatgttgtgcggatgccggacggatcgctgctcaaccgttattgggacgatcgcgacacgccgcgtgacgaatcctggcttgaggacgttgaaaccgcgaaacattctggtcgcccgcccaacgaggtgtaccgcgatttacgcgcgggagcggcctcaggttgggattactcttcccgttggctgcgtgatactggtcgtctggcgagcattcgtaccacccagttcatccccatcgatctgaatgccttcctgtttaaactggagagcgccatcgccaacatctcggcgctgaaaggcgagaaagagacagaagcgctgttccgccagaaggccagtgcccgtcgcgatgcggtaaaccgttacctctgggatgatgaaaacggcatctaccgcgattacgactggcgacgcgaacaactggcgctgttttccgctgccgccattgtgccgctctatgtcggcatggcgaaccatgaacaggccgatcgtctggcaaacgccgtacgcagccggttactgacacctggcgggattctggcaagcgagtacgaaaccggtgaacagtgggataaacccaatggctgggcaccgttacaatggatggcaattcagggatttaaaatgtatggcgatgaccttctgggtgatgaaatcgcgcgcagctggctgaaaacggtgaatcagttctatctggaacagcacaaaatgatcgagaaataccatattgccgatggtgttccccgcgaaggcggcggtggcgagtatccgttgcaggatgggtttggctggactaacggtgtggtacgccgtttaattggtttgtacggcgaaccataa
68.seq id no.2
69.pcr扩增的引物19-trl-hindiiif
70.cccaagcttaaaggagggaaatcatgctcaatcagaaaattcaaaacc
71.seq id no.3
72.pcr扩增的引物19-trl-ecori
73.ccggaattcttatggttcgccgtacaaacc
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1