一种具有神经保护活性的炭角酸及其制备方法和应用
1.本发明涉及医药和微生物及化合物技术领域,特别涉及一种从黑柄炭角菌(xylaria nigripes)大米发酵物中提取的化合物炭角酸(xylarinic acid),及其制备方法和在制药领域中的新用途。该化合物具有较显著的神经保护活性,能够在制备新的神经保护药物中应用。
背景技术:
2.天然产物是指动植物的提取物或动物和微生物体内的组成成分或其代谢产物等方面的化学成分,主要包括蛋白质、氨基酸、多糖、萜类、甾体类、苯丙素类等化合物(化学进展,2002,05,405-407)。由于天然产物资源丰富、结构新颖独特、生物活性较强、靶点广泛、作用机制独特的优点,广泛应用于活性先导化合物的发现及新药的制备(journal of natural products,1997,60,52-60)。
3.高等真菌(higher fungi),又被称为大型真菌(macrofungi),是天然产物的重要来源之一。调查显示,我国存在的真菌数量至少有10万余种,目前已报道的有8000余种,大约有400种真菌经试验发现具有药用功效,其中高等真菌数量占比最多。部分高等真菌便于发酵培养,且随着外界培养条件改变,所产生的次生代谢产物化学结构也会产生变化,表现出来的生物活性显得多样化,因此被视为“创造系数”极高的生物体(中国科学基金,2007,02,69-70)。
4.炭角菌属真菌生存方式大多数为腐生、少数为寄生,从热带到温带,炭角菌属的分布很广,通常生长在枯木上或者蚁穴旁,果生炭角菌则寄生在壳斗科植物的落地坚果上。炭角菌属真菌在自然界中起着重要的生态作用,这可能由于它们与种子植物长期共同进化所致(mycological progress,2019,18,495-510)。黑柄炭角菌为民间药用真菌,关于炭角属真菌已报道过的化学成分包括萜类、甾醇类、生物碱和聚酮类化合物等,多数具有抗菌、抗肿瘤、酶抑制等生物活性。
5.如今抑郁、焦虑症状或失眠状态的患者越来越多,来自文献数据显示,目前中国焦虑和抑郁的发病率为5%~6%,失眠的发病率为10%~20%,老年人发病率高达25%,以及考虑到焦虑、失眠和抑郁的共存性,轻、中度心理障碍整体的发病率为10%~15%(科技与创新,2021,07,14-20)。因此,抗抑郁症药物正在对抗日益攀升的忧郁症和焦虑症发病率方面发挥越来越重要的作用,抗抑郁症及神经保护药物市场的发展潜力十分可观。
6.乌灵参是黑柄炭角菌类上市药物,已被广泛应用于临床抑郁症和焦虑症的治疗。当前对于黑柄炭角菌类调控神经的作用机制研究主要从前期情绪障碍类疾病研究的相关作用靶点而延伸过来(例如基于单胺类递质假说等),到目前为止研究人员还不能很好确定黑柄炭角菌类药物调控神经的作用机制及有效化学成分。现有技术对于黑柄炭角菌化学成分抗抑郁及具有神经保护药效活性的化学成分研究,以及相关药物开发工作非常有限。
7.本专利申请的发明人前期对黑柄炭角菌的发酵物进行了抗抑郁活性筛选,动物实验表明:黑柄炭角菌发酵液的乙酸乙酯部位粗提物能改善小鼠的抑郁样行为,提高脑源性
神经营养因子(bdnf)蛋白表达水平,这提示黑柄炭角菌的乙酸乙酯层提取物存在抗抑郁活性成分。本发明成功制备分离获得一种结构新颖的黑柄炭角菌次生代谢产物炭角酸,通过神经保护活性评价实验,验证了化合物炭角酸的神经保护活性作用,可应用于制备新药。
技术实现要素:
8.针对现有技术中存在的不足,本发明的目的是提供一种从黑柄炭角菌(xylaria nigripes)大米发酵物中提取的化合物——炭角酸(xylarinic acid),及其制备方法和在制备新的神经保护药物中的应用,用其制备的药物可以用于治疗包括但不限于抑郁症、焦虑症,也可改善神经退行性疾病患者的认知障碍和运动迟缓。
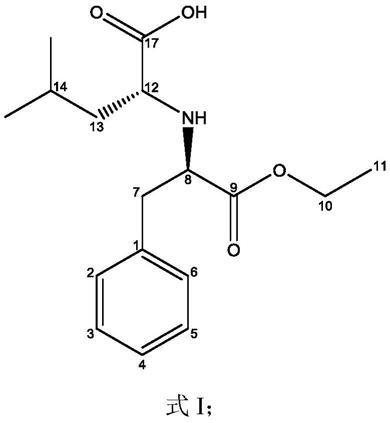
9.所述化合物炭角酸为结构式i所示的化合物:
[0010][0011]
所述式i炭角酸(xylarinic acid)为氨基酸类衍生化合物,9位乙氧基取代,9位羰基取代,7位苯基取代,系统命名为((8r,12r)-9-乙氧基-9-羰基-7-苯基丙烷-8-取代)-d-亮氨酸。
[0012]
其立体构型如式ⅲ所示:
[0013][0014]
本发明还公开了上述式i所示化合物的制备方法,包括如下步骤:
[0015]
将黑柄炭角菌菌株(no.cgbwshf 00611)采用大米培养基培养,所得发酵物用丙酮
浸泡,离心分离获得丙酮提取液与沉淀物,将丙酮提取液蒸发浓缩(优选用旋转蒸发仪),留适量水在提取液中,得到丙酮层粗提物,使用乙酸乙酯萃取,减压浓缩后获得浸膏,离心所得沉淀物重复上述浸泡-离心-浓缩-萃取-减压浓缩过程至提取完全(优选地,上述浸泡-离心-浓缩-萃取-减压浓缩过程共进行5次),合并得到的总浸膏过200-300目的正相硅胶色谱柱,采用石油醚/乙酸乙酯洗脱液(1/0,20/1,10/1,5/1,2/1,1/1,0/1)依次梯度洗脱,每个梯度的溶剂洗脱体积为3个柱体积,共得到的7个粗组分,依次记为a,b,c,d,e,f,g组分,最后用甲醇将硅胶柱上残留样品冲洗干净,d组分通过中压制备液相色谱分离,采用甲醇/水洗脱剂(20/80,40/60,60/40,80/20,100/0,v/v)梯度洗脱得到5个亚组分,依次记为d1,d2,d3,d4,d5组分,d2组分通过制备液相色谱分离,采用乙腈/水流动相(mecn/h2o,以4ml/min流速和25/75-35/65,v/v的梯度洗脱20min)洗脱,在13.8分钟时接峰,所得溶液减压浓缩后,用乙腈复溶挥干后得到炭角酸晶体。
[0016]
本发明还公开了上述的化合物炭角酸或其药学上可接受的制剂在制备用于神经保护药物中的应用。
[0017]
进一步的,所述用于神经保护药物为抗抑郁症和/或抗焦虑症药物。
[0018]
在本发明中,所述式i所示炭角酸的神经保护活性具体体现在:本发明提供的炭角酸能够显著提高模型损伤神经细胞pc12的存活率,对pc12神经细胞凋亡有较好的抑制效果,对氧糖剥夺/复氧(ogd/-r)诱导的pc12神经细胞凋亡的保护活性优于阳性对照药物阿米替林。因此,所述式i所示炭角酸具有作为制备新型抗抑郁、抗焦虑及镇静安神药物的潜在用途。
[0019]
本发明与现有技术相比,具有以下优点和有益效果:
[0020]
1、本发明所涉及制备的炭角酸是首次制备获得的新化合物,是一种氨基酸类衍生化合物,与市场上已有的任意一种单一成分药物化学结构完全不同。基于此化合物进一步开发成的专属性抗抑郁、抗焦虑药物可以避开现有上市药物专利,为市场提供更多选择。
[0021]
2、本发明是首次揭示黑柄炭角菌发酵制备的次生代谢物——氨基酸类衍生化合物具有神经保护活性,有助于药物研发领域关注黑柄炭角菌次生代谢物的神经保护活性,寻找具有抗抑郁、抗焦虑的先导化合物。
[0022]
3、本发明拟保护的炭角酸,来源丰富,并可通过微生物发酵手段来获取,全部生产过程无化学污染,绿色环保。
附图说明
[0023]
图1为实施例1中制备的炭角酸的氢谱图(600mhz,cd3od);
[0024]
图2为实施例1中制备的炭角酸的碳谱图(150mhz,cd3od);
[0025]
图3为实施例1中制备的炭角酸关键的二维核磁相关示意图;
[0026]
图4为实施例1中制备的炭角酸的实验与计算ecd光谱图;
[0027]
图5为实施例1中制备的炭角酸1h-1
h cosy谱图;
[0028]
图6为实施例1中制备的炭角酸hsqc谱图;
[0029]
图7为实施例1中制备的炭角酸的hmbc谱图;
[0030]
图8为实施例1中制备的炭角酸的高分辨-电喷雾-质谱(hr-esi-ms)谱图;
[0031]
图9为实施例2中炭角酸对pc12细胞存活率保护作用检测结果;
[0032]
图10为实施例2中炭角酸对pc12细胞凋亡保护作用检测结果。
具体实施方式
[0033]
为使本技术的发明目的、发明内容呈现得更加清楚,下面申请人将结合具体实施例对本发明的技术方案进行清楚、完整的描述。
[0034]
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
[0035]
下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
[0036]
表1:实验仪器与材料
[0037]
[0038][0039]
实施例1炭角酸的提取方法:
[0040]
黑柄炭角菌(xylaria nigripes)于2013年采集于云南省哀牢山,由北京林业大学戴玉成教授鉴定,从鲜子实体中分离得到的菌株样本(no.cgbwshf00611)保存于中南民族大学药学院药用真菌与民族药研究组,也是文献“four new resorcinol derivatives with neuroprotective activities from xylaria nigripes”(lan-qing li,et al.natural product research(2021),doi:10.1080/14786419.2021.1897591)中报道的菌株,具体见该文献3.2部分第5行。公众可从该研究组购买获得。
[0041]
上述菌株(no.cgbwshf00611)的制备方法如下:将黑柄炭角菌子实体置接种箱内,用75%酒精对菇体表面进行消毒。解剖刀灭菌后在菇柄中部纵切,并用接种铲在菇盖及菇柄处切5个方块,挑取一块组织,接移到pda(potato dextrose agar,马铃薯葡萄糖琼脂)培养基上,置24℃培养,待组织块长出菌丝即获得菌株no.cgbwshf00611。
[0042]
炭角酸的分离纯化过程:将上述经pda培养后的菌株切成小块接种于大米培养基中,在25℃的暗光条件下培养30天。大米培养基的制备过程如下:在500ml锥形瓶中装入100g大米和100ml水,放入高压灭菌锅中在121℃灭菌15min。经大米培养基培养后所得发酵物先用丙酮浸泡,每次浸泡24小时,然后用离心机离心分离得到丙酮提取液与沉淀物,通过旋转蒸发仪将丙酮提取液蒸发浓缩,留适量水在提取液中,得到丙酮层粗提物,使用乙酸乙酯萃取,得到乙酸乙酯层,再减压浓缩后获得浸膏。对离心所得沉淀物重复上述浸泡-离心-浓缩-萃取-减压浓缩过程,共操作5次,最后合并五次的浸膏得到总浸膏182g。
[0043]
总浸膏经过200-300目的正相硅胶色谱柱,洗脱剂为石油醚/乙酸乙酯混合溶剂(1/0,20/1,10/1,5/1,2/1,1/1,0/1,v/v),依次梯度洗脱,每个梯度的溶剂洗脱体积为3个柱体积(柱体积为2100cm3),共得到的7个粗组分,依次记为a,b,c,d,e,f,g组分,最后用甲醇将硅胶柱上残留样品冲洗干净。d组分经过中压快速制备液相色谱仪,采用甲醇/水流动相(20/80,40/60,60/40,80/20,100/0,v/v)梯度洗脱得到5个亚组分,依次记为d1,d2,d3,d4,d5组分。d2组分通过制备型高效液相色谱仪分离,条件:zorbax sb-c18柱子(粒径5μm,规格9.4mm
×
150mm),采用乙腈/水流动相(mecn/h2o,以4ml/min流速和25/75-35/65,v/v的
梯度洗脱20min),在13.8分钟时接峰,即为炭角酸溶液,所得溶液减压浓缩后,用0.5ml乙腈复溶,自然挥干后得到炭角酸晶体(5.8mg)。
[0044]
炭角酸的结构鉴定,如图1-8所示分别为实施例1中制备的炭角酸晶体的氢谱图(600mhz,cd3od)、碳谱图(150mhz,cd3od)、炭角酸关键的二维核磁相关示意图、炭角酸的实验与计算ecd光谱图、炭角酸晶体的1h-1
h cosy谱图、hsqc谱图、hmbc谱图以及高分辨-电喷雾-质谱(hr-esi-ms)谱图。
[0045]
炭角酸晶体,hresi-ms:m/z 330.16748[m+na]
+
(计算值为330.16758),确定其分子式为c
17h25
no4,可推测其不饱和度为6。其
13
c nmr和dept谱数据(表2)给出15个碳信号,三个ch3(δ
c 23.0,22.8,14.2),三个ch2(δ
c 62.7,42.5,38.3),六个ch(δ
c 130.4,129.7,128.2,62.6,60.9,25.9),三个c(前两个羰基季碳δ
c 176.5,173.1,137.4)。1h nmr谱数据(表2)给出δ
h 7.30(2h,m),δ
h 7.26(1h,m),δ
h 7.24(2h,m),表明存在单取代苯环的结构。从δ
h 1.12(3h,t,j=7.2hz),δ
h 0.89(3h,d,j=6.6hz),δ
h 0.86(3h,d,j=6.6hz)可以看出这三个甲基(不含甲氧基)连接在支链末端。
[0046]
表2炭角酸的1h和
13
c nmr数据(δ以ppm为单位,j以hz为单位)
[0047][0048][0049]
at 600mhz(1h nmr)and 150mhz(
13
c nmr),in methanol-d4[0050]
在1h-1
h cosy谱上,可推测得到四个片段信息,即-ch2(7)-ch2(8)-,-ch(2)-ch(3)-ch(4)-ch(5)-ch(6)-,-ch(12)-ch2(13)-ch(14)-,-ch2(10)-ch3(11)片段(图3)。在hmbc谱上,δ
h 7.24(m,h-2/6)与c-7(δ
c 38.8),δ
h 3.80(t,h-8)与c-1(δ
c 137.4)的相关性建立了苯环单取代的片段结构。δ
h 3.04(m,h-7),δ
h 4.08(dd,h-10)与c-9(s,δc173.1)的相
关性确定了单取代支链上酯基的结构。两个甲基δ
h 0.89(d,h-15),δ
h 0.86(d,h-16)与c-13(δ
c 42.5),δ
h 1.70(m,h-14)与c-12(δ
c 60.9),δ
h 1.46(m,h-13)与c-17(δ
c 176.5)的相关性确定单取代支链上含羧基位置的结构片段(图3)。最后通过δ
h 3.33(m,h-12)与c-8(δ
c 62.6)的相关性,结合1h-1
h cosy谱的信息,确定炭角酸平面结构。
[0051][0052]
炭角酸的结构中含有2个手性碳原子(c-8和c-12),因此包含了4种可能的构型(式ⅱ)。由于手性碳的空间距离较近,在roesy谱图上未找到手性碳上质子与其他远程质子相关的信号,无法根据roe信号确定炭角酸的相对构型,于是我们采用了碳谱计算(也称为nmr计算)的方法来推断其相对构型。基于炭角酸立体构型分析,对炭角酸a和b进行了碳谱计算,详细计算方法参见论文(jing li,ji-kai liu,and wen-xuan wang,“giao 13
c nmr calculation with sorted training sets improves accuracy and reliability for structural assignation”[j],the journal of organic chemistry,2020,85,11350-11358.)。计算结果如下表3所示,mae表示平均误差,rms表示均方根值,p
mean
表示定量的置信度,p
rel
表示相对概率,当存在多个p
mean
》5%的假定结构时,p
rel
值越大的假定结构即为正确的。根据表格数据可知,炭角酸的相对构型存在两种情况:8r,12r或者8s,12s。
[0053]
表3炭角酸的实验与计算碳谱数据(δ以ppm为单位)
[0054][0055]
为了进一步确定其绝对构型,对炭角酸进行了ecd计算,发现炭角酸b构型(即rr构型)的ecd计算值与实验值吻合度较高(图4),因此确定炭角酸绝对立体构型为8r,12r(式ⅲ),该化合物为新化合物,命名为炭角酸(xylarinic acid)。
[0056][0057]
实施例2:实施例1制备的式i所示的炭角酸对神经细胞保护作用活性检测
[0058]
1.实验药物与试剂
[0059]
细胞培养液rpmi-1640、透气细胞培养瓶、96孔细胞培养板、24孔细胞培养板、pc12细胞、胎牛血清、胰蛋白酶、cck8试剂盒、青霉素-链霉素双抗溶液(青霉素工作浓度100u/ml,链霉素工作浓度为0.1mg/l)、炭角酸、阿米替林、磷酸盐缓冲液pbs(0.03mol/l、ph=7.2)、微孔滤器、注射器、hoechst staining kit、乙醇、dmso、4%多聚甲醛细胞固定液、triton x-100、50ml离心管、15ml离心管、ep管、1ml枪头、200ul枪头、手套、口罩等。
[0060]
2.实验仪器
[0061]
三气培养箱、恒温培养箱、酶标仪、普通显微镜、荧光显微镜、离心机、高压蒸汽灭菌锅、激光共聚焦显微镜等。
[0062]
3.实验方法
[0063]
3.1细胞处理
[0064]
购买的pc12细胞在37℃、5%co2培养箱中适应性培养。培养液为rpmi-1640培养液(含5%胎牛血清和1%双抗)。在37℃、5%co2饱和湿度培养箱中培养,待细胞长满培养瓶底后,倒掉培养液,用pbs洗涤2次,加入胰蛋白酶至胰蛋白酶终浓度为0.25%,消化2min,再向其中加入rpmi-1640培养液终止消化,轻柔吹打,以1200r/min离心5min,重悬细胞沉淀,接种于培养瓶,显微镜下观察拍照,待细胞长满单层,即可用于实验。
[0065]
3.2溶液配制
[0066]
工作液母液:称取一定量的炭角酸,先用dmso溶解,然后加入pbs配置成10-3
mol
·
l-1
的工作液母液,其中加入dmso的体积为工作液母液体积的0.5%。
[0067]
工作液:将10-3
mol
·
l-1
(后文mol
·
l-1
用m表示)的工作液母液用rpmi-1640培养液稀释100倍配置成10-5
m的工作液,之后梯度稀释成10-6
、10-7
、10-8
m的工作液,过滤分装,-4℃保存。
[0068]
阳性药物阿米替林用rpmi-1640培养液配置成10-6
m溶液。
[0069]
3.3实验模型的建立、分组、造模及给药:
[0070]
建立氧糖剥夺/复氧(oxygen glucose deprivation-reoxygenation,ogd/r)模型用rpmi-1640培养液将经3.1处理后的细胞稀释为104个/ml的细胞悬液,接种于96孔板,每孔加入200μl,适应性培养24h。分为正常对照组(对照组)、模型组、dmso组、实验组(炭角酸药物组)、阳性药物阿米替林组进行实验:正常对照组全量换液成rpmi-1640培养液(含5%胎牛血清),在恒温培养箱培养3h后,全量换液成rpmi-1640培养液(含5%胎牛血清),在恒温培养箱培养24h;模型组、dmso组、实验组全量换成1640无糖培养液,在1%o2,5%co2的三气培养箱低氧处理3h后,dmso组加工作液中对应剂量的dmso,实验组分别加相应孔容量的10-5
、10-6
、10-7
、10-8
m工作液,阿米替林组加与实验组等体积的10-6
m阿米替林工作液,然后恢复常氧,复氧24h。
[0071]
4.指标检测
[0072]
4.1细胞形态学观察
[0073]
按照3.3项方法处理的pc12细胞后,在显微镜下观察细胞形态。
[0074]
4.2 cck8法检测细胞存活率
[0075]
按照3.3项方法处理的各组pc12细胞后,全量换液成rpmi-1640培养液(含5%胎牛血清),每孔加入10μl cck8,37℃孵育3h,酶标仪检测各组细胞在450nm下的吸光度值。
[0076][0077]
4.3检测细胞凋亡情况
[0078]
按照3.3项方法处理各组pc12细胞后,用pbs轻轻润洗2次,每孔加入细胞固定液0.3ml,室温固定细胞45min。弃液,用pbs洗2次,每孔加入0.25%triton x-100液0.2ml,室温处理10min。弃液,用pbs洗2次,每孔加入0.2ml hoechrst染色液(1:400),室温浸染细胞15min。弃液,pbs洗涤细胞3次,每孔加入pbs溶液0.3ml,于激光共聚焦显微镜下观察细胞凋亡情况。
[0079]
5.统计学处理
[0080]
对数据分析采用spss21.0软件,实验数据采用(平均数
±
标准差)表示。使用单因素方差分析比较各组间差异,方差齐时使用lsd检验法进行两两比较,方差不齐时使用tamhane’s t2进行两两比较。p《0.05表示差异有显著性意义,p《0.01表示差异有非常显著性差异。
[0081]
6.实验结果
[0082]
6.1各组pc12细胞形态特点鉴定
[0083]
将pc12各组细胞置于光学显微镜下观察,可见对照组细胞胞体、突体明显,细胞形态呈梭形,模型组、dmso组、炭角酸实验组部分细胞胞体、突体皱缩,细胞形态呈圆形,损伤程度明显。
[0084]
6.2各组pc12细胞存活率情况
[0085]
如表4所示,pc12细胞模型组与对照组相比,细胞活力od值及存活率明显降低,具有显著性差异(p《0.01);模型组与dmso组相比,无明显差异;与模型组相比,炭角酸药物组浓度为10-6
m和10-7
m细胞活力od值及存活率显著上升,具有统计学意义(p《0.01),阳性药物阿米替林组浓度为10-6
m与模型组相比,具有显著性差异(p《0.01)。
[0086]
表4各组pc12细胞活力od值及细胞存活率结果n=6
[0087][0088]
与对照组相比,*p《0.05,**p《0.01;与模型组相比,#p《0.05,##p《0.01
[0089]
炭角酸对pc12细胞存活率保护作用检测结果如图9所示,pc12细胞模型组与对照组相比,细胞存活率明显降低,具有显著性差异(p《0.01);模型组与dmso组相比,无明显差异;与模型组相比,药物组浓度为10-6
m和10-7
m细胞存活率显著上升,具有统计学意义(p《0.01),药物组浓度为10-5
m和10-8
m与模型组相比,具有显著性差异(p《0.01);浓度为10-6
m的药物组与阳性药物阿米替林(amitriptyline)组相比,前者细胞存活率更高。
[0090]
6.3各组pc12细胞凋亡情况
[0091]
通过荧光成像检测炭角酸对pc12细胞凋亡保护作用检测的荧光成像图发现,低氧/复氧诱导的pc12细胞严重损伤,染色体发生了浓缩和断裂,细胞膜结构发生起泡现象,形成凋亡小体,hoechst染色时出现深染而发亮,10-6
m和10-7
m炭角酸对低氧/复氧诱导的pc12细胞表现出较强的抗氧化作用。
[0092]
如表5所示,与对照组相比,模型组pc12细胞的平均荧光强度显著降低(p《0.01),与模型组相比,dmso组pc12细胞的平均荧光强度差异不显著(p》0.05),1
×
10-6
m炭角酸药物组与模型组相比,平均荧光强度显著升高,具有统计学意义(p《0.01)。
[0093]
表5各组pc12细胞凋亡检测结果n=6
[0094][0095]
与对照组相比,*p《0.05,**p《0.01;与模型组相比,#p《0.05,##p《0.01。
[0096]
炭角酸对pc12细胞凋亡保护作用检测结果如图10所示,与对照组相比,模型组pc12细胞的平均荧光强度显著降低(p《0.01),与模型组相比,dmso组pc12细胞的平均荧光强度差异不显著(p》0.05),1
×
10-6
m炭角酸药物组与模型组相比,平均荧光强度显著升高,具有统计学意义(p《0.01)。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1