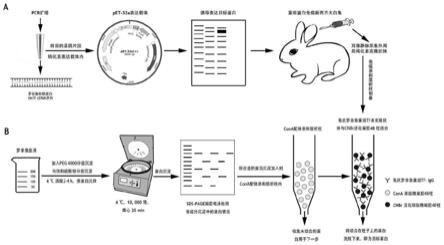
罗非鱼血清转铁蛋白的纯化方法及其应用
4000溶液的终浓度分别为3%、5%、8%和12%,取最后一次所得沉淀即为peg纯化的转铁蛋白粗蛋白。
13.优选地,所述饱和硫酸铵溶液分级沉淀的步骤如下:
14.用终浓度为25~35%饱和硫酸铵溶液与透析后的peg纯化的转铁蛋白粗蛋白搅拌、离心,取沉淀保留备用,继续向上清中加入终浓度为65~75%饱和硫酸铵溶液,搅拌、离心后取沉淀,透析,即得硫酸铵纯化的转铁蛋白粗蛋白。
15.优选地,步骤(3)的具体步骤为:将硫酸铵纯化的转铁蛋白粗蛋白用pbs溶液透析,并用pbs稀释至1.5~2.5mg/ml,加入到pbs缓冲液平衡后的配体亲和层析柱中,室温下混合旋转2.5~3.5h,得到含转铁蛋白回收液。
16.优选地,所述配体亲和层析柱的填料为cona琼脂糖凝胶4b柱填料。
17.优选地,所述平衡缓冲液为9.5~10.5mm pbs溶液,ph为7.2~7.4。
18.优选地,所述免疫亲和层析柱的制备方法为:
19.cnbr-activated sepharose 4b柱填料用hcl溶液活化,用耦合缓冲液预处理,用ph 4.5~5.5,浓度为45~50mm甘氨酸缓冲液封闭1.5~2.5h,得到处理后的柱填料;
20.将纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体与耦合缓冲液透析后加入到处理后的柱填料中,于室温下旋转混合过夜,依次交替用醋酸盐缓冲液和耦合缓冲液旋转清洗柱填料,离心后将柱填料转移至亲和层析重力柱内。
21.优选地,步骤(4)中采用甘氨酸缓冲液洗脱,所述甘氨酸缓冲液的ph为4.5~5.5,甘氨酸缓冲液浓度为45~55mm。
22.优选地,所述醋酸盐缓冲液的ph为3.5~4.5,所述耦合缓冲液的ph为7.8~8.5,所述清洗时间为1~3h,清洗次数为2~4次。
23.本发明还提供了一种上述纯化方法得到的罗非鱼血清转铁蛋白在制备抑菌产品中的应用。
24.与现有技术相比,本发明的有益效果如下:
25.本发明提供的罗非鱼血清转铁蛋白的纯化方法,采用聚乙二醇(peg)分级沉淀、配体亲和层析与免疫亲和层析相结合的方式纯化罗非鱼血清转铁蛋白(ontf),该纯化方法简便、高效,得到的罗非鱼血清转铁蛋白纯度高,且不破坏罗非鱼血清转铁蛋白的活性和稳定性。
26.本发明的罗非鱼血清转铁蛋白能有效抑制病原菌,大大降低罗非鱼由于链球菌、单胞菌感染而造成的死亡,填补了硬骨鱼血清转铁蛋白高效纯化方法和相关功能的空白,同时在研究鱼类先天免疫系统以及抵御病原菌感染的工作中具有重要的指导意义。
附图说明
27.图1为peg 4000溶液分级沉淀和饱和硫酸铵溶液纯化转铁蛋白结果,a为peg 4000溶液分级沉淀和饱和硫酸铵溶液纯化转铁蛋白的sds-page图,b为peg 4000溶液分级沉淀和饱和硫酸铵溶液纯化转铁蛋白的western-blot图,其中a和b中的泳道1为未纯化的罗非鱼血清转铁蛋白,泳道2~5分别为实施例4中的3%、5%、8%和12%的peg 4000溶液分级沉淀后的转铁蛋白,泳道6为实施例4的30%饱和硫酸铵溶液纯化转铁蛋白,泳道7为实施例4的70%饱和硫酸铵溶液纯化转铁蛋白图;
28.图2为实施例4得到的罗非鱼血清转铁蛋白sds-page和western-blot图,a为实施例4得到的罗非鱼血清转铁蛋白sds-page图,b为实施例4得到的罗非鱼血清转铁蛋白western-blot图;
29.图3为罗非鱼血清转铁蛋白抑菌功能的结果图,a中第一行为各组中的脾脏匀浆上清100倍稀释液中s.agalactiae含量,第二行为各组中的脾脏上清100倍稀释液中a.hydrophila含量,第三行为各组中的肝脏上清10倍稀释液中s.agalactiae含量,第四行为各组中的肝脏上清100倍稀释液中a.hydrophila含量,b中(ⅰ)为各组中的脾脏上清100倍稀释液中s.agalactiae的数量统计结果,(ⅱ)为各组中的脾脏上清100倍稀释液中a.hydrophila的数量统计结果,(ⅲ)为各组中的肝脏上清10倍稀释液中s.agalactiae的数量统计结果,(ⅳ)为各组中的肝脏上清10倍稀释液中a.hydrophila的数量统计结果;
30.图4为各组罗非鱼肝脏、脾脏组织病理切片结果图,图中的箭头为相应的病变情况,包含炎性细胞的浸润、含铁血黄素的沉着、组织纤维化、细胞核被挤向一端,细胞轮廓模糊不清等病理变化;
31.图5为死亡拯救实验中各组别罗非鱼存活率统计图;
32.图6为各组别罗非鱼肝脏、脾脏中炎症因子表达量的动态变化;
33.图7为罗非鱼血清转铁蛋白纯化流程图。
具体实施方式
34.本发明提供了一种罗非鱼血清转铁蛋白的纯化方法,包括以下步骤:
35.(1)将罗非鱼血清采用peg 4000溶液分级沉淀,得到peg纯化的转铁蛋白粗蛋白;
36.(2)用饱和硫酸铵溶液分级沉淀peg纯化的转铁蛋白粗蛋白,得到硫酸铵纯化的转铁蛋白粗蛋白;
37.(3)采用配体亲和层析柱对硫酸铵纯化的转铁蛋白粗蛋白溶液进行分离,得到转铁蛋白回收液;
38.(4)将转铁蛋白回收液在免疫亲和层析柱进行层析,收集转铁蛋白洗脱液,透析、浓缩,即得纯化的罗非鱼血清转铁蛋白。
39.作为一种可实施的方式,本发明所用罗非鱼饲养于半自动循环养殖系统内,保持水质、水温良好,每天投喂体重10%质量的浮性饲料。本发明可选的采集体重为200~220g的罗非鱼血清。采集罗非鱼血清的方法优选地如下:将罗非鱼以40mg/l的ms-2,2,2进行麻醉,待罗非鱼麻醉好后,于每条鱼尾静脉采集外周血2ml,将采集后的外周血于4℃冰箱内静置过夜,于4℃下,800g离心10min,收集上层清液,即得罗非鱼血清,转移至-20℃内保存备用。本发明中,采集外周血的注射器可选为2.5ml一次性无菌注射器。本发明对ms-2,2,2来源没有限定,采用本领域公知的市售产品即可。本技术的ms-2,2,2购自sigma-andrich。
40.在本发明中,将罗非鱼血清采用peg 4000溶液分级沉淀,得到peg纯化的转铁蛋白。所述peg 4000溶液分级沉淀优选的步骤如下:将罗非鱼血清用等体积的pbs溶液稀释,加入peg 4000溶液搅拌离心进行分级沉淀,每次离心所得上清液用于下一次peg 4000溶液的分级沉淀;每次分级沉淀时所用peg 4000溶液的终浓度分别为3%、5%、8%和12%,取最后一次所得沉淀即为peg纯化的转铁蛋白粗蛋白,最终得到的peg纯化的转铁蛋白粗蛋白含量相对较高的粗蛋白。所述peg 4000溶液优选为45~55%,进一步优选为48~53%,更优选
为50%。所述搅拌的条件为3~5℃搅拌1.5~2.5h,更优选为4℃搅拌2h,所述搅拌方式可采用磁力搅拌器搅拌。本发明中,可将得到的peg纯化的转铁蛋白保存在-80℃冰箱中备用。所述pbs溶液浓度优选为9.5~10.5mm无菌pbs溶液。所述离心条件优选为10000rpm于4℃离心20min。
41.在本发明中,用饱和硫酸铵溶液分级沉淀peg纯化的转铁蛋白粗蛋白,得到硫酸铵纯化的转铁蛋白粗蛋白。将peg纯化的转铁蛋白粗蛋白以10mm无菌pbs透析,去除上清中的peg成分,透析结束后以peg 20000粉末将溶液浓缩至透析前的原始体积,并向其中加入饱和硫酸溶液分级沉淀,在4℃静置过夜后,以4℃、12000rpm离心15min。离心后的沉淀以5ml的10mm无菌pbs重悬,得到硫酸铵纯化的转铁蛋白粗蛋白,保存在-80℃冰箱中备用。所述饱和硫酸铵溶液分级沉淀的步骤优选地如下:用终浓度为25~35%饱和硫酸铵溶液与透析后的peg纯化的转铁蛋白粗蛋白搅拌、离心,收集沉淀(保留备用),向上清中继续加入终浓度为65~75%饱和硫酸铵溶液,搅拌、离心后取沉淀,透析,即得硫酸铵纯化的转铁蛋白粗蛋白。
42.在本发明中,采用配体亲和层析柱对硫酸铵纯化的转铁蛋白溶液进行分离,得到转铁蛋白回收液。进一步优选地,将硫酸铵纯化的转铁蛋白粗蛋白用pbs溶液透析,并用pbs溶液稀释至1.5~2.5mg/ml,加入到pbs缓冲液平衡后的配体亲和层析柱中,室温下混合旋转2.5~3.5h,得到转铁蛋白回收液。所述配体亲和层析柱的填料优选为cona琼脂糖凝胶4b柱填料。所述pbs缓冲液优选为9.5~10.5mm pbs溶液,进一步优选为9.8~10.3mm,更优选为10mm,ph优选为7.2~7.4。本发明中配体亲和层析柱的制备方法优选为吸取2ml cona琼脂糖凝胶4b柱填料于15ml规格的伯乐重力柱内,使填料自然下沉,每次用5ml的10mm pbs溶液清洗重力柱,共清洗3次。本发明中在将硫酸铵纯化的转铁蛋白稀释前可将硫酸铵纯化的转铁蛋白溶液以5000rpm,4℃离心10min,保留上清,弃掉沉淀,以防止硫酸铵纯化的转铁蛋白溶液堵住柱子。本发明的配体亲和柱对蛋白溶液的承载量可选的为1~5ml。本发明中可将配体亲和层析柱分别以5ml的ph 4.5和ph 8.5的50mmnacl溶液交替清洗层析柱2次,之后以5ml的10mm pbs溶液清洗3次,并加入4mlph 6.0的醋酸盐缓冲液和1ml的无水乙醇,于4℃封存。本发明对cona琼脂糖凝胶4b柱填料购自ge healthcare公司,15ml规格重力柱购自伯乐公司。
43.在本发明中,将转铁蛋白回收液在免疫亲和层析柱进行层析,收集转铁蛋白洗脱液,透析、浓缩,即得纯化的罗非鱼血清转铁蛋白。所述免疫亲和层析柱的制备方法优选为:cnbr-activated sepharose 4b柱填料用hcl溶液活化,耦合缓冲液预处理,用ph 4.5~5.5,浓度为45~50mm甘氨酸缓冲液封闭1.5~2.5h,得到处理后的柱填料;将兔抗罗非鱼血清转铁蛋白重组蛋白多克隆抗体与耦合缓冲液混合,加入到处理后的柱填料中,于室温下旋转混合过夜,依次交替用醋酸盐缓冲液和耦合缓冲液旋转清洗柱填料,离心后将柱填料转移至亲和层析重力柱内。该制备方法进一步优选为:取cnbr-activated sepharose 4b柱填料1~3g,加入10~30ml 0.8~1.2mm的hcl溶液,室温下旋转混合25~35min,以450~550ml 0.08~0.12m的hcl溶液抽滤后,加入4~6ml耦合缓冲液抽滤,得到处理后的柱填料;将纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体以耦合缓冲液中透析后加入到处理后的柱填料中,于室温下旋转混合过夜,去上清后,加入4~6mlph3.5~4.5的醋酸盐缓冲液于室温下旋转清洗1~3h,去上清后,加入5mlph7.8~8.5的耦合缓冲液于室温下旋转清洗1~
3h,去上清,将离心后的柱填料转移至bio-rad亲和层析重力柱内,备用。本发明用耦合缓冲液抽滤,是为了去除残余盐酸。本发明所述的透析优选截留分子量为8~15kda的透析袋,市面上可采购到的常规款即可。透析次数优选为2~4次,时间优选为1.5~2.5h/次,透析次数更优选为3次,时间更优选为2h/次,透析后回收透析袋内的目标蛋白。本发明中去上清的方式可选为以500g,4℃离心5min后去上清。本发明中的加入4~6mlph3.5~4.5的醋酸盐缓冲液于室温下旋转清洗1~3h,去上清后,加入4~6mlph7.8~8.5的耦合缓冲液于室温下旋转清洗1~3h,去上清,上述两个步骤交替重复3次。本发明中用1
×
pbs清洗柱子后还包括加入2倍柱体积的1
×
pbs溶液以及终浓度0.1%的nan3,制备好的柱子保存于4℃以备使用。
44.作为一优选地实施方式,本发明的耦合缓冲液为0.1m nahco3、0.5m nacl,所述耦合缓冲液的ph为8.3,本发明对耦合缓冲液的制备方法没有特殊限定,作为一可选的实施方式,本发明的耦合缓冲液制备方法将0.1m nahco3、0.5m nacl混合均匀,调ph为8.3即得。
45.在本发明中,作为一优选的方式,所述兔抗罗非鱼重组转铁蛋白多克隆抗体的制备方法如下:
46.将melon凝胶纯化载体和melon凝胶纯化缓冲液置于室温平衡25~35min,混合后吸取4.5~5.5ml于15ml规格的伯乐重力柱中,使上清液于重力柱下端流出;取0.8~1.2ml罗非鱼重组转铁蛋白免疫后的兔血清,4℃,500g离心10min后取上清液,与450~550μl 1
×
melon凝胶纯化缓冲液混合,以上述条件再次离心后将上清液在450~550ml 1
×
melon凝胶纯化缓冲液中透析,向透析后的血清中加入8~12μl 5
×
再生缓冲液混匀后转移到平衡后的重力柱内,于室温旋转混合4~6min,收集重力柱内的上清液,得到纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体。本发明中,所述罗非鱼血清转铁蛋白重组蛋白的氨基酸序列如seq id no.1所示。本发明中,于室温旋转混合4~6min,收集上清液,所述收集上清液的具体步骤为将柱内液体转移至离心管,500g离心30s,收集上清液并加入终浓度0.02%nan3。本发明的透析选择截留分子量为8-14kda分子量的md44型透析袋,品牌为vake。本发明的melon凝胶纯化载体、melon凝胶纯化缓冲液与所述的再生缓冲液购自购自thermo公司,本发明的重力柱购自伯乐公司。
47.在本发明中,作为一优选方式,将转铁蛋白回收液加入到免疫亲和层析柱中,旋转混合过夜,回收柱内液体,用17~23倍柱体积的pbs溶液对亲和层析柱进行预洗,加入ph4.5~5.545~55mm的甘氨酸缓冲液1.5~2.5ml洗脱目标蛋白,于室温旋转混合1.5~2.5h,收集洗脱液,用1
×
pbs溶液透析后用peg 20000溶液浓缩至0.8~1.2ml。所述洗脱次数为1~3次,更优选为2次。所述透析优选为于4℃透析至内外液离子浓度与ph平衡。本发明中,如需重复使用免疫亲和层析柱,可以2ml的耦合缓冲液(ph8.3)和2ml的醋酸盐缓冲液(ph4.0)室温交替清洗3次,后以20倍柱体积的1
×
pbs再次清洗柱子,并加入2倍柱体积的1
×
pbs以及终浓度0.1%的nan3,于4℃封存。
48.本发明还提供了一种上述任意一项所述的纯化方法得到的罗非鱼血清转铁蛋白在制备抑菌产品中的应用。
49.本发明中,所述的产品可为药物、食品和保健品等。本发明的罗非鱼优选为尼罗罗非鱼。
50.在本发明中,若无特殊说明,所有的原料组分均为本领域技术人员熟知的市售商品。
51.下面将结合本发明中的实施例,对本发明中的技术方案进行清楚、完整地描述。显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
52.在实施例中,所述cnbr-activated sepharose 4b柱填料购自ge healthcare公司,亲和层析重力柱购自伯乐公司。
53.实施例1
54.一种免疫亲和层析柱的制备方法,具体步骤如下:
55.1)将melon凝胶纯化载体和melon凝胶纯化缓冲液置于室温平衡30min,固液混合后吸取5.0ml于伯乐重力柱中,500g离心1min后去上清液,即得平衡后的重力柱;
56.2)取1ml罗非鱼重组转铁蛋白免疫后的兔血清以6000g,4℃离心15min,提前准备好500μl 1
×
melon凝胶纯化缓冲液于离心管内,加入免疫后的兔血清上清充分混匀后,以5000g离心10min,转移上清至透析袋内,以500ml 1
×
melon凝胶纯化缓冲液透析2次,每次2h,向透析后的血清中加入10μl 5
×
再生缓冲液混匀后转移到平衡后的重力柱内,于室温旋转混合5min,收集上清液并加入终浓度0.02%nan3,得到纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体。
57.3)取cnbr-activated sepharose 4b柱填料3g,加入30ml 1mm的hcl溶液,室温下旋转混合30min,以500ml 0.1m的hcl溶液抽滤后,加入5ml耦合缓冲液抽滤,得到处理后的柱填料;其中,所述耦合缓冲液是将0.1m nahco3、0.5m nacl混合均匀,调ph为8.3制备得到。
58.4)将纯化后的兔抗罗非鱼重组转铁蛋白的多克隆抗体于耦合缓冲液中透析3次,每次2h,透析后的溶液与处理后的柱填料混合,于室温下旋转混合过夜,以500g,4℃离心5min后去上清,加入5mlph5.5的50mm甘氨酸缓冲液室温旋转1.5h对亲和层析柱进行封闭,以500g,4℃离心5min后去上清,加入5mlph4.0的醋酸盐缓冲液于室温下旋转清洗2h,以500g,4℃离心5min后去上清,加入5mlph8.3的耦合缓冲液于室温下旋转清洗2h,去上清,上述两步操作交替重复3次,将最后一次离心后的柱填料转移至bio-rad亲和层析重力柱内,以20倍柱体积的无菌1
×
pbs清洗柱子,最后加入2倍柱体积的1
×
pbs以及终浓度0.1%的nan3,备用。
59.实施例2
60.一种免疫亲和层析柱的制备方法,具体步骤如下:
61.1)将melon凝胶纯化载体和melon凝胶纯化缓冲液置于室温平衡25min,固液混合后吸取4.5ml于伯乐重力柱中,500g离心1min后去上清液,即得平衡后的重力柱;
62.2)取1ml罗非鱼重组转铁蛋白免疫后的兔血清以6000g,4℃离心15min,提前准备好500μl 1
×
melon凝胶纯化缓冲液于离心管内,加入免疫后的兔血清上清充分混匀后,以5000g离心10min,转移上清至透析袋内,以500ml 1
×
melon凝胶纯化缓冲液透析2次,每次2h,向透析后的血清中加入10μl 5
×
再生缓冲液混匀后转移到平衡后的重力柱内,于室温旋转混合5min,收集上清液并加入终浓度0.02%nan3,得到纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体。
63.3)取cnbr-activated sepharose 4b柱填料2g,加入20ml 1.2mm的hcl溶液,室温
下旋转混合35min,以550ml 0.08m的hcl溶液抽滤后,加入4ml耦合缓冲液抽滤,得到处理后的柱填料;其中,所述耦合缓冲液是将0.1mnahco3、0.5m nacl混合均匀,调ph为8.5制备得到。
64.4)将纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体于耦合缓冲液中透析3次,每次2h,透析后的溶液与处理后的柱填料混合,于室温下旋转混合过夜,以500g,4℃离心5min后去上清,加入5mlph为4.5的50mm甘氨酸缓冲溶液,室温旋转2.5h对亲和层析柱进行封闭,以500g,4℃离心5min后去上清,加入6mlph3.5的醋酸盐缓冲液于室温下旋转清洗3h,以500g,4℃离心5min后去上清,加入5ml ph8.5的耦合缓冲液于室温下旋转清洗1h,去上清,上述两步操作交替重复2次,将最后一次离心后的柱填料转移至bio-rad亲和层析重力柱内,以20倍柱体积的无菌1
×
pbs清洗柱子,最后加入2倍柱体积的1
×
pbs以及终浓度0.1%的nan3,备用。
65.实施例3
66.一种免疫亲和层析柱的制备方法,具体步骤如下:
67.1)将melon凝胶纯化载体和melon凝胶纯化缓冲液置于室温平衡35min,固液混合后吸取5.5ml于伯乐重力柱中,500g离心1min后去上清液,即得平衡后的重力柱;
68.2)取1ml罗非鱼重组转铁蛋白免疫后的兔血清以6000g,4℃离心15min,提前准备好500μl 1
×
melon凝胶纯化缓冲液于离心管内,加入免疫后的兔血清上清充分混匀后,以5000g离心10min,转移上清至透析袋内,以500ml 1
×
melon凝胶纯化缓冲液透析2次,每次2h,向透析后的血清中加入10μl 5
×
再生缓冲液混匀后转移到平衡后的重力柱内,于室温旋转混合5min,收集上清液并加入终浓度0.02%nan3,得到纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体。
69.3)取cnbr-activated sepharose 4b柱填料1g,加入10ml 0.8mm的hcl溶液,室温下旋转混合25min,以450ml 0.12m的hcl溶液抽滤后,加入6ml耦合缓冲液抽滤,得到处理后的柱填料;其中,所述耦合缓冲液是将0.1mnahco3、0.5m nacl混合均匀,调ph为7.8制备得到。
70.4)将纯化后的兔抗罗非鱼重组转铁蛋白多克隆抗体于耦合缓冲液中透析3次,每次2h,透析后的溶液与处理后的柱填料混合,于室温下旋转混合过夜,以500g,4℃离心5min后去上清,加入5mlph为4.5的50mm甘氨酸缓冲溶液,室温旋转2.5h对亲和层析柱进行封闭,以500g,4℃离心5min后去上清,加入4mlph4.5的醋酸盐缓冲液于室温下旋转清洗1h,以500g,4℃离心5min后去上清,加入5ml ph7.8的耦合缓冲液于室温下旋转清洗3h,去上清,上述两步操作交替重复4次,将最后一次离心后的柱填料转移至bio-rad亲和层析重力柱内,以20倍柱体积的无菌1
×
pbs清洗柱子,最后加入2倍柱体积的1
×
pbs以及终浓度0.1%的nan3,备用。
71.实施例4
72.一种罗非鱼血清转铁蛋白的纯化方法,具体步骤如下:
73.(1)选取210g的尼罗罗非鱼,饲养于半自动循环养殖系统内,保持水质、水温良好,每天投喂体重10%质量的浮性饲料,将尼罗罗非鱼以40mg/l的ms-2,2,2进行麻醉,待尼罗罗非鱼麻醉好后,于每条鱼尾静脉采集外周血2ml,将采集后的外周血于4℃冰箱内静置过夜,于4℃下,800g离心10min,收集上层清液,即得罗非鱼血清,转移至-20℃内保存备用
74.(2)将5ml罗非鱼血清以等体积9.5~10.5mm无菌pbs进行稀释,加入50%peg 4000溶液搅拌离心进行分级沉淀,每次离心所得上清液用于下一次peg 4000溶液的分级沉淀,每次分级沉淀时所用peg 4000溶液的终浓度分别为3%、5%、8%和12%,每次离心在4℃下,以磁力搅拌器充分搅拌2h后以10000rpm于4℃离心20min,取最后一次所得沉淀即为peg纯化的转铁蛋白粗蛋白;
75.(3)将peg纯化的转铁蛋白粗蛋白以10mm无菌pbs透析,去除上清中的peg成分,透析结束后以peg 20000粉末将溶液浓缩至透析前的原始体积,并向其中加入饱和硫酸铵溶液,第一次加入饱和硫酸铵溶液的终浓度至30%,在4℃搅拌过夜后,以4℃、12000rpm离心15min,收集沉淀,上清转移至新的烧杯中,再次加入饱和硫酸铵溶液至终浓度为70%,在4℃搅拌过夜后,以4℃、12000rpm离心15min,收集沉淀,离心后的沉淀以5ml的10mm无菌pbs重悬,并在500mlpbs缓冲液透析,每次2h,共透析3次,最后以peg 20000浓缩至终体积为3~5ml,得到硫酸铵纯化的转铁蛋白粗蛋白,保存在-80℃冰箱中备用;
76.(4)cona琼脂糖凝胶4b柱填料充分摇匀后,吸取2mlcona琼脂糖凝胶4b柱填料于伯乐重力柱内,使其自然下沉,弃掉缓冲液,以5ml的ph7.2的10mm pbs溶液清洗重力柱3次,即得平衡后的配体亲和层析柱;
77.(5)将硫酸铵纯化的转铁蛋白溶液以5000rpm,4℃离心10min,保留上清,用10mm pbs溶液稀释2mg/ml,加入到平衡后的配体亲和层析柱中,室温下混合旋转3h,将未挂柱的蛋白液回收,得到转铁蛋白回收液;
78.(6)将转铁蛋白回收液转移到实施例1制备好的免疫亲和层析柱中,于4℃旋转混合过夜,回收柱内液体,以20倍柱体积的无菌pbs对亲和层析柱进行预洗,加入ph5.050mm的甘氨酸缓冲液2ml洗脱,于室温旋转混合2h,收集洗脱液,继续加入ph5.050mm的甘氨酸缓冲液2ml洗脱,于室温旋转混合2h,收集洗脱液,合并上述洗脱液,在4℃用1
×
pbs溶液透析至无色,然后用peg 20000溶液浓缩至1.0ml。
79.实施例5
80.一种罗非鱼血清转铁蛋白的纯化方法,具体步骤如下:
81.(1)选取200g的尼罗罗非鱼,饲养于半自动循环养殖系统内,保持水质、水温良好,每天投喂体重10%质量的浮性饲料,将尼罗罗非鱼以40mg/l的ms-2,2,2进行麻醉,待尼罗罗非鱼麻醉好后,于每条鱼尾静脉采集外周血2ml,将采集后的外周血于4℃冰箱内静置过夜,于4℃下,800g离心10min,收集上层清液,即得罗非鱼血清,转移至-20℃内保存备用
82.(2)将5ml罗非鱼血清以等体积9.5mm无菌pbs进行稀释,加入50%peg 4000溶液搅拌离心进行分级沉淀,每次离心所得上清液用于下一次peg 4000溶液的分级沉淀,每次分级沉淀时所用peg 4000溶液的终浓度分别为3%、5%、8%和12%,每次离心在4℃下,以磁力搅拌器充分搅拌2h后以10000rpm于4℃离心20min,取最后一次所得沉淀即为peg纯化的转铁蛋白;
83.(3)将peg纯化的转铁蛋白粗蛋白以10mm无菌pbs透析,去除上清中的peg成分,透析结束后以peg 20000粉末将溶液浓缩至透析前的原始体积,并向其中加入饱和硫酸铵溶液,第一次加入饱和硫酸铵溶液的终浓度至35%,在4℃搅拌过夜后,以4℃、12000rpm离心15min,收集沉淀,上清转移至新的烧杯中,再次加入饱和硫酸铵溶液至终浓度为65%,在4℃搅拌过夜后,以4℃、12000rpm离心15min,收集沉淀,离心后的沉淀以5ml的10mm无菌pbs
重悬,并在500mlpbs缓冲液透析,每次2h,共透析3次,最后以peg 20000浓缩至终体积为3~5ml,得到硫酸铵纯化的转铁蛋白粗蛋白,保存在-80℃冰箱中备用;
84.(4)cona琼脂糖凝胶4b柱填料充分摇匀后,吸取2mlcona琼脂糖凝胶4b柱填料于伯乐重力柱内,使其自然下沉,弃掉缓冲液,以5ml的ph7.39.5mm pbs溶液清洗重力柱3次,即得平衡后的配体亲和层析柱;
85.(5)将硫酸铵纯化的转铁蛋白溶液以5000rpm,4℃离心10min,保留上清,用9.5mm pbs溶液稀释1.5mg/ml,加入到平衡后的配体亲和层析柱中,室温下混合旋转2.5h,将未挂柱的蛋白液回收,得到转铁蛋白回收液;
86.(6)将转铁蛋白回收液转移到实施例1制备好的免疫亲和层析柱中,于4℃旋转混合过夜,回收柱内液体,以20倍柱体积的无菌pbs对亲和层析柱进行预洗,加入ph4.545mm的甘氨酸缓冲液2.5ml洗脱,于室温旋转混合2.5h,收集洗脱液,继续加入ph4.545mm的甘氨酸缓冲液1.5~2.5ml洗脱,于室温旋转混合2.5h,收集洗脱液,合并上述洗脱液,在4℃用1
×
pbs溶液透析至无色,然后用peg 20000溶液浓缩至0.8ml。
87.实施例6
88.一种罗非鱼血清转铁蛋白的纯化方法,具体步骤如下:
89.(1)选取220g的尼罗罗非鱼,饲养于半自动循环养殖系统内,保持水质、水温良好,每天投喂体重10%质量的浮性饲料,将尼罗罗非鱼以40mg/l的ms-2,2,2进行麻醉,待尼罗罗非鱼麻醉好后,于每条鱼尾静脉采集外周血2ml,将采集后的外周血于4℃冰箱内静置过夜,于4℃下,800g离心10min,收集上层清液,即得罗非鱼血清,转移至-20℃内保存备用
90.(2)将5ml罗非鱼血清以等体积9.5~10.5mm无菌pbs进行稀释,加入50%peg 4000溶液搅拌离心进行分级沉淀,每次离心所得上清液用于下一次peg 4000溶液的分级沉淀,每次分级沉淀时所用peg 4000溶液的终浓度分别为3%、5%、8%和12%,每次离心在4℃下,以磁力搅拌器充分搅拌2h后以10000rpm于4℃离心20min,取最后一次所得沉淀即为peg纯化的转铁蛋白粗蛋白;
91.(3)将peg纯化的转铁蛋白粗蛋白以10mm无菌pbs透析,去除上清中的peg成分,透析结束后以peg 20000粉末将溶液浓缩至透析前的原始体积,并向其中加入饱和硫酸铵溶液,第一次加入饱和硫酸铵溶液的终浓度至25%,在4℃搅拌过夜后,以4℃、12000rpm离心15min,收集沉淀,上清转移至新的烧杯中,再次加入饱和硫酸铵溶液至终浓度为75%,在4℃搅拌过夜后,以4℃、12000rpm离心15min,收集沉淀,离心后的沉淀以5ml的10mm无菌pbs重悬,并在500ml pbs缓冲液透析,每次2h,共透析3次,最后以peg 20000浓缩至终体积为3~5ml,得到硫酸铵纯化的转铁蛋白粗蛋白,保存在-80℃冰箱中备用;
92.(4)cona琼脂糖凝胶4b柱填料充分摇匀后,吸取2mlcona琼脂糖凝胶4b柱填料于伯乐重力柱内,使其自然下沉,弃掉缓冲液,以5ml的ph7.410.5mm pbs溶液清洗重力柱3次,即得平衡后的配体亲和层析柱;
93.(5)将硫酸铵纯化的转铁蛋白溶液以5000rpm,4℃离心10min,保留上清,用10mm pbs溶液稀释2.5mg/ml,加入到平衡后的配体亲和层析柱中,室温下混合旋转3.5h,将未挂柱的蛋白液回收,得到转铁蛋白回收液;
94.(6)将转铁蛋白回收液转移到实施例1制备好的免疫亲和层析柱中,于4℃旋转混合过夜,回收柱内液体,以20倍柱体积的无菌pbs对亲和层析柱进行预洗,加入ph5.555mm的
甘氨酸缓冲液1.5ml洗脱,于室温旋转混合1.5h,收集洗脱液,继续加入ph5.555mm的甘氨酸缓冲液1.5ml洗脱,于室温旋转混合1.5h,收集洗脱液,合并上述洗脱液,在4℃用1
×
pbs溶液透析至无色,然后用peg 20000溶液浓缩至1.2ml。
95.试验例1
96.分别将实施例4中的步骤(2)中用3%、5%、8%和12%的peg 4000溶液沉淀得到的转铁蛋白,步骤(3)中70%的饱和硫酸铵溶液得到的硫酸铵纯化的转铁蛋白,步骤(6)得到的最终溶液、对比例1步骤(3)中30%的饱和硫酸铵溶液得到的硫酸铵纯化的转铁蛋白结果进行sds-page和western-blot检测,检测结果见图1和图2。
97.由图1结果可知,实施例4中步骤(2)中用3%、5%、8%、12%的peg4000溶液均沉淀出了转铁蛋白及其他杂蛋白;步骤(3)中70%的饱和硫酸铵溶液沉淀出了转铁蛋白及其他杂蛋白,且杂蛋白的数量有所减少;步骤(6)得到的最终溶液中含有转铁蛋白且几乎不含有其他杂蛋白;对比例1步骤(3)中30%的饱和硫酸铵溶液沉淀出了转铁蛋白,且杂蛋白的数量也有所减少。
98.由图2可知,本发明通过纯化,成功获得了蛋白分子量为73.2kda的罗非鱼血清转铁蛋白,且该转铁蛋白的纯度高,纯度95%以上。
99.试验例2
100.将实施例4制备得到的尼罗罗非鱼血清转铁蛋白用于功能验证。
101.(1)尼罗罗非鱼的免疫:从养殖系统内捕捞70尾健康的罗非鱼,随机分入7组并驯化若干天,使罗非鱼充分适应养殖桶环境。各组分别记为pbs组、pbs+s.agalactiae组、pbs+a.hydrophila组、bsa+s.agalactiae组、bsa+a.hydrophila组、ontf+s.agalactiae组,ontf+a.hydrophila组,配制无菌10mm pbs与bsa溶液,活化s.agalactiae与a.hydrophila,并分别与bsa和ontf混合,bsa蛋白终浓度为50μg/ml、ontf蛋白终浓度为250μg/ml,菌液终浓度为1
×
108cfu/ml,按照组别分别配制用于免疫的混合液,并对各组罗非鱼进行注射免疫,后放回到对应的养殖桶中继续养殖,免疫后的12h、24h和48h分别从各组中取罗非鱼3尾,使用解剖工具取其脾脏和肝脏的组织样品。
102.(2)涂板检测:配制1l lb固体培养基,其成分包括胰蛋白胨10g、酵母提取物5g、氯化钠10g以及琼脂15g,按照说明书配制1l脑心浸萃液体培养基,然后加入琼脂15g,通过高温蒸汽灭菌锅灭菌,待培养基温度降低到50℃时,在超净工作台中铺制平板,待培养基凝固后,倒扣放入冰箱备用。获取组织样品后,通过天平称重并记录每个样品的质量,以pbs溶液调整组织匀浆液浓度,使每微升溶液中含有的组织质量相同。涂板检测的时间必须是取样当天,以确保组织样品中菌落的存活状态。在超净工作台中以电动匀浆器将组织样本充分匀浆。以500g,4℃离心10min,并转移上清至新的离心管内,得到组织匀浆上清。将上一步得到的上清以无菌pbs进行稀释,分别稀释10倍和100倍,将肝脏、脾脏组织匀浆上清液、10倍稀释液、100倍稀释液分别涂布于固体平板上。每个组别,每种组织,每种浓度各涂布3个平板作为平行。涂布后将平板置于37℃培养箱内培养过夜,次日将平板取出拍照、计数,并统计出每个组织样本中的菌落数量(cfu/g)。涂板检测验证罗非鱼血清转铁蛋白的抑菌功能结果见图3。
103.(3)病理切片:将“(1)尼罗罗非鱼的免疫”中获取的所述各组别罗非鱼的肝脏、脾脏组织样品转移至4%多聚甲醛溶液中,并于4℃固定过夜。此后,对样品编号并送往武汉市
赛尔维生物科技有限公司,通过石蜡包埋、脱蜡、he染色、脱水封片、显微拍摄等步骤,获得罗非鱼组织样本的组织病理学切片结果,以分析罗非鱼组织样本的病理变化。各组罗非鱼肝脏、脾脏组织病理切片结果图见图4。
104.(4)死亡拯救:从养殖系统中随机选取约50g重的罗非鱼140尾,平均分成7组,分组情况同“(1)尼罗罗非鱼的免疫”。对上述罗非鱼按组别进行免疫,具体材料制备与免疫流程参照“(1)尼罗罗非鱼的免疫”(菌浓度为1
×
107cfu/ml与1
×
108cfu/ml,ontf蛋白浓度为250μg/ml)。免疫当天起,30天内每天统计各组罗非鱼的死亡数量。死亡拯救实验中各组别罗非鱼存活率统计见图5。
105.(5)罗非鱼肝脏、脾脏中炎症因子表达量的动态变化:
106.①
rna提取与cdna合成:将“(1)尼罗罗非鱼的免疫”中获取的组织样本取出置于冰面上,向每个样本加入200μl trizol,以电动匀浆器充分研磨成组织匀浆。研磨结束后,继续加入800μl trizol于室温静置10min。以12000rpm、4℃离心10min,上清转移到新的离心管中。向上清液中加入300μl氯仿,充分涡旋,使其混匀。静置10min后以12000rpm、4℃离心15min。吸取上层水相转移到新的离心管中。然后加入500μl异丙醇,轻轻混匀,直到不出现分层状态后,静置10min。以12000rpm、4℃离心15min,弃去上清。并向沉淀中加入1ml无水乙醇,轻轻上下颠倒悬浮沉淀。重复上述步骤,洗涤沉淀2~3次。室温晾干沉淀,后加入适量depc水,以溶解所得的rna沉淀。通过nanodrop 2000超微量紫外分光光度计检测所得rna浓度与od值,以1%琼脂糖凝胶电泳检测rna的提取效果,是否发生明显的降解,后保存于-80℃备用。通过hifair iii反转录试剂盒(yeasen)以总rna为模板合成cdna,所有步骤按说明书执行。合成的cdna以depc水稀释10倍后作为qpcr的模板。
107.②
通过abi的quantstudio 5qpcr仪检测各组别罗非鱼的肝脏、脾脏中onil-6、onil-8、ontnf-α与onil-10表达量的动态变化。qpcr的体系包括mix 10μl、浓度为2μm/l的上、下游引物各2μl、模板3μl、ddh2o 3μl。引物由北京六合华大基因科技有限公司合成。qpcr以罗非鱼β-actin作为内参基因,通过2-δδct
的方法计算相对表达量。
108.各组别罗非鱼肝脏、脾脏中炎症因子表达量的动态变化见图6。
109.由图3可知,采用罗非鱼血清转铁蛋白能够有效地抑制s.agalactiae和a.hydrophila,对s.agalactiae和a.hydrophila抑制率均能达到70%以上。
110.由图4可知,病原菌感染组、病原菌+bsa共同感染组的罗非鱼肝脏、脾脏中出现了明显的病理学损失,包括但不限于皮下组织出血、含铁血黄素沉着、空泡等。而病原菌+罗非鱼血清转铁蛋白共同感染组的罗非鱼肝脏、脾脏无明显的病理学损伤,与空白对照组相似。因此,罗非鱼血清转铁蛋白能够有效减缓s.agalactiae和a.hydrophila对罗非鱼肝脏、脾脏的病理学损伤。
111.由图5可知,罗非鱼血清转铁蛋白显著提高了由s.agalactiae和a.hydrophila感染后的罗非鱼存活率,存活率为40%(以1
×
108cfu/ml的菌液浓度免疫罗非鱼)和60%(以1
×
107cfu/ml的菌液浓度免疫罗非鱼),与对照组相比,存活率均提高了20%~30%。
112.由6可知,罗非鱼血清转铁蛋白显著抑制了il-6、il-8、tnf-α的表达量,显著提高了il-10的表达量。
113.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应
视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1