一种抗体及其用途的制作方法
1.本发明涉及生物技术领域,具体涉及一种主要结合血浆激肽释放酶前体的抗体及其用途。
背景技术:
2.血浆激肽释放酶(plasma kallikrein,pk)属丝氨酸蛋白酶家族的一员,最早是在哺乳动物的血浆中被发现。它由位于4q35染色体上单个基因(klkb1)编码,主要在肝脏中合成。pk是激肽释放酶-激肽系统(kks)的一个关键酶,可作用于高分子量激肽原(kh),从而使其活化释放小分子缓激肽(bk),进而通过作用于缓激肽受体参与凝血、纤维蛋白溶解、补体激活以及炎症发生等生物学过程。而血浆前激肽释放酶(plasma prekallikrein,ppk)是血浆激肽释放酶的前体,血浆激肽释放酶以血浆前激肽释放酶(ppk)形式大量存在于血液循环中,并进一步通过凝血因子xiia剪切其内在的arg-iie键激活转化成pk。
3.近年来,随着对血浆激肽释放酶的基因学、分子学和药理学的研究更加深入,人们对其生理和病理角色有了深入的认识。研究表明,血浆激肽释放酶与炎症性疾病、肿瘤、心血管疾病、肾病、中枢神经系统疾病、视网膜病以及糖尿病视网膜疾病等多种疾病密切相关(costa-neto,c.m.et al.participation of kallikrein-kinin system in different pathologies.int.immunopharmacol.2008,8,135-142)。例如遗传性血管水肿(hae),它是一种常染色体显性遗传性,主要是由于患者体内c1-inh缺乏,导致其对血浆激肽释放酶的抑制作用减弱,不受控制的激活kks系统,释放血管活性物质,使血管通透性增加引起典型的肿胀(farkas,h.orphan drugs for the treatment of hereditary angioedema.expert opinion on orphan drugs,2015,1,141-156)。又例如,在糖尿病黄斑水肿患者眼部玻璃体中,发现其kks系统过度激活,导致视网膜血管通透性增加和视网膜增厚。近年来已公开多项资料表明血浆激肽释放酶抑制剂可以降低视网膜血管通透性,用于治疗糖尿病视网膜疾病和糖尿病黄斑水肿(feener,e.p.plasma kallikrein and diabetic macular edema.curr.diab.rep.2010,10,270-275;liu j.et al.plasma kallikrein-kinin system and diabetic retinopathy.biol.chem.2013,394,319-328)。
4.有研究证实在健康的人类志愿者中观察到随着血浆pkk水平的剂量依赖性降低,伴随着缓激肽生成能力的降低,并且具有可接受的安全性和耐受性。这项研究揭示有望通过靶向pkk用于治疗hae和其他涉及接触系统激活和缓激肽产生过多的疾病(jason d.f.ionis-pkkrx a novel antisense inhibitor of prekallikrein and bradykinin production.nucleic acid therapeutics,2019,29(2),volume 29,82-91)。
5.目前还未有靶向ppk的蛋白或多肽类药物成功上市,ionis公司ionis-pkk-lrx,其为2¢-o-(2-甲氧基乙基)修饰的嵌合反义寡核苷酸,旨在结合和选择性降低肝脏中的激肽前释放酶mrna,用于治疗hae的适应症处于ii期临床研究阶段。目前还未有结合血浆前激肽释放酶(ppk)的抗体或蛋白。
技术实现要素:
6.本发明提供一种抗体或抗原结合片段,其包含重链可变区和轻链可变区,其中重链可变区包括以下三个互补决定区(cdr):cdr1含有序列dyemh;cdr2含有序列aihpgsggtaynqkfkg;cdr3含有序列pygypfay;轻链可变区包括以下三个互补决定区(cdr):cdr1含有序列kasediynrla;cdr2含有序列getglea;cdr3含有序列qqywstpwt。
7.本发明提供的抗体或抗原结合片段包括鼠源抗体、嵌合抗体、人源化抗体或全人源化抗体或其抗原结合片段。
8.本发明进一步提供一些抗体或抗原结合片段,其重链可变区序列选自seq id no:1-13,15-23中的任一种,轻链可变区序列选自seq id no:24-42的任一种。
9.本发明更进一步提供了一些抗体或抗原结合片段,其重链可变区为seq id no:1,轻链可变区选自seq id no:24-32的任一种;或者其重链可变区为seq id no:2或3,轻链可变区选自seq id no:24-26、28或31的任一种;或者其重链可变区为seq id no:4或6,轻链可变区选自seq id no:24-26、28的任一种;或者其重链可变区选自seq id no:5、7或8中任一种,轻链可变区为seq id no:24;或者其重链可变区选自seq id no:9-13中任一种,轻链可变区选自seq id no:33-35的任一种;或者其重链可变区为seq id no:15,轻链可变区选自seq id no:25、36-42的任一种;或者其重链可变区选自seq id no:12或16-23中任一种,轻链可变区为seq id no:42。
10.本发明所述抗原结合片段优选自fab、fab
’‑
sh、fv、scfv或(fab’)2片段。
11.本发明还提供了一些核酸分子,其编码上述抗体或抗原结合片段;还进一步提供了表达所述核酸的表达载体;同时进一步提供了包含所述载体的宿主细胞,所述宿主细胞包含原核细胞或真核细胞,更优选的选自酵母细胞、哺乳动物细胞(例如293细胞或cho细胞)。
12.本发明提供的部分核酸分子,其重链可变区核酸序列选自seq id no:43-65中的任一种,轻链可变区核酸序列选自seq id no:66-84的任一种。
13.本发明更进一步提供了编码部分抗体或抗原结合片段的核酸分子,其重链可变区核酸序列为seq id no:43,轻链可变区核酸序列选自seq id no:66-74的任一种;或者其重链可变区核酸序列为seq id no:44或45,轻链可变区的核酸序列选自seq id no:66-68、70或73的任一种;或者其重链可变区核酸序列为seq id no:46或48,轻链可变区的核酸序列选自seq id no:66-68、70的任一种;或者其重链可变区核酸序列选自seq id no:47、49或50中任一种,轻链可变区的核酸序列为seq id no:66;或者其重链可变区核酸序列选自seq id no:51-55中任一种,轻链可变区的核酸序列选自seq id no:75-77中的任一种;或者其重链可变区核酸序列选自seq id no:57,轻链可变区的核酸序列选自seq id no:67、78-84的任一种;或者其重链可变区核酸序列选自seq id no:54、58-65中任一种,轻链可变区的核酸序列为seq id no:84。
14.同发明还进一步提供了轻链恒定区如seq id no:85及其突变体;重链恒定区如human igg1、human igg2、human igg4等,其中human igg1优选seq id no:86及其突变体;human igg2优选seq id no:87及其突变体;human igg4优选seq id no:88及其突变体。
15.本发明示例给出的抗体及抗原结合片段的序列对应关系见表1:
16.表1部分抗体及抗原结合片段的序列
17.[0018][0019]
本发明给出示例中涉及的抗体,除kh01为鼠源抗体外,其余均为人源化抗体,所述人源化抗体的轻链恒定区为seq id no:85;kh02-kh30,kh47-kh55的重链恒定区为human igg4(seq id no:88),kh31-kh46、kh56-kh63的重链恒定区为human igg1(seq id no:86)。
[0020]
在一个具体的实施方案中,本发明涉及的抗体(kh34)重链氨基酸序列如seq id no:89,核苷酸序列如seq id no:90,和轻链氨基酸序列如seq id no:91,核苷酸序列如seq id no:92。
[0021]
本发明还提供了一种药物组合物,包含上述的抗体或抗原结合片段,和药学上可接受的赋形剂;所述药物组合物优选为玻璃体内注射剂、视网膜下注射制剂、脉络膜内注射制剂、静脉注射制剂、肿瘤内注射制剂或肌肉注射制剂。
[0022]
本发明还提供了所述的体或抗原结合片段或药物组合物在制备用于预防或治疗受试者中血浆激肽释放酶或血浆前激肽释放酶相关的疾病的药物中的用途;所述与血浆激肽释放酶或血浆前激肽释放酶相关的疾病优选为水肿、类风湿性关节炎、痛风、肠道疾病、口腔粘膜炎、神经性疼痛、炎性疼痛、椎管狭窄-退行性脊柱疾病、糖尿病、动脉或静脉血栓形成、主动脉瘤、骨关节炎、脉管炎、肺栓塞、中风、败血病、系统性红斑狼疮性肾炎和烧伤、视网膜疾病;所述水肿优选自遗传性血管性水肿、脑水肿或头部外伤;所述视网膜疾病优选自糖尿病性黄斑水肿,视网膜静脉阻塞,年龄相关性黄斑变性,继发于视网膜静脉阻塞的黄斑水肿,葡萄膜炎、眼内炎或息肉状脉络膜血管病变。
[0023]
本发明中提及的mhl可参见现有技术(如专利wo2011085103a、wo2014113701a、wo2017100679a等),并可根据本领域的常规技术手段进行构建及制备,其重链见序列seq id no:14,轻链见序列seq id no:56。
[0024]
定义
[0025]
本发明所述“结合”或“特异性结合”指在体外测定法中,抗体与抗原(如人ppk)的表位进行结合。结合的亲和力由kd(结合速率)或kd(解离常数)进行表征。本发明所述的抗体结合或特异性结合人血浆前激肽释放酶(ppk)并不排除其可能对其他抗原或表位的结合,例如血浆激肽释放酶(pk)。
[0026]
本发明所述“表位”意指抗原的与抗体特异性结合的部分。表位通常由部分(moiety)(诸如氨基酸或多糖侧链)的化学活性(诸如,极性、非极性或疏水性)表面基团构成,并且可以具有特定三维结构特征以及特定电荷特征。表位可由形成构象空间单元的连续和/或不连续氨基酸构成。对于不连续表位,来自抗原的线性序列的不同部分的氨基酸因蛋白质分子的折叠而在三维空间上靠近。
[0027]
本发明所述“抗体”指包含抗原结合位点的结合蛋白。术语“结合位点”或“抗原结合位点”指配体实际上结合的抗体分子的区域。术语“抗原结合位点”包含抗体重链可变结构域(vh)和/或抗体轻链可变结构域(vl)或vh/vl对,并可源自完整的抗体或抗体片段如单链fv、vh结构域和/或vl结构域、fab或(fab)2。在本发明的一个实施方案中,每个抗原结合位点包含抗体重链可变结构域(vh)和/或抗体轻链可变结构域(vl),和优选地由抗体轻链可变结构域(vl)和抗体重链可变结构域(vh)对组成。
[0028]
本发明的抗体或可包含六个互补性决定区(cdrs),其中三个重链可变结构域cdrs(cdrh1,cdrh2和cdrh3)和三个轻链可变结构域cdrs(cdrl1,cdrl2和cdrl3)。cdr和框架区(frs)共同组成重链或轻链可变结构域。“互补性决定区”或“cdrs”中的氨基酸残基负责抗原结合。“构架”或“fr”区是互补性决定区之外的那些可变结构域区域。fr的可变性要低于cdr,fr分子共四个,分别为fr1、fr2、fr3和fr4。抗体的轻链和重链从n端到c端包括结构域fr1,cdr1、fr2、cdr2、fr3、cdr3和fr4。各条链上的cdr通过所述框架氨基酸分开。在识别抗体时,四个fr分子卷曲使cdr分子相互靠近。特别地,重链的cdr3是最有助于抗原结合的区域。
[0029]
本发明的术语“fab”指包含抗体重链可变结构域(vh),抗体恒定结构域1(ch1),抗
体轻链可变结构域(vl)和抗体轻链恒定结构域(cl)的多肽,重链和轻链结构域之间通过二硫键稳定。一个fab可形成一个抗原结合位点,两个“fab”可通过二硫键形成“(fab’)2”,因此具有两个抗原结合位点。“f(ab’)2”片段可以进一步被还原,形成两个fab’片段。
[0030]
本发明的术语“scfv”指包含抗体重链可变结构域(vh)和轻链可变结构域(vl)的多肽,重链和轻链结构域之间通过短肽稳定,scfv是抗原结合的关键区域。“fv”指包含抗体重链可变结构域(vh)和轻链可变结构域(vl)的多肽,重链和轻链结构域之间通过非共价键结合在一起。
[0031]
本发明的结合分子或抗体还包含一个或多个免疫球蛋白种类的免疫球蛋白恒定区。免疫球蛋白种类包括igg,igm,iga,igd,和ige同种型,并且在igg和iga的情形中,包括它们的亚型。在优选的实施方案中,本发明的抗体具有igg型抗体的恒定结构域结构。
[0032]
本发明的术语“恒定区”指除了可变区之外的抗体结构域的总合。恒定区不直接涉及抗原的结合,但是显示不同的效应子功能。根据重链的恒定区的氨基酸序列,抗体被分为下述类别:iga,igd,ige,igg和igm,并且其中igg和iga被进一步细分为如下亚型:igg1,igg2,igg3,和igg4,iga1和iga2。对应于不同种类的抗体的重链恒定区分别被称为α、δ、ε、γ和μ。所有5种抗体中轻链恒定区被称为κ(kappa)和λ(lambda)。在本发明中来自人来源的恒定区指亚类igg1,igg2,igg3,或igg4的人抗体重链恒定区和/或κ或λ轻链恒定区。
[0033]
根据本发明所述的抗体或抗原结合片段还包括具有“保守序列修饰”的结合分子或抗体(“变体”)。这意味着不影响或改变上述特征的核苷酸和氨基酸序列修饰。可以通过本领域已知的技术对核苷酸或氨基酸进行修饰,如位点定向诱变和pcr介导的诱变。在抗体或抗原结合片段中的非必需氨基酸残基可以优选地被来自相同侧链家族的另一种氨基酸残基置换。因此,“变体”抗体或抗原结合片段是指其氨基酸序列与“母体”氨基酸序列相比,具有一个或多个氨基酸的添加、缺失和/或置换。因此本发明所述抗体或抗原结合片段的核苷酸或氨基酸序列均包括具有“保守序列修饰”与母体核苷酸或氨基酸具有至少80%、85%、90%、95%、98%、99%或以上同源性的序列。
[0034]
本发明的术语“嵌合抗体”指抗体包括来自一种来源或物种的抗体可变结构域,以及源自另外来源或物种的恒定区的至少一部分,通常通过重组dna技术进行制备。例如,在一个实施方案中,包括鼠可变区和人恒定区的嵌合抗体。
[0035]
本发明的术语“人源化抗体”指抗体的恒定区部分(即ch区和cl区)或抗体全部由人类抗体基因编码。人源化抗体可以大大降低异源抗体对人类机体造成的免疫反应。
[0036]
本发明的术语“宿主细胞”指可以被改造从而产生根据本发明所述的抗体的任何细胞系。在一个实施方案中,将hek293细胞和cho细胞用作宿主细胞。在本技术中,表述“细胞”、“细胞系”和“细胞培养物”可交替使用,且包括他们的后代。
[0037]
本发明的术语“药学上可接受的赋形剂”是指能够递送本发明有效量活性分子、不干扰活性分子生物活性并且对宿主或者患者无毒副作用的任何制剂或载体介质,包括任何本领域普通技术人员已知的溶剂、分散介质、表面活性剂、抗氧剂、防腐剂(例如抗菌剂、抗真菌剂)、等张剂、吸收延迟剂、盐、防腐剂、药物、药物稳定剂、粘合剂、赋形剂、崩解剂、润滑剂、甜味剂、矫味剂、染料等及其组合。优选地,所述赋形剂适合用于眼内、静脉内、肌内、皮下、肠胃外、关节内等方式给药。
[0038]
说明书附图
[0039]
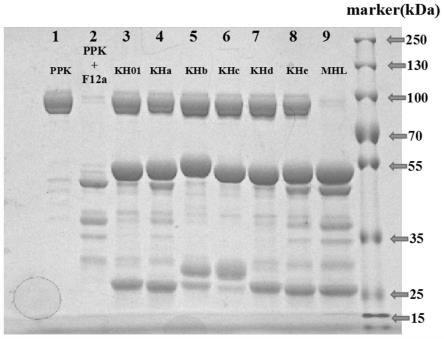
图1为pk前体活性检测的部分sds-page的条带
[0040]
图2为恒河猴眼底荧光素钠血管造影评分标准图(以视网膜微血管渗漏严重情况从0-10分进行评分,生理盐水组ffa图片为0分,以只给予ca-i组为8分,透光不完全,眼底模糊不清为9分,无法透光(动物无光感)为10分)
[0041]
图3为恒河猴视网膜微血管渗漏严重情况评分结果
[0042]
图4为恒河猴眼底荧光素钠血管造影图
具体实施方式
[0043]
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。
[0044]
本发明描述的抗体重轻链的cdr移植,pcr引入位点突变及突变文库的筛选是通过常规基因重组技术及基于抗原抗体相互作用的免疫学技术所完成,具体实验方法步骤如《《分子克隆》》第三版(joseph sambrook,科学出版社,2002年8月1日)及类似实验手册所记载。
[0045]
实施例一小鼠免疫及杂交瘤筛选:采用标准腹腔免疫或足底免疫两种方式对balb/c雌性小鼠(鼠龄6-8周,购于达硕实验动物有限公司)进行免疫,10ug抗原human kallikrein(enzyme research,货号:3792a)/只小鼠,每2至3周进行一次注射,所有小鼠初次免疫使用等体积cfa(sigma,货号:slbw7430)与抗原humankallikrein(enzyme research,货号:3792a),混合乳化,冲刺免疫前的加强免疫(约第二次免疫-第四次免疫)使用ifa(sigma,货号:f5506)免疫;在融合前三天对小鼠进行冲刺免疫,融合前冲刺免疫所用抗原human kallikrein为pbs配制(20ug/只小鼠)。拧脖处死小鼠,用70%乙醇浸泡小鼠5min进行消毒。摘取脾脏及淋巴结,适当研磨脾脏和淋巴结,分别将获得的淋巴b细胞或脾脏b细胞同p3x63ag8.653骨髓瘤细胞(货号:crl-1580,购于atcc)或fo骨髓瘤细胞(货号:tcm31,购于中科院细胞库)按一定比例进行混合,使用电融合仪进行融合。在杂交瘤细胞恢复到最佳状态时,进行elisa检测。根据elisa检测检测结果,挑选阳性杂交瘤细胞扩大培养。2-3天后进行第二次检测(结合elisa与功能活性),将有功能活性的杂交瘤细胞株扩大培养。使用trizol法提取杂交瘤细胞的总rna,取5μg总rna进行反转录,得到cdna;然后以cdna为模板,使用5’race技术进行pcr扩增,将pcr产物连接进酶切载体pcdna3.4中,连接产物通过热激转化进感受态stellar competent cells中,进行菌落pcr鉴定,将阳性克隆提取少量质粒送测序,获得杂交瘤抗体基因轻重链可变区序列。
[0046]
实施例二、嵌合抗体构建:根据小鼠杂交瘤抗体可变区基因序列与人轻重链恒定区设计引物,对小鼠杂交瘤抗体轻重链可变区基因序列进行pcr扩增,得到嵌合抗体q片段;对人轻链恒定区和人重链恒定区(higg4或者higg1)pcr扩增,得到嵌合抗体h片段;利用同源重组的方法将q片段和h片段同时连接进酶切载体pcdna3.4中。将测序正确的质粒转染进expicho细胞或者hek293细胞进行蛋白表达,细胞培养约7-10天左右,离心收集细胞上清;细胞上清利用akta蛋白纯化仪进行亲和纯化,得到嵌合抗体蛋白。
[0047]
实施例三、抗体人源化:由于鼠源抗体容易引起人的hama反应,为了减少鼠源抗体在人体内的的免疫原性,需要对鼠源抗体进行人源化抗体改造。本实施例采用传统的cdr移植,框架改组和关键氨基酸回复突变设计等方法,对多个候选分子进行人源化。具体方法为
首先通过ncbi数据库比对,将鼠源抗体轻重链cdr区分别移植进与之序列高度相似的人胚系基因fr区中,得到人源化后的抗体可变区;然后利用同源重组方法分别将轻重链的恒定区同相应的抗体可变区进行拼接并连接进表达载体中,通过菌落pcr筛选,测序鉴定获得正确的抗体轻重链表达质粒。然后将测序正确的轻重链质粒转染expicho或hek293细胞中进行表达;7-10天后,细胞上清利用akta蛋白纯化仪进行亲和纯化,得到人源化抗体蛋白。随后将人源化抗体进行活性测定。对优选的抗体分子同母本抗体分子进行序列比较分析,根据氨基酸位置、极性、分子量、空间构象等多方面确定对活性影响较大的氨基酸分子,将这些氨基酸进行回复突变,以进一步增加抗体分子的活性,通过组合筛选最终获得人源化抗体分子。
[0048]
实施例四与人ppk结合亲和力测试
[0049]
用octetqke refurb检测仪检测候选抗体与抗原human prekallikrein(enzyme research,货号:hpk1302)的亲和力,将候选抗体loading于传感器上,与不同浓度的抗原进行结合解离反应,条件为baseline时间:120s,loading时间:300s,association时间:600s,dissociation时间:2000s,反应完成后,用octet分析软件进行结果分析,结果如表2。
[0050]
表2
[0051][0052]
实施例五抑制ppk转化为pk的活性检测方法
[0053]
plasma prekallikrein(血浆前激肽释放酶,ppk)是一个单条氨基酸链的蛋白(分子量为86kd)被factor xiia因子酶切激活(仅切开一个肽键)后成为具有酶活性的plasma kallikrein(血浆激肽释放酶,pk),分子量仍为86kd,为一个二硫键相连的双条肽链蛋白(52kd+36/33kd),通过还原sds-page能将ppk和pk两个蛋白明显区分,基于此可检测抗体分子是否可抑制factor xiia酶切ppk转变为pk。该样品反应体系为15μl,主要有ppk蛋白250μ
g/ml、factor xiia因子250ng/ml、抗体蛋白500μg/ml,稀释液为检测缓冲液。首先将ppk蛋白和抗体蛋白样品用检测缓冲液配制好,37℃恒温箱反应45min,然后加入factor xiia因子,37℃恒温箱反应45min。反应结束后加入5μl的4
×
loading buffer,100℃,10min,终止反应。然后进行sds-page电泳,每孔上样量为10μl,5%浓缩胶(80v,40min),12%分离胶(120v,1h),待溴酚蓝跑至胶的底部即可。待电泳完成后,取出凝胶,纯化水冲洗后加入sds-page瞬蓝染色液染色5-15min;染色完成后,用纯化水脱色至背景色变浅,最后使用凝胶成像系统image lab拍照。
[0054]
图1结果显示:ppk是一个单条氨基酸链的蛋白,分子量为86kd,还原sds-page为单条带(见泳道1)。加入f12a因子ppk被酶切为pk,pk分子量仍为86kd,为一个二硫键相连的双条肽链蛋白,经过蛋白变性处理后,pk分成分子量分别为52kd和36/33kd的肽链(见泳道2)。加入抗体分子后,可以显著抑制f12a因子酶切ppk(见泳道3-8);而不具有ppk活性的mhl则不能抑制ppk被酶切(见泳道9)。其中kha-e为鼠源抗体分子,通过如实施例一所述的杂交瘤筛选获得。
[0055]
实施例六、人血浆活性检测方法
[0056]
人血浆中存在ppk、pk等蛋白,但通过检测发现人血浆原液或稀释液中pk并不显现出活性,可能是一个酶活抑制的平衡状态。如果额外加入factor xiia因子将打破平衡,产生具有酶活性的pk蛋白,以此原理检测pk抑制剂的活性。首先是抗体样品准备,用检测缓冲液(20mm tris-hcl,ph=7.50、150mm nacl、1mm edta、0.1%peg-8000和0.1%triton x-100)将抗体蛋白进行稀释至200μg/ml作为起始浓度,进行4倍梯度稀释,共11个浓度梯度,稀释好后待用。用检测缓冲液将人血浆稀释40倍,factor xiia因子稀释至100ng/ml,底物肽(h-pro-phe-arg-amc)稀释至1000μm备用。分别吸取50μl检测缓冲液及稀释后的各个浓度梯度抗体蛋白溶液加至96孔不透光酶标板;另取20μl人血浆40倍稀释样至上述96孔板中,37℃孵育30min;再加入浓度为100ng/ml factor xiia 20μl,37℃孵育45min;最后向上述96孔不透光酶标板各孔中加入浓度1000μm底物肽(h-pro-phe-arg-amc)10μl。将准备好的96孔板放入多功能酶标仪(spectra max i3x)进行检测,检测参数:激发光360nm、发射光480nm,每60s读一次,共读10min。将酶反应速率(斜率)进行归一化处理后与浓度(nm)进行四参数曲线拟合,计算出ic50(nm),具体结果见表3。
[0057]
表3
[0058]
[0059][0060]
实施例七、动物药效研究
[0061]
1、灵长类动物疾病模型构建
[0062]
在糖尿病视网膜病变病人的玻璃体内,有显著的碳酸酐酶i(ca-i)过量表达。ca-i的表达量增加会引起玻璃体内微环境的改变,从而激发kks信号通路的激活,引起视网膜血管通透性增加,导致病人的视网膜血管渗漏和黄斑水肿(dme)。向恒河猴(4岁,3.2-4.9kg)玻璃体内注射碳酸酐酶量为0.4mg—0.55mg/眼,30min荧光素眼底血管造影(ffa)观察微血管渗漏越严重。
[0063]
2、含有受试药物的辅料配方见表3:
[0064]
表3受试药物的辅料配方
[0065]
蔗糖50mg/ml精氨酸17.42mg/ml吐温200.5mg/ml枸橼酸2.1mg/ml盐酸调ph至7.5
[0066]
3、给药方式
[0067]
将受试药物(kh34)(25μg/眼、5μg/眼、1μg/眼)玻璃体注射给药,次日进行碳酸酐酶玻璃体注射造模。造模后30min通过眼底荧光素钠血管造影(ffa)观测药物分子对ca-i诱导视网膜血管渗漏的抑制作用,评价候选分子在灵长类dme疾病模型下的动物药效。
[0068]
4、实验结果
[0069]
评分标准:以视网膜微血管渗漏严重情况从0-10分进行评分,生理盐水组ffa图片为0分,以只给予ca-i组为8分,透光不完全,眼底模糊不清为9分,无法透光(动物无光感)为10分。具体图片见图2。
[0070]
实验研究评分结果见图3,眼底荧光素钠血管造影见图4(受试药物每组4只眼睛),本发明药物能显著抑制视网膜血管渗漏。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1