一种鹅星状病毒、鹅坦布苏病毒检测引物组和方法
1.本发明涉及分子生物学技术领域,更具体的说是涉及一种鹅星状病毒、鹅坦布苏病毒检测引物组和方法。
背景技术:
2.雏鹅痛风是由鹅星状病毒引起的一种以内脏器官和关节尿酸盐沉积为主要特征的鹅新型传染病,给我国鹅养殖业造成严重经济损失。鹅坦布苏病是由黄病毒引起的一种以产蛋下降、脑炎样神经症状和传染性卵巢炎为主要症状的鹅传染病,该病严重危害养鹅业的发展。
3.目前已报道的用于检测goastv和tmuv的方法主要包括病毒分离培养、 rt-pcr、rt-qpcr、环介导等温扩增(lamp)和下一代测序等。临床中较为常用的是常规pcr,传统的pcr检测方法灵敏度较低,实时荧光定量pcr检测需要昂贵的仪器,lamp检测则较容易被污染。
4.因此,如何提供一种鹅星状病毒、鹅坦布苏病毒检测引物组和方法是本领域技术人员亟需解决的问题。
技术实现要素:
5.有鉴于此,本发明提供了一种鹅星状病毒、鹅坦布苏病毒检测引物组和方法。
6.本发明建立了一种特异性好,灵敏度高的双重nano-pcr检测方法,用于临床样品中goastv和tmuv的快速检测,为今后相关疾病的检测和试剂盒的研制奠定基础
7.为了实现上述目的,本发明采用如下技术方案:
8.一种鹅星状病毒、鹅坦布苏病毒检测引物组,包括:引物goastv-nano-f、引物goastv-nano-r;引物tmuv-nano-f、引物tmuv-nano-r;引物 goastv-nano-f的序列如seq id no.1所示,引物goastv-nano-r的序列如 seq id no.2所示,引物tmuv-nano-f的序列如seq id no.3所示,引物 tmuv-nano-r的序列如seq id no.4所示。
9.本发明还提供了含有上述引物组的试剂或试剂盒。
10.本发明还提供了一种非诊断治疗目的使用nano-pcr检测鹅星状病毒、鹅坦布苏病毒的方法,nano-pcr使用上述的引物组。
11.优选的:包括以下步骤:
12.(1)提取待测样品的总rna,反转录为cdna;
13.(2)建立nano-pcr反应体系,利用引物组进行nano-pcr反应;
14.(3)将pcr反应产物检测,当样品扩增出458bp和872bp条带时,说明该样品含鹅星状病毒、鹅坦布苏病毒;当样品只扩增出458bp条带时,说明该样品含鹅星状病毒;当样品只扩增出872bp时,说明该样品含鹅坦布苏病毒。
15.优选的:步骤(2)中nano-pcr反应体系为25μl:5u/μl taq enzymemix 0.4μl,2
×
nano-qpcrbuffer 12.5μl,goastv和tmuv阳性质粒模板各1μl,10μm引物goastv-nano-f、引
物goastv-nano-r、引物 tmuv-nano-f、引物tmuv-nano-r各0.5μl,ddh2o 8.1μl。
16.优选的:步骤(2)中nano-pcr反应条件为:94℃预变性3min;94℃变性30s,50℃退火30s,72℃延伸1min,循环35次;72℃延伸10min。
17.经由上述的技术方案可知,与现有技术相比,本发明公开提供了一种鹅星状病毒、鹅坦布苏病毒检测引物组和方法,取得的技术效果为nano-pcr 是将纯金纳米颗粒(1~100纳米)形成提高热导率的胶体纳米流体的聚合酶链式反应的高级形式,减少了在非目标温度下的时间、非特异性扩增和增加特异性扩增。
18.本发明根据goastv和tmuv各自的保守基因序列设计分别设计了一对特异性引物,扩增的目的片段大小分别为458bp和872bp,大小差别在200bp 以上,易于通过琼脂糖凝胶电泳进行区分,成功建立了一种能够同时检测 goastv和tmuv的特异性强、敏感性高的nano-pcr检测方法,对goastv 和tmuv阳性质粒的最小检浓度分别为1.21
×
101copies/μl和1.21
×
10
3 copies/μl,敏感性分别是用相同引物的普通pcr的100倍和10倍,对gpv、 gocv、ndv和fadv4种鹅常见病毒均无扩增,具有较好的特异性。临床样品的检测结果显示,goastv和tmuv阳性率分别为45%(9/20)和5%(1/20),说明在齐齐哈尔地区鹅群中的goastv感染率相对较高,存在tmuv感染。
附图说明
19.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
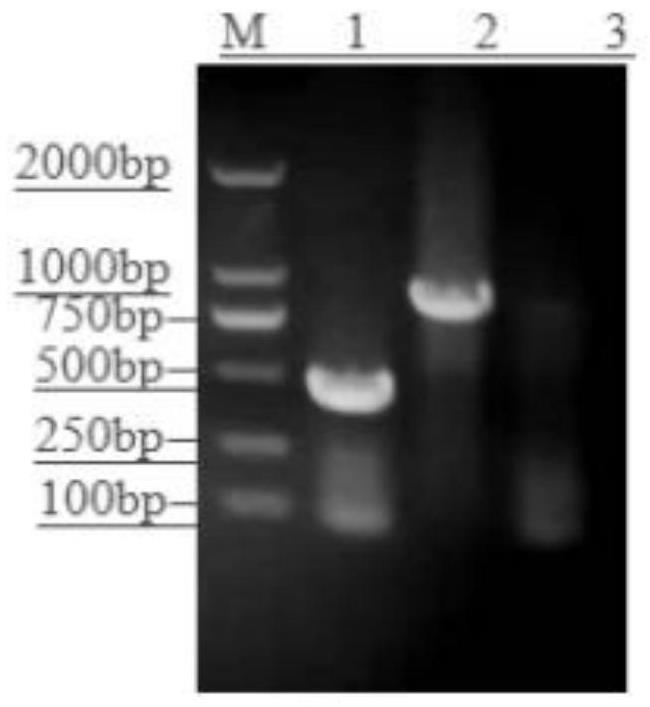
20.图1附图为本发明提供的pcr扩增图,其中,m:dl2000 marker;1: nano-pcrproduct ofgoastv;2:nano-pcrproduct oftmuv;3:阴性对照。
21.图2附图为本发明提供的双重nano-pcr退火温度的优化图,其中,m: dl2000 marker;1:50℃;2:51℃;3:52℃;4:53℃;5:54℃;6:55℃; 7:阴性对照。
22.m:dl2000 marker;1:50℃;2:51℃;3:52℃;4:53℃;5:54℃; 6:55℃。
23.图3附图为本发明提供的双重nano-pcr引物浓度的优化图,其中,m: dl2000 marker;1:0.2μm;2:0.3μm;3:0.4μm;4:0.5μm。
24.图4附图为本发明提供的双重nano-pcr的特异性扩增结果图,m: dl2000 marker;1:goastv+tmuv;2:tmuv;3:goastv;4:gpv;5: gocv;6:ndv;7:fadv;8:阴性对照。
25.图5附图为本发明提供的双重nano-pcr敏感性扩增结果图,其中,m: dl2000 marker;1~9:分别为1.21
×
108copies/μl~1.21
×
100copies/μl。
26.图6附图为本发明提供的双重pcr敏感性扩增结果图,其中,m:dl2000 marker;1~9:分别为1.21
×
108copies/μl~1.21
×
100copies/μl。
具体实施方式
27.下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他
实施例,都属于本发明保护的范围。
28.本发明实施例公开了一种鹅星状病毒、鹅坦布苏病毒检测引物组和方法。
29.实施例1
30.材料与方法
31.病毒
32.goastv、tmuv、gpv、gocv、fadv均由黑龙江省农业科学院畜牧兽医分院畜禽疾病诊疗技术研究室保存,新支流三联疫苗购自哈药集团生物疫苗有限公司。
33.主要试剂
34.一般性扩增纳米pcr试剂盒购自上海沪峥生物科技有限公司,总rna 提取试剂盒购自元亨公司,t载体pcr产物快速连接试剂盒、质粒提取试剂盒和胶回收试剂盒购自生工生物工程(上海)股份有限公司,primescripttmrtreagent kit with gdna eraser和taq酶购自宝日医生物技术(北京)有限公司, 2
×
taqpcrmastermix ii购自天根生化科技(北京)有限公司。
35.方法
36.引物的设计与合成
37.根据genbank上发已表的goastv毒株(基因登录号:mh052598.1)和 tmuv(基因登录号:jf895923.2)各自基因序列,利用oligo7.0、primer5.0 和dnastar软件分别设计引物,引物由生工生物工程(上海)股份有限公司合成。引物序列如下:goastv-nano-f,5
’‑
tcagggaaaacggcaacc-3’,如seq id no.1所示;goastv-nano-r,5
’‑
ggcagaggcaggtaatcg
‑ꢀ3’
,如seq id no.2所示;tmuv-nano-f,5
’‑
atgcttcctgaccactt cgct-3’,如seq id no.3所示,tmuv-nano-r,5
’‑
ccatcaaccacg ggatttttc-3’,如seq id no.4所示,扩增片段大小分别为458bp和8 72bp。
38.模板质粒的制备
39.按照总rna提取试剂盒说明书上所述方法提取goastv和tmuv总 rna,按照反转录试剂盒说明书上所述步骤进行反转录制备cdna。已反转录所制备的cdna为模板、所设计的两对引物为引物,按照下述pcr反应体系进行pcr扩增。pcr反应体系(20μl):2
×
pcr mix10μl,ddh2o 3 μl,goastv或tmuv上下游引物(10μmol/l)各1.0μl;模板dna 3μ l。反应条件为:94℃预变性3min;94℃变性30s,51℃退火30s,72℃延伸1min,循环35次;72℃延伸10min。
40.扩增产物经1.2%琼脂糖凝胶电泳鉴定大小与预期相近后进行胶回收和纯化。按照t载体连接试剂盒说明书上方法将回收产物与t载体相连,转化至 dh5α感受态细胞中,挑取菌落进行pcr鉴定(体系程序同上20μlpcr反应体系)重组质粒,将鉴定正确的重组质粒送上海生工测序,测序结果正确的阳性重组质粒保存于-20℃备用。
41.pcr扩增和阳性重组质粒的鉴定
42.以反转录的goastv和tmuv的cdna为模板,按照上述的反应体系和反应条件进行pcr扩增,扩增产物经1.2%的琼脂糖凝胶电泳分析,结果特异性扩增出相应目的条带,大小分别为458bp和872bp,与预期大小相符,结果见图1。经pcr鉴定和测序分析结果表明,成功构建了goastv和tmuv t 载体阳性重组质粒。
43.对比实验
44.双重nano-pcr扩增及反应条件的优化(退火温度和引物浓度)
45.nano-pcr扩增体系(25μl):taq enzyme mix(5u/μl)0.4μl, 2
×
nano-qpcrbuffer 12.5μl,goastv和tmuv阳性质粒模板各1μl,10μm 引物goastv-nano-f、引物goastv-nano-r、引物tmuv-nano-f、引物tmuv-nano-r各0.5μl,ddh2o 8.1μl。反应条件为:94℃预变性3min;94℃变性30s,51℃退火30s,72℃延伸1min,循环35次;72℃延伸10min。
46.按照上述利用上述nano-pcr扩增体系中的反应条件进行扩增,对退火温度(退火温度在50~55℃之间设置6个梯度)和引物终浓度进行优化(引物终浓度选择0.2μm、0.3μm、0.4μm和0.5μm 4个浓度)。
47.通过对退火温度和引物浓度进行优化,最终确定当退火温度为50℃,引物浓度为0.2μm时,goastv和tmuv的目的基因片段均能得到较好扩增,优化扩增产物经1.2%的琼脂糖凝胶电泳分析结果如图2和3所示。
48.实施例2
49.特异性检测
50.以所构建的goastv和tmuv阳性质粒为标准阳性对照,以ddh2o为标准阴性对照,用所建立的双重nano-pcr检测方法对、gocv、ndv和fadv 的dna或cdna模板进行扩增以验证所建立方法的特异性。
51.特异性检测结果显示,所建立的双重nano-pcr检测方法能够特异性扩增 goastv和tmuv,而对gpv、gocv、ndv、fadv四种病毒均无扩增,结果见图4,表明所建立的双重nano-pcr检测方法具有较好的特异性。
52.实施例3
53.敏感性检测
54.测定goastv和tmuv阳性重组质粒的浓度,用灭菌超纯水将它们调节为相同浓度并进行10倍倍比稀释,共稀释9个浓度梯度,即1.21
×
10
8 copies/μl~1.21
×
100copies/μlcopies/μl。
55.敏感性检测结果显示,所建立的双重nano-pcr检测方法对goastv和 tmuv阳性重组质粒的最低检出浓度为分别为1.21
×
101拷贝/μl和1.21
×
103拷贝/μl。扩增敏感性较双重pcr分别高100倍和10倍,表明所建立的双重 nano-pcr检测方法具有较高的敏感性,结果如图5和图6所示。
56.实施例4
57.临床样品的检测
58.将人工混合的阳性样品和采集自齐齐哈尔及其周边地区的20份临床鹅样品按照试剂盒所述方法制备为制备模板,用上述所建立的双重nano-pcr检测方法进行检测。
59.共检测出goastv 9份,tmuv 1份,阳性率分别为45%(9/20)和5% (1/20)。表明所建立的双重nano-pcr检测方法能够用于goastv和tmuv 临床样品的检测。
60.本说明书中各个实施例采用递进的方式描述,每个实施例重点说明的都是与其他实施例的不同之处,各个实施例之间相同相似部分互相参见即可。
61.对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一
致的最宽的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1