有机化合物及包含该有机化合物的有机电致发光元件的制作方法
1.本发明涉及有机化合物及包含该有机化合物的有机电致发光元件。
背景技术:
2.与现有的液晶显示器(lcd)、等离子显示面板(pdp)和场发射显示器(fed)等其他平板显示元件相比,有机电致发光元件(oled)结构简单,在制作工艺上具有各种优点,具有高亮度和优异的视场角特性,响应速度快,驱动电压低,因此被积极地进行开发及商品化,使其能够用于如挂壁式电视的平板显示器或显示器的背光、照明、广告牌等的光源。
3.就有机电致发光元件而言,由伊士曼柯达公司的唐(c.w.tang)等人报告了最初的有机el元件,(c.w.tang,s.a.vanslyke,应用物理通讯(applied physics letters),51卷913页,1987年),其发光原理通常是基于,当施加电压时,从阳极注入的空穴和从阴极注入的电子重组,形成激子,即电子-空穴对,通过将该激子的能量传递到发光材料以转换为光。
4.更具体而言,有机电致发光元件具有包括阴极(电子注入电极)和阳极(空穴注入电极)及上述两个电极之间一个以上的有机层的结构。此时,有机电致发光元件从阳极开始以空穴注入层(hole injection layer,hil)、空穴传输层(hole transport layer,htl)、发光层(light emitting layer,eml)、电子传输层(electron transport layer,etl)或电子注入层(electron injection layer,eil)的顺序层叠,为提高发光层的效率,可将空穴传输辅助层或空穴阻挡层(hole blocking layer,hbl)分别进一步包括在发光层的前后。
5.在有机电子元件中用作有机物层的材料根据功能可分为发光材料和电荷传输材料,例如,穴注入材料、空穴传输材料、电子传输材料、电子注入材料等。
6.寿命和效率是有机电子发光元件的最大问题,随着显示器变得越来越大,这些效率和寿命问题必须得到解决。效率和寿命、驱动电压等是相互关联的,当效率提高时,驱动电压相对降低,随着驱动电压下降,由于驱动时所产生的焦耳热(joule heating)导致的有机物质的结晶化减少,结果,表现出寿命增加的倾向。
7.然而,简单地改善所述有机物层不能使效率极大化。这是因为,当各有机物层之间的能级以及t1值、物质的固有性质(迁移率(mobility)、界面性质等)等实现最佳组合时,才可以同时实现长寿命和高效率。
8.并且,近年来,在有机电致发光元件中,为了解决空穴传输层中的发光问题,在空穴传输层和发光层之间必须存在发光辅助层,并且根据每个发光层(红(r)、绿(g)、蓝(b))需开发互不相同的发光辅助层。
9.通常,电子(electron)从电子传输层传递到发光层,空穴(hole)从空穴传输层传递到发光层,并通过复合(recombination)生成激子(exciton)。
10.然而,就用于空穴传输层的物质而言,由于需具有低的homo值,因此大部分具有低的t1值,由此,在发光层中生成的激子(exciton)被转移到空穴传输层,导致发光层内电荷不平衡(charge unbalance),这导致在空穴传输层界面处发光。
11.当空穴传输层界面发光时,发生有机电元件的色纯度及效率下降、寿命变短的问
题。因此,迫切需要具有高t1值并具有空穴传输层homo能级与发光层的homo能级之间的homo能级的发光辅助层。
12.现有技术文献
13.非专利文献
14.(非专利文献1)克雷布斯、弗雷德里克.c等(krebs,frederik c.,et al.),“一种分子热电物质,4,8,12-三氧杂-12c-磷杂-4,8,12,12c-四氢二苯并[cd,mn]芘的合成、结构和特性(synthesis,structure,and properties of 4,8,12-trioxa-12c-phospha-4,8,12,12c-tetrahydrodibenzo[cd,mn]pyrene,a molecular pyroelectric.)”,美国化学会志(journal of the american chemical society),119.6(1997年):1208-1216页。
技术实现要素:
[0015]
发明要解决的问题
[0016]
本发明的目的在于,能够提供一种新型有机化合物及包含该有机化合物的有机电致发光元件。
[0017]
本发明的另一目的在于,能够提供一种可具有较高的玻璃转化温度及热稳定性的新型有机化合物。
[0018]
本发明又一目的在于,提供一种有机电致发光元件,其具有优异的空穴传输特性,并通过降低空穴传输层与发光层之间的homo能级差,调节空穴注入特性,减少发光层界面的空穴蓄积,从而降低驱动电压并显著改善发光效率及寿命特性。
[0019]
用于解决问题的手段
[0020]
为了实现本发明不同的上述目的,本发明提供一种以下述化学式1表示的化合物:
[0021]
[化学式1]
[0022][0023]
其中,
[0024]
n、m及o彼此相同或不同,各自独立地为0至5的整数,
[0025]
p为0或1的整数,
[0026]
x1为n、o或s,
[0027]
a环、b环及c环彼此相同或不同,各自独立地为取代或未取代的碳原子数为6至30的芳基或者取代或未取代的碳原子数为5至60的杂芳基,
[0028]
r1至r4彼此相同或不同,各自独立地选自由氢、氘、氰基、硝基、卤素基、羟基、取代或未取代的碳原子数为1至4的烷硫基、取代或未取代的碳原子数为1至30的烷基、取代或未取代的碳原子数为3至20的环烷基、取代或未取代的碳原子数为2至30的烯基、取代或未取代的碳原子数为2至24的炔基、取代或未取代的碳原子数为7至30的芳烷基、取代或未取代的碳原子数为6至30的芳基、取代或未取代的碳原子数为5至60的杂芳基、取代或未取代的
碳原子数为6至30的杂芳烷基、取代或未取代的碳原子数为1至30的烷氧基、取代或未取代的碳原子数为1至30的烷基氨基、取代或未取代的碳原子数为6至30的芳氨基、取代或未取代的碳原子数为7至30的芳烷基氨基、取代或未取代的碳原子数为2至24的杂芳氨基、取代或未取代的碳原子数为1至30的烷基甲硅烷基、取代或未取代的碳原子数为6至30的芳基甲硅烷基及取代或未取代的碳原子数为6至30的芳氧基组成的组,并能够与相邻的基团彼此键合以形成取代或未取代的环。
[0029]
并且,本发明涉及一种有机电致发光元件,包括:第一电极;与上述第一电极相对的第二电极;及介于上述第一电极与上述第二电极之间的一个以上的有机物层。其中,上述一个以上的有机物层包含以上述化学式1表示的化合物。
[0030]
在本发明中,除非有特别限定,则“氢”为氢、氕、氘或氚。
[0031]
在本发明中,“卤素基”为氟、氯、溴或碘。
[0032]
在本发明中,“烷基”是指源自碳原子数为1至40的直链或支链的饱和烃的一价取代基。作为例子,可举出甲基、乙基、丙基、异丁基、仲丁基、戊基、异戊基、己基等,但不限于此。
[0033]
在本发明中,“烯基(alkenyl)”是指源自具有一个以上碳-碳双键的碳原子数为2至40的直链或支链的不饱和烃的一价取代基。作为例子,可举出乙烯基(vinyl)、烯丙基(allyl)、异丙烯基(isopropenyl)、2-丁烯基(2-butenyl)等,但不限于此。
[0034]
在本发明中,“炔基(alkynyl)”是指源自具有一个以上碳-碳三键的碳原子数为2至40的直链或支链的不饱和烃的一价取代基。作为例子,可举出乙炔基(ethynyl)、2-丙炔基(2-propynyl)等,但不限于此。
[0035]
在本发明中,“烷硫基”是指通过硫键(-s-)键合的上述记载的烷基。
[0036]
在本发明中,“芳基”是指源自单环或两个以上的环结合的碳原子数为6至60的芳香族烃的一价取代基。并且,可包括两个以上的环侧连(pendant)或稠合的形式,具体地,萘基、蒽基、菲基、三苯基、芘基、非那烯基(phenalenyl)、苝基、屈基、芴基等,但不限于此。所述芴基可以被取代,相邻的基团可以相互结合形成环。
[0037]
在本发明中,“杂芳基”是指源自具有碳原子数为6至30的单杂环或多杂环芳香族烃的一价取代基。此时,环中一个以上的碳,优选为1至3个碳被杂原子如n、o、s或se取代。并且,可包括两个以上的环彼此侧连(pendant)或稠合的形式,还可包括与芳基稠合的形式。作为这种杂芳基的例子,可举出如吡啶基、吡嗪基、嘧啶基、哒嗪基、三嗪基等6元单环,如酚噻吩基(phenoxathienyl)、吲哚嗪基(indolizinyl)、吲哚基(indolyl)、嘌呤基(purinyl)、喹啉基(quinolyl)、苯并噻唑(benzothiazole)、咔唑基(carbazolyl)的多环,以及2-呋喃基,n-咪唑基,2-异恶唑基,2-吡啶基,2-嘧啶基等,但不限于此。
[0038]
在本发明中,“芳氧基”是以ro-表示的一价取代基,上述r指碳原子数为6至60的芳基。作为这种芳氧基的例子,可举出苯氧基、萘氧基、二苯氧基等,但不限于此。
[0039]
在本发明中,“烷基氧基”是以r'o-表示的一价取代基,上述r'指碳原子数为1至40的烷基,可包括直链(linear)、支链(branched)或环状(cyclic)结构。作为烷基氧基的例子,可举出甲氧基、乙氧基、正丙氧基、1-丙氧基、叔丁氧基、正丁氧基、戊氧基等,但不限于此。
[0040]
在本发明中,“烷氧基”可以是直链、支链或环链。烷氧基的碳原子数没有特别的限
制,优选为碳原子数为1至20。具体地,可以为甲氧基、乙氧基、正丙氧基、异丙氧基(isopropoxy)、异丙氧基(i-propyloxy)、正丁氧基、异丁氧基、叔丁氧基、仲丁氧基、正戊氧基、新戊氧基、异戊氧基、正己氧基、3,3-二甲基丁氧基、2-乙基丁氧基、正辛氧基、正壬氧基、正癸氧基、苄氧基、对甲基苄氧基等,但不限于此。
[0041]
在本发明中,“芳烷基”指芳基以及烷基构成的如上所述的芳基-烷基基团。优选的芳烷基包括低级烷基基团。优选的芳烷基基团的非限制性的例子包括苄基、2-苯乙基以及萘甲基。与母体残基的键合通过烷基实现。
[0042]
在本发明中,“芳氨基”指被碳原子数为6至30的芳基取代的胺。
[0043]
在本发明中,“烷基氨基”指被碳原子数为1至30的烷基取代的胺。
[0044]
在本发明中,“芳烷基氨基”指被碳原子数为6至30的芳基-烷基取代的胺。
[0045]
在本发明中,“杂芳氨基”指被碳原子数为6至30的芳基以及杂环基取代的胺基。
[0046]
在本发明中,“杂芳烷基”指被杂环基取代的芳基-烷基基团。
[0047]
在本发明中,“环烷基”是指源自碳原子数为3至40个的单环或多环非-芳香族烃的一价取代基。作为这种环烷基的例子,可举出如环丙基、环丁基、环戊基、环己基、降冰片基(norbornyl)、金刚烷(adamantine)等,但不限于此。
[0048]
在本发明中,“杂环烷基”是指源自碳原子数为3至40个的非-芳香族烃的一价取代基,环中一个以上碳,优选1至3个碳被杂原子如n、o、s或se取代。作为这种杂环烷基的例子,可举出吗啉、哌嗪等,但不限于此。
[0049]
在本发明中,“烷基甲硅烷基”是指被碳原子数为1至40的烷基取代的甲硅烷基,“芳基甲硅烷基”是指被碳原子数为6至60的芳基取代的甲硅烷基。
[0050]
在本发明中,“稠合环”是指稠合脂肪族环、稠合芳香族环、稠合杂脂肪族环、稠合杂芳香族环或它们组合的形式。
[0051]
在本发明中,“与相邻基团相互键合形成环”是指,与相邻的基团相互键合形成取代或未取代的脂肪族烃环;取代或未取代的芳香族烃环;取代或未取代的脂肪族杂环;取代或未取代的芳香族杂环;或它们的稠合环。
[0052]
在本发明中,“芳香族烃环”的例子有苯基、萘基、蒽基等,但不限于这些。
[0053]
在本发明中,“脂肪族杂环”是指包含一个以上杂原子的脂肪族环。
[0054]
在本发明中,“芳香族杂环”是指包含一个以上杂原子的芳香族环。
[0055]
在本发明中,“取代”是指与化合物的碳原子键合的氢原子被其他取代基替换,对于取代的位置而言,只要是氢原子能被取代的位置,即取代基可取代的位置,则对于取代的位置没有限制,两个以上被取代时,两个以上的取代基彼此相同或不同。就上述取代基而言,可被选自由氢、氰基、硝基、卤素基、羟基、碳原子数为1至30的烷基、碳原子数为2至30的烯基、碳原子数为2至24的炔基、碳原子数为2至30的杂烷基、碳原子数为6至30的芳烷基、碳原子数为6至30的芳基、碳原子数为2至30的杂芳基、碳原子数为3至30的杂芳烷基、碳原子数为1至30的烷氧基、碳原子数为1至30的烷基氨基、碳原子数为6至30的芳氨基、碳原子数为7至30的芳烷基氨基、碳原子数为2至24的杂芳氨基、取代或未取代的碳原子数为1至30的烷基甲硅烷基、取代或未取代的碳原子数为6至30的芳基甲硅烷基及取代或未取代的碳原子数为6至30的芳氧基组成的组中的一个以上的取代基取代,但不限于上述示例。
[0056]
发明的效果
[0057]
本发明涉及具有较高的玻璃转化温度及热稳定性的新型有机化合物,上述新型有机化合物被用作有机电致发光元件的材料,具有优异的空穴传输特性,并通过降低空穴传输层与发光层之间的homo能级差,调节空穴注入特性,减少发光层界面的空穴蓄积,从而降低驱动电压并显著改善发光效率及寿命特性。
具体实施方式
[0058]
以下,对本发明的实施例进行详细说明,以使本发明所属技术领域的普通技术人员易于实施。然而,本发明可以以各种不同的形式实现,不限于本说明书中说明的实施例。
[0059]
根据本发明的新型有机化合物可具有高玻璃转化温度及热稳定性,尤其,由于具有易于空穴传输的homo能级,因此可用作向发光层的空穴传输特性优异的有机电致发光元件的空穴传输辅助层材料。
[0060]
即使上述本发明的化合物结构具有结晶性下降的特征,但由于该结构彼此形成立体刚性稠合环结构,因此可以降低分子的运动性。相反,相比于环烷基或芳基等结构,就简单的分子结构而言,其分子为非平面结构,通常,像具有长链的烷基一样的非平面化的结构,由于分子的旋转运动或振动运动等特征引起的运动性而可能导致能量损失。如上所述,由于彼此形成立体刚性稠合环结构的本发明的特性,因此具有高耐热性,并且可减少因运动性造成的能量损失。
[0061]
具体地,以下述化学式1表示的化合物如下:
[0062]
[化学式1]
[0063][0064]
其中,
[0065]
n、m及o彼此相同或不同,各自独立地为0至5的整数,
[0066]
p为0或1的整数,
[0067]
x1为n、o或s,
[0068]
a环、b环及c环彼此相同或不同,各自独立地为取代或未取代的碳原子数为6至30的芳基或者取代或未取代的碳原子数为5至60的杂芳基,
[0069]
r1至r4彼此相同或不同,各自独立地选自由氢、氘、氰基、硝基、卤素基、羟基、取代或未取代的碳原子数为1至4的烷硫基、取代或未取代的碳原子数为1至30的烷基、取代或未取代的碳原子数为3至20的环烷基、取代或未取代的碳原子数为2至30的烯基、取代或未取代的碳原子数为2至24的炔基、取代或未取代的碳原子数为7至30的芳烷基、取代或未取代的碳原子数为6至30的芳基、取代或未取代的碳原子数为5至60的杂芳基、取代或未取代的碳原子数为6至30的杂芳烷基、取代或未取代的碳原子数为1至30的烷氧基、取代或未取代的碳原子数为1至30的烷基氨基、取代或未取代的碳原子数为6至30的芳氨基、取代或未取代的碳原子数为7至30的芳烷基氨基、取代或未取代的碳原子数为2至24的杂芳氨基、取代
或未取代的碳原子数为1至30的烷基甲硅烷基、取代或未取代的碳原子数为6至30的芳基甲硅烷基及取代或未取代的碳原子数为6至30的芳氧基组成的组,并能够与相邻的基团彼此键合以形成取代或未取代的环。
[0070]
上述c环可以为取代或未取代的碳原子数为6至30的芳基。
[0071]
具体地,上述化学式1表示的化合物可以是下述化学式9表示的化合物:
[0072]
[化学式9]
[0073][0074]
其中,
[0075]
n、m、p、a环、b环、x1及r1至r4与上述化学式1中的定义相同。
[0076]
上述a环可以选自由以下述化学式2至化学式4组成的取代基构成的组:
[0077]
[化学式2]
[0078][0079]
[化学式3]
[0080][0081]
[化学式4]
[0082][0083]
其中,
[0084]
*表示键合部分,
[0085]
q为0至5的整数,
[0086]
r及s彼此相同或不同,各自独立地为0至7的整数,
[0087]
y1选自由o、s、se、n(r8)及c(r9)(r
10
)组成的组,
[0088]
r5至r
10
彼此相同或不同,各自独立地选自由氢、氘、氰基、硝基、卤素基、羟基、取代或未取代的碳原子数为1至4的烷硫基、取代或未取代的碳原子数为1至30的烷基、取代或未取代的碳原子数为3至20的环烷基、取代或未取代的碳原子数为2至30的烯基、取代或未取代的碳原子数为2至24的炔基、取代或未取代的碳原子数为7至30的芳烷基、取代或未取代的碳原子数为6至30的芳基、取代或未取代的碳原子数为5至60的杂芳基、取代或未取代的碳原子数为6至30的杂芳烷基、取代或未取代的碳原子数为1至30的烷氧基、取代或未取代的碳原子数为1至30的烷基氨基、取代或未取代的碳原子数为6至30的芳氨基、取代或未取代的碳原子数为7至30的芳烷基氨基、取代或未取代的碳原子数为2至24的杂芳氨基、取代或未取代的碳原子数为1至30的烷基甲硅烷基、取代或未取代的碳原子数为6至30的芳基甲
硅烷基及取代或未取代的碳原子数为6至30的芳氧基组成的组,可与相邻的基团彼此键合以形成取代或未取代的环。
[0089]
上述b环可以选自由以下述化学式5至化学式8组成的取代基构成的组:
[0090]
[化学式5]
[0091][0092]
[化学式6]
[0093][0094]
[化学式7]
[0095][0096]
[化学式8]
[0097][0098]
其中,
[0099]
*表示键合部分,
[0100]
t为0至5的整数,
[0101]
u及x彼此相同或不同,各自独立地为0至7的整数,
[0102]
v及w彼此相同或不同,各自独立地为0至4的整数,
[0103]
y2选自由o、s、se、n(r
16
)及c(r
17
)(r
18
)组成的组,
[0104]r11
至r
18
彼此相同或不同,各自独立地选自由氢、氘、氰基、硝基、卤素基、羟基、取代或未取代的碳原子数为1至4的烷硫基、取代或未取代的碳原子数为1至30的烷基、取代或未取代的碳原子数为3至20的环烷基、取代或未取代的碳原子数为2至30的烯基、取代或未取代的碳原子数为2至24的炔基、取代或未取代的碳原子数为7至30的芳烷基、取代或未取代的碳原子数为6至30的芳基、取代或未取代的碳原子数为5至60的杂芳基、取代或未取代的碳原子数为6至30的杂芳烷基、取代或未取代的碳原子数为1至30的烷氧基、取代或未取代的碳原子数为1至30的烷基氨基、取代或未取代的碳原子数为6至30的芳氨基、取代或未取代的碳原子数为7至30的芳烷基氨基、取代或未取代的碳原子数为2至24的杂芳氨基、取代或未取代的碳原子数为1至30的烷基甲硅烷基、取代或未取代的碳原子数为6至30的芳基甲硅烷基及取代或未取代的碳原子数为6至30的芳氧基组成的组,可与相邻的基团彼此键合以形成取代或未取代的环。
[0105]
其中,所述r3为取代或未取代的金刚烷基。
[0106]
根据本发明的以化学式1表示的化合物选自由下述化合物组成的组,但不限于此:
[0107]
[0108]
[0109]
[0110]
[0111]
[0112]
[0113]
[0114]
[0115]
[0116]
[0117]
[0118]
[0119]
[0120]
[0121]
[0122]
[0123]
[0124]
[0125]
[0126]
[0127]
[0128]
[0129]
[0130]
[0131][0132]
本发明的以上述化学式1表示的化合物可有用地用作空穴传输层或者空穴传输辅助层。
[0133]
上述化合物内包含可使homo上升并可进行微调的取代基,因此随着将本发明的化合物用作有机电致发光元件中的空穴传输层或者空穴传输辅助层物质,可根据注入到发光层的电子迁移率来将空穴迁移率调节到最佳。
[0134]
由于这些特征,当将上述有机化合物用作有机电致发光元件的材料时,可以在发光效率、寿命等大多数的元件特性上表现出等同或优异的特性。
[0135]
本发明提供包含以上述化学式1表示的化合物的有机电致发光元件。
[0136]
本发明的有机化合物可被有用地用作空穴传输层或者空穴传输辅助层材料。
[0137]
并且,本发明涉及在阴极与阳极之间层叠有至少包括发光层的由一层或多层形成的有机薄膜层的有机电致发光元件,上述有机薄膜层为上述第一电极与发光层之间的空穴传输层和/或空穴传输辅助层。
[0138]
上述空穴传输层和/或空穴传输辅助层为以上述化学式1表示的化合物。
[0139]
上述空穴传输辅助层通过降低空穴传输层和发光层之间的homo能级差来控制空穴的注入特性,从而减少空穴传输辅助层和发光层界面处的空穴蓄积,可以减少由极化子(polaron)引起的激子在界面处消失的猝灭现象(quenching)。由此,减少了元件的劣化现象并且使元件稳定,从而提高了效率和寿命。
[0140]
上述有机电致发光元件可具有层叠阳极、空穴注入层、空穴传输层、空穴传输辅助层、发光层、电子传输层、电子注入层及阴极的结构,根据需要还可层叠电子传输辅助层。
[0141]
以下,对本发明的有机电致发光元件进行举例说明。然而,下述示例的内容并不限定本发明的有机电致发光元件。
[0142]
本发明的有机电致发光元件可具有依次层叠阳极(空穴注入电极)、空穴注入层(hil)、空穴传输层(htl)、空穴传输辅助层、发光层(eml)及阴极(电子注入电极)的结构,优选地,可在阳极与发光层之间进一步包括空穴传输辅助层,并在阴极与发光层之间进一步包括电子传输层(etl)、电子注入层(eil)。并且,还可在阴极与发光层之间进一步包括电子
传输辅助层。
[0143]
作为根据本发明的有机电致发光元件的制造方法,首先在基板表面以常规方法涂布阳极用物质来形成阳极。此时,所使用的基板优选为透明度、表面平滑度、处理容易性以及防水性优异的玻璃基板或透明塑料基板。并且,作为阳极用物质,可使用透明且导电性优异的氧化铟锡(ito)、氧化铟锌(izo)、氧化锡(sno2)、氧化锌(zno)等。
[0144]
接着,在上述阳极表面以常规的方法真空热蒸镀或旋涂空穴注入层(hil)物质来形成空穴注入层。作为这种空穴注入层物质可举出铜酞菁(cupc)、4,4',4"-三(3-甲基苯基氨基)三苯胺(m-mtdata)、4,4',4"-三(3-甲基苯基氨基)苯氧基苯(m-mtdapb)、作为星爆(starburst)型胺类的4,4',4"-三(n-咔唑基)三苯胺(tcta)、4,4',4"-三(n-(2-萘基)-n-苯基氨基)-三苯胺(2-tnata)或能在出光兴产(idemitsu)公司购买的ide406。
[0145]
在上述空穴注入层表面以常规的方法真空热蒸镀或旋涂空穴传输层物质来形成空穴传输层。作为上述空穴传输层物质可以使用通常使用的空穴传输层物质,也可以使用根据本发明的以上述化学式1表示的化合物。
[0146]
通过在上述空穴传输层表面真空热蒸镀或旋涂根据本发明的以上述化学式1表示的化合物来形成空穴传输辅助层。如上所述,上述空穴传输辅助层可以使用根据本发明的化合物作为空穴传输辅助层物质,并且还可以使用常用的空穴传输辅助层材料来形成空穴传输辅助层。
[0147]
在上述空穴传输辅助层表面以常规的方法真空热蒸镀或旋涂发光层(eml)物质来形成发光层。此时,所使用的发光层物质中,单独的发光物质或发光主体物质在绿色时可使用三(8-羟基喹啉基)铝(alq3)等,蓝色时可使用alq3、4,4'-n,n'-二咔唑-联苯(4,4'-n,n'-dicabazole-biphenyl,cbp)、聚(正乙烯基咔唑)(poly(n-vinylcabazole),pvk)、9,10-二(萘-2-基)蒽(9,10-di(naphthalene-2-yl)anthracene,adn)、4,4',4"-三(n-咔唑-9-基)三苯胺(tcta)、1,3,5-三(n-苯基苯并咪唑-2-基)苯(1,3,5-tris(n-phenylbenzimidazole-2-yl)benzene,tpbi)、3-叔丁基-9,10-二(萘-2-基)蒽(3-tert-butyl-9,10-di(naphth-2-yl)anthracene,tbadn)、e3、二苯乙烯基亚芳基(distyrylarylene,dsa)或它们中的两种以上的混合物,但不限于此。
[0148]
就在发光层物质中能够与发光主体一起使用的掺杂剂(dopant)而言,可使用能够从出光兴产(idemitsu)购买的ide102、ide105,作为磷光掺杂剂(dopant)可使用三(2-苯基吡啶)合铱(iii)(ir(ppy)3)、双[(4,6-二氟苯基)吡啶基-n,c-2']吡啶甲酰合铱(iii)(firpic)(参考文献[chihaya adachi等,appl.phys.lett.,2001,79,3082-3084])、八乙基卟啉铂(ii)(ptoep)、tbe002(科比恩公司)等。
[0149]
在上述发光层表面以常规的方法真空热蒸镀或旋涂电子传输层(etl)物质来形成电子传输层。此时,对所使用的电子传输层物质没有特别限制,优选地,可使用三(8-羟基喹啉)铝(alq3)。
[0150]
选择性地,在发光层与电子传输层之间进一步形成空穴阻挡层(hbl),并在发光层使用磷光掺杂剂(dopant),可以防止三重态激子或空穴扩散到电子传输层中的现象。
[0151]
空穴阻挡层的形成可通过以常规的方法真空热蒸镀或旋涂空穴阻挡层物质来实施,对空穴阻挡层物质没有特别的限制,但可以优选使用(8-羟基喹啉基)锂(liq)、双(8-羟基-2-甲基喹啉基)-联苯氧基铝(balq)、浴铜灵(bathocuproine,bcp)及氟化锂(lif)等。
[0152]
在上述电子传输层表面以常规的方法真空热蒸镀或旋涂电子注入层(eil)物质来形成电子注入层。此时,电子注入层物质可使用lif、liq、li2o、bao、nacl、csf等物质。
[0153]
在上述电子注入层表面以常规的方法真空热蒸镀阴极用物质来形成阴极。
[0154]
此时,所使用的阴极用物质可有锂(li)、铝(al)、铝-锂(al-li)、钙(ca)、镁(mg)、镁-铟(mg-in)、镁-银(mg-ag)等。并且,前面发光有机电致发光元件可使用氧化铟锡(ito)或氧化铟锌(izo)以形成能够透光的透明阴极。
[0155]
可使用覆盖层形成用组合物在上述阴极的表面形成覆盖层(cpl)。
[0156]
以下,将通过代表性例子来说明上述化合物的合成方法。然而,本发明的化合物的合成方法不限于下述示例的方法,本发明的化合物可通过以下示例的方法和本领域已知的方法制备。
[0157]
[合成例]
[0158]
《合成例1:化合物32的合成》
[0159]
1-1)化合物1-1的合成
[0160][0161]
在氮气气流下,将1-溴金刚烷(215.1g,1000mmol)溶解于的1,3-二氯苯(220.5g,1500mmol)。之后,加入的氯化铝(4.0g,30mmol)并在60℃温度搅拌8小时。反应完成后,使用水和二氯甲烷萃取有机层。用mgso4对萃取的溶液利处理来去除水分,且进行干燥浓缩后,采用柱色谱纯化。之后,利用甲醇进行重结晶而获得了182.8g(收率:65%)的化合物1-1。
[0162]
1-2)化合物1-2的合成
[0163][0164]
在氮气气流下,向圆底烧瓶加入n-苯基-[1,1'-联苯]-4-胺(n-phenyl-[1,1'-biphenyl]-4-amine,21.0g,85.60mmol)、化合物1-1(26.48g,94.16mmol)、t-buona(16.45g,171.2mmol)、pd2(dba)3(1.57g,1.71mmol)、sphos(1.41g,3.42mmol)及甲苯(350ml)后,在100℃搅拌,进行反应。反应完成后,使用甲苯和水萃取了有机层。用mgso4对萃取的溶液进行处理来去除水分,且进行减压浓缩后,通过柱色谱及重结晶方法进行纯化,制备了31.46g(收率:75%)的化合物1-2。
[0165]
1-3)化合物32的合成
[0166][0167]
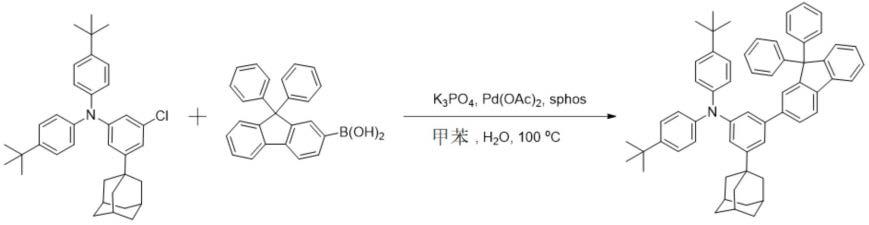
在氮气气流下,向圆底烧瓶加入化合物1-2(10.0g,20.40mmol)、[1,1'-联苯]-4-基硼酸([1,1'-biphenyl]-4-ylboronic acid,4.85g,24.49mmol)、k3po4(10.83g,51.01mmol)、pd(oac)2(0.09g,0.41mmol)、sphos(0.34g,0.82mmol)、甲苯(100ml)及水(10ml)后,在100℃搅拌,进行反应。反应完成后,使用甲苯和水萃取了有机层。用mgso4对萃取的溶液进行处理来去除水分,且进行减压浓缩后,通过柱色谱及重结晶方法进行纯化,制备了7.44g(收率:60%)的化合物32。
[0168]
《合成例2:化合物39的合成》
[0169][0170]
除了使用(9,9-二甲基-9h-芴-2-基)硼酸((9,9-dimethyl-9h-fluoren-2-yl)boronic acid,5.83g,24.49mmol)代替[1,1'-联苯]-4-基硼酸之外,以与化合物32的合成方法相同的方法制备了7.54g(收率:57%)的化合物39。
[0171]
《合成例3:化合物47的合成》
[0172][0173]
除了使用(9-苯基-9h-咔唑-3-基)硼酸((9-phenyl-9h-carbazol-3-yl)boronic acid,7.03g,24.49mmol)代替[1,1'-联苯]-4-基硼酸之外,以与化合物32的合成方法相同的方法制备了7.82g(收率:55%)的化合物47。
[0174]
《合成例4:化合物905的合成》
[0175][0176]
除了使用(4-(9h-咔唑-9-基)苯基)硼酸((4-(9h-carbazol-9-yl)phenyl)boronic acid,7.03g,24.49mmol)代替[1,1'-联苯]-4-基硼酸之外,以与化合物32的合成方法相同的方法制备了7.11g(收率:50%)的化合物905。
[0177]
《合成例5:化合物191的合成》
[0178]
5-1)化合物5-1的合成
[0179][0180]
除了使用4-(萘-1-基)-n-苯基苯胺(4-(naphthalen-1-yl)-n-phenylaniline,8.0g,27.08mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了10.53g(收率:72%)的化合物5-1。
[0181]
5-2)化合物191的合成
[0182][0183]
除了使用化合物5-1(10.0g,18.51mmol)和(4-(萘-1-基)苯基)硼酸((4-(naphthalen-1-yl)phenyl)boronic acid,5.51g,22.22mmol)之外,以与化合物32的合成方法相同的方法制备了6.82g(收率:52%)的化合物191。
[0184]
《合成例6:化合物208的合成》
[0185]
6-1)化合物6-1的合成
[0186][0187]
除了使用4-(萘-2-基)-n-苯基苯胺(4-(naphthalen-2-yl)-n-phenylaniline,8.0g,27.08mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了11.26g(收率:77%)的化合物6-1。
[0188]
6-2)化合物208的合成
[0189][0190]
除了使用化合物6-1(10.0g,18.51mmol)和(9,9-二甲基-9h-芴-2-基)硼酸((9,9-dimethyl-9h-fluoren-2-yl)boronic acid,5.29g,22.22mmol)之外,以与化合物32的合成方法相同的方法制备了7.24g(收率:56%)的化合物208。
[0191]
《合成例7:化合物67的合成》
[0192]
7-1)化合物7-1的合成
[0193][0194]
除了使用9,9-二甲基-n-苯基-9h-芴-2-胺(9,9-dimethyl-n-phenyl-9h-fluoren-2-amine,16.0g,56.06mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了21.70g(收率:73%)的化合物7-1。
[0195]
7-2)化合物67的合成
[0196][0197]
除了使用化合物7-1(10.0g,18.86mmol)和(9,9-二甲基-9h-芴-2-基)硼酸((9,9-dimethyl-9h-fluoren-2-yl)boronic acid,5.39g,22.64mmol)之外,以与化合物32的合成方法相同的方法制备了7.83g(收率:58%)的化合物67。
[0198]
《合成例8:化合物69的合成》
[0199][0200]
除了使用化合物7-1(10.0g,18.86mmol)和二苯并[b,d]噻吩-3-基硼酸(dibenzo[b,d]thiophen-3-ylboronic acid,5.16g,22.64mmol)之外,以与化合物32的合成方法相同的方法制备了6.52g(收率:51%)的化合物69。
[0201]
《合成例9:化合物90的合成》
[0202]
9-1)化合物9-1的合成
[0203][0204]
除了使用n-苯基二苯并[b,d]呋喃-3-胺(n-phenyldibenzo[b,d]furan-3-amine,8.0g,30.85mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了10.89g(收率:70%)的化合物9-1。
[0205]
9-2)化合物90的合成
[0206][0207]
除了使用化合物9-1(10.0g,19.84mmol)和[1,1'-联苯]-4-基硼酸([1,1'-biphenyl]-4-ylboronic acid,4.71g,23.81mmol)之外,以与化合物32的合成方法相同的方法制备了6.54g(收率:53%)的化合物90。
[0208]
《合成例10:化合物356的合成》
[0209]
10-1)化合物10-1的合成
[0210][0211]
除了使用二([1,1'-联苯]-4-基)胺(di([1,1'-biphenyl]-4-yl)amine,25.0g,77.78mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了34.35g(收率:78%)的化合物10-1。
[0212]
10-2)化合物356的合成
[0213][0214]
除了使用化合物10-1(10.0g,17.66mmol)和[1,1'-联苯]-4-基硼酸([1,1'-biphenyl]-4-ylboronic acid,4.20g,21.19mmol)之外,以与化合物32的合成方法相同的方法制备了6.64g(收率:55%)的化合物356。
[0215]
《合成例11:化合物362的合成》
[0216][0217]
除了使用化合物10-1(10.0g,17.66mmol)和(9,9-二甲基-9h-芴-2-基)硼酸((9,9-dimethyl-9h-fluoren-2-yl)boronic acid,5.05g,21.19mmol)之外,以与化合物32的合成方法相同的方法制备了7.42g(收率:58%)的化合物362。
[0218]
《合成例12:化合物364的合成》
[0219][0220]
除了使用化合物10-1(10.0g,17.66mmol)和二苯并[b,d]噻吩-3-基硼酸(dibenzo[b,d]thiophen-3-ylboronic acid,4.83g,21.19mmol)之外,以与化合物32的合成方法相同的方法制备了6.43g(收率:51%)的化合物364。
[0221]
《合成例13:化合物383的合成》
[0222]
13-1)化合物13-1的合成
[0223][0224]
除了使用n-([1,1'-联苯]-4-基)-9,9-二甲基-9h-芴-2-胺(n-([1,1'-biphenyl]-4-yl)-9,9-dimethyl-9h-fluoren-2-amine,20.0g,55.33mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了26.83g(收率:80%)的化合物13-1。
[0225]
13-2)化合物383的合成
[0226][0227]
除了使用化合物13-1(10.0g,16.49mmol)和苯硼酸(phenylboronic acid,2.41g,19.79mmol)之外,以与化合物32的合成方法相同的方法制备了6.09g(收率:57%)的化合物383。
[0228]
《合成例14:化合物390的合成》
[0229][0230]
除了使用化合物13-1(10.0g,16.49mmol)和(9,9-二甲基-9h-芴-2-基)硼酸((9,9-dimethyl-9h-fluoren-2-yl)boronic acid,4.71g,19.79mmol)之外,以与化合物32的合成方法相同的方法制备了7.56g(收率:60%)的化合物390。
[0231]
《合成例15:化合物906的合成》
[0232]
15-1)化合物15-1的合成
[0233][0234]
除了使用n-([1,1'-联苯]-4-基)二苯并[b,d]呋喃-3-胺(n-([1,1'-biphenyl]-4-yl)dibenzo[b,d]furan-3-amine,20.0g,59.63mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了25.25g(收率:73%)的化合物15-1。
[0235]
15-2)化合物906的合成
[0236][0237]
除了使用化合物15-1(10.0g,17.24mmol)和[1,1'-联苯]-2-基硼酸([1,1'-biphenyl]-2-ylboronic acid,4.10g,20.68mmol)之外,以与化合物32的合成方法相同的方法制备了5.77g(收率:48%)的化合物906。
[0238]
《合成例16:化合物424的合成》
[0239][0240]
除了使用化合物15-1(10.0g,17.24mmol)和二苯并[b,d]呋喃-4-基硼酸(dibenzo[b,d]furan-4-ylboronic acid,4.39g,20.68mmol)之外,以与化合物32的合成方法相同的方法制备了6.14g(收率:50%)的化合物424。
[0241]
《合成例17:化合物907的合成》
[0242]
17-1)化合物17-1的合成
[0243][0244]
除了使用4-(二苯并[b,d]噻吩-2-基)-n-苯基苯胺(4-(dibenzo[b,d]thiophen-2-yl)-n-phenylaniline,20.0g,56.90mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了23.75g(收率:70%)的化合物17-1。
[0245]
17-2)化合物907的合成
[0246][0247]
除了使用化合物17-1(10.0g,16.77mmol)和苯硼酸(phenylboronic acid,2.45g,20.13mmol)之外,以与化合物32的合成方法相同的方法制备了5.14g(收率:48%)的化合物907。
[0248]
《合成例18:化合物908的合成》
[0249][0250]
除了使用化合物17-1(10.0g,16.77mmol)和萘-2-基硼酸(naphthalen-2-ylboronic acid,3.46g,20.13mmol)之外,以与化合物32的合成方法相同的方法制备了6.00g(收率:52%)的化合物908。
[0251]
《合成例19:化合物911的合成》
[0252]
19-1)化合物19-1的合成
[0253][0254]
除了使用n-(4-(二苯并[b,d]呋喃-2-基)苯基)-[1,1'-联苯]-4-胺(n-(4-(dibenzo[b,d]furan-2-yl)phenyl)-[1,1'-biphenyl]-4-amine,10.0g,24.30mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了11.96g(收率:75%)的化合物19-1。
[0255]
19-2)化合物911的合成
[0256][0257]
除了使用化合物19-1(10.0g,15.24mmol)和苯硼酸(phenylboronic acid,2.23g,18.29mmol)之外,以与化合物32的合成方法相同的方法制备了5.96g(收率:56%)的化合物911。
[0258]
《合成例20:化合物909的合成》
[0259]
20-1)化合物20-1的合成
[0260][0261]
除了使用n-苯基-4-(9-苯基-9h-咔唑-3-基)苯胺(n-phenyl-4-(9-phenyl-9h-carbazol-3-yl)aniline,10.0g,24.36mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了11.33g(收率:71%)的化合物20-1。
[0262]
20-2)化合物909的合成
[0263][0264]
除了使用化合物20-1(10.0g,15.26mmol)和苯硼酸(phenylboronic acid,2.23g,
18.31mmol)之外,以与化合物32的合成方法相同的方法制备了5.32g(收率:50%)的化合物909。
[0265]
《合成例21:化合物620的合成》
[0266]
21-1)化合物21-1的合成
[0267][0268]
除了使用双(9,9-二甲基-9h-芴-2-基)胺(bis(9,9-dimethyl-9h-fluoren-2-yl)amine,25.0g,62.26mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了31.79g(收率:79%)的化合物21-1。
[0269]
21-2)化合物620的合成
[0270][0271]
除了使用化合物21-1(10.0g,15.47mmol)和苯硼酸(phenylboronic acid,2.26g,18.57mmol)之外,以与化合物32的合成方法相同的方法制备了6.17g(收率:58%)的化合物620。
[0272]
《合成例22:化合物910的合成》
[0273][0274]
除了使用化合物21-1(10.0g,15.47mmol)和(9,9-二甲基-9h-芴-2-基)硼酸((9,9-dimethyl-9h-fluoren-2-yl)boronic acid,4.42g,18.57mmol)之外,以与化合物32的合成方法相同的方法制备了6.84g(收率:55%)的化合物910。
[0275]
《合成例23:化合物622的合成》
[0276][0277]
除了使用化合物21-1(10.0g,15.47mmol)和[1,1'-联苯]-3-基硼酸([1,1'-biphenyl]-3-ylboronic acid,3.68g,18.57mmol)之外,以与化合物32的合成方法相同的方法制备了5.08g(收率:43%)的化合物622。
[0278]
《合成例24:化合物649的合成》
[0279]
24-1)化合物24-1的合成
[0280][0281]
除了使用n-(9,9-二甲基-9h-芴-2-基)二苯并[b,d]呋喃-3-胺(n-(9,9-dimethyl-9h-fluoren-2-yl)dibenzo[b,d]furan-3-amine,10.0g,26.63mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了12.22g(收率:74%)的化合物24-1。
[0282]
24-2)化合物649的合成
[0283][0284]
除了使用化合物24-1(10.0g,16.12mmol)和苯硼酸(phenylboronic acid,2.36g,19.35mmol)之外,以与化合物32的合成方法相同的方法制备了5.34g(收率:50%)的化合物649。
[0285]
《合成例25:化合物316的合成》
[0286]
25-1)化合物25-1的合成
[0287][0288]
除了使用n,9,9-三苯基-9h-芴-2-胺(n,9,9-triphenyl-9h-fluoren-2-amine,10.0g,24.42mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了11.66g(收率:73%)的化合物25-1。
[0289]
25-2)化合物316的合成
[0290][0291]
除了使用化合物25-1(10.0g,15.28mmol)和萘-2-基硼酸(naphthalen-2-ylboronic acid,3.15g,18.34mmol)之外,以与化合物32的合成方法相同的方法制备了5.59g(收率:49%)的化合物316。
[0292]
《合成例26:化合物335的合成》
[0293]
26-1)化合物26-1的合成
[0294][0295]
除了使用n-苯基-9,9'-螺二[芴]-2-胺(n-phenyl-9,9'-spirobi[fluoren]-2-amine,10.0g,24.54mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了12.17g(收率:76%)的化合物26-1。
[0296]
26-2)化合物335的合成
[0297][0298]
除了使用化合物26-1(10.0g,15.33mmol)和萘-1-基硼酸(naphthalen-1-ylboronic acid,3.16g,18.40mmol)之外,以与化合物32的合成方法相同的方法制备了5.93g(收率:52%)的化合物335。
[0299]
《合成例27:化合物344的合成》
[0300]
27-1)化合物27-1的合成
[0301][0302]
除了使用n-(萘-2基)-10,11-二氢螺[二苯并[a,d][7]轮烯-5,9'-芴]-2'-胺(n-(naphthalen-2-yl)-10,11-dihydrospiro[dibenzo[a,d][7]annulene-5,9'-fluoren]-2'-amine,10.0g,20.59mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了10.68g(收率:71%)的化合物27-1。
[0303]
27-2)化合物344的合成
[0304][0305]
除了使用化合物27-1(10.0g,13.69mmol)和苯硼酸(phenylboronic acid,2.00g,16.43mmol)之外,以与化合物32的合成方法相同的方法制备了4.86g(收率:46%)的化合物344。
[0306]
《合成例28:化合物725的合成》
[0307]
28-1)化合物28-1的合成
[0308][0309]
除了使用双(二苯并[b,d]呋喃-3-基)胺(bis(dibenzo[b,d]furan-3-yl)amine,10.0g,28.62mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了13.09g(收率:77%)的化合物28-1。
[0310]
28-2)化合物725的合成
[0311][0312]
除了使用化合物28-1(10.0g,16.83mmol)和[1,1'-联苯]-4-基硼酸([1,1'-biphenyl]-4-ylboronic acid,4.00g,20.13mmol)之外,以与化合物32的合成方法相同的方法制备了6.47g(收率:54%)的化合物725。
[0313]
《合成例29:化合物29的合成》
[0314]
29-1)化合物29-1的合成
[0315][0316]
除了使用双(4-(叔丁基)苯基)胺(bis(4-(tert-butyl)phenyl)amine,10.0g,35.53mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了13.09g(收率:70%)的化合物29-1。
[0317]
29-2)化合物29的合成
[0318][0319]
除了使用化合物29-1(10.0g,19.00mmol)和(9,9-二苯基-9h-芴-2-基)硼酸((9,9-diphenyl-9h-fluoren-2-yl)boronic acid,7.44g,22.80mmol)之外,以与化合物32的合成方法相同的方法制备了7.06g(收率:46%)的化合物29。
[0320]
《合成例30:化合物30的合成》
[0321]
30-1)化合物30-1的合成
[0322][0323]
除了使用二苯胺(diphenylamine,6.0g,35.45mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了10.72g(收率:73%)的化合物30-1。
[0324]
30-2)化合物30的合成
[0325][0326]
除了使用化合物30-1(10.0g,24.16mmol)和9,9'-螺二[芴]-2-基硼酸(9,9'-spirobi[fluoren]-2-ylboronic acid,10.44g,28.99mmol)之外,以与化合物32的合成方法相同的方法制备了8.38g(收率:50%)的化合物30。
[0327]
《合成例31:化合物331的合成》
[0328]
31-1)化合物31-1的合成
[0329][0330]
除了使用n,9,9-三苯基-9h-芴-4-胺(n,9,9-triphenyl-9h-fluoren-4-amine,10.0g,24.42mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了11.18g(收率:70%)的化合物31-1。
[0331]
31-2)化合物331的合成
[0332][0333]
除了使用化合物31-1(10.0g,15.28mmol)和苯硼酸(phenylboronic acid,2.24g,18.34mmol)之外,以与化合物32的合成方法相同的方法制备了5.00g(收率:47%)的化合物331。
[0334]
《合成例32:化合物594的合成》
[0335]
32-1)化合物32-1的合成
[0336][0337]
除了使用n-([1,1'-联苯]-4-基)-9,9'-螺二[芴]-4-胺(n-([1,1'-biphenyl]-4-yl)-9,9'-spirobi[fluoren]-4-amine,10.0g,20.68mmol)代替n-苯基-[1,1'-联苯]-4-胺之外,以与化合物1-2的合成方法相同的方法制备了11.30g(收率:75%)的化合物32-1。
[0338]
32-2)化合物594的合成
[0339][0340]
除了使用化合物32-1(10.0g,13.73mmol)和苯硼酸(phenylboronic acid,2.01g,16.47mmol)之外,以与化合物32的合成方法相同的方法制备了5.50g(收率:52%)的化合物594。
[0341]
《合成例33:化合物410的合成》
[0342]
33-1)化合物33-1的合成
[0343]
[0344]
除了使用1-溴-3,5-二甲基金刚烷(1-bromo-3,5-dimethyladamantane,121.6g,500mmol)代替1-溴金刚烷之外,以与化合物1-1的合成方法相同的方法制备了80.4g(收率:52%)的化合物33-1。
[0345]
33-2)化合物33-2的合成
[0346][0347]
除了使用化合物33-1(9.41g,30.43mmol)和n-([1,1'-联苯]-4-基)-9,9-二甲基-9h-芴-2-胺(n-([1,1'-biphenyl]-4-yl)-9,9-dimethyl-9h-fluoren-2-amine,10.0g,27.66mmol)之外,以与化合物1-2的合成方法相同的方法制备了12.46g(收率:71%)的化合物33-2。
[0348]
33-3)化合物410的合成
[0349][0350]
除了使用化合物33-2(10.0g,15.77mmol)和(4-(叔丁基)苯基)硼酸((4-(tert-butyl)phenyl)boronic acid,3.37g,18.92mmol)之外,以与化合物32的合成方法相同的方法制备了5.19g(收率:45%)的化合物410。
[0351]
《合成例34:化合物374的合成》
[0352]
34-1)化合物34-1的合成
[0353][0354]
除了使用化合物33-1(10.58g,34.22mmol)和n-([1,1'-联苯]-4-基)-[1,1'-联苯]-2-胺(n-([1,1'-biphenyl]-4-yl)-[1,1'-biphenyl]-2-amine,10.0g,31.11mmol)之外,以与化合物1-2的合成方法相同的方法制备了12.76g(收率:69%)的化合物34-1。
[0355]
34-2)化合物374的合成
[0356][0357]
除了使用化合物34-1(10.0g,16.83mmol)和菲-9-基硼酸(phenanthren-9-ylboronic acid,4.48g,20.19mmol)之外,以与化合物32的合成方法相同的方法制备了5.82g(收率:47%)的化合物374。
[0358]
《合成例35:化合物912的合成》
[0359]
35-1)化合物35-1的合成
[0360][0361]
除了使用化合物33-1(9.71g,31.39mmol)和n-苯基-[1,1'-联苯]-4-胺(n-phenyl-[1,1'-biphenyl]-4-amine,7.0g,28.53mmol)之外,以与化合物1-2的合成方法相同的方法制备了10.35g(收率:70%)的化合物35-1。
[0362]
35-2)化合物912的合成
[0363][0364]
除了使用化合物35-1(10.0g,19.30mmol)和(4-(二苯并[b,d]呋喃-4-基)苯基)硼酸((4-(dibenzo[b,d]furan-4-yl)phenyl)boronic acid,6.67g,23.16mmol)之外,以与化合物32的合成方法相同的方法制备了6.31g(收率:45%)的化合物912。
[0365]
[实施例1:有机电致发光元件制造(红色)]
[0366]
在形成有反射层的基板上使用ito形成阳极,并用n2等离子体或紫外线(uv)-臭氧进行表面处理。在其上部作为空穴注入层(hil)以10nm的厚度蒸镀hat-cn。接着,以100nm的厚度蒸镀n4,n4,n4',n4'-四([1,1'-联苯]-4-基)-[1,1'-联苯]-4,4'-二胺(n4,n4,n4',n4'-tetra([1,1'-biphenyl]-4-yl)-[1,1'-biphenyl]-4,4'-diamine)形成了空穴传输层(htl)。
[0367]
在上述空穴传输层上部以85nm的厚度真空蒸镀本发明的化合物32来形成空穴传输辅助层,并在上述空穴传输辅助层上部,作为发光层(eml)以35nm的厚度蒸镀4,4'-n,n'-二咔唑-联苯(4,4'-n,n'-dicarbazole-biphenyl,cbp)的同时,作为掺杂剂(dopant)掺杂了约3%左右的双(1-苯基异喹啉)(乙酰丙酮)合铱(iii)(bis-(1-phenylisoquinolyl)
iridium(iii)acetylacetonate,(piq)2ir(acac))。
[0368]
以1:1混合蒽衍生物和liq并将其以30nm的厚度蒸镀在发光层(eml)上作为电子传输层(etl),并在电子传输层(etl)上以1nm的厚度蒸镀liq作为电子注入层(eil)。随后,以16nm的厚度蒸镀以1:4混合镁和银(ag)的混合物作为阴极,在上述阴极上以60nm的厚度蒸镀n4,n4'-双[4-[双(3-甲基苯基)氨基]苯基]-n4,n4'-二苯基-[1,1'-联苯]-4,4'-二胺(dntpd)作为覆盖层(capping layer)。在其上利用紫外线固化型粘结剂来贴合含吸湿剂的密封盖(sealcap),以保护有机电致发光元件免受大气中的o2或水分的影响,由此制造了有机电致发光元件。
[0369]
[实施例2至35]
[0370]
除了以下表1所示的方式使用空穴传输辅助层化合物以外,以与实施例1相同的方法制造了实施例2至35的有机电致发光元件及比较例1至3的有机电致发光元件。
[0371]
[化合物a]
[0372][0373]
[化合物b]
[0374][0375]
[化合物c]
[0376][0377]
[实验例1:元件性能分析]
[0378]
在上述中,针对根据实施例1至35及比较例1至3制造的有机电致发光元件,测量以
10ma/cm2的电流驱动时的电光特性及以20ma/cm2的恒流驱动时的95%减少寿命,并显示在表1中。
[0379]
[表1]
[0380]
[0381][0382]
根据表1的实验结果,与比较例相比,将本发明的化合物作为有机电致发光元件的空穴传输辅助层材料时,虽驱动电压显示等同或较低水平,但表现出了优秀的元件效率特性及长寿命特性。
[0383]
[实施例36:有机电致发光元件制造(绿色)]
[0384]
使用ito在形成有反射层的基板上形成阳极,并用n2等离子体或紫外线(uv)-臭氧进行表面处理。在其上方作为空穴注入层(hil),以10nm的厚度蒸镀hat-cn。接着,以110nm的厚度蒸镀n4,n4,n4',n4'-四([1,1'-联苯]-4-基)-[1,1'-联苯]-4,4'-二胺(n4,n4,n4',n4'-tetra([1,1'-biphenyl]-4-yl)-[1,1'-biphenyl]-4,4'-diamine)形成了空穴传输层(htl)。
[0385]
在上述空穴传输层上部以40nm的厚度真空蒸镀本发明的化合物32来形成空穴传输辅助层,并在上述空穴传输辅助层上部,作为发光层(eml)以35nm的厚度蒸镀4,4'-n,n'-二咔唑-联苯(4,4'-n,n'-dicarbazole-biphenyl,cbp)的同时,作为掺杂剂(dopant)掺杂了约5%左右的三(2-苯基吡啶)-铱(tris(2-phenylpyridine)-iridium,ir(ppy)3)。
[0386]
并且,作为电子传输层(etl),在发光层(eml)上以30nm的厚度蒸镀以1:1的质量比混合的蒽衍生物和liq,并在其上以1nm的厚度蒸镀liq作为电子注入层(eil)。随后,以16nm的厚度蒸镀以1:4混合镁和银(ag)的混合物作为阴极,在上述阴极上以60nm的厚度蒸镀n4,n4'-双[4-[双(3-甲基苯基)氨基]苯基]-n4,n4'-二苯基-[1,1'-联苯]-4,4'-二胺(dntpd)作为覆盖层(capping layer)。在其上利用紫外线固化型粘结剂来贴合含吸湿剂的密封盖(seal cap),以保护有机电致发光元件免受大气中的o2或水分的影响,由此制造了有机电
致发光元件。
[0387]
[实施例36至70]
[0388]
除了以下表2所示的方式使用空穴传输辅助层化合物以外,以与实施例36相同的方法制造了实施例36至70的有机电致发光元件及比较例4至6的有机电致发光元件。
[0389]
[实验例2]
[0390]
在上述中,针对根据实施例36至70及比较例4至6制造的有机电致发光元件,测量以10ma/cm2的电流驱动时的电光特性及以20ma/cm2的恒流驱动时的95%减少寿命,并显示在表2中。
[0391]
[表2]
[0392]
[0393]
[0394][0395]
根据表2的实验结果,与比较例相比,将本发明的化合物作为有机电致发光元件的空穴传输辅助层材料时,虽驱动电压显示等同或较低水平,但表现出优秀的元件效率特性及长寿命特性。
[0396]
[实施例71:有机电致发光元件制造(htl)]
[0397]
使用ito在形成有反射层的基板上形成阳极,并用n2等离子体或紫外线(uv)-臭氧进行表面处理。在其上方作为空穴注入层(hil),以10nm的厚度蒸镀hat-cn。接着,以110nm的厚度蒸镀化合物67形成了空穴传输层(htl)。
[0398]
在上述空穴传输层上部,作为发光层(eml)以35nm的厚度蒸镀4,4'-n,n'-二咔唑-联苯(4,4'-n,n'-dicarbazole-biphenyl,cbp)的同时,作为掺杂剂(dopant)掺杂了约5%左右的三(2-苯基吡啶)-铱(tris(2-phenylpyridine)-iridium,ir(ppy)3)。
[0399]
并且,作为电子传输层(etl),在发光层(eml)上以30nm的厚度蒸镀以1:1的质量比混合的蒽衍生物和liq,并在其上以1nm的厚度蒸镀liq作为电子注入层(eil)。随后,以16nm的厚度蒸镀以1:4混合镁和银(ag)的混合物作为阴极,在上述阴极上以60nm的厚度蒸镀n4,n4'-双[4-[双(3-甲基苯基)氨基]苯基]-n4,n4'-二苯基-[1,1'-联苯]-4,4'-二胺(dntpd)作为覆盖层(capping layer)。在其上利用紫外线固化型粘结剂来贴合含吸湿剂的密封盖(seal cap),以保护有机电致发光元件免受大气中的o2或水分的影响,由此制造了有机电致发光元件。
[0400]
[实施例72至80]
[0401]
除了以下表3所示的方式使用空穴传输层化合物以外,以与实施例71相同的方法制造了实施例72至80的有机电致发光元件及比较例7至9的有机电致发光元件。
[0402]
[实验例3:元件性能分析]
[0403]
在上述中,针对根据实施例71至80及比较例7至9制造的有机电致发光元件,测量以10ma/cm2的电流驱动时的电光特性及以20ma/cm2的恒流驱动时的95%减少寿命,并显示在表3中。
[0404]
[表3]
[0405][0406]
根据表3的实验结果,与比较例相比,将本发明的化合物作为有机电致发光元件的空穴传输层材料时,虽驱动电压显示等同或较低水平,但表现出优秀的元件效率特性及长寿命特性。
[0407]
以上,详细说明了本发明的优选实施例,但本发明的权利要求保护范围不限于此,本领域技术人员利用本发明权利要求范围中定义的本发明的基本概念进行的各种修改及改进也包括在本发明所要保护的权利范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1