一株丛毛红曲霉工程菌及其应用
1.本发明属于食品生物技术领域,尤其涉及一株丛毛红曲霉工程菌及其应用。
背景技术:
2.红曲起源于中国,已有上千年历史,是近年来备受关注的功能性食品,经红曲霉发酵后的大米就是红曲米,其中含有多种活性物质,以色素、莫纳可林k(monacolin k, mk)和γ-氨基丁酸为主,有益于人体健康。近年来,研究人员通过发酵条件优化和筛选高产mk的红曲霉突变菌株等方法,提高了红曲霉的mk产量及其应用价值。同时,随着现代生物技术的不断发展,基因工程技术为改良红曲霉菌株提供了有效的手段,即通过基因工程手段促进次生代谢物合成关键基因的表达,从而提高其mk合成能力。
3.1979年,endo首次从红色红曲霉(monascus ruber)的培养物中分离出一种可抑制体内胆固醇合成的活性物质,并命名为monacolin k,该物质与albert等从土曲霉(aspergillus terreus)的培养物中分离获得的洛伐他汀(lovastatin)具有相同的分子结构。
4.mk具有降血脂、抗癌防癌、抗炎抑菌、保护神经等功效。mk降血脂功效的主要作用机理为:mk与人体内胆固醇合成途径的限速酶hmg-coa还原酶(hmgr)的结构相似,能够对hmgr形成高效的竞争性抑制,从而达到降低胆固醇合成的效果。
5.如何提升mk的发酵产量是研究红曲的一大热点,首先选育高产mk突变菌株,优化发酵条件都能够在一定程度上提高mk的合成产量,例如利用紫外诱变筛选出来的红曲菌株合成mk的能力是初始菌株的2到5倍不等(常聪,2018)。另外,优化发酵基质也能起到显著效果,zhang等(2018)采用大米、小米、小麦和大麦等不同种类的谷物进行红色红曲霉(m. ruber)的固态发酵,结果发现小米为基质的mk产量最高(7.25mg/g)。
6.如今,利用分子生物技术研究mk的生物合成途径是研究红曲霉的新方向,红曲霉mk合成基因簇中部分基因的功能已经得到解析,其过表达能够显著提升红曲霉的mk产量,而且还可以实现异源表达。sakai等(2012)以米曲霉(a. oryzae)作为宿主,成功地将mk合成基因簇在米曲霉中进行异源表达。
技术实现要素:
7.本发明的目的在于提供一株丛毛红曲霉工程菌及其应用。该丛毛红曲霉工程菌不仅高产莫纳可林k(monacolin k,mk),而且不产桔霉素。
8.为实现上述目的,本发明采用如下技术方案:一株丛毛红曲霉工程菌ti-02,其分类命名为:丛毛红曲霉(monascus pilosus),该菌株已于2021年1月5日在中国微生物菌种保藏管理委员会普通微生物中心保藏,保藏号为cgmcc no. 21449,保藏地址为:北京市朝阳区北辰西路1号院3号。
9.上述一株丛毛红曲霉工程菌的制备方法,具体包括以下步骤:1)将莫纳可林k(mk)合成基因簇上的外排泵基因mok i(其序列如seq id no.1所
示)构建到真核表达载体pneo0380上,获得mok i基因的过表达载体pneo-mki。
10.2)采用农杆菌介导法,将过表达载体pneo-mki转化到丛毛红曲霉模式菌株cicc 5045中,经筛选培育、红曲米发酵和检测分析,得到高产莫纳可林k(mk)且不产桔霉素的丛毛红曲霉工程菌ti-02。
11.上述步骤1)具体为:设计合成mok i基因编码区两端的特异引物mki1-4(5
′‑
cccaagcttatggcttcccaccagtctgaga-3
′
)和mki2-4(5
′‑
cgagctcctagactcgttca tcgcggc-3
′
),采用rt-pcr技术,从丛毛红曲霉模式菌株cicc 5045中克隆出mok i基因的编码区,其序列如seq id no.1所示;将mok i基因的编码区构建到真核表达载体pneo0380上,获得含有mok i基因的过表达载体pneo-mki。
12.上述步骤2)具体为:采用冻融法,将过表达载体pneo-mki转化到农杆菌agl1中,获得含有mok i基因过表达载体的重组农杆菌agl1/pneo-mki;将获得的重组农杆菌与丛毛红曲霉模式菌株cicc 5045进行共培养,经过筛选培育(利用含有80
ꢀµ
g/ml遗传霉素g418的培养基进行筛选培养)、红曲米发酵和检测分析,获得了高产monacolin k且不产桔霉素的丛毛红曲霉工程菌ti-02。
13.上述一株丛毛红曲霉工程菌在莫纳可林k生产中的应用。
14.本发明的显著优点在于:
①
成功获得了过表达mok i基因的丛毛红曲霉转化菌株ti-02。
15.②
丛毛红曲霉转化菌株ti-02固态发酵产物红曲米的mk总产量分别比出发菌株相对提高了87.8%,其中酸式mk的含量分别比出发菌株提高了1.3倍。
16.③
丛毛红曲霉不同转化菌株的固态发酵产物红曲米中均未检出桔霉素,市售红曲米样品的桔霉素含量为10.36 mg/kg。
附图说明
17.图1为mok i基因编码区的pcr扩增结果;m:dna marker dl2000,1:mok i基因编码区的pcr扩增产物。
18.图2为mok i基因过表达载体pneo-mki的示意图。
19.图3为丛毛红曲霉转化子的pcr鉴定结果;m:dna marker dl2000,1-3:阳性转化子,4:阴性对照(出发菌株cicc 5045),5:阳性对照(质粒pneo-mki)。
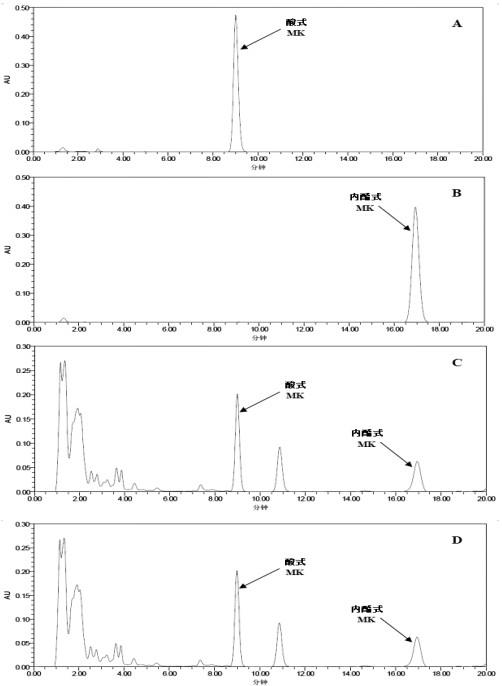
20.图4为丛毛红曲霉固态发酵产物中mk含量检测的hplc图谱;a:酸式mk标准品的色谱图,b:内酯式mk标准品的色谱图,c:丛毛红曲霉转化菌株待测样品的色谱图,d:出发菌株待测样品的色谱图。
21.图5为丛毛红曲霉固态发酵产物中mk产量的hplc检测结果。
22.图6为丛毛红曲霉固态发酵产物中桔霉素含量检测的hplc图谱;a:桔霉素标准品的色谱图,b:丛毛红曲霉转化菌株待测样品的色谱图,c:市售红曲米待测样品的色谱图。
具体实施方式
23.下面结合具体实施例,进一步阐述本发明。实施例仅用于说明本发明而不用于限制本发明的范围。
24.下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如:分子克隆实
验指南(第三版)(sambrook等著,黄培堂译,2002)中所述的条件,或者按照试剂制造厂商所建议的条件。
25.实施例:(1)丛毛红曲霉mok i基因的克隆
①
丛毛红曲霉总rna的提取与检测将丛毛红曲霉(monascus pilosus)模式菌株cicc 5045接种于麦芽汁液体培养基中,培养4-5天后,采用美国invitrogen公司的trizol试剂,按照其说明书的方法,从丛毛红曲霉的菌丝体中提取出总rna。
26.总rna完整性的检测:取5
µ
l丛毛红曲霉总rna,经1wt%琼脂糖凝胶电泳(6v/cm)20min后,呈现出三条清晰可区分的条带,分别为28s、18s和5.8s rna,其中28s rna和18s rna的比例大约为2∶1,说明获得的丛毛红曲霉总rna较为完整,可用于后续的rt-pcr等实验。
27.总rna浓度和od值的检测:取1
µ
l丛毛红曲霉总rna,用超微量紫外分光光度计(nd-2000c)检测其浓度和od
260/280
值,结果显示,丛毛红曲霉总rna的浓度为1592.9 ng/
µ
l,od
260
/od
280
=2.1,说明获得的总rna纯度较高,可用于后续rt-pcr等实验。
28.②
丛毛红曲霉mok i基因编码区的rt-pcr采用宝生物工程(大连)有限公司的primescript
® rt reagent kit(perfect real time),参照其说明书的方法(将37℃的反应时间改为60 min),将丛毛红曲霉总rna反转录合成第一链cdna。
29.根据genbank已报道的丛毛红曲霉mok i基因的核苷酸序列(dq176595.1),设计合成mok i基因编码序列两端的特异引物mki1-4(5
′‑
cccaagcttat ggcttcccaccagtctgaga-3
′
)和mki2-4(5
′‑
cgagctcctagactcgttca tcgcggc-3
′
),分别在引物的5’端添加合适的酶切位点hind
ꢀⅲ
和sacⅰ(引物序列的下划线部分)和保护碱基,用高保真酶primerstar
®
hs dna polymerase进行pcr扩增,pcr反应条件:98℃ 5min;随之以98℃ 10sec,55℃ 5sec,72℃ 1.5min进行35个循环后,以72℃延伸10min,结果得到了约1.6kb的目的条带(图1)。对pcr扩增产物进行电泳和胶回收后,送往铂尚生物技术(上海)有限公司进行测序。
30.测序结果表明,采用rt-pcr技术获得的丛毛红曲霉模式菌株cicc 5045的mok i基因的编码序列如seq id no.1所示;序列分析结果表明,其与genbank报道的mok i基因同源性为100%,编码区长度为1632 bp,编码543个氨基酸,其蛋白质的分子量约为57.3 kda。
31.(2)mok i基因转化丛毛红曲霉
①
mok i基因过表达载体的构建对上述rt-pcr获得的mok i基因的编码区进行酶切后,将酶切产物回收并连接到pneo0380载体上,然后对重组载体进行pcr和酶切鉴定以及测序验证,结果表明成功构建了mok i基因的过表达载体pneo-mki,载体图谱如图2所示。
32.②
含有mok i基因的过表达载体pneo-mki转化丛毛红曲霉采用冻融法,将过表达载体pneo-mki转化到农杆菌agl-1中,经pcr和酶切鉴定,成功获得了含有mok i基因过表达载体pneo-mki的重组农杆菌agl-1/pneo-mki。
33.制备丛毛红曲霉模式菌株cicc 5045的孢子悬浮液,然后将含有mok i基因的重组农杆菌agl-1/pneo-mki与丛毛红曲霉孢子进行共培养,经过筛选培养,得到了一批丛毛红
曲霉抗性转化子。
34.(3)丛毛红曲霉转化菌株的获得及其发酵培养和检测分析
①
丛毛红曲霉抗性转化子的pcr鉴定用软件vector nti 7.0设计一对正反向特异引物pgpda-f1(5
′‑
ctgcactcg acctgctgaggtc-3
′
)和mki2-8(5
′‑
caatttggctcagacccatcat-3
′
),用于丛毛红曲霉抗性转化子的pcr鉴定,其扩增产物的大小为847bp。
35.先将重组农杆菌agl1/pneo-mki与丛毛红曲霉菌株cicc 5045的分生孢子进行共培养后,利用含有80
ꢀµ
g/ml遗传霉素g418的筛选培养基进行筛选培养,得到丛毛红曲霉的一批抗性转化子。然后,将抗性转化子分别接种于麦芽汁液体培养基中,培养3-4天后,采用基因组dna快速提取试剂盒(北京鼎国生物技术有限责任公司),从其菌丝体中提取基因组dna,用引物pgpda-f1和mki2-8进行pcr扩增,结果表明:成功获得了一批过表达mok i基因的丛毛红曲霉转化菌株,命名为ti-01、ti-02、ti-03、ti-04、ti-05、ti-06(图3)。
36.②
丛毛红曲霉转化菌株的发酵培养及其mk产量的hplc检测pda培养基的配制:取200 g新鲜土豆削皮,切块,20 min沸水煮烂成汁,经四层纱布过滤后加入葡萄糖20 g,琼脂粉20 g,加水溶解后定容至1000 ml,ph自然,121℃下高压灭菌20 min。
37.种子培养基的配制:葡萄糖50 g,蛋白胨5 g,酵母膏1 g,kh2po
4 1 g,feso4•
7h2o 0.01 g,mgso4•
7h2o 0.5 g,加水溶解后定容至1000 ml,ph自然,121℃下高压灭菌20 min。
38.固态发酵培养基的配制:称取30 g大米,置于250 ml塑料发酵瓶中,加入6 g甘油与20 ml水,封口后于121℃下杀菌20 min。
39.不同菌株的发酵培养:丛毛红曲霉的转化菌株和出发菌株cicc 5045,分别接种在pda平板上活化培养7天后,用无菌水冲取孢子,经三层擦镜纸过滤后,调整孢子的浓度至1
×
106个/ml。按1wt%接种量接种于种子培养基中,28℃,220 rpm培养48h后备用。将种子液稀释至孢子浓度约为1
×
107个/ml后,按照10wt%接种量接种至固态发酵培养基中,每个菌株分别做4个重复,28℃培养15天。
40.待测样品的前处理:将发酵完成的红曲米样品置于50℃的鼓风干燥箱中烘干至恒重,研磨粉碎后过80目筛子,称取1.0 g样品置于10 ml棕色容量瓶中,用75vol%乙醇定容至10 ml,超声处理30 min,期间摇匀一次,待超声完成后再摇匀一次,并静置5 min,随后取上清液经0.45 μm滤膜过滤后,用于hplc进样检测。
41.酸式mk标准溶液的配制:称取1.5 mg mk标准样品,置于10 ml棕色容量瓶中,加入2 ml的0.2 mol/l naoh溶液,再用75vol%乙醇溶解后定容至10 ml,50℃水浴30 min,期间振摇2次,使内酯式mk转化为酸式mk,配制成150 μg/ml的标准液,置于4℃冰箱中保存备用。
42.内酯式mk标准溶液的配制:称取1.5 mg mk标准样品,置于10 ml棕色容量瓶中,用75vol%乙醇溶解后定容至10 ml,配制成150 μg/ml标准液,置于4℃冰箱中保存备用。
43.采用美国waters公司的e2695高效液相色谱仪检测上述红曲米样品中的mk含量,色谱条件如下:色谱柱为waters sunfire c18(5 μm,4.6
×
120 mm),流动相为乙腈∶0.18%磷酸水溶液=55∶45(v/v);流速为1 ml/min;检测器的波长为238 nm;柱温为30℃;进样量为20 μl。检测结果如图4和图5所示,不同转化菌株(ti-01~ti-06)固态发酵红曲米中的mk总产量分别为254.78、267.30、198.22、247.40、241.87、234.20 mg/kg,分别比出发菌株相对
提高了79.0%、87.8%、39.3%、73.8%、69.9%、64.5%;其中酸式mk的含量分别为60.89、82.80、57.91、73.04、82.22、76.36 mg/kg,分别比出发菌株提高了0.7倍、1.3倍、0.6倍、1.1倍、1.3倍、1.1倍。
44.③
丛毛红曲霉转化菌株发酵产物中桔霉素含量的hplc检测待测样品的前处理:将经过研磨并过80目筛子的红曲米粉末,称取1.0 g置于棕色容量瓶中,用甲醇定容至10 ml,超声处理30 min,60℃水浴浸提60 min,5000 g离心20 min,取上清液经0.45 μm滤膜过滤后,用于hplc进样检测,并以市售红曲米作为对照。
45.桔霉素标准溶液的配制:精确称取桔霉素标准品1 mg,置于10 ml棕色容量瓶中,用甲醇溶解后定容至10 ml,质量浓度为100 μg/ml,置于4℃冰箱中保存备用。
46.采用美国agilent公司的1200infinity series高效液相色谱仪检测上述红曲米样品的桔霉素含量,色谱条件如下:色谱柱为waters sunfire c18(5 μm,4.6 mm
×
250 mm);流动相为超纯水(用磷酸调ph至 2.5)∶乙腈=50∶50(v/v);流速为1 ml/min;荧光检测器的波长为λex=331 nm,λem=500 nm;柱温为28℃;进样量为20 μl。检测结果如图6所示,丛毛红曲霉不同转化菌株(ti-01~ti-06)的固态发酵产物红曲米中均未检出桔霉素,而市售红曲米样品的桔霉素含量为10.36 mg/kg。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1