一种嵌合抗原受体及其应用
1.本发明属于生物与医药技术领域,具体涉及一种嵌合抗原受体及其应用。
背景技术:
2.恶性肿瘤严重人类生命健康和社会进步。肿瘤治疗主要依赖手术、化疗和放疗这些传统手段。尽管传统治疗手段在一定程度上改善了肿瘤治疗临床效果,但是患者5年生存率依然较低。肿瘤治疗需要更加有效的新型治疗方法。
3.近年来,免疫治疗在临床实践中展示出较好的抗肿瘤效果,成为了肿瘤治疗的新选择。以嵌合抗原受体(chimeric antigen receptor,car)修饰t细胞为代表的肿瘤靶向免疫治疗的成就尤为突出,在体外和临床实验中表现出良好的靶向性、杀伤性和持久性,展示了巨大的应用前景。car序列主要由抗原识别区和共刺激信号分子以及其他片段组成,其中抗原识别区负责与特异分子结合、保证杀伤特异性;共刺激信号则决定了car-t细胞活化程度与持久性。对car-t细胞来说,其识别的靶抗原决定了治疗有效性和安全性。肿瘤、尤其是实体肿瘤具有很强的异质性,导致肿瘤细胞上抗原表达的差异巨大。肿瘤细胞的这一特性决定了需要不断寻找新靶点来满足治疗需要。
4.连接蛋白3(claudin3,cldn3)是参与细胞间紧密连接构成的重要蛋白分子,具有维持上皮细胞及内皮细胞的屏障功能,并对细胞旁物质选择渗透性和细胞极化等重要生理功能有决定作用。近来研究发现,锌指转录因子、表皮生长因子等信号分子参与调节cldn3的基因表达,而cldn3蛋白的异常表达与多种恶性肿瘤的发生发展有着密切关系。但目前还没有任何关于cldn3特异性嵌合抗原受体的研究和报道。因此,本发明的目的旨在设计一种cldn3特异性嵌合抗原受体。
技术实现要素:
5.本发明的目的旨在提供一种cldn3特异性嵌合抗原受体及其应用。
6.为实现发明目的,本发明采用的技术方案如下:
7.本发明第一方面提供了一种嵌合抗原受体,所述嵌合抗原受体包含cldn3结合结构域、跨膜结构域、共刺激结构域、胞内信号传导结构域;其中,所述cldn3结合结构域包含抗cldn3单链抗体,所述抗cldn3单链抗体的氨基酸序列如seq id no.1所示。
8.进一步地,所述共刺激结构域为来自cd28蛋白和/或4-1bb蛋白的共刺激信号分子。
9.在本发明的一个具体实施方式中,所述共刺激结构域为来自cd28蛋白的共刺激信号分子;更进一步地,来自cd28蛋白的共刺激信号分子的氨基酸序列如seq id no.2所示。
10.在本发明的另一个具体实施方式中,所述共刺激结构域为来自4-1bb蛋白的共刺激信号分子;更进一步地,来自4-1bb蛋白的共刺激信号分子的氨基酸序列如seq id no.3所示。
11.进一步地,所述跨膜结构域为来自cd28蛋白和/或cd8a蛋白的多肽。
12.在本发明的一个具体实施方式中,所述跨膜结构域为来自cd28蛋白的多肽;更进一步地,来自cd28蛋白的多肽的氨基酸序列如seq id no.4所示。
13.在本发明的一个具体实施方式中,所述跨膜结构域为来自cd8a蛋白的多肽;更进一步地,来自cd8a蛋白的多肽的氨基酸序列如seq id no.5所示。
14.进一步地,所述胞信号传导结构域为包含cd3ζ的信号传导结构域;更进一步地,所述胞信号传导结构域的氨基酸序列如seq id no.6所示。
15.进一步地,所述cldn3结合结构域通过铰链区与跨膜结构域相连接,所述铰链区为来自cd8a蛋白的多肽;更进一步地,所述铰链区的氨基酸序列如seq id no.7所示。
16.进一步地,所述嵌合抗原受体还包含前导肽序列,所述前导肽序列为来自cd8a蛋白的多肽。更进一步地,所述前导肽序列的氨基酸序列如seq id no.8所示。
17.进一步地,所述嵌合抗原受体还包含标签序列;所述标签序列选自poly-arg、poly-his、flag、strep-tag ii或c-myc中的任意一种。poly-arg、poly-his、flag、strep-tag ii或c-myc标签具体如表1所示。在本发明的一个具体实施方式中,所述标签序列为c-myc。
18.表1标签的序列
19.标签残基氨基酸序列poly-arg5-6(通常为5个)rrrrrpoly-his2-10(通常为6个)hhhhhhflag8dykddddkstrep-tag ii8wshpqfekc-myc12eqkliseedlgs
20.进一步地,所述标签序列位于前导肽序列与cldn3结合结构域之间,前导肽序列通过标签序列与cldn3结合结构域相连接。
21.进一步地,所述嵌合抗原受体的氨基酸序列如seq id no.9或seq id no.10所示。
22.本发明第二方面提供了与上述第一方面所述嵌合抗原受体相关的生物材料。所述生物材料为下述b1)至b8)中的任意一种:
23.b1)编码上述第一方面所述嵌合抗原受体的核酸分子;
24.b2)含有b1)所述核酸分子的表达盒;
25.b3)含有b1)所述核酸分子的重组载体;
26.b4)含有b2)所述表达盒的重组载体;
27.b5)含有b1)所述核酸分子的细胞系;
28.b6)含有b2)所述表达盒的细胞系;
29.b7)含有b3)所述重组载体的细胞系;
30.b8)含有b4)所述重组载体的细胞系。
31.进一步地,上述b1)中,所述核酸分子为seq id no.11或seq id no.12所示的dna分子。
32.进一步地,上述b2)中,所述表达盒依次由启动子、编码上述嵌合抗原受体的核酸分子和终止子组成。
33.进一步地,上述b3)或b4)中,所述载体可为病毒载体。进一步地,所述病毒载体可
为慢病毒载体或逆转录病毒载体。更进一步地,所述重组载体是将上述嵌合抗原受体的核酸分子插入病毒载体中,得到表达上述嵌合抗原受体的重组病毒载体。
34.进一步地,上述b5)或b6)或b7)或b8)中,所述细胞系可为用于病毒包装的细胞系或用于病毒传代培养的细胞系。
35.本发明第三方面提供了一种car-t细胞的制备方法,包括如下步骤:将上述第一方面所述的嵌合抗原受体的编码基因导入t细胞中并使所述编码基因得到表达,得到car-t细胞。
36.进一步地,所述嵌合抗原受体的编码基因通过慢病毒表达系统或逆转录病毒表达系统导入t细胞中。
37.更进一步地,将上述第一方面所述的嵌合抗原受体的编码基因导入t细胞中并使所述编码基因得到表达的方法为方法(一)或方法(二):
38.所述方法(一)包括如下步骤:用慢病毒感染t细胞;所述慢病毒是将重组慢病毒载体转染慢病毒包装细胞,然后进行细胞培养得到的;所述慢病毒载体为将所述嵌合抗原受体的编码基因插入慢病毒载体中得到的。
39.所述方法(二)包括如下步骤:用逆转录病毒感染t细胞;所述逆转录病毒是将重组逆转录病毒载体转染逆转录病毒包装细胞,然后进行细胞培养后得到的;所述重组逆转录病毒载体为将所述嵌合抗原受体的编码基因插入逆转录病毒载体中得到的。
40.本发明第四方面提供一种按照上述第三方面所述制备方法制备得到的car-t细胞。上述第三方面所述制备方法中的慢病毒或重组慢病毒载体或逆转录病毒或重组逆转录病毒载体也属于本发明的保护范围。
41.本发明第五方面提供上述第一方面所述嵌合抗原受体或上述第二方面所述生物材料或上述慢病毒或重组慢病毒载体或逆转录病毒或重组逆转录病毒载体在如下m1)-m4)中任一种中的应用:
42.m1)制备治疗或辅助治疗肿瘤的产品;
43.m2)制备杀伤肿瘤细胞的产品;
44.m3)制备生产car-t细胞的产品;
45.m4)生产car-t细胞。
46.本发明第六方面提供了一种治疗或辅助治疗肿瘤的产品,所述产品包含上述第四方面所述的car-t细胞或慢病毒或重组慢病毒载体或逆转录病毒或重组逆转录病毒载体。
47.进一步地,所述肿瘤为cldn3阳性的肿瘤;所述cldn3阳性的肿瘤包括但不限于卵巢癌或结肠癌。
48.与现有技术相比,本发明取得的积极有益效果如下:
49.本发明提供的嵌合抗原受体能够特异识别cldn3抗原,具有良好的靶向性,并且在t细胞中能够稳定的表达;包含该嵌合抗原受体的car-t细胞在体外表现出很好的靶向性,其对cldn3阳性表达的细胞有极强的杀伤能力,而对抗原阴性的细胞没有明显杀伤作用;并且其在体内实验中,同样显示出很好的抗原靶向性和肿瘤杀伤活性,因此,本发明制备的car-t细胞能够用于肿瘤的靶向治疗。
附图说明
50.图1为利用gepia数据库分析cldn3在肿瘤及正常组织中的mrna表达水平的结果图;
51.图2为humanproteinatlas数据库分析cldn3蛋白卵巢癌肿瘤细胞膜、结肠癌肿瘤细胞膜、直肠癌肿瘤细胞膜表达的结果图;其中,a为卵巢癌肿瘤细胞膜,b为结肠癌肿瘤细胞膜、c为直肠癌肿瘤细胞膜;
52.图3为嵌合抗原受体cldn3-28z的慢病毒表达载体结构示意图;
53.图4为嵌合抗原受体cldn3-bbz的慢病毒表达载体结构示意图;
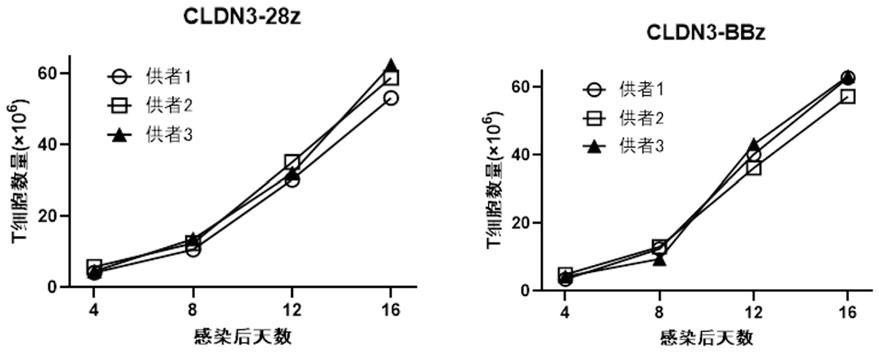
54.图5为cldn3-28z car-t细胞、cldn3-bbz car-t细胞增殖结果图;其中,cldn3-28z 表示cldn3-28z car-t细胞,cldn3-bbz表示cldn3-bbz car-t细胞;
55.图6为car表达水平检测结果图;其中t表示未感染t细胞,cldn3-28z表示cldn3-28z car-t细胞,cldn3-bbz表示cldn3-bbz car-t细胞;
56.图7为不同肿瘤细胞系中cldn3表达水平检测结果图;
57.图8为elisa检测各靶细胞与car-t细胞共培养上清中细胞因子il-2、ifn-γ的水平结果图;其中,cldn3-28z表示cldn3-28z car-t细胞,cldn3-bbz表示cldn3-bbz car-t细胞;
58.图9为car-t细胞体外对肿瘤细胞杀伤作用检测结果图;其中,t表示未感染t细胞,cldn3-28z表示cldn3-28z car-t细胞,cldn3-bbz表示cldn3-bbz car-t细胞;
59.图10为car-t细胞的体内杀瘤活性检测结果(肿瘤体积)图,其中t表示未感染t细胞,cldn3-28z表示cldn3-28z car-t细胞,cldn3-bbz表示cldn3-bbz car-t细胞。
具体实施方式
60.以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
61.需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、部件和/或它们的组合。
62.下列实施例中未注明具体条件的实验方法,均采用本技术领域常规技术,或按照生产厂商所建议的条件;所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
63.为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
64.实施例一:cldn3蛋白作为car-t细胞治疗靶点的可行性研究
65.(一)cldn3在肿瘤组织和正常中的表达研究
66.为了探究cldn3蛋白作为car-t细胞治疗靶点的可行性,发明人利用gepia数据库分析了cldn3在不同肿瘤组织和正常组织中mrna的表达情况,具体结果如图1所示。
67.由图1可知,cldn3在多种肿瘤组织中高表达,而在正常组织中的表达水平都很低。
68.(二)cldn3在不同组织中的蛋白表达水平及表达部位
69.发明人利用human protein atlas数据库分析cldn3蛋白在不同组织中的表达水平及表达部位,具体结果如图2所示。
70.由图2可知,cldn3蛋白在卵巢癌、结肠癌、直肠癌等多种类型肿瘤的恶性细胞的表面高表达。结果表明,cldn3蛋白在肿瘤细胞表面高表达,适合作为car-t细胞治疗靶点。
71.实施例二:car表达序列的设计及慢病毒的构建
72.(一)嵌合抗原受体cldn3-28z、cldn3-bbz的序列设计
73.1、嵌合抗原受体cldn3-28z的序列设计
74.嵌合抗原受体cldn3-28z依次由前导肽序列、标签序列、cldn3结合结构域、铰链区、跨膜结构域、共刺激结构域、胞内信号传导结构域组成,其氨基酸序列如seq id no.9所示。
75.其中,所述前导肽序列帮助car蛋白合成后向细胞膜转运,前导肽序列来自人cd8a蛋白,其氨基酸序列如seq id no.8所示。所述标签序列用于car检测,采用的具体标签序列为c-myc,其氨基酸序列为:eqkliseedlgs。所述cldn3结合结构域为抗cldn3单链抗体,用于识别cldn3蛋白并启动t细胞激活信号,其氨基酸序列如seq id no.1所示。所述铰链区为来自人cd8a蛋白的多肽,其氨基酸序列如seq id no.7所示,铰链区用于帮助car分子保持正确构象,保证car-t细胞的准确激活。所述跨膜结构域即跨膜区,为来自人cd28蛋白的多肽,其氨基酸序列如seq id no.4所示,跨膜结构域用于维持car分子在细胞膜中的镶嵌状态。所述共刺激结构域为来自人cd28蛋白的共刺激信号分子,其氨基酸序列如seq id no.2所示,共刺激结构域用于维持car-t细胞的高效激活。所述胞内信号传导结构域为包含人cd3ζ的信号传导结构域,其氨基酸序列如seq id no.6所示,胞内信号传导结构域用于增强car-t细胞的活性状态。
76.2、嵌合抗原受体cldn3-bbz的序列设计
77.嵌合抗原受体cldn3-bbz依次由前导肽序列、标签序列、cldn3结合结构域、铰链区、跨膜结构域、共刺激结构域、胞内信号传导结构域组成,其氨基酸序列如seq id no.10所示。
78.其中,所述前导肽序列帮助car蛋白合成后向细胞膜转运,前导肽序列来自人cd8a蛋白,其氨基酸序列如seq id no.8所示。所述标签序列用于car检测,采用的具体标签序列为c-myc,其氨基酸序列为:eqkliseedlgs。所述cldn3结合结构域为抗cldn3单链抗体,用于识别cldn3蛋白并启动t细胞激活信号,其氨基酸序列如seq id no.1所示。所述铰链区为来自人cd8a蛋白的多肽,其氨基酸序列如seq id no.7所示,铰链区用于帮助car分子保持正确构象,保证car-t细胞的准确激活。所述跨膜结构域即跨膜区,为来自人cd8a蛋白的多肽,其氨基酸序列如seq id no.5所示,跨膜结构域用于维持car分子在细胞膜中的镶嵌状态。所述共刺激结构域为来自人4-1bb蛋白的共刺激信号分子,其氨基酸序列如seq id no.3所示,共刺激结构域用于维持car-t细胞的高效激活。所述胞内信号传导结构域为包含人cd3ζ的信号传导结构域,其氨基酸序列如seq id no.6所示,胞内信号传导结构域用于增强car-t细胞的活性状态。
79.(二)慢病毒载体的构建
80.1、嵌合抗原受体cldn3-28z慢病毒表达质粒的构建
81.根据上述嵌合抗原受体cldn3-28z的氨基酸序列,由上海生工生物工程有限公司
人工合成编码嵌合抗原受体cldn3-28z的基因序列,具体核苷酸序列如seq id no.11所示。
82.分别对编码嵌合抗原受体cldn3-28z的基因序列和慢病毒载体pcdh-ef1-mcs(购自addgene)进行ecori和sali双酶切(内切酶购自宝生物公司,操作按照说明书进行)。获得酶切产物后,使用快速连接酶进行片段连接(快速连接酶购自宝生物公司,连接步骤按说明书进行),然后将连接产物转化感受态细胞(购自宝生物公司,转化步骤按说明书进行)。对转化产物进行扩增后交由上海生工公司进行测序,测序正确,即得到嵌合抗原受体cldn3-28z的慢病毒表达载体(如图3所示)。嵌合抗原受体cldn3-28z的慢病毒表达载体用于后续病毒生产。
83.2、嵌合抗原受体cldn3-bbz慢病毒表达载体的构建
84.根据上述嵌合抗原受体cldn3-bbz的氨基酸序列,由上海生工生物工程有限公司人工合成编码嵌合抗原受体cldn3-bbz的基因序列,具体核苷酸序列如seq id no.12所示。
85.分别对编码编码嵌合抗原受体cldn3-bbz的基因序列和慢病毒载体pcdh-ef1-mcs(购自addgene)进行ecori和sali双酶切(内切酶购自宝生物公司,操作按照说明书进行)。获得酶切产物后,使用快速连接酶进行片段连接(快速连接酶购自宝生物公司,连接步骤按说明书进行),然后将连接产物转化感受态细胞(购自宝生物公司,转化步骤按说明书进行)。对转化产物进行扩增后交由上海生工公司进行测序。测序正确,即得到嵌合抗原受体cldn3-bbz的慢病毒表达载体(如图4所示)。嵌合抗原受体cldn3-bbz的慢病毒表达载体dna序列用于后续病毒生产。
86.(三)慢病毒制备
87.1、嵌合抗原受体cldn3-28z慢病毒制备
88.提前18-24h将293t细胞接种到6cm培养皿,保证转染时细胞融合率达到80%。次日观察293t细胞,确认细胞状态良好且融合度在80%-90%时,更换新鲜培养基并加入25μm磷酸氯喹。更换培养基2h后,小心加入上述构建的嵌合抗原受体cldn3-28z慢病毒表达载体、包装载体(pspax2和pmd2.g)和磷酸钙转染试剂(宝生物,操作按产品说明书进行)。转染6h后,将上清吸出后加入适量新鲜培养基,继续培养48h后,得到病毒液(记作cldn3-28z病毒液),收集cldn3-28z病毒液上清,置于4℃待用。
89.2、嵌合抗原受体cldn3-bbz慢病毒制备
90.提前18-24h将293t细胞接种到6cm培养皿,保证转染时细胞融合率达到80%。次日观察293t细胞,确认细胞状态良好且融合度在80%-90%时,更换新鲜培养基并加入25μm磷酸氯喹。更换培养基2h后,小心加入上述构建的嵌合抗原受体cldn3-bbz慢病毒表达载体、包装载体(pspax2和pmd2.g)和磷酸钙转染试剂(宝生物,操作按产品说明书进行)。转染6h后,将上清吸出后加入适量新鲜培养基,继续培养48h后得到病毒液(记作cldn3-bbz病毒液),收集cldn3-bbz病毒液上清,置于4℃待用。
91.实施例二:car-t细胞的制备及car表达的检测
92.(一)car-t细胞的制备
93.使用t细胞纯化试剂盒(美天旎,操作按产品说明书进行)从人外周血中获得t细胞后,按照4
×
106个t细胞加入40μl活化磁珠(美天旎)比例混匀,并加入il-2至200iu/ml进行活化。
94.t细胞活化48后计数,按照2
×
106~4
×
106个t细胞加入3ml病毒上清的比例进行离
心感染。感染程序如下:32℃,1000
×
g,1.5h,加速5,降速5。感染结束后,更换为新鲜培养基和il-2(200iu/ml)进行扩增,并每2-3天进行扩瓶处理。
95.将感染cldn3-28z慢病毒病毒液的t细胞记作cldn3-28z car-t细胞。将感染cldn3-bbz病毒液的t细胞记作cldn3-bbz car-t细胞。
96.(二)car-t细胞计数及car表达检测
97.1、car-t细胞计数
98.在car-t细胞感染后4、8、12和16天时分别进行计数。具体计数操作为:将t细胞吹打混匀后,吸取10μl至计数板上,在显微镜下计数后计算car-t细胞密度,然后根据总体积算出car-t细胞总数。分别对来源于3位供者的细胞进行计数,其具体计数结果如图5所示。由图5可知,cldn3-28z car-t细胞和cldn3-bbz car-t细胞均能够高效增殖。
99.2、car表达水平检测
100.为了确定car表达效率,在感染后14天时,吸取car-t细胞,使用流式缓冲液(含2%胎牛血清的磷酸盐缓存液)离心清洗后,加入2μl抗myc标签的荧光素偶联抗体,4℃避光孵育30min,使用流式缓冲液再次离心清洗后进行流式细胞术检测。同时以未感染的t细胞进行对比实验。检测结果如图6所示。
101.由图6可知,未感染t细胞(记作t)表面没有检测到myc荧光信号,而cldn3-28z car-t细胞和cldn3-bbz car-t细胞表面均具有较强荧光信号。由此说明,car序列在t细胞中表达并正确定位到细胞膜表面,表明car-t细胞构建成功。
102.实施例三:car-t细胞的功能检测
103.(一)多种肿瘤细胞系中cldn3表达水平检测
104.供试肿瘤细胞系:jurkat、skov3或hct116。
105.收集肿瘤细胞并用流式缓冲液离心清洗后,加入2μl抗cldn3的荧光偶联抗体,4℃避光孵育30min,使用流式缓冲液再次离心清洗后进行流式细胞术检测。检测结果如图7所示。
106.由图7可知,jurkat细胞不表达cldn3,卵巢癌细胞skov3和结肠癌细胞hct116表达高水平的cldn3。
107.(二)elisa检测各靶细胞与car-t细胞共培养上清中细胞因子il-2、ifn-γ的水平分别收集肿瘤细胞(jurkat、skov3或hct116)和car-t细胞(cldn3-28z car-t细胞或cldn3-bbz car-t细胞),计数,然后将1
×
105个肿瘤细胞和1
×
105个car-t细胞混合。培养24h后收集上清,进行elisa(biolegend,操作按产品说明书进行)检测以确定t细胞效应细胞因子白介素-2(il-2)和干扰素-g(ifn-g)的分泌。检测结果如图8所示。
108.由图8可知,cldn3-28z car-t细胞或cldn3-bbz car-t细胞在抗原阳性细胞(skov3和hct116)刺激下均能分泌高水平的效应细胞因子,而与抗原阴性细胞(jurkat)孵育后没有明显效应细胞因子分泌。由此说明,构建的cldn3-28z car-t细胞、cldn3-bbz car-t细胞均具有抗原依赖性,只能被靶抗原特异性激活。
109.(三)car-t细胞体外对肿瘤细胞特异性杀伤作用
110.将1
×
105个skvo3肿瘤细胞加入细胞培养皿,待其贴壁后加入2
×
104个t细胞或car-t细胞。培养5天后,收集培养皿中的全部残余细胞,流式缓冲液离心清洗后,加入2μl死细胞染料、2μl抗epcam的荧光偶联抗体和2μl抗cd3的荧光偶联抗体,4℃避光孵育30min,使
用流式缓冲液再次离心清洗后进行流式细胞术检测。检测结果如图9所示。
111.由图9可知,在t细胞共孵育体系(t)中,剩余的活细胞中大部分为肿瘤细胞(tumor cell,epcam阳性),而t细胞(t cell,cd3阳性)比例很低;在car-t细胞共孵育体系(cldn3-28z或cldn3-bbz)中,剩余细胞中几乎全部是t细胞,肿瘤细胞仅有少量存活。结果表明,构建的cldn3-28z car-t细胞、cldn3-bbz car-t细胞均能够有效杀伤抗原阳性的肿瘤细胞。
112.(四)car-t细胞的体内抗肿瘤活性
113.利用小鼠异种移植瘤模型观察了car-t细胞的体内抗肿瘤活性。在免疫缺陷的nsg小鼠皮下接种5
×
105个skvo3肿瘤细胞,10天后待皮下形成明显肿块后,经尾静脉给予2
×
106个t细胞或者car-t细胞(cldn3-28z car-t细胞或cldn3-bbz car-t细胞)回输(每组5只小鼠)。t细胞回输后,每周进行2次肿瘤测量并计算肿瘤体积,根据肿瘤体积制作肿瘤生长曲线。结果如图10所示。
114.由图10可知,与t细胞相比,2种cldn3特异性car-t细胞均能显著抑制肿瘤生长。由此说明,构建的car-t细胞在体内具有良好的抗肿瘤活性。
115.以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
116.上述实施例的作用在于说明本发明的实质性内容,但并不以此限定本发明的保护范围。本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1