一种手性二苯基乙二胺钌络合物的制备方法与流程
1.本发明涉及医药合成、农药、精细化工等领域用钌贵金属催化剂制备技术领域,尤其涉及一种手性二苯基乙二胺钌络合物的制备方法。
背景技术:
2.手性配体和手性催化剂是手性催化合成领域的核心,其在医药、液晶材料、农用化学以及精细化工行业生产中都有着广泛的应用。现阶段,{[(1r,2r)或(1s,2s)-(-)-2-氨基-1,2-二苯基乙基](对甲苯磺酰基)氨基)}(均三甲苯)氯化钌络合物在特定的不对称催化领域取得了较大的突破,被广泛的应用于酮与亚胺的不对称催化氢化、michael反应、diels-alder反应、henry反应等。相比于小分子手性二胺催化剂,手性二胺配位金属钌催化剂具有更多的活性位点,具有反应速度快、高收率、高选择性等优势,使手性二胺钌催化剂具有极高的应用价值。
[0003]
目前,{[(1r,2r)或(1s,2s)-(-)-2-氨基-1,2-二苯基乙基](对甲苯磺酰基)氨基}(均三甲苯)氯化钌的合成工艺主要通过两步反应制备而得。第一步,原料1,3,5-三甲苯与对伞花烃氯化钌二聚体通过配体置换反应,反应结束后,再经过提纯得到均三甲苯氯化钌二聚体;第二步,将上述制备而得的均三甲苯氯化钌二聚体与配体[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺发生配位反应,得到目标产物,这样的反应制备过程较为繁琐,后处理周期长,得到的产品纯度也较低,所得产品须进一步重结晶提纯,导致产品收率降低,金属耗量增大。因此,设计制备过程简便,后处理时间短,产品纯度和收率高的{[(1r,2r)或(1s,2s)-(-)-2-氨基-1,2-二苯基乙基](对甲苯磺酰基)氨基}(均三甲苯)氯化钌的合成工艺成为本领域亟需。
技术实现要素:
[0004]
有鉴于此,本发明提供了一种手性二苯基乙二胺钌络合物的制备方法,解决了现有技术中获得目标产物的方法存在的反应制备过程较为繁琐,后处理周期长,得到的产品纯度也较低,所得产品须进一步重结晶提纯,导致产品收率降低,金属耗量增大的问题。
[0005]
为了达到上述目的,本发明采用如下技术方案:
[0006]
本发明提供一种手性二苯基乙二胺钌络合物的制备方法,包括如下步骤:
[0007]
(a)将(1,5-环辛二烯)二氯化钌、有机溶剂和1,3,5-三甲苯混合后进行反应,得到溶液体系a;
[0008]
(b)将[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺和有机溶剂混合,得到溶液体系b;
[0009]
(c)将溶液体系a、溶液体系b与碱试剂混合后进行反应,反应结束后顺次冷却、过滤、洗涤、抽干、真空干燥,得到手性二苯基乙二胺钌络合物;
[0010]
所述手性二苯基乙二胺钌络合物为{[(1r,2r)或(1s,2s)-(-)-2-氨基-1,2-二苯基乙基](对甲苯磺酰基)氨基}(均三甲苯)氯化钌。
[0011]
作为优选,所述步骤(a)、(b)和(c)中的反应独立的在无氧氛围中进行。
[0012]
作为优选,步骤(a)中,所述有机溶剂为无水乙醇和/或异丙醇;所述(1,5-环辛二烯)二氯化钌与有机溶剂的质量体积比为1g:4~10ml;所述(1,5-环辛二烯)二氯化钌与1,3,5-三甲苯的物质的量之比为1:3~6。
[0013]
作为优选,步骤(b)中,所述有机溶剂为石油醚、环己烷、甲苯中一种或两种;所述[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺与有机溶剂的质量体积比为1g:3~30ml;所述[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺的物质的量为步骤(a)中(1,5-环辛二烯)二氯化钌的物质的量的1.05~1.2倍;所述步骤(b)中的有机溶剂的体积为步骤(a)中有机溶剂的体积的1~3倍。
[0014]
作为优选,步骤(c)中,所述碱试剂为无水醋酸钠或无水碳酸钠;所述碱试剂的物质的量为步骤(a)中(1,5-环辛二烯)二氯化钌的物质的量的4~8倍。
[0015]
作为优选,步骤(a)中,所述反应的温度为50~80℃,反应的时间为3~8h。
[0016]
作为优选,步骤(c)中,所述反应的温度为50~80℃,反应的时间为2~8h。
[0017]
作为优选,步骤(c)中,所述溶液体系a、溶液体系b与碱试剂混合的方式为:将溶液体系a与碱试剂混合,得到混合液,再将溶液体系b滴加到混合液中。
[0018]
作为优选,步骤(c)中,溶液体系b滴加到混合液中,溶液体系b的滴加时间为10~30min。
[0019]
作为优选,步骤(c)中,所述真空干燥的温度为50~80℃,真空干燥的时间为3~10h,真空干燥至真空度≤-0.05mpa。
[0020]
经由上述的技术方案可知,与现有技术相比,本发明有益效果如下:
[0021]
本发明采用一步合成法,以(1,5-环辛二烯)二氯化钌作为金属前驱体,1,3,5-三甲苯和配体[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺为反应原料,于混合溶剂体系下,通过碱试剂的配合,直接加热反应,合成得到目标产物,操作步骤简便,金属利用率提升,生产成本大大降低,产品收率达到90.0%以上,纯度大于98.5%;整个反应过程不涉及危险化学品,操作环境更好更安全,适合工业化生产。
具体实施方式
[0022]
本发明提供一种手性二苯基乙二胺钌络合物的制备方法,包括如下步骤:
[0023]
(a)将(1,5-环辛二烯)二氯化钌、有机溶剂和1,3,5-三甲苯混合后进行反应,得到溶液体系a;
[0024]
(b)将[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺和有机溶剂混合,得到溶液体系b;
[0025]
(c)将溶液体系a、溶液体系b与碱试剂混合后进行反应,反应结束后顺次冷却、过滤、洗涤、抽干、真空干燥,得到手性二苯基乙二胺钌络合物;
[0026]
所述手性二苯基乙二胺钌络合物为{[(1r,2r)或(1s,2s)-(-)-2-氨基-1,2-二苯基乙基](对甲苯磺酰基)氨基}(均三甲苯)氯化钌。
[0027]
在本发明中,所述步骤(a)、(b)和(c)中的反应独立的在无氧氛围中进行。
[0028]
在本发明中,所述步骤(a)的具体步骤为:在无氧条件下,将(1,5-环辛二烯)二氯化钌和有机溶剂混合,再加入原料1,3,5-三甲苯搅拌反应,得到溶液体系a;
[0029]
在本发明中,所述步骤(b)的具体步骤为:于室温、无氧条件下,将配体[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺和有机溶剂混合,搅拌至澄清,得到溶液体系b;
[0030]
在本发明中,所述步骤(c)的具体步骤为:在搅拌、无氧状态下,将溶液体系a、溶液体系b与碱试剂混合后进行反应,反应结束后顺次冷却、过滤、洗涤、抽干、真空干燥,得到目标产物{[(1r,2r)或(1s,2s)-(-)-2-氨基-1,2-二苯基乙基](对甲苯磺酰基)氨基}(均三甲苯)氯化钌。
[0031]
在本发明中,步骤(a)中,所述有机溶剂优选为无水乙醇和/或异丙醇,进一步优选为无水乙醇;所述(1,5-环辛二烯)二氯化钌与有机溶剂的质量体积比优选为1g:4~10ml,进一步优选为1g:5~8ml;所述(1,5-环辛二烯)二氯化钌与1,3,5-三甲苯的物质的量之比优选为1:3~6,进一步优选为1:4~5。
[0032]
在本发明中,步骤(b)中,所述有机溶剂优选为石油醚、环己烷、甲苯中一种或两种,进一步优选为石油醚和/或环己烷;所述[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺与有机溶剂的质量体积比优选为1g:3~30ml,进一步优选为1g:15~25ml;所述[(1r,2r)或(1s,2s)-n-(2-氨基-1,2-二苯乙基)]对甲苯磺酰胺的物质的量优选为步骤(a)中(1,5-环辛二烯)二氯化钌的物质的量的1.05~1.2倍,进一步优选为步骤(a)中(1,5-环辛二烯)二氯化钌的物质的量的1.1~1.15倍;所述步骤(b)中的有机溶剂的体积优选为步骤(a)中有机溶剂的体积的1~3倍,进一步优选为步骤(a)中有机溶剂的体积的2~2.5倍。
[0033]
在本发明中,步骤(c)中,所述碱试剂优选为无水醋酸钠或无水碳酸钠,进一步优选为无水醋酸钠;所述碱试剂的物质的量优选为步骤(a)中(1,5-环辛二烯)二氯化钌的物质的量的4~8倍,进一步优选为步骤(a)中(1,5-环辛二烯)二氯化钌的物质的量的5~6倍。
[0034]
在本发明中,步骤(a)中,所述反应的温度优选为50~80℃,进一步优选为65~70℃;反应的时间优选为3~8h,进一步优选为4~6h。
[0035]
在本发明中,步骤(c)中,所述反应的温度优选为50~80℃,进一步优选为60~75℃;反应的时间优选为2~8h,进一步优选为4~7h。
[0036]
在本发明中,步骤(c)中,所述溶液体系a、溶液体系b与碱试剂混合的方式为:将步骤(a)得到的溶液体系a中加入碱试剂,搅拌5~15min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中。
[0037]
在本发明中,步骤(c)中,所述溶液体系b滴加到混合液中,溶液体系b的滴加时间优选为10~30min,进一步优选为15~25min。
[0038]
在本发明中,步骤(c)中,所述真空干燥的温度优选为50~80℃,进一步优选为60~75℃;真空干燥的时间优选为3~10h,进一步优选为4~8h;真空干燥优选为真空干燥至真空度≤-0.05mpa,进一步优选为真空干燥至真空度≤-0.07mpa。
[0039]
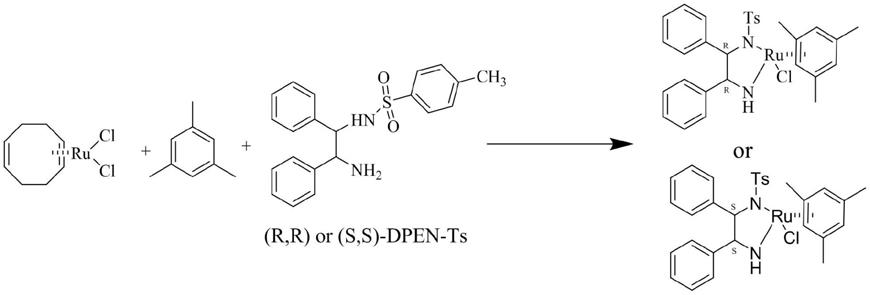
本发明所述所述手性二苯基乙二胺钌络合物{[(1r,2r)或(1s,2s)-(-)-2-氨基-1,2-二苯基乙基](对甲苯磺酰基)氨基}(均三甲苯)氯化钌的制备方法的化学反应过程如下:
[0040][0041]
下面结合实施例对本发明提供的技术方案进行详细的说明,但是不能把它们理解为对本发明保护范围的限定。
[0042]
实施例1
[0043]
(a)于65℃下,无氧条件氛围中,将14.01g(1,5-环辛二烯)二氯化钌和60ml无水乙醇混合,再加入原料24.04g 1,3,5-三甲苯搅拌反应5h,得到溶液体系a;
[0044]
(b)于室温、无氧条件下,将19.30g配体(1r,2r)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺和60ml石油醚混合,搅拌至澄清,得到溶液体系b;
[0045]
(c)在搅拌、无氧状态下,向步骤(a)得到的溶液体系a中加入20.51g无水醋酸钠,搅拌5min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中,滴加时间为10min,于65℃条件下,继续搅拌反应3h,待反应结束后,冷却、过滤、洗涤、抽干,在60℃下真空干燥5h,得到目标产物28.40g,收率91.3%,产物纯度98.9%。
[0046]
实施例1制备的化合物的元素分析结果为c 57.94%,h 4.95%,ru 16.06%;理论值为c 57.91%,h 4.86%,ru 16.24%。
[0047]
实施例2
[0048]
(a)于75℃下,无氧条件氛围中,将14.01g(1,5-环辛二烯)二氯化钌和90ml异丙醇混合,再加入原料30.14g 1,3,5-三甲苯搅拌反应4h,得到溶液体系a;
[0049]
(b)于室温、无氧条件下,将20.14g配体(1s,2s)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺和150ml环己烷混合,搅拌至澄清,得到溶液体系b;
[0050]
(c)在搅拌、无氧状态下,向步骤(a)得到的溶液体系a中加入26.51g无水醋酸钠,搅拌15min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中,滴加时间为15min,于75℃条件下,继续搅拌反应2.5h,待反应结束后,冷却、过滤、洗涤、抽干,在70℃下真空干燥4h,得到目标产物28.19g,收率90.6%,产物纯度98.7%。
[0051]
实施例2制备的化合物的元素分析结果为c 57.86%,h 4.98%,ru 16.03%;理论值为c 57.91%,h 4.86%,ru 16.24%。
[0052]
实施例3
[0053]
(a)于80℃下,无氧条件氛围中,将14.01g(1,5-环辛二烯)二氯化钌和130ml无水乙醇混合,再加入原料35.14g 1,3,5-三甲苯搅拌反应3.5h,得到溶液体系a;
[0054]
(b)于室温、无氧条件下,将21.64g配体(1r,2r)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺和300ml甲苯混合,搅拌至澄清,得到溶液体系b;
[0055]
(c)在搅拌、无氧状态下,向步骤(a)得到的溶液体系a中加入40.50g无水碳酸钠,搅拌10min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中,滴加时间为
25min,于80℃条件下,继续搅拌反应2h,待反应结束后,冷却、过滤、洗涤、抽干,在75℃下真空干燥3.5h,得到目标产物28.25g,收率90.8%,产物纯度98.6%。
[0056]
实施例3制备的化合物的元素分析结果为c 57.87%,h 4.99%,ru 16.01%;理论值为c 57.91%,h 4.86%,ru 16.24%。
[0057]
实施例4
[0058]
(a)于50℃下,无氧条件氛围中,将14.01g(1,5-环辛二烯)二氯化钌与40ml无水乙醇和40ml异丙醇的混合体系混合,再加入原料26.14g 1,3,5-三甲苯搅拌反应8h,得到溶液体系a;
[0059]
(b)于室温、无氧条件下,将20.34g配体(1r,2r)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺与100ml环己烷和100ml甲苯的混合体系混合,搅拌至澄清,得到溶液体系b;
[0060]
(c)在搅拌、无氧状态下,向步骤(a)得到的溶液体系a中加入23.80g无水醋酸钠,搅拌10min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中,滴加时间为15min,于50℃条件下,继续搅拌反应7h,待反应结束后,冷却、过滤、洗涤、抽干,在80℃下真空干燥3h,得到目标产物28.28g,收率90.9%,产物纯度98.6%。
[0061]
实施例4制备的化合物的元素分析结果为c 57.87%,h 5.01%,ru 16.01%;理论值为c 57.91%,h 4.86%,ru 16.24%。
[0062]
实施例5
[0063]
(a)于70℃下,无氧条件氛围中,将14.01g(1,5-环辛二烯)二氯化钌与60ml无水乙醇和50ml异丙醇的混合体系混合,再加入原料31.54g 1,3,5-三甲苯搅拌反应5h,得到溶液体系a;
[0064]
(b)于室温、无氧条件下,将21.24g配体(1s,2s)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺与200ml石油醚和100ml环己烷的混合体系混合,搅拌至澄清,得到溶液体系b;
[0065]
(c)在搅拌、无氧状态下,向步骤(a)得到的溶液体系a中加入30.80g无水醋酸钠,搅拌15min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中,滴加时间为25min,于70℃条件下,继续搅拌反应4.5h,待反应结束后,冷却、过滤、洗涤、抽干,在70℃下真空干燥3.5h,得到目标产物28.15g,收率90.5%,产物纯度98.7%。
[0066]
实施例5制备的化合物的元素分析结果为c 57.89%,h 4.97%,ru 16.03%;理论值为c 57.91%,h 4.86%,ru 16.24%。
[0067]
实施例6
[0068]
(a)于80℃下,无氧条件氛围中,将14.01g(1,5-环辛二烯)二氯化钌与80ml无水乙醇和60ml异丙醇的混合体系混合,再加入原料36g 1,3,5-三甲苯搅拌反应3h,得到溶液体系a;
[0069]
(b)于室温、无氧条件下,将21.85g配体(1r,2r)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺与200ml石油醚和200ml甲苯的混合体系混合,搅拌至澄清,得到溶液体系b;
[0070]
(c)在搅拌、无氧状态下,向步骤(a)得到的溶液体系a中加入40.5g无水碳酸钠,搅拌15min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中,滴加时间为30min,于80℃条件下,继续搅拌反应2.5h,待反应结束后,冷却、过滤、洗涤、抽干,在80℃下真空干燥5.5h,得到目标产物28.22g,收率90.7%,产物纯度98.7%。
[0071]
实施例6制备的化合物的元素分析结果为c 57.93%,h 4.96%,ru 16.03%;理论
值为c 57.91%,h 4.86%,ru 16.24%。
[0072]
实施例7
[0073]
(a)于65℃下,无氧条件氛围中,将560.32g(1,5-环辛二烯)二氯化钌和2.5l无水乙醇混合,再加入原料961.60g 1,3,5-三甲苯搅拌反应4.5h,得到溶液体系a;
[0074]
(b)于室温、无氧条件下,将772g配体(1r,2r)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺和2.5l石油醚混合,搅拌至澄清,得到溶液体系b;
[0075]
(c)在搅拌、无氧状态下,向步骤(a)得到的溶液体系a中加入820.4g无水醋酸钠,搅拌10min,得到混合液,再将步骤(b)得到的溶液体系b滴加到混合液中,滴加时间为20min,于65℃条件下,继续搅拌反应2.5h,待反应结束后,冷却、过滤、洗涤、抽干,在70℃下真空干燥3.5h,得到目标产物1137.35g,收率91.4%,产物纯度98.8%。
[0076]
实施例7制备的化合物的元素分析结果为c 57.87%,h 4.96%,ru 16.05%;理论值为c 57.91%,h 4.86%,ru 16.24%。
[0077]
对比例1
[0078]
与实施例1的区别在于所述反应过程在有氧氛围下进行,无氧条件更改为通入空气,其它同实施例1。得到目标产物26.04g,收率83.7%,产物纯度95.4%。
[0079]
说明反应过程处于有氧条件下,会使配体变质或反应过程有副产物的生成,并且对目标产物的收率及纯度都有较大影响。
[0080]
对比例2
[0081]
与实施例2的区别在于所述步骤(b)中的有机溶剂为异丙醇,其它同实施例2,所得物质需在真空干燥前进行重结晶提纯。得到目标产物16.55g,收率53.2%。
[0082]
说明反应步骤(a)与步骤(b)采用同一溶剂时,会使配体(1r,2r)-n-(2-氨基-1,2-二苯乙基)对甲苯磺酰胺与反应中间体均三甲苯氯化钌二聚体发生副反应,合成不含氯手性钌络合物,须进一步提纯,分离副产物。
[0083]
对比例3
[0084]
与实施例1的区别在于不添加碱试剂,其它同实施例1,所得物质需在真空干燥前进行重结晶提纯。得到目标产物13.22g,收率42.5%。
[0085]
说明反应处于无碱试剂条件下,会使反应难以进行或反应极为缓慢,并且反应过程伴随副产物的生成。
[0086]
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1