一种多核苷酸、载体元件及表达载体和宿主细胞及应用的制作方法
1.本发明属于生物技术领域,具体涉及一种多核苷酸、包含该多核苷酸的载体元件、包含该载体元件的表达载体、包含该表达载体的宿主细胞以及该宿主细胞在生产蛋白中的应用。
背景技术:
2.近年来,蛋白质药物被应用于不同疾病的治疗,其中单克隆抗体(mabs)是发展最快的一类。其中,目前生物药领域主要使用的哺乳类宿主细胞包含cho、nso、sp2/0、hek等,而在整个单株抗体则以cho为主要宿主细胞。cho细胞是生产这些蛋白质药物应用最广泛的细胞株,表达载体影响目标蛋白的表达量与表达稳定性。
3.cho细胞至少包括如下优点:(1)适合悬浮培养,符合工业大规模生产的需求;(2)糖型修饰与人相似,贴近天然mabs的结构和功能;(3)外源基因可以稳定地整合到cho细胞中达到高表达量;(4)非人源细胞,故人源病毒不能感染和扩增;(5)分泌低量的内源蛋白,有利于目的蛋白的分离纯化;(6)研究与药物开发应用历史完整,故目前的新药开发仍以cho细胞为主要平台。
4.近几年的细胞株开发平台的发展过程中,cho细胞也不断地被挑选与改造而衍生出多个细胞系,如dg44、dxb11、cho-s、cho-k1与chozn等。这些细胞系是经由人工挑选优化、突变筛选或基因工程的方式建立并用于不同的药物发展与平台应用。随着基因改造技术的进步与发现(如:zinc finger、talent与crispr),根据应用需求可以为自有的野生型cho细胞株进行各项改造已达到产量、提高稳定性或质量的升级。
5.宿主细胞主要提供蛋白质药物表达的部分平台,相应的表达株载体可进一步体现出其生产能力。故挑选适当且符合宿主细胞的载体细胞株构建十分重要。
6.现有的表达载体的构建策略包括如下步骤:启动子的挑选(猿猴空泡病毒40(sv40)、延伸因子-1α(ef-1α)和巨细胞病毒(cmv)等);筛选基因的选择(谷氨酰胺合成酶基因(glutaminesynthetase,gs)、l-氨基亚砜蛋氨酸(methionine sulphoximine,msx)、二氢叶酸还原酶(dhfr)(mtx)和抗嘌呤霉素(puromycin)基因等);表基因调控元件的使用(ucoe和mar等);载体元件的排列(单顺反子载体、多启动子表达载体、ires(内部核糖体进入位点)或furin-2a(弗林蛋白酶-2a多肽)元件介导的三顺反子载体)。将上述启动子、终结子与筛选基因进行基础排列便形成原型载体。
7.除了以上数种必要元件,添加如ucoe和mar的特殊基因组开放区于表达载体也是可应用的方向。基因组开放区具有如下特点:来源于真核生物,相关基因具稳定高表达的特性与基因组区间含大量的表基因修饰。这样的特点可有效率的构建符合蛋白质药物工业生产用细胞株,同时缩短蛋白质药物临床前研究的时间。将基因组开放区置入原型载体中便形成具高表达与稳定性的哺乳类细胞表达载体。
8.以下简单介绍几种较为常用的载体:
9.(1)thermofisher
10.pcdna系列载体:主要架构为启动子、终结子与筛选基因基本串联。试用多数哺乳类细胞表达,但稳定性较差。
11.pcho-1.0:主要架构为启动子、终结子与筛选基因基本串联。该载体的特点是使用优化的启动子(重组)使其便于cho细胞抗体药物的表达。
12.(2)lonzovectors system:主要架构为启动子、终结子与筛选基因。该筛选系统以gs筛选为主要筛选标记,载体进一步添加transposon等元件使细胞株开发效率提升。
13.(3)merckexpression technology(novagen):主要架构为启动子、终结子与筛选基因。载体进一步添加ucoe元件并挑选不同的启动子进行搭配。。用于提高表达量与提升稳定性,进而使细胞株开发效率提升。
14.如上所述,“表基因调控元件的使用(ucoe和mar等)”目前为普遍使用的相似元件。该元件置于载体启动子前端进而增强目标基因表达与表达稳定性,目前主要应用范围是哺乳类动物细胞稳定细胞株构建。但是,传统载体用于稳定细胞株构建的过程需花费较高的人力、物力才能挑选高表达的细胞株;且传统载体构建的细胞株稳定性不佳。
技术实现要素:
15.有鉴于此,为了克服现有技术的缺陷,本发明的目的在于提供了一种多核苷酸、载体元件及表达载体和宿主细胞,应用于稳定细胞株构建并应用于重组蛋白的表达。
16.为了达到上述目的,本发明采用以下的技术方案:
17.本发明一方面提供了一种多核苷酸,所述多核苷酸包括如seq id no.1和/或seq id no.2所示的核苷酸序列。
18.根据本发明的一些优选实施方面,所述多核苷酸包括如seq id no.1和seq id no.2所示的核苷酸序列。
19.本发明第二方面提供了一种载体元件,包括如上所述的多核苷酸。
20.根据本发明的一些优选实施方面,包括启动子,所述多核苷酸位于所述启动子的上游。
21.根据本发明的一些优选实施方面,所述启动子为选自cmv、eef1a1、mpgk、hpgk、sv40中的一种。
22.根据本发明的一些优选实施方面,包括开放阅读框,所述开放阅读框位于所述多核苷酸的下游。
23.根据本发明的一些优选实施方面,所述开放阅读框位于所述启动子的下游。
24.根据本发明的一些优选实施方面,所述载体元件依次包括多核苷酸、启动子和开放阅读框。
25.本发明第三方面提供了一种表达载体,所述表达载体包括如上所述的载体元件。
26.根据本发明的一些优选实施方面,所述表达载体为质粒。
27.根据本发明的一些优选实施方面,所述表达载体通过如下构建方法得到:
28.获得核苷酸seq id no.1和seq id no.2的序列,完成相对应序列的基因合成;将核苷酸seq id no.1和seq id no.2序列进行拼接并与pem载体进行拼接,得到空载体;利用所述空载体进行单克隆抗体表达载体的构建;对构建完成的所述表达载体通过pvui酶切制备线性化质粒。
29.本发明第四方面提供了一种宿主细胞,所述宿主细胞中含有或者整合有如上所述的表达载体。
30.根据本发明的一些优选实施方面,所述宿主细胞为哺乳类细胞。
31.根据本发明的一些优选实施方面,所述宿主细胞为选自cho细胞、nso细胞、sp2/0细胞、hek细胞或上述细胞的延伸细胞系中的一种。
32.本发明第五方面提供了一种如上所述的宿主细胞在生产蛋白中的应用。
33.由于采用了以上的技术方案,相较于现有技术,本发明的有益之处在于:本发明的包括如seq id no.1和/或seq id no.2所示的核苷酸序列的多核苷酸,其与细胞的转录调控基因有强烈的共参与关系并维持持家基因等高表达基因稳定,将含有其的载体元件导入表达载体可提高宿主细胞转录调控因子的辨识度,并进而提高并维持外来基因的表达,最终用以构建稳定且高表达的生产用细胞株。
附图说明
34.为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
35.图1为本发明优选实施例中载体元件的示意图;
36.图2为本发明优选对比例中pem载体结构图;
37.图3为本发明优选实施例中pem-g-g载体结构图;
38.图4为本发明优选实施例中pem-g-ge载体结构图;
39.图5为本发明优选实施例中pem-ge-g载体结构图;
40.图6为本发明优选实施例中pem-ge-ge载体结构图;
41.图7为本发明另一优选对比例中pem-1.2k ucoe载体结构图;
42.图8为本发明优选实施例中载体元件于小库筛选应用测试的比较结果。
具体实施方式
43.为了使本技术领域的人员更好地理解本发明的技术方案,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分的实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都应当属于本发明保护的范围。
44.实施例1载体元件的结构
45.如图1所示,本实施例中的载体元件依次包括多核苷酸h3k27ac修饰区、启动子以及开放阅读框,h3k27ac修饰区位于启动子的上游(图1中最左侧),开放阅读框位于启动子的下游(图1中最右侧)。
46.其中,h3k27ac修饰区包括如seq id no.1和seq id no.2所示的核苷酸序列。且如seq id no.1和seq id no.2所示的核苷酸序列相似度大于或等于95%,以实现生产用细胞株的稳定和高表达。
47.启动子为选自cmv、eef1a1、mpgk、hpgk、sv40中的一种。
48.实施例2表达载体结构图
49.如图3-6所示表达载体结构图,本实施例提供一种包括实施例1中的载体元件。表达载体为质粒。
50.其中,图3为pem-g-g载体结构图;图4为pem-g-ge载体结构图;图5为pem-ge-g载体结构图;图6为pem-ge-ge载体结构图。
51.本实施例中的表达载体可用于多个肽链的体外生产方法,如用于转化/转染细胞或构建稳定细胞株。
52.实施例3表达载体的构建
53.合成的dna序列搭配自有的pem载体系统,经由载体构建的一系列过程,最终构建一个表达载体。具体包括如下步骤:
54.1、自有的pem载体系统已经具备启动子(cmv)加下游开放阅读框系统,其构建方式为:ncbi公开数据库获得启动子序列及开放阅读框序列,基因合成并添加相关酶切位点用于启动子和开放阅读框酶切酶连及启动子加开放阅读框与载体的酶切酶连。
55.2、获得核苷酸seq id no.1和seq id no.2序列并基因合成
56.从ncbi获得目的片段序列,完成相对应的dna序列的基因合成。
57.3、重轻链空载体的构建
58.seq id no.1和seq id no.2序列的拼接及seq id no.1和seq id no.2序列与载体的拼接过程均使用gibson assembly技术完成拼接;最终获得pem-g-hc、pem-ge-hc、pem-g-lc、pem-ge-lc的空载体。
59.具体gibson assembly拼接方法如下:
60.3.1、对pem空载启动子上游选择xhoi酶切位点进行酶切,胶回收获得一个线性的黏性末端片段,即为gibson assembly的样本片段。
61.3.2、seq id no.1和seq id no.2序列分别根据空载体启动子上游xhoi酶切位点处的部分碱基设计gibson assembly的引物,保证一个20bp的overlap(根据overlap的识别,连接酶才能精确连接),根据设计引物,对seq id no.1和seq id no.2分别pcr获得相应的gibson assembly的insert片段。
62.3.3、使用gibson assembly试剂盒将样本片段和insert片段连接。连接产物进行转化(dh5α),过夜培养后观察菌落形态,选择形状均匀一致的6个单菌落进行clone pcr验证。在验证其真实性后,挑选需要的两个单菌落进行扩繁,并小量抽提质粒。
63.4、单克隆抗体表达完整表达载体的构建
64.以测试蛋白为her2(igg-hc、igg-lc)举例,具体构建过程如下:
65.4.1、通过基因合成方法准备goi(mab)
66.4.1.1)goi的5'端设计切位为hindiii。
67.4.1.2)goi的3'端设计切位为ecori。
68.4.1.3)goi(mab)设计应删除以下限制酶切位:hindiii、ecori、apali、apai、bamhi、sali、scai、nrui、smai、noti、bglii、xhoi、xbai、pvui。
69.4.2、建构goi(mab-hc)于pem-hc、goi(mab-lc)于pem-lc载体。
70.4.2.1)利用hindiii/ecori限制酶分别对pem-hc、pem-lc与goi(mab-hc、lc)进行
酶切,经琼脂糖凝胶电泳验证片段大小正确后,选择所需的片段条带进行胶回收。
71.4.2.2)分别连接载体与goi以构建pem-hc-goi(mab-hc)和pem-lc-goi(mab-lc)
72.对胶回收后的片段使用t4连接酶连接(hc与pem-hc连接、lc与pem-lc连接)以构建连接产物pem-hc-goi(mab-hc)和pem-lc-goi(mab-lc)。
73.4.2.3)转化及clone pcr验证pem-hc-goi(mab-hc)和pem-lc-goi(mab-lc)的真实性
74.于4.2.2)步结束后的连接产物进行转化(dh5α),过夜培养后观察菌落形态,选择形状均匀一致的6个单菌落进行clone pcr验证。在验证其真实性后,挑选需要的两个单菌落进行扩繁,并小量抽提质粒(pem-hc-goi(mab-hc)和pem-lc-goi(mab-lc))。
75.5、建构pem-goi表达载体
76.5.1、利用noti/apali限制酶分别对pem-hc-goi(mab-hc)和pem-lc-goi(mab-lc)载体进行酶切,琼脂糖凝胶电泳验证片段大小正确后,选择需要的片段条带进行胶回收。
77.5.2、连接pem-hc-goi(mab-hc)与pem-lc-goi(mab-lc)进而构建pem-goi(mab)表达载体
78.对回收后的片段使用t4连接酶连接pem-hc-goi(mab-hc)与pem-lc-goi(mab-lc)进而构建pem-goi(mab)。
79.5.3、转化及clone pcr验证pem-goi(mab)质粒的真实性
80.于5.2步结束后的连接产物进行转化(dh5α),观察菌落形态,选择形状均匀一致的6个单菌落进行clone pcr验证。在验证其真实性后,挑选需要的两个单菌落进行扩繁,并抽提质粒pem-goi(mab),琼脂糖凝胶电泳及nanodrop 2000确定质粒浓度和质量。
81.6、目的基因测序
82.构建完成的pem-goi(mab)表达载体测序验证插入目的dna序列正确性。
83.7、为稳定细胞系的建立,pem-goi(mab)表达载体可以通过pvuii线性化
84.构建完成的pemgs.05-goi(mab)表达载体通过pvui酶切制备线性化质粒后,用无水酒精进行沉降,回收的质粒进行浓度和质量检测。质粒回收浓度在1ug/ul左右,紫外光260/280比值在1.80-2.0左右,260/230比值在2左右,结果符合细胞转染的要求。
85.实施例4宿主细胞的培养
86.宿主细胞:cho-k1(atcc#ccl-61),已驯化至emcd cho培养基中。
87.培养基:emcd cho medium+0.5%anti-clumping agent+4mm l-gln。
88.培养条件:37℃,5%co2,120rpm(轴距为50mm)。
89.容器:125ml及250ml摇瓶。
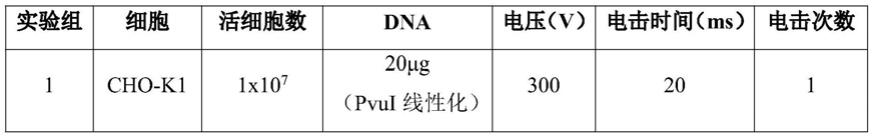
90.电转染及稳定细胞株筛选:细胞转染应在宿主细胞cho-k1复苏1.5周至3周内进行,宿主细胞活率在90%以上。传代过程中细胞密度控制在4x10
6 cells/ml以下。在转染前48小时活化细胞,按照8-10x10
5 cells/ml接种密度传代至带档板摇瓶中。转染前24小时,再次按照8-10x10
5 cells/ml接种细胞使其转染当天应保证细胞密度控制在1.5-2.0x10
6 cells/ml,细胞活率应大于95%,电转染参数如下表:
[0091][0092]
实施例5制备mini pool并加压筛选稳定细胞株
[0093]
mini pool:细胞经转染后按一定密度进行96孔板铺板,孔内细胞群称为mini pool
[0094]
1、细胞转染48h后,取样进行细胞计数,用octet检测上清蛋白表达量。
[0095]
2、挑选高表达量实验组,将相同载体的细胞混合采用筛选培养基(emcd cho medium+1%ht+0.5%anti-clumping agent+30μm msx+10μg/ml puromycin)进行96孔板铺板,分别按铺板密度10000cells/200μl/孔或15000cells/200μl/孔两个条件进行96孔板铺板,制备mini pool并加压筛选。培养条件:37℃,5%co2,静置培养。
[0096]
3、96孔板经培养2-3周后,显微镜下观察mini pool细胞生长情况。
[0097]
待mini pool细胞汇合度≥50%后,用octet检测上清中蛋白表达量,保留表达量相对较高的mini pool依次扩大至24孔板、6孔板、50ml摇管和125ml摇瓶培养。每阶段均用octet检测上清中蛋白表达量,每个载体96孔板阶段分别检测约80-150个左右mini pool,全部扩大至24孔板培养。待24孔板mini pool细胞汇合度>80%后,根据表达量保留约1/3mini pool扩大至6孔板培养。待6孔板mini pool细胞汇合度>80%后,根据表达量保留约1/2mini pool扩大至50ml摇管培养。50ml摇管培养3-4天后,保留8个左右表达量和活细胞数较优的mini pool扩大至125ml摇瓶培养。
[0098]
96孔板、24孔板和6孔板培养条件:37℃,5%co2,静置培养。50ml摇管培养条件:37℃,5%co2,180rpm(轴距50mm)。125ml摇瓶培养条件:37℃,5%co2,120rpm(轴距50mm)。
[0099]
最终筛选出的稳定细胞株进行流加培养评估:
[0100]
[0101][0102]
实施例6蛋白纯化
[0103]
对于流加培养后的细胞上清进行蛋白纯化,纯化步骤如下:
[0104]
6.1、装柱
[0105]
将protein a填料(ge mabselect surea lx 1ml)混匀,加到重力柱中,至柱高30mm,此时柱体积约有1ml。将重力柱固定,打开重力柱下端的堵头,使得保存液缓慢流出。
[0106]
6.2、再生
[0107]
直至保存液快至柱面时,缓缓加入再生液(50mm氢氧化钠/1m氯化钠溶液)总共20ml至柱中,每次等到液面接近填料表面时加入10ml再生液,共计2次。注意每次加入时力度不要过大以免冲击柱面。时刻保持柱面上方有再生液。
[0108]
6.3、预平衡
[0109]
直至再生液快至柱面时,缓缓加入平衡液(20mm磷酸缓冲溶液/150mm氯化钠;ph=7.0),总共20ml至柱中,每次等到液面下降至填料表面时加入10ml平衡液,共计2次。注意每次加入时力度不要过大以免冲击柱面。时刻保持柱面上方有平衡液。
[0110]
6.4、孵育
[0111]
预平衡完毕后,用堵头堵住出液孔,再加入0.5ml平衡液,用移液器小心重悬填料,等填料上层平整后,缓慢加入待纯化上清(上样量不超过40mg蛋白/ml柱体积),室温下孵育30min。
[0112]
6.5、清洗柱子
[0113]
孵育结束后,打开堵头,上清溶液在重力作用下,缓慢滴落(为提高回收率,可重复6.4操作1~2次)至收集容器中,用20ml平衡液清洗柱子,操作方式同6.3。
[0114]
6.6、洗脱
[0115]
待最后一次平衡液流干后,慢慢加入洗脱液(0.1m柠檬酸缓冲溶液;ph=3.5),分次加入,收集洗脱液。
[0116]
6.7、中和
[0117]
调节洗脱液与中和液(1m三氨基甲烷(tris))的比例,使终点ph控制在5.5
±
0.2范围内,向样品洗脱液(6.6)按比例加入中和液。
[0118]
6.8、过滤
[0119]
将上一步骤溶液用0.22μm针式过滤器过滤。
[0120]
6.9、检测
[0121]
用分光光度计检测过滤后溶液,记录浓度和纯化日期。
[0122]
6.10、再次清洗柱子
[0123]
用20ml平衡液清洗柱子,操作方式同6.3。
[0124]
6.11、再次再生柱子
[0125]
用20ml再生液清洗柱子,操作方式同6.2。
[0126]
6.12、保存
[0127]
用5ml保存液清洗柱子,操作方式同6.2,最后一次加5ml保存液(20%乙醇/150mm
氯化钠溶液)将堵头堵上,盖上柱盖。重力柱保存在4℃重复使用。
[0128]
纯化后样品进行-40℃保存。
[0129]
实施例7测试与分析
[0130]
表1.小库细胞用于流加培养的表达数据
[0131][0132]
表2.小库细胞用于流加培养的目标蛋白质量数据:带电性
[0133]
样品名称acidicpeak(%)mainpeak(%)basicpeak(%)pem-ge-ge32.6755.5411.78pem-g-ge(d13)31.0257.1111.86pem-g-ge(d15)31.6256.2912.09pem34.347.3318.39pem-1.2kucoe34.7748.5816.66
[0134]
表3.小库细胞用于流加培养的目标蛋白质量数据:糖型
[0135][0136]
根据研究表明,“表基因调控元件的使用(ucoe和mar等)”目前为普遍使用的相似元件,该元件置于载体启动子前端进而增强目标基因表达与表达稳定性,故设定多核苷酸修饰区均位于启动子上游。图2为无元件引入的载体,而图3-6为利用排列组合形成的4种载体系统,图7为1.2k ucoe取代本发明中g element或ge element引入的载体,其他元件一致。将抗体轻重链置入载体后进行性能比较。如图8结果显示多核苷酸h3k27ac修饰区(g element或ge element)置入的载体可提高小库筛选效率及表达的中位数,提高效率忧于1.2k ucoe,而g element或ge element之间各项的排列组合并无显著差异。经过挑选的最
佳小库细胞于流加培养表达可达2.87g/l(表1),与1.2k ucoe相比较,蛋白表达量显著提高。将表达的蛋白质量进行质量分析(cex及n-glycan),结果也符合现行抗体药物的范围(带电性:主峰55~60%;糖型:man 3~5%)。故本发明中构建的载体用于生物药物的表达符合需求。
[0137]
本发明利用基因组的h3k27ac修饰区,该表基因修饰区与细胞的转录调控基因有强烈的共参与关系并维持持家基因等高表达基因的稳定;将该基因组元件导入表达载体可提高宿主细胞转录调控因子的辨识度,并进而提高并维持外来基因的表达;最终用以构建稳定且高表达的生产用细胞株,提高稳定细胞株的开发效率和细胞稳定性。
[0138]
本发明利用h3k27ac修饰区应用于启动子上游以稳定启动子的功能,以提升载体效率;h3k27ac修饰区与cpg甲基化具关联性,可用于元件挑选。本发明的含基因组开放区的哺乳类细胞表达载体用于稳定细胞株构建并应用于重组蛋白的表达。
[0139]
上述实施例只为说明本发明的技术构思及特点,其目的在于让熟悉此项技术的人士能够了解本发明的内容并据以实施,并不能以此限制本发明的保护范围。凡根据本发明精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围之内。
[0140]
序列表
[0141]
seq id no.1
[0142]
g element片段
[0143]
accctttccaccctccctactcttcagaggaggaaccccctttctccttcccacttgttggagggggctggggccaggctgttctggcttggggtataataccccctaccccttctactttcccctcctctcagacctcaccctgcctccacgagggcagccaagaaaggagagtccctggctgcagggccagtaggcacgtcccaggacggggagggacttccgccctcacgtccagctctccgccctggggctgcagtgggtgaaaggggcagtgtctcctagcctgggcggtgcaaccctcaggttccgaggaggaacgctctgggaggcttctttgcctcctccaacccaacccacaaccaggacattgtcctcaccccggggccccaacctagaccttaactgaggaacacagaggccagtttgtaagtctcaattatgcagggcatcccgacctgtggcgtagggagcgcccctccaggccgcttccctagcctcctcctggccctcacagcccaggcctctggcccaagaaatggaagtgggggtgggggatggaactgcgaatgcgaagggcccccgcaggaggcaaagtgacccctcccgggccttttctgctccgagacttgtttttgcctgtgtcactaccgaagaaccacgagaagatcctcaacttttccacagcctttgcataaaggggagagggtcggcggtgcagctgtggcacacacgcacttctgctcaacccgcccccccccgcccccgttcctgttccttcccaggttctccccattttatcggggcggcaacttttaggtccctgggtcctggaagtccttagtacacactcttcgtccttaagtccatagtctgtattccctcggtcctatcctgtcccccatcaccgggtcacctccccagcgaagcaatctcagttcccctccccctctcagccccgagcccacacgtttggtgcctgcacatttcaaaaacgaggcgggtccaaagagagggggtggggaggtgccgagtggcccagctactcgcggctttacggctgcacgtagctcaggcctcagcgcccttgagctgtgactggatggatgagcggggcgggaggcggggcgagcgtcctcggcgctccccaccaccccagttcctataaatacggactgcagccctccccggt
[0144]
seq id no.2
[0145]
ge element片段
[0146]
accctttccaccctccctactcttcagaggaggaaccccctttctccttcccacttgttggagggggctggggccaggctgttctggcttggggtataataccccctaccccttctactttcccctcctctcagacctcaccctgcctccacgagggcagccaagaaaggagagtccctggctgcagggccagtaggcacgtcccaggacggggagggacttccgccctcacgtccagctctccgccctggggctgcagtgggtgaaaggggcagtgtctcctagcctgggcggtgcaac
cctcaggttccgaggaggaacgctctgggaggcttctttgcctcctccaacccaacccacaaccaggacattgtcctcaccccggggccccaacctagaccttaactgaggaacacagaggccagtttgtaagtctcaattatgcagggcatcccgacctgtggcgtagggagcgcccctccaggccgcttccctagcctcctcctggccctcacagcccaggcctctggcccaagaaatggaagtgggggtgggggatggaactgcgaatgcgaagggcccccgcaggaggcaaagtgacccctcccgggccttttctgctccgagacttgtttttgcctgtgtcactaccgaagagacgcggcagcccggcggagcggggcgggtgagtcacccacacaaaggaagagggccttgcccctcgccggccgctgcttcctgtgaccccgtggtgtaccggccgcacttcagtcaccccgggcgctctttcggagcaccgctggcctccgctgggggaggggatctgtctaatggcgttggagtttgctcacatttggtgggtggagactgtagccaggccagcctggccatggaagtaattcttggaatttgcccattttgagtttggagcgaagctgattgacaaagctgcttagccgttcaaaggtattcttcgaactttttttttaaggtgttgtgaaaaccaccgctaattcaaat
[0147]
1.2k ucoe片段
[0148]
atcgatccctccgcgcctacagctcaagccacatccgaagggggaggcggggcgaggacagtgaccggagtctcctcagcggtggcttttctgcttggcagcctcagcggctggcgccaaaaccggactccgcccacttcctcgcccctgcggtgcgagggtgtggaatcctccagacgctgggggagggggagttgggagcttaaaaactagtacccctttgggaccactttcagcagcgaactctcctgtactccaggggtcagttccacagacgcgggccaggggtgggtcattgcggcgtgaacaataatttgactagaagttgattcgggtgtttccggaaggggccgagtcaatccgccgagttggggcacggaaaacaaaaagggaaggctactaagatttttctggcgggggttatcattggcgtaactgcagggaccacctcccgggttgagggggctggatctccaggctgcggattaagcccctcccgtcggcgttaatttcaaactgcgcgaccgtttctcacctgccttgcgccaaggcagggggcgggaccctattccaagaggtagtaactagcaggactctagccttccgcaattcattgagcgcatttacggaagtaacgtcgggtactgtctctggccgcaagggtgggaggagtacgcatttggcgtaaggtggggcgtagagccttcccgccattggcggcggatagggcgtttacgcgacggcctgacgtagcggaagtcgcgttagtgggggggaaggttctagaaaagcggcggcagcggctctagcggcagtagcagcagcgccgggtcccgtgcggaggtgctcctcgcagagttgtttctcgagcagcggcagttctcactacagcgccaggacgagtccggttcgtgttcgtccgcggagatctctctcatctcgctcggctgcgggaaatcgggctgaagcgactgagtccgcgatggaggtaacgggtttgaaatcaatgagttattgaaaagggcatggcgaggccgttggcgcctcagtggaagtcggccagccgcctccgtgggagagaggcaggaaatcggaccaattcagtagcagtggggcttaaggtttatgaacggggtcttgagcggaggcctgagcgtacaaacagcttccccaccctcagcctcccggcgccatttcccttcactgggggtgggggatggggagctttcacatggcggacgctgccccgctggggtgaaagtggggcgcggaggcggcaattcttattccctttctaaagcacgctgcttcgggggccacggcgtctctgtaca
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1