造血干细胞的体外培养方法和包括其的组合物及其用途
1.本发明涉及生物技术和生物医学工程领域,具体地,涉及造血干细胞的体外培养方法和包括其的组合物及其用途。
背景技术:
2.近年来,关于造血干细胞体外培养体系和技术取得了长足发展。但是造血干细胞体内所处微环境极其复杂,而目前所采用的培养方式及其微环境条件尚不能完全模拟体内骨髓造血微环境在体外构建仿生体系。因此,迫切需要提供能够维持干细胞干性、自我更新和定向分化特性的造血干细胞,用于临床上治疗血液疾病。
技术实现要素:
3.本发明旨在至少在一定程度上解决相关技术中的技术问题之一。
4.一方面,本发明的实施方案提供了一种体外培养造血干细胞的方法。根据本发明的实施方案,该方法包括:提供3d培养基质;使造血干细胞生长于3d培养基质,其中3d培养基质以成阵列排布的多个单元提供,每个单元优选为0.5mm至5mm直径的圆柱体并且由具有海绵状结构的交联材料形成,海绵状结构的平均孔直径为10μm至110μm、孔壁硬度为0.1kpa至24.7kpa。
5.根据本发明实施例的体外培养方法,利用具有天然骨髓基质生理机械特性的三维仿生培养微环境,使得体外培养出的造血干细胞在移植到受体后能够在体内分化产生各种类型的血液细胞,并且相对于在2d环境中培养出的造血干细胞表现出更高的干细胞活性,进而促进血液重建和干细胞分化,修复造血功能损伤。
6.根据本发明的实施方案,海绵状结构的平均孔直径为50μm至70μm或90μm至110μm。
7.根据本发明的实施方案,交联材料的交联度为10%-50%。
8.根据本发明的实施方案,交联材料的粘弹性为50pa至200pa。
9.根据本发明的实施方案,3d培养基质的厚度为0.5mm至2mm,优选为0.5mm。
10.根据本发明的实施方案,交联材料是生物可降解的。
11.根据本发明的实施方案,交联材料是可注射医用材料。
12.根据本发明的实施方案,交联材料选自可交联的人工合成生物材料和/或可交联的天然生物材料。
13.根据本发明的实施方案,可交联的人工合成生物材料为选自聚酸酐、聚酸酯、聚丙烯酰胺、聚氨基酸、聚酰胺、聚丙烯、聚苯乙烯、聚乙二醇衍生物、聚乙二醇、聚乳酸、聚羟基酸、聚乳酸醇酸共聚物、聚酯、聚吡咯、聚甲基丙烯酸酯、聚二甲基硅氧烷、聚缩醛、聚氰基丙烯酸酯、聚氨基甲酸酯、聚乙烯、聚碳酸酯或聚氧化乙烯中的一种或多种。
14.根据本发明的实施方案,可交联的天然生物材料为选自明胶、明胶衍生物、藻酸盐、藻酸盐衍生物、胶原、蛋白多糖、糖蛋白、琼脂、基质胶、透明质酸、层连接蛋白和纤维连接蛋白中的一种或多种。
15.根据本发明的实施方案,交联剂为选自戊二醛、硫酸钙、氯化钙、硫酸锌、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐中的一种或多种。
16.根据本发明的实施方案,该体外培养造血干细胞的方法还包括:使造血干细胞与间充质干细胞共同生长于3d培养基质。
17.根据本发明的实施方案,造血干细胞与间充质干细胞的细胞数量比率为1:0.5至1:10。
18.另一方面,本发明的实施方案提供了一种组合物。根据本发明的实施方案,该组合物包括:根据如上所述的方法培养的造血干细胞;和如上任一实施方案中定义的3d培养基质。在一些实施方案中,该组合物还包含间充质干细胞,优选地所述造血干细胞与所述间充质干细胞的细胞数量比率为1:0.5-10。
19.根据本发明的实施方案,该组合物还包括药学上可接受的辅料。
20.另一方面,本发明的实施方案提供了根据如上所述的组合物在制备用于治疗血液疾病的药物中的用途。
21.根据本发明的实施方案,组合物以尾静脉注射或骨髓腔注射的方式施用至有此需要的受体。
22.根据本发明的实施方案,将组合物以1至15个单元的剂量以骨髓腔注射的方式施用。
23.根据本发明的实施方案,将组合物中的造血干细胞以1
×
10
4-5
×
104个细胞的剂量以静脉注射的方式施用。
24.根据本发明的实施方案,血液疾病包括自由辐照或高剂量化疗药物或自身免疫病引起的血液再生障碍性、血小板减少症和白血病。
附图说明
25.本发明上述的和/或附加的方面和优点从下面结合附图对实施例的描述中将变得明显和容易理解,其中:
26.图1是根据本发明实施例的用于体外培养造血干细胞的3d培养基质的代表性示意图,其中3d培养基质具有类似于天然骨髓具有不同孔径和硬度(以杨氏模量计,单位为kpa)。图1a为3d培养基质的内部孔径电镜扫描成像图;图1b为3d培养基质的平均孔径统计结果;图1c为3d培养基质的硬度测定结果;图1d为在3d培养基质中进行体外培养后的造血干细胞的电镜扫描成像图。
27.图2是根据本发明实施例的分别以3d培养和2d培养后的造血干细胞以游离细胞形式注射至小鼠尾静脉(一代移植)后受体小鼠中血液重建的对比。图2a为受体小鼠外周血中随时间推移的重建嵌合率;图2b为来自供体的造血干细胞在受体小鼠体内分化为b淋巴细胞的动态统计图;图2c为来自供体的造血干细胞在受体小鼠体内分化为t淋巴细胞的动态统计图;图2d为来自供体的造血干细胞在受体小鼠体内分化为髓系细胞的动态统计图;图2e为来自供体的造血干细胞在受体小鼠体内分化为中性粒细胞的动态统计图,其中gp为3d培养基质组,2d为二维培养组。
28.图3是根据本发明实施例的分别以3d培养和2d培养后的造血干细胞进行二代移植后的受体小鼠中血液重建的对比。具体地,将造血干细胞在仿生3d培养基质培养后,以游离
细胞形式通过尾静脉一代移植后,然后进行二代移植。图3a为二代移植的血液重建结果;图3b为来自供体的造血干细胞在受体内分化为b淋巴细胞、t淋巴细胞和髓系细胞的组分图;图3c为来自供体的造血干细胞在受体内分化为b淋巴细胞动态统计图;图3d为来自供体的造血干细胞在受体内分化为t淋巴细胞动态统计图;图3e为来自供体的造血干细胞在受体内分化为髓系细胞动态统计图,其中gp为3d培养基质组,2d为二维培养组。
29.图4是根据本发明实施例的造血干细胞与间充质干细胞分别在二维和三维条件下共培养图。图4a为形成在图形化多孔阵列基板上的3d培养基质;图4b为造血干细胞和间充质干细胞共培养的接种示意图;图4c为造血干细胞和间充质干细胞单独和共培养在二维条件下培养的明场成像图片;图4d为分别在二维和三维条件下培养的造血干细胞和间充质干细胞的活性测定结果。
30.图5是根据本发明实施例的造血干细胞与间充质干细胞分别在2d和3d培养基质中共培养后的形态学表征。图5a为造血干细胞与间充质干细胞分别在2d和3d培养基质中共培养的扫描电镜表征;图5b为造血干细胞与间充质干细胞分别在2d和3d培养基质中共培养后的激光共聚焦显微镜成像及三维重构图;图5c为造血干细胞与间充质干细胞分别在2d和3d培养基质中共培养后,通过qpcr检测造血干细胞notch1、notch2、hes1和hey1的mrna表达。
31.图6是根据本发明实施例的骨髓腔移植体外构建的造血干细胞与间充质干细胞三维微环境后的荧光示踪和流式定量表征。图6a为分别用荧光染料dir标记造血干细胞、did标记间充质干细胞体外成像的表征;图6b为骨髓腔移植细胞后动物体内成像示踪图;图6c为移植后采用流式细胞术鉴定受体外周血中来自供体的造血干细胞的比例;图6d和6e为移植后采用流式细胞术鉴定受体骨髓中来自供体的造血干细胞的比例及统计分析结果。
32.图7是根据本发明实施例的骨髓腔移植体外构建的最低剂量造血干细胞与间充质干细胞三维微环境后的体内移植重建试验。图7a示出了动物试验方案;图7b为移植后受体动物的外周血血常规分析结果;图7c为移植后采用流式细胞术分析受体动物的外周血中来自供体动物的各种分化细胞的嵌合率结果。
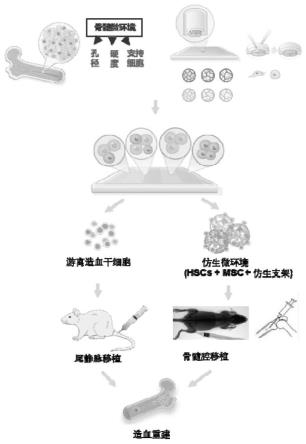
33.图8显示了根据本发明实施方案的体外培养造血干细胞分别用于静脉移植和骨髓腔移植以进行造血重建的示意图。
具体实施方式
34.下面详细描述本发明的实施例,所述实施例的示例在附图中示出。下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
35.血液再生障碍是血液疾病中的一种非恶性骨髓衰竭性疾病。以全血细胞减少(白细胞、红细胞和血小板)、造血功能减低、造血组织减少、非造血组织增多为主要疾病特点。主要发病机制是由高剂量辐照和化药等理化因素及遗传因素导致骨髓造血干细胞衰竭、造血微环境改变及免疫紊乱,进而增大感染、贫血和出血的概率,甚至死于感染及重要脏器出血。目前临床上暂无针对高剂量急性辐照或化疗引起的血液再生障碍性和血小板减少症特效疗法,只是通过一些药物疗法治疗起缓解作用。近年来,细胞疗法治疗辐照引起的血液综合征逐渐增多,造血干细胞因其强大的分化和自我更新能力,为高剂量辐照或者高剂量化疗药物引起的血液再生障碍性和血小板减少症的病人带来一种创新的治疗方案,在造血干细胞体外培养的研究上以及在临床应用上均具有重要意义。
36.造血干细胞是维持机体正常造血动态平衡的核心细胞,主要存在于骨髓中,部分存在于脐血、外周血和胎盘中。众所周知,造血干细胞通常产生各种类型的血细胞,并分化为包括t细胞、b细胞和nk细胞等在内的淋系细胞和包括红细胞、巨核细胞、肥大细胞和成髓细胞在内的髓系细胞。由于具有自我更新和分化的能力,功能性造血干细胞移植后可重建受体血液系统,因此在移植中被广泛应用,以治疗血液疾病并促进造血重建,提高患者生存率。近年来,虽然关于造血干细胞体外培养体系和技术取得了长足发展,研究者们对培养方式和细胞因子组合在造血干细胞体外扩增培养和分化中的调节作用也有了较为系统的认识,但是造血干细胞体内所处微环境极其复杂,而目前所采用的培养方式及其微环境条件尚不能完全模拟体内骨髓造血微环境在体外构建仿生体系,进而无法满足造血干细胞干性维持特性、自我更新及其定向分化的需要。首先,造血干细胞目前体外培养仍是以2d培养方式为主,培养后真正具有造血移植功能的初始造血干祖细胞的数量至今不太理想;其次,体外培养最终所获得的造血干祖细胞常常伴有不同程度的功能缺失,具体表现在归巢和植入能力的降低或丧失。
37.另外,面对临床上的挑战,高剂量辐照或化疗引起的血液再生障碍性和放射性血小板减少症一直是悬而未决的问题,用造血干细胞移植是解决这类问题的最好方法,但造血干细胞临床治疗也面临着一些挑战,首先是脐血中造血干细胞数量很低,低细胞剂量导致的植入不良限制了脐带血移植的有效性,另一个方面,是造血干细胞在病人体内定植效率以及分化出下游子代细胞(中性粒细胞和血小板)效率问题,目前普遍的造血干细胞移植都是面临着这个问题,此外是gvhd的发生,这些问题都是造成造血干细胞移植后治疗效果不理想的主要原因。
38.在体内,细胞外基质为细胞微环境提供结构支架和三维空间。目前,大多数造血干细胞体外培养的研究都依赖于2d培养,没有考虑到造血干细胞所处微环境的三维物理特性。目前,用于三维培养系统的支架,材料和方法非常多样,所形成常见的架构为多孔和聚合结构,进而在体外模拟组织或器官再生。三维多孔支架材料在生产过程中所涉及的材料种类繁多,然而许多材料在降解性、生物相容性、细胞粘附、递送方式等方面存在问题。为了突破2d细胞培养的局限性以及上述3d体系存在的不足,本发明旨在利用微组织工程方法使用天然和合成支架材料在体外模拟造血干细胞在体内的自然状态构建出可用于造血干细胞和骨髓间充质细胞共培养的3d仿生微环境,最终在体外构建出造血干细胞3d微环境,并通过骨髓腔递送的方式治疗高剂量辐照引起的血液再生障碍性和血小板减少症。
39.基于以上,本技术的发明人在研究过程中发现:由急性高剂量辐照引起的严重血液疾病主要包括血液再生障碍和放射性血小板减少症。目前,临床上尚无特效治疗方法,只能通过输血、抗生素、激素和免疫调节药物来治疗,只是起到缓解作用并且容易复发、复发后再次缓解率低以及晚期有演化为克隆性疾病的风险,如骨髓增生异常综合征、急性髓系白血病等。由辐照引起的血液再生障碍和放射性血小板减少症本质上是造血干细胞损伤、功能紊乱甚至是耗竭,从而导致造血干细胞向巨核细胞定向分化的数量急剧减少,进而引起血小板生成量的不足,同时,造血干细胞的枯竭导致向淋巴细胞和中性粒细胞的分化减少,进而造成机体免疫力下降,抵御疾病和感染的能力减弱。目前临床上所用的产品,都是补充造血干细胞下游细胞的不足(血小板)和调节下游免疫细胞的状态起到缓解作用,并没有从本质上解决核心问题,而真正的从源头解决由高剂量辐照引起的血液再生障碍和放射
性血小板减少症就是移植造血干细胞,提供造血的种子,从而达到彻底治愈血液再生障碍和放射性血小板减少症。
40.为此,一方面,本发明的实施方案提供了一种体外培养造血干细胞的方法。根据本发明的实施方案,该方法包括:提供3d培养基质;使造血干细胞生长于3d培养基质,其中3d培养基质以成阵列排布的多个单元提供,每个单元优选为0.5mm至5mm直径的圆柱体并且由具有海绵状结构的交联材料形成,海绵状结构的平均孔直径为10μm至110μm、孔壁硬度为0.1kpa至24.7kpa。
41.根据本发明实施例的体外培养方法,利用具有天然骨髓基质生理机械特性的三维仿生培养微环境,使得体外培养出的造血干细胞在移植到受体后能够在体内分化产生各种类型的血液细胞,并且相对于在2d环境中培养出的造血干细胞表现出更高的干细胞活性,进而促进血液重建和干细胞分化,修复造血功能损伤。
42.根据本发明的实施方案,海绵状结构的平均孔直径为10μm至110μm,具体为50μm至70μm或90μm至110μm。基于天然骨髓结构(平均孔径为20μm至80μm),海绵状结构的平均孔径与骨髓基质的孔径相似,更加有利于在体外仿生培养以实现仿生微环境的构建。
43.根据本发明的实施方案,海绵状结构的孔壁硬度为0.1kpa至24.7kpa。基于天然骨髓结构(杨氏模量为0.3-24.7kpa),海绵状结构的孔壁硬度与骨髓基质的硬度相似,更加有利于在体外仿生培养以实现仿生微环境的构建。
44.根据本发明的实施方案,交联材料的交联度为10%-50%。根据本发明的实施方案,交联材料的粘弹性为50pa至200pa。由此,作为3d培养基质的低交联度粘弹性的交联材料可以更好地模拟骨髓生长环境,促进造血干细胞的自我更新和分化,进而有利于造血重建和血小板恢复。
45.根据本发明的实施方案,3d培养基质的厚度为0.5mm至2mm,优选为0.5mm。从而,为确保向生长在3d培养基质的造血干细胞提供充足的营养物质。
46.根据本发明的实施方案,交联材料是生物可降解的。由此,有利于方便的将体外培养后的造血干细胞从3d培养基质分离出来进行后续静脉注射移植。本领域技术人员可以利用本领域常规的降解方法,包括但不限于蛋白酶、胰酶、tryple或者胶原酶,或被细胞自身分泌的降解酶所降解。在一个具体实施例中,3d培养基质可以大于3天的时间段被细胞自身所降解。
47.根据本发明的实施方案,交联材料是可注射医用材料。由此,可以不经去除基质而直接将包含造血干细胞的部分或全部3d培养基质直接用于后续骨髓腔递送,而不会引起对受体的不利副作用。在一个具体实施例中,包含造血干细胞的部分或全部3d培养基质可以利用》23号针头的注射器进行骨髓腔注射。
48.根据本发明的实施方案,交联材料选自可交联的人工合成生物材料和/或可交联的天然生物材料。
49.根据本发明的实施方案,可交联的人工合成生物材料为选自聚酸酐、聚酸酯、聚丙烯酰胺、聚氨基酸、聚酰胺、聚丙烯、聚苯乙烯、聚乙二醇衍生物、聚乙二醇、聚乳酸、聚羟基酸、聚乳酸醇酸共聚物、聚酯、聚吡咯、聚甲基丙烯酸酯、聚二甲基硅氧烷、聚缩醛、聚氰基丙烯酸酯、聚氨基甲酸酯、聚乙烯、聚碳酸酯或聚氧化乙烯中的一种或多种。
50.根据本发明的实施方案,可交联的天然生物材料为选自明胶、明胶衍生物、藻酸
盐、藻酸盐衍生物、胶原、蛋白多糖、糖蛋白、琼脂、基质胶、透明质酸、层连接蛋白和纤维连接蛋白中的一种或多种。
51.根据本发明的实施方案,交联剂为选自戊二醛、硫酸钙、氯化钙、硫酸锌、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐中的一种或多种。
52.根据本发明的实施方案,该体外培养造血干细胞的方法还包括:使造血干细胞与间充质干细胞共同生长于3d培养基质。体内骨髓天然生理微环境不仅包括孔径和硬度的机械结构因素,基质细胞是其中的重要组成部分,基质细胞通过分泌细胞因子、细胞外基质以及细胞与细胞之间的直接接触来调节造血干细胞的增殖与分化,维持造血干细胞的干性。骨髓间充质干细胞是骨髓微环境中的重要组成成分,作为一种基质前细胞,通过其再生、多向分化和支持能力以及免疫调节特性对造血组织和功能有多方面的影响,在造血干细胞的维持及形成适合造血的微环境中也起着至关重要的作用。骨髓间充质干细胞具有分泌造血因子的特点,研究表明造血干细胞移植联合骨髓间充质干细胞输注可促进造血干细胞的归宿与植入,促进造血重建。
53.根据本发明的实施方案,将造血干细胞与间充质干细胞在3d培养基质中共同培养,其中间充质干细胞作为造血干细胞的支持细胞。该共培养体系在体外重现了体内造血干细胞龛的功能,为造血干细胞提供了一个特殊的微环境,通过细胞之间的相互作用影响和调节干细胞数量和功能。
54.在一些具体实例中,通过以下步骤获得造血干细胞:利用磁珠获得含有造血干细胞的造血干祖细胞群;将含有造血干细胞的造血干祖细胞群进行流式分选,以便获得造血干细胞。
55.在一些实施例中,造血干细胞可以是原代分离获得的,也可以是由诱导多能干细胞分化获得的。在一些实施例中,原代分离的造血干细胞为脐带血造血干细胞、脐带造血干细胞、外周血造血干细胞中的至少一种。
56.在另一些具体实例中,通过以下步骤获得间充质干细胞:将不同来源的组织消化裂解以获得细胞悬液;将细胞悬液经过贴壁诱导分化成熟,以获得间充质干细胞。在另一些具体实例中,进一步将获得的间充质干细胞进行特异抗体标记,以进行流式鉴定和确认。
57.在一些实施例中,间充质干细胞可以是原代诱导分化获得的。在一些实施例中,间充质干细胞为选自脂肪间充质干细胞、骨髓间充质干细胞、牙髓间充质干细胞、脐带间充质干细胞、胎盘间充质干细胞、脐带血间充质干细胞、羊水间充质干细胞、宫血间充质干细胞中的至少一种。
58.根据本发明的实施方案,共培养的造血干细胞与间充质干细胞的细胞数量比率为1:0.5至1:10。由此,通过调整造血干细胞与间充质干细胞的细胞数量之间的比率可以更好地使体外培养获得的造血干细胞具有更高的干细胞活性和分化能力。
59.在一些具体实例中,将造血干细胞以2
×
105至1
×
106个/ml的密度接种于3d培养基质。由此,造血干细胞可以以合适的密度在3d培养基质中得到良好且充分的生长。
60.另一方面,本发明的实施方案提供了一种组合物。根据本发明的实施方案,该组合物包括:根据如上所述的方法培养的造血干细胞;和如上任一实施方案中定义的3d培养基质。
61.在临床应用中,将在3d培养基质中生长的造血干细胞例如通过降解交联材料的方
式分离出来,然后将游离的造血干细胞移植到受体后能够在体内分化产生各种类型的血液细胞,并且相对于在2d环境中培养出的造血干细胞表现出更高的干细胞活性,进而促进血液重建和干细胞分化,因此可以有效地治疗由辐照或高剂量化疗药物或自身免疫病引起的血液再生障碍性、血小板减少症以及白血病等其它血液疾病。
62.在一些实施方案中,组合物还包含间充质干细胞。由此以包含造血干细胞和间充质干细胞的3d培养基质作为仿生微环境直接整体递送至骨髓腔,从而更加有效地促进造血干细胞在骨髓腔内定植,加快血液重建。利用该造血干细胞仿生微环境进行治疗,促进血液重建,并提升血小板水平,因此可用于治疗高剂量辐照或者高剂量化疗药物引起的血液再生障碍性和血小板减少症,并且安全有效。
63.根据本发明的实施方案,该组合物还包括药学上可接受的辅料。具体地,药学上可接受的辅料可以包括生理学上相容的任何和所有溶剂、抗细菌剂、抗真菌剂、分散介质、包衣、等渗剂等。具体实例可以是生理盐水、磷酸盐缓冲盐水、葡萄糖、海藻酸、羧甲基纤维素、甘油、乙醇等以及它们的组合物中的一种或多种。在一些实施方案中,药学上可接受的辅料包括等渗剂,例如糖类、甘露醇、山梨醇或氯化钠等。
64.另一方面,本发明的实施方案提供了根据如上所述的组合物在制备用于治疗血液疾病的药物中的用途。
65.在本发明的至少一些实施方式中,该造血干细胞仿生三维微环境在体内能够分化出血液系统中所有的血细胞类型。利用造血干细胞三维仿生微环境,能够用于治疗高剂量辐照或者高剂量化疗药物引起的血液再生障碍性和血小板减少症,安全有效,作用时间长。相较于二维共培养的游离细胞,造血干细胞三维仿生微环境整体递送至体内能够促进造血干细胞在骨髓内定植,促进血液快速重建。
66.根据本发明的实施方案,组合物以尾静脉注射或骨髓腔注射的方式施用至有此需要的受体。
67.根据本发明的实施方案,将组合物以1至15个单元的剂量以骨髓腔注射的方式施用。
68.根据本发明的实施方案,将组合物中的造血干细胞以1
×
10
4-5
×
104个细胞的剂量以静脉注射的方式施用。
69.根据本发明的实施方案,最低拯救致死剂量辐照小鼠的造血干细胞的剂量为1
×
10
3-5
×
104个细胞。
70.根据本发明的实施方案,血液疾病包括由辐照或高剂量化疗药物或自身免疫病引起的血液再生障碍性、血小板减少症和白血病。
71.因此根据如上所述,用于治疗血液疾病的药物包括游离的造血干细胞;和生长于3d培养基质的造血干细胞和间充质干细胞的仿生微环境。从而为患有严重血液疾病的病人带来一种创新的治疗方案,在造血干细胞体外培养的研究上以及在临床应用上均具有重要意义。
72.本发明还提供了一种治疗高剂量辐照或者高剂量化疗药物引起的血液再生障碍性和血小板减少症的方法,所述方法包括向由此需要的受试者施用治疗有效量的游离造血干细胞或包含造血干细胞的本文所述的组合物。在一些实施方案中,以静脉注射或骨髓腔注射的方式施用治疗有效量的游离造血干细胞或包含造血干细胞的本文所述的组合物。通
过该方法能够促进高剂量放疗或化疗患者体内血液重建,从而能够用于治疗高剂量辐照或者高剂量化疗药物引起的血液再生障碍性、血小板减少症以及白血病等其它血液疾病。
73.下面对本文中的一些术语进行解释和说明,本领域技术人员应该理解的是,这些解释和说明仅用来帮助理解,而不能看做是对本技术保护范围的限制。
74.本文中“治疗”是指干预或者改变特定健康状态的过程,其作广义上理解,即不单单包括治愈,消除疾病,还可以指缓解,减轻疾病症状,降低疾病所带来的痛苦。
75.本文中,术语“仿生微环境”是指基于体内天然生理环境在体外人工模拟构建与体内具有相似的生理结构和组成,从而使造血干细胞在体外培养更加接近体内真实情况,重现体内的生理环境。
76.需要说明的是,本领域技术人员可以理解,在利用根据本发明的体外培养方法对造血干细胞进行3d培养过程中,可以向3d培养基质中加入本领域常规使用的培养基(例如,包括但不限于mem、dmem、rpmi-1640、dmem/f12等)和其它需要的物质(例如,包括但不限于fbs、青霉素、链霉素、生长刺激因子等)。
77.下面将结合实施例对本发明的方案进行解释。本领域技术人员将会理解,下面的实施例仅用于说明本发明,而不应视为限定本发明的范围。实施例中未注明具体技术或条件的,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
78.实施例1提供3d培养基质
79.1.1图形化多孔阵列基板
80.首先利用激光雕刻做出图形化多孔阵列基板。多孔阵列基板的材料为疏水材料,具体可理解为聚甲基丙烯酸甲酯,聚甲基丙烯酸甲酯疏水,使得可交联材料能够形成具有以成阵列排布的多个单元(例如图4a所述的圆柱形)的3d培养基质,进而造血干细胞和细胞培养基可轻松被种植并生长于本发明实施方案的3d培养基质中。图形化多孔阵列基板可采用本领域成熟的微加工技术获得,如激光切割和雕刻、3d打印等在聚甲基丙烯酸甲酯板上加工而成。结合计算机辅助设计并绘制如coredraw等画图软件,可定制化设计不同规格的图形化多孔阵列基板。如利用激光切割和雕刻中激光雕刻机的主要加工参数为:切割能量100%,切割次数2,切割线速度10%。
81.具体地,根据商品化的不同规格的细胞培养孔板的孔径尺寸,可相应的设计对应规格的图形化多孔阵列基板,可以在每个培养室(例如细胞培养孔板的每个孔)中根据需要设计数量不同和直径不同以成阵列排布的多个呈圆柱体的单元。每个培养室的直径为5-50毫米;培养室之间的孔边间距不小于0.5mm。
82.1.2 3d培养基质的体外构建
83.将充满反应溶液(即可交联的人工合成生物材料和/或可交联的天然生物材料和交联剂)的模具迅速置于低温环境中静置,进行成胶反应,温度为-40℃至-5℃。20小时后取出置于室温时冰晶融化,将材料从模具中取出并进行适当的清洗,清洗后的材料在-60℃真空环境中冷冻干燥2小时得到3d培养基质。
84.本实施例中的3d培养基质是基于骨髓天然孔径和硬度体外模拟构建,如图1a所示,为造血干细胞生长提供三维空间结构,以利于在体外培养中构建接近造血干细胞体内生存的三维仿生微环境(图1d),为造血干细胞在体外的扩增培养创造更适宜的环境。
85.每个单元为0.5mm至5mm直径的圆柱体并且由具有海绵状结构的交联材料形成,所述海绵状结构的平均孔直径为10μm至110μm,其中部分为50μm至70μm,另一部分为90μm至110μm(参见图1b)。所述海绵状结构的孔壁硬度为0.1kpa至24.7kpa(参见图1c,平均值为11.2kpa),其中对照组为30kpa至350kpa的硬度分布,实验组为本发明3d培养基质的硬度分布。由结果可知,本发明实施方案中用于培养造血干细胞的3d培养基质的硬度(约11.2kpa)与动物体内天然骨髓基质的硬度接近。因此,利用本发明培养的造血干细胞不仅可以在降解3d培养基质后直接静脉注射,也可以直接以生长于3d培养基质中作为整体仿生微环境不经基质降解而直接进行骨髓腔移植。
86.实施例2提取原代造血干细胞和间充质干细胞
87.2.1造血干细胞
88.小鼠处死后,从分离出的胫骨、股骨和髂骨提取骨髓细胞。用c-kit抗体染色形成c-kit抗体-造血干细胞复合物,然后进行磁珠孵育以使该复合物与磁珠相连,过滤纯化后获得c-kit+细胞群。为了进一步纯化造血干细胞,采用lin mix混合抗体对富集到的c-kit+细胞群进行复染。去除lin+细胞后,采用sca-1抗体对lin-c-kit+细胞再次进行复染。通过流式细胞术分选出lin-c-kit+sca-1+细胞,即基本上纯的造血干细胞。
89.2.2骨髓来源的间充质干细胞
90.小鼠处死后,从胫骨、股骨和盆骨提取骨髓细胞。经过常规培养后,收集贴壁细胞,并利用流式细胞术进行鉴定,从而获得骨髓来源的间充质干细胞。
91.实施例3利用3d培养基质对造血干细胞进行体外单独培养及其一代和二代静脉移植
92.将实施例2.1获得的造血干细胞lin-c-kit+sca-1+细胞按照1
×
106个/ml的密度接种于实施例1.2得到的3d培养基质和普通细胞培养板分别进行三维和二维培养。培养一周后,使3d培养基质降解并收集培养后的游离造血干细胞,同时另外收集经2维平板培养的游离造血干细胞。将经过培养的3
×
104个来自c57bl/6-cd45.2+小鼠骨髓lin-c-kit+sca-1+的造血干细胞与3
×
105个来自c57bl/6-cd45.1+小鼠全骨髓竞争性细胞一起通过尾静脉注射移植到经过致死剂量照射(9.5gy)的c57bl/6-cd45.1+/cd45.2+(f1)一代受体小鼠体内。移植后如图2所示时间点分别采集经移植受体小鼠尾静脉血,采用抗cd45.1抗体(特异性识别来自受体的细胞)、抗cd45.2抗体(特异性识别来自供体的细胞)、抗cd3抗体(特异性识别分化出的t细胞)、抗cd11b抗体(特异性识别分化出的髓系细胞)、抗b220抗体(特异性识别分化出的b细胞)、抗gr-1抗体(特异性识别分化出的中性粒细胞)染色30分钟,同时进行dapi染色以指示细胞活性,使用lsr fortessa(bd)流式细胞分析仪分析细胞表型,并统计受体小鼠外周血中来自供体细胞的嵌合率及谱系分化情况。嵌合率表示受体小鼠外周血和骨髓中成活的来自供体细胞的比例。谱系分化表示来自供体细胞的各种分化出的不同细胞的比例。
93.3d培养组的造血干细胞移植后嵌合率持续高于2d培养组且稳定上升,而2d培养组嵌合率整体有轻微下降趋势(如图2a);3d培养组和2d培养组的受体小鼠外周血中由供体细胞分化出各种谱系细胞较为均衡。3d培养组中由供体细胞分化出的b、t、髓系和中性粒细胞各种细胞的比例均高于2d培养组(如图2b-2d),且其中由供体细胞分化出的b系细胞的比例较2d培养组有显著差异(p《0.05,如图2b)。
94.持续跟踪至移植后20周,安乐死受体小鼠,取其后腿胫骨、股骨、髂骨共6根腿骨,每只鼠取出一根股骨提取骨髓细胞用于分析骨髓内供体细胞比例,用抗cd45.1、抗cd45.2抗体染色30分钟,同时进行dapi染色以指示细胞活性,使用lsr fortessa(bd)流式细胞分析仪分析细胞表型,并统计受体小鼠骨髓中来自供体细胞的嵌合率(结果与图2所示的外周血中的嵌合率相似,未示出)。余下腿骨一并提取全骨髓细胞后按照每只3
×
105个细胞的剂量尾静脉注射移植到经过致死剂量照射(9.5gy)的c57bl/6-cd45.1+/cd45.2+(f1)的二代受体小鼠体内,然后按照图3所示的时间点跟踪分析二代受体小鼠外周血中来自供体细胞的嵌合率。在进行二代移植后,3d培养组的受体小鼠外周血中来自供体细胞的嵌合率在移植后16周持续稳定在90%以上,而2d培养组从移植后2周至4周嵌合率已有明显下降,并且移植重建率一直较低(如图3a),两组间的差异明显高于一代移植。并且在分化造血方面,3d培养组b、t、髓系各系中供体细胞占比均高于2d培养组(如图3b-3e)。以上结果证明了3d培养较2d培养更好地维持了造血干细胞自我更新并进行长期造血重建的能力,而2d培养的造血干细胞至二代移植时已基本丧失了持续造血能力。由此可知,经2d培养获得的造血干细胞大部分只能发挥多能分化功能并短期进行造血重建,而3d培养获得分化细胞中的部分造血干细胞在二代移植后仍然维持了干性,即一代移植后的造血干细胞归巢到骨髓并保持相对静息的状态。在一代移植时主要由活跃的具有短期造血功能的造血干细胞或造血干祖细胞主要发挥造血功能;而在二代移植的二次刺激下,2d培养获得的造血干细胞已耗竭其分化造血的潜能并无法自我更新,而3d培养得到的造血干细胞则能够自我更新并仍具有多向分化潜能,得以长期维持造血。
95.实施例4利用3d培养基质对造血干细胞和间充质干细胞进行体外共同培养及其骨髓腔移植
96.4.1造血干细胞和间充质干细胞体外共同培养
97.将实施例2获得的造血干细胞和间充质干细胞种植入实施例1.2提供的3d培养基质中,以观察造血干细胞是否能在3d培养基质中生长。在种植造血干细胞前首先对3d培养基质进行灭菌处理。本实施例中使用的灭菌方法是紫外线照射灭菌法,即通过对3d培养基质进行长时间(不短于2小时)的紫外线照射来使3d培养基质符合细胞无菌培养要求。为了模拟体内造血干细胞的微环境,如图4b所示,我们采用造血干细胞和间充质干细胞共培养系统模拟体内的微环境,如图4c所示通过2d培养可以看到造血干细胞在有间充质干细胞的地方优先生长。
98.随后将准备好的造血干细胞和间充质干细胞悬液滴加至无菌3d培养基质,由于3d培养基质具有海绵状的内部多孔结构,细胞悬液由于其张力作用会自动进入3d培养基质的孔径内部。因此,使细胞悬液体积与3d培养基质体积相似,以允许细胞悬液充分浸润至3d培养基质内部而不聚集在3d培养基质外部。在细胞培养环境(例如常规细胞培养箱)中静置一段时间以允许细胞贴附于3d培养基质的孔径内壁。随后,向培养室中补充足够的常规培养基以允许细胞的充分生长。
99.在3d培养基质中,通过calcein-am/pi染色观察细胞的生长情况。如图4d所示,从图片中我们可以看出,在2d培养条件和3d培养条件下,造血干细胞与间充质干细胞共培养几乎没有死细胞。在3d培养条件中,造血干细胞与间充质干细胞共培养生长稳定。
100.4.2造血干细胞和间充质干细胞的体外表征
101.在骨髓腔注射前,对体外构建的微环境进行表征,以确定细胞在体外的生长状态。将来自8-12周龄的c57bl/6-cd45.1+小鼠骨髓lin-c-kit+sca-1+造血干细胞和间充质干细胞在3d培养基质培养的或2d培养后,通过扫描式电子显微镜(sem)检测造血干细胞的生长状况。如图5a所示,造血干细胞在2d培养和3d培养中与间充质干细胞有比较密切的接触,并通过calcein-am/pi染色和三维重构确认了经与间充质干细胞共同培养于3d培养基质的造血干细胞活性良好(如图5b)。另外,利用trizol法提取细胞或组织总rna,按照试剂盒说明进行反转录,sybr green进行实时定量pcr反应检测notch1、notch2、hes1和hey1的mrna表达。由于notch受体分布在造血干细胞表面,通过分析notch基因及下游靶基因的mrna表达,可以确定参与造血干细胞干性维持和自我更新的调控机制。如图5c所示,3d共培养增加了造血干细胞上notch1和hes1的基因表达量。
102.4.3仿生微环境的体内示踪
103.4.3.1动物体内成像示踪的定性表征
104.本实施例骨髓腔注射为不经手术直接原位注射移植,为了验证移植的细胞是否进入骨髓腔,首先在进行2d或3d培养前分别用荧光染料dir标记造血干细胞并用荧光染料did标记间充质干细胞,以便利用荧光成像表征标记细胞(图6a)。将荧光标记的两种细胞接种到3d培养基质或2d培养环境中生长1天,然后进行骨髓腔移植。采用动物活体成像示踪系统对细胞进行成像表征,可以检测出荧光标记的细胞在动物体内的位置和分布。如图6b所示,可以看到3d培养组的造血干细胞和间充质干细胞在注射3天后依然定植在骨髓腔。
105.4.3.2流式细胞术定量表征
106.移植的造血干细胞和间充质干细胞在受体小鼠体内的存活数量和分布对于其发挥治疗作用非常重要。因此利用流式细胞分析术对受体小鼠体内来自供体的细胞进行定量。如图6c所示,移植3天后,外周血中几乎检测不到来自供体的细胞(造血干细胞和间充质干细胞),而在骨髓的位置,3d培养组的驻留在骨髓位置的来自供者的细胞数量显著高于其它两个组,表明3d培养基质可以促进造血干细胞和间充质干细胞在骨髓内定植(图6d和6e)。
107.实施例5骨髓腔递送仿生微环境缓解致死剂量辐照小鼠的死亡率并促进造血重建
108.5.1将仿生微环境移植至经过致死量辐照的小鼠骨髓腔,统计死亡率并检测血常规参数
109.本实施例提供的骨髓腔移植体外构建的最低剂量造血干细胞与间充质干细胞三维微环境后的体内移植重建试验。将1-15个单元的来自8-12周龄的c57bl/6-cd45.1+小鼠骨髓lin-c-kit+sca-1+造血干细胞(50-200个造血干细胞/单元,即共计约1500个造血干细胞)和间充质干细胞(800-1200个间充质干细胞/单元,即共计约10000个)在3d培养基质培养的或2d培养的1天后,然后将其骨髓腔原位移植到经过致死剂量照射(9gy)的8周龄c57bl/6-cd45.2+小鼠体内。移植4周后采集移植受体小鼠尾静脉血进行血常规分析,如图7b所示,3d共培养组外周血的白细胞、中性粒细胞、淋巴细胞和血小板均髓样细胞均高于2d共培养组。
110.5.2、流式细胞术检测血液重建
111.受体cd45.2+小鼠在接受骨髓腔移植后4周取外周血进行分析,评估供体造血干细胞的短期或长期重建血液系统的活性。
112.移植4周后从尾静脉采集经移植的受体小鼠的外周血,外周血经过红细胞裂解后,采用抗cd45.1、抗cd45.2、抗cd3、抗cd11b、抗b220在4℃避光孵育30分钟。染色结束以后,加入1ml缓冲液,混匀清洗细胞,在4℃以500
×
g离心5分钟得到细胞沉淀。弃上清,加入250μl缓冲液。在分析之前,加入5μl的1μg/ml dapi进行染色,以排除死亡细胞。使用lsr fortessa(bd)流式细胞分析仪分析细胞表型,统计各组来自供体细胞的嵌合率。cd45.1+的细胞代表供体来源的细胞,cd45.2+的细胞代表宿主残留的细胞。如图7c所示,3d共培养组培养的造血干细胞移植后嵌合率高于2d共培养组(如图7c),3d共培养组和2d共培养组受体鼠外周血供体细胞的淋巴谱系分化均较为均衡,3d共培养组髓系供体细胞占比均高于2d共培养组。以上结果揭示了3d共培养组较2d共培养更好地促进造血重建的能力。
113.上述结果体现了3d培养基质并结合间充质干细胞所构建的仿生微环境相对于传统2d培养对于维持造血干细胞干性及造血重建功能具有显著优势,对于研究影响造血干细胞干性的关键因素和帮助临床应用上提高造血干细胞移植效果均具有重要意义。
114.在本发明中,术语“一个实施例”、“一些实施例”、“示例”、“具体示例”、或“一些示例”等意指结合该实施例或示例描述的具体特征、结构、材料或者特点包含于本发明的至少一个实施例或示例中。在本说明书中,对上述术语的示意性表述不必须针对的是相同的实施例或示例。而且,描述的具体特征、结构、材料或者特点可以在任一个或多个实施例或示例中以合适的方式结合。此外,在不相互矛盾的情况下,本领域的技术人员可以将本说明书中描述的不同实施例或示例以及不同实施例或示例的特征进行结合和组合。
115.尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1