一种CAR细胞疗法用核酸构建体及其慢病毒载体、细胞制剂和应用的制作方法
一种car细胞疗法用核酸构建体及其慢病毒载体、细胞制剂和应用
【技术领域】
1.本发明涉及细胞免疫治疗的技术领域,特别是一种car细胞疗法用核酸构建体及其慢病毒载体、细胞制剂和应用的技术领域。
背景技术:
2.恶性肿瘤是危害人类健康的重大疾病之一。传统的肿瘤治疗方式,如手术、放疗和化疗,是近几十年来用于肿瘤治疗的主要策略。但是,病人容易对药物和放疗治疗产生抗性,致使高频率的肿瘤复发。近年来,肿瘤细胞治疗因其靶向性、效果显著和几无副作用等优点得到了极大关注,逐步成为肿瘤综合治疗中的一个重要手段,被业界称为肿瘤的绿色疗法,也是当前肿瘤治疗基础研究和临床应用的热点与发展方向。
3.肿瘤的嵌合抗原受体(chimeric antigen receptor,car)疗法,指一种用嵌合抗原受体修饰的免疫细胞治疗肿瘤的新型精准靶向疗法,近几年通过优化改良在临床肿瘤治疗上取得了很好的效果,具有精准、快速和高效的特点,有可能治愈癌症,非常有前景。在通常情况下,肿瘤的嵌合抗原受体细胞疗法通过基因工程技术,将识别肿瘤的定位导航装置嵌合抗原受体转导入免疫细胞(如t细胞和nk细胞),对应地重组为car-t细胞和car-nk细胞。car-t细胞和car-nk细胞能够利用其转导的car结构,专门识别体内肿瘤细胞后获得激活,通过免疫作用释放大量的多种效应因子,从而高效地杀灭肿瘤细胞,达到治疗恶性肿瘤的目的。
4.嵌合抗原受体通常由肿瘤相关抗原结合区、胞外铰链区、跨膜结构域以及包含或不包含共刺激结构域的细胞内信号传导结构域序贯串联组成。随着科学技术研究的持续推进,cars至今已经发展到了第四代。其中,第一代cars包含胞外单链可变片段scfv、跨膜区和单个胞内激活信号cd3ζ或fcεriγ。第一代car-t细胞只能引起短暂的t细胞增殖和较少的细胞因子分泌,其体内抗肿瘤活性受到极大限制,并且t细胞增殖减少最终会导致t细胞的凋亡。第二代cars在第一代cars的基础上引入了一个共刺激分子,提高了肿瘤杀伤效力。在第三代cars中,则搭载了多个共刺激因子,如cd28、cd134(ox40)和cd137(4-1bb)等。共刺激分子可以激活t细胞内的jnk、erk和nf-κb等信号通路,使t细胞在抗肿瘤活性、增殖活性、存活周期和细胞因子(如il-2、tnf-α和ifn-γ)的分泌延长等方面均产生显著提高。第四代cars在第三代cars的基础上增加了可选择性的标记及编码cars扩增和自杀的启动子。
5.研究表明,car设计和内在特性也会影响car修饰免疫细胞的扩增和持久性。目前,包含cd3-ζ信号结构域和共刺激结构域(通常为cd28或4-1bb)的第二代cars仍然是临床使用中最常见的核酸构建体。此外,研究发现,采用cd28作为共刺激分子时,t细胞虽然杀伤作用强但持续时间短,而采用4-1bb作为共刺激分子时,t细胞虽然持续时间长但杀伤能力有限。
6.因此,现有的嵌合抗原受体免疫细胞疗法在用于肿瘤治疗上仍有许多不尽理想之处。例如car-t细胞治疗过程中会出现多种不良反应,包括细胞因子释放综合征等。而且由
于这些毒副反应的临床表现往往错综复杂,变化多端,进展迅速;而且每种car修饰细胞制品因为生产工艺或car结构的不同有着独特不同效应特征,有待进一步充分的认识及精确的评估。
技术实现要素:
7.本发明的目的就是解决现有技术中的问题,提出一种含有特定胞内信号结构组合的car细胞疗法用核酸构建体及其慢病毒载体、细胞制剂和应用,所制备出的细胞制剂相较于其他car结构构建的免疫细胞制剂具有较高的活性,尤其该类car结构修饰的nk细胞,对表达目标靶点肿瘤细胞(如表达her-2的乳腺癌细胞)具有极高的杀伤能力。
8.为实现上述目的,本发明通过以下技术方案来实现:
9.一种car细胞疗法用核酸构建体,包括依次串连的信号肽、抗原结合区、胞外铰链区、跨膜结构域和胞内信号域;
10.所述信号肽为human igkviii、human il-2或human insulin等;
11.所述抗原结合区为anti-cd19 scfv、anti-her-2 scfv、anti-ror1 scfv或anti-bcma scfv等;
12.所述胞外铰链区为来自cd8、cd28、ctla4、pd-1、nkg2d、igg1、含ch2ch3区域的igg4或不含ch2ch3区域的igg4的铰链区序列等;
13.所述跨膜结构域为来自t细胞受体的α、β或ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、dap10、dap12、nkg2a、nkg2d、pd-1或ctla的跨膜结构域序列等;
14.所述胞内信号域由dap10 cd、cd137 cd和cd3ζsd所组成。
15.作为优选,所述信号肽为cd8 sp,所述cd8 sp的核酸序列和多肽序列分别如序列表中的seq id no.1和seq id no.2所示。
16.作为优选,所述抗原结合区为her-2scfv,所述her-2scfv的核酸序列和多肽序列分别如序列表中的seq id no.3和seq id no.4所示。
17.作为优选,所述胞外铰链区为cd8 h、cd28 h或igg4 h-ch2-ch3,所述cd8 h的核酸序列和多肽序列分别如序列表中的seq id no.5和seq id no.6所示,所述cd28 h的核酸序列和多肽序列分别如序列表中的seq id no.7和seq id no.8所示,所述igg4 h-ch2-ch3的核酸序列和多肽序列分别如序列表中的seq id no.9和seq id no.10所示。
18.作为优选,所述跨膜结构域为cd8 tmd、cd28 tmd或nkg2d tmd,所述cd8 tmd的核酸序列和多肽序列分别如序列表中的seq id no.11和seq id no.12所示,所述cd28 tmd的核酸序列和多肽序列分别如序列表中的seq id no.13和seq id no.14所示,所述nkg2d tmd的核酸序列和多肽序列分别如序列表中的seq id no.15和seq id no.16所示。
19.作为优选,所述dap10 cd的核酸序列和多肽序列分别如序列表中的seq id no.17和seq id no.18所示,所述cd137 cd的核酸序列和多肽序列分别如序列表中的seq id no.19和seq id no.20所示,所述cd3ζsd的核酸序列和多肽序列分别如序列表中的seq id no.27和seq id no.28所示。
20.作为优选,所述胞内信号域的顺序为dap10 cd-cd137 cd-cd3ζsd,所述dap10 cd-cd137 cd-cd3ζsd的核酸序列和多肽序列分别如序列表中的seq id no.29和seq id no.30
tmd的核酸序列和多肽序列分别如序列表中的seq id no.11和seq id no.12所示,所述cd28 tmd的核酸序列和多肽序列分别如序列表中的seq id no.13和seq id no.14所示,所述nkg2d tmd的核酸序列和多肽序列分别如序列表中的seq id no.15和seq id no.16所示。
49.共刺激域(costimulatory domain,cd)可实现协同刺激分子和细胞内信号的双重活化,使t细胞持续增殖并释放细胞因子,提高t细胞的抗肿瘤能力。
50.所述胞内信号域由dap10 cd、cd137 cd和cd3ζsd所组成。更进一步的,所述dap10 cd的核酸序列和多肽序列分别如序列表中的seq id no.17和seq id no.18所示,所述cd137 cd的核酸序列和多肽序列分别如序列表中的seq id no.19和seq id no.20所示,所述cd3ζsd的核酸序列和多肽序列分别如序列表中的seq id no.27和seq id no.28所示。所述胞内信号域的顺序为dap10 cd-cd137 cd-cd3ζsd,所述dap10 cd-cd137 cd-cd3ζsd的核酸序列和多肽序列分别如序列表中的seq id no.29和seq id no.30所示。
51.其中,所涉及的核酸序列和多肽序列如下表1所示:
52.53.54.55.56.57.58.59.60.61.62.[0063][0064]
表1序列表
[0065]
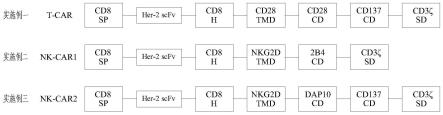
将上述多种不同的信号肽、抗原结合区、胞外铰链区、跨膜结构域和胞内信号域依次组合串连,得到如图1所示的实施例一至三的car序列组合,具体序列分别为seq id no.31、seq id no.32和seq id no.33。
[0066]
实施例四、慢病毒载体的构建:
[0067]
将实施例一至三的car序列进行合成,并将合成后的car序列克隆在puc57载体中,分别命名为puc57-t-car、puc57-nk-car1和puc57-nk-car2。提取puc57-t-car、puc57-nk-car1和puc57-nk-car2质粒,用quickcut限制性内切酶bamhi和xbai(takara公司)进行酶切。其中,酶切体系如下:
[0068]
puc57-t-car/puc57-nk-car1/puc57-nk-car21μg,bamhi和xbai各1μl,10x quickcut green buffer2μl,用水补到20μl,37℃水浴15min,酶切后的产物经琼脂糖凝胶电泳分离后,用琼脂糖凝胶dna片段回收试剂盒(购自takara公司)进行dna片段回收(结果见图2,从电泳图上可以看出泳道1~3为puc57-t-car/puc57-nk-car1/puc57-nk-car2载体经bamhi和xbai酶切后释放出t-car/nk-car1/nk-car2的条带)。再用同样的方法bamhi和xbai酶切pcdh-sffv-luc-t2a-egfp载体(图3),用琼脂糖凝胶电泳分离并回收酶切后的载体片段(结果见图2,从电泳图上可以看出泳道4为酶切后pcdh-sffv-luc-t2a-egfp载体部
分)。
[0069]
将回收后的t-car/nk-car1/nk-car2片段与酶切后的载体通过t4连接酶(购自takara公司)进行连接。其中,反应体系和条件如下:
[0070]
经bamhi和xbai酶切的t-car/nk-car1/nk-car2和pcdh-sffv-luc-t2a-egfp载体分别定量,再根据载体,目的条带1:3摩尔比加进体系,10x t4 dnaligase buffer 1μl,连接酶1μl,用水补到10μl,16℃连接4h或者过夜。连接产物转化入e.coli dh5a感受态细菌中,37℃过夜培养后,挑取单个菌落,扩大培养后,用质粒提取试剂盒(购自axygene公司)按照试剂盒操作说明提取阳性克隆的质粒,经酶切和测序检测,将正确的载体命名为pcdh-t-car/pcdh-nk-car1/pcdh-nk-car2。
[0071]
实施例五、慢病毒包装和滴度测定:
[0072]
1)质粒:
[0073]
·
pcdh-t-car/pcdh-nk-car1/pcdh-nk-car2;
[0074]
·
vsv-g:pmd2.g(addgene#12259);
[0075]
·
rev:prsv-rev(addgene#12253);
[0076]
·
gag/pol:pmdlg/prre(addgene#12251)。
[0077]
2)细胞系:
[0078]
·
低传代数293t细胞。
[0079]
3)试剂:
[0080]
·
293t培养基:高糖dmem(含丙酮酸钠和谷氨酰胺)+10%fbs+glutamax;
[0081]
·
病毒收获培养基:取50ml 293t培养基,加入0.5g bsa(sigmaa9418)和终浓度为10~15mm的hepes,0.22μm过滤;
[0082]
·
opti-mem培养基:用于混合转染复合物;
[0083]
·
转染试剂:x-tremegene hp dna(或其他低毒性高效率的试剂)。
[0084]
4)包装流程:
[0085]
·
第一天:根据下表2种植293t细胞;
[0086]
·
第二天-上午:根据下表2准备混合opti-mem培养基、质粒和转染试剂,为293t细胞换新鲜培养基,混合物在室温静置15~30min后逐滴加入293t细胞培养体系中,并轻柔摇匀;
[0087]
[0088][0089]
表2 opti-mem培养基
[0090]
·
第二天-下午:在转染6~8h后,轻柔换液为病毒收获培养基;
[0091]
·
第四天:转染后48h,取细胞培养上清于400
×
g离心4min,并用0.45μm过滤;按体积加入5
×
peg8000溶液,每20~30min混合一次,共进行3~5次,4℃放置6h或者过夜;4℃,4000g离心20min吸弃上清,静置管子1~2min,吸走残余液体;加入适量的病毒溶解液溶解病毒沉淀,将病毒液分管,放入-80℃冰箱冻存,过夜后取一支进一步测量病毒滴度;ht-1080种24孔板,5孔,每孔42000cells,待贴壁后,进行病毒侵染;配制8ug/ml polybrene mem培养基10ml;配置15ul病毒原液+135ul培养基;之后逐级稀释,取15ul+135ul,进行4次;随后每组取50ul,加到450ul培养基孔中,稀释级别分别为102、103、104和105;72h后,消化细胞进行流式分析gfp%,结果如图4所示,按以下公式进行计算,获得包装后的慢病毒滴度为:
[0092]
tu
t-car
=(8.01
×
0.01
×
42000/0.5)
×
10000=6.73e7 tu/ml
[0093]
tu
nk-car1
=(2.95
×
0.01
×
42000/0.5)
×
100000=2.45e8 tu/ml
[0094]
tu
nk-car2
=(8.94
×
0.01
×
42000/0.5)
×
10000=7.51e7 tu/ml。
[0095]
其中,滴度(tu/ml)=(f
×
c/v)
×
d;
[0096]
f=gfp阳性细胞频率(gfp阳性细胞百分比/100);
[0097]
c=转导时的每孔细胞数(42,000个细胞);
[0098]
v=转导体积(ml)(0.5ml);
[0099]
d=慢病毒稀释因子。
[0100]
实施例六、car-nk细胞制备:
[0101]
1)nk细胞纯化和扩增:
[0102]
采取20ml健康志愿者的新鲜抗凝血,用淋巴分离液(购自ge公司)分离外周血单核细胞(pbmc);分离的细胞计数后,按2.5x106/孔密度在包被过cd16的6孔板中刺激培养72h,之后再换普通的6孔板继续培养扩增72h;用nk磁珠分选纯化细胞(购自miltenyi biotec公司),加含10%fbs+200iu/ml il-2的1640(购自thermo scientific)培养基继续进行诱导培养,得到纯化的nk细胞,并用流式检测cd3和cd56表型比例。检测结果如图5,其中,横轴表示cd3,纵轴表示cd56,cd3阴性且cd56阳性代表的细胞群为nk细胞,表明本方法制备的nk细胞比例大于90%;
[0103]
2)靶向her-2 car-nk细胞制备:
[0104]
得到纯化后的nk细胞,按每孔约2.5x10
6 nk细胞接种到24孔板(bd biosciences)中,并在终浓度protamine sulfate 8ug/ml(sigma-aldrich)及bx7951.5um(sigma-aldrich)的存在下与适量的病毒上清液混合,最终体积不超过1ml;补充细胞因子,并将板在室温下以1000
·
g离心1h;离心后,不除去病毒上清液,将板在37℃,5%co2下孵育4~6h;
孵育结束后,在室温下以1000
·
g的速度进行第二次离心1h,然后从孔和1ml新鲜的nk细胞生长培养基;将细胞在每天添加细胞因子的培养基中维持2天后,从而获得表达her-2 car-nk细胞(以下简称为car-nk),并进行进一步转染效率鉴定;将转染后nk细胞用重组human her-2-fc蛋白孵育15min,4℃,洗涤后用pe标记的鼠抗人anti-igg1抗体孵育15min,4℃,进一步行流式检测;结果如图6所示,其中,横坐标表示scfv表达情况。
[0105]
实施例七、car-nk细胞对肿瘤细胞的杀伤:
[0106]
1)car-nk细胞对肿瘤细胞杀伤力检测:
[0107]
将her-2阳性乳腺癌细胞bt474和her-2阴性乳腺癌细胞mda-mb-468用培养基调整到1x106/ml,加入终浓度为5ug/ml calcein-am进行标记,37℃孵育1h,用pbs洗涤三遍后,用无酚红1640完全培养基重悬细胞,计数;调整肿瘤细胞10000/孔加入到96孔圆底板中;按e:t为10:1、5:1、2.5:1、1.25:1、0.625:1和0.03125:1分别加入空载体转染的mock nk细胞及相应不同组car-nk细胞1x105、5x104、2.5x104、1.25x104、0.625x104和0.03125x104;肿瘤细胞再加一组2%triton x-100及不处理组,100g离心5min,37℃共培养3h后,300g离心5min,每孔吸取100ul转移至96平底板中检测od值;检测结果如图7所示,表明含dap10 cd-cd137 cd-cd3ζsd胞内信号域nk-car2的car-nk细胞对her-2阳性乳腺癌细胞杀伤力显著高于其他组nk细胞,而对于her-2阴性乳腺癌细胞mda-mb-468的杀伤无明显差别;
[0108]
2)检测car-nk细胞与不同细胞共培养后ifn-γ和tnf-α分泌水平
[0109]
将her-2阳性乳腺癌细胞bt474及her-2阴性乳腺癌细胞mda-mb-468按e:t为2.5:1与空载体转染的mocknk细胞及不同组car-nk细胞共培养12h后取上清行elisa检测上清中ifn-γ和tnf-α的浓度;检测结果如图8所示,含dap10-cd137-cd3zeta胞内信号域nk-car2的car-nk细胞与her-2阳性乳腺癌细胞bt474共培养后ifn-γ和tnf-α的分泌水平明显高于其他组。
[0110]
上述实施例是对本发明的说明,不是对本发明的限定,任何对本发明简单变换后的方案均属于本发明的保护范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1