提高解脂耶氏酵母耐热性的方法及用于发酵合成甘露醇
1.本发明专利属于食品或医药领域,涉及采用食品安全微生物(解脂耶氏酵母 yarrowia lipolytica)发酵葡萄糖等碳源,直接合成甘露醇,取代采用植物提取法或化学合成法制造甘露醇的方法,具体涉及一种提高解脂耶氏酵母耐热性的方法及用于发酵合成甘露醇。
背景技术:
2.甘露醇(d-mannitol)是自然界天然存在的最广泛的一种多元醇,具有6个羟基,是山梨醇的2位羟基的同分异构体,分子量为182.19克/摩尔,是一种白色针状结晶体,熔点168摄氏度。甘露醇的饱和度低,在25℃下每100毫升水只能溶解21.6克,因此甘露醇容易从水溶液中结晶。甘露醇已经在食品、药品以及精细化工领域得到广泛的应用,如医药中作为利尿剂、高渗透降压药,还能诱导人多种癌细胞株细胞凋亡,在辅助治疗胰腺癌具有一定的作用(发明名称:甘露醇在制备抗胰腺癌药物中的应用,专利号:zl201210590592.8)。早在1972年即被美国fda批准为药物。甘露醇具有低热量同时具有一定的甜味的特性(甜度约为蔗糖的50%),应用于各类食品中。甘露醇具有不吸湿的特性,还应用于食品或者饲料填充剂。国际市场每年有15-20万吨的甘露醇应用于医药、食品等领域。正是由于甘露醇具有重要的应用价值,研究开发高效率且经济可行的甘露醇合成方式具有重要的意义。
3.目前常见的甘露醇合成方法包括:
4.(1)提取法:从褐藻(如海带)中采用水提法提取甘露醇。将褐藻粉碎用热水提取,过滤、浓缩得到甘露醇粗结晶,再溶解、脱色、浓缩、二次结晶得到甘露醇。缺点是成本较高。
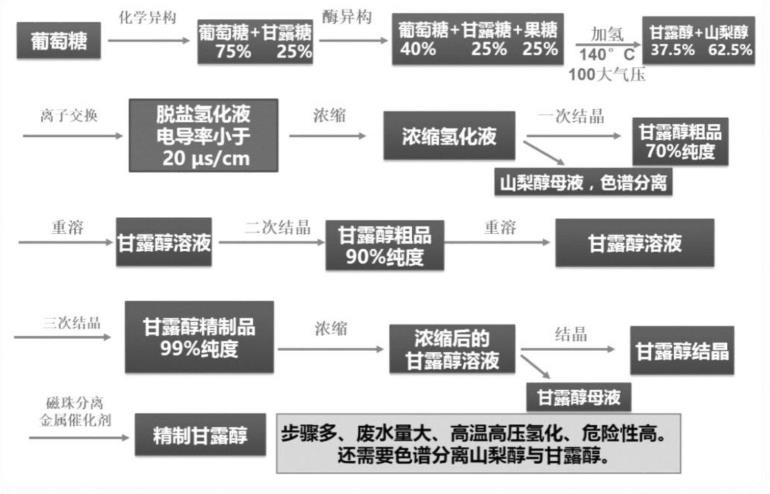
5.(2)化学合成法:目前甘露醇的主要生产方法为化学合成法,包括酶异构、化学异构、化学加氢、色谱分离、结晶过程。首先葡萄糖经过酶异构成为葡萄糖与果糖的混合物,再化学异构将部分葡萄糖异构为d-甘露糖。经过酶异构与化学异构得到含葡萄糖、 d-甘露糖与果糖的混合物,再化学高温高压加氢,葡萄糖得到山梨醇,果糖中的β-果糖转化为甘露醇,α-果糖得到山梨醇,甘露糖转化为甘露醇,因此加氢后得到含甘露醇与山梨醇的混合物(约40:60的比例含量),由于甘露醇的溶解度比较低,先将部分甘露醇结晶出来,不能在结晶的甘露醇与山梨醇混合物再经过色谱分离分别得到甘露醇与山梨醇,再分别浓缩结晶。整个步骤比较复杂,而且具有一定的危险性(需要制备氢气,再高温高压下完成加氢),而且色谱分离设备投入大,加氢过程还需要使用金属催化剂 (如镭镍催化剂等金属催化剂,raney nickel),在后续纯化过程中需要去除,增加了成本。催化剂的残留也是影响甘露醇品质的重要因素之一。酶法-化学法由葡萄糖合成甘露醇的过程详见说明书附图1。
6.基于植物提取法以及化学合成法的缺点,学术企业界迫切需要研究开发生物发酵合成甘露醇的方法。近十来年也取得了较大的进展。
7.由于甘露醇常用于食品添加剂,生产过程需要符合食品安全要求,其中包括使用的发酵合成的菌种也需要符合食品安全的要求。虽然有很多微生物能发酵合成甘露醇,但有的微生物尚不具备食品安全微生物的要求,未经过食品安全认证。如有的利用近平滑假
丝酵母(candida parapsilosis)发酵葡萄糖等碳源合成甘露醇(如发明专利 cn201310081411.3,一株产甘露醇的菌株及用该菌株发酵生产甘露醇的方法)。有的利用短乳杆菌(lactobacillus brevis)厌氧发酵含果糖的原料生成甘露醇(如中国发明专利201410161602.5,一株产甘露醇的短乳杆菌菌株及其生产甘露醇的方法),有的利用明串珠菌(leuconostoc sp.)厌氧发酵果糖合成甘露醇(如中国发明专利 201711191671.0,高产甘露醇的柠檬明串珠菌hm1菌株及其发酵制备甘露醇的方法)。虽然乳杆菌或明串珠菌属于食品安全微生物,但是发酵原料为果糖,果糖相比葡萄糖其价值要高出很多,如结晶果糖需要12000元1000公斤,而葡萄糖仅需要3000元1000 公斤。而且乳杆菌生长慢,发酵时间长,果糖浓度低,如需要厌氧发酵一周以上,不耐受高糖果糖,也不能耐受中高温,如在高于200克/升果糖中则受到生长抑制,发酵一般在25-28度进行,这些因素决定了利用乳杆菌发酵合成甘露醇难以具备实际应用价值,因此尚未见发酵法合成甘露醇的工业化生产的成功例子。
8.而解脂耶氏酵母(yarrowia lipolytica或candida lipolytica)是一种公认的食品安全微生物(yarrowia lipolytica:safety assessment of an oleaginous yeastwith a great industrial potential,crit rev microbiol,2014,40(3):187
–ꢀ
206),能作为多种天然化合物的合成底盘或者宿主,近年来受到学术界的密切关注 (biotechnological applications of yarrowia lipolytica:past,present andfuture,biotechnology advances,2015,33:1522
–
1546)。解脂耶氏酵母也是合成赤藓糖醇的优秀底盘(yarrowia lipolytica as an emergingbiotechnologicalchassis for functional sugars biosynthesis.criticalreviews in food science and nutrition,2021,61(4),535-552),同时也能合成少量的甘露醇与阿拉伯糖醇,作为赤藓糖醇合成过程中的副产物(highly efficienterythritol recovery from waste erythritol mother liquid by yeast-mediatedbiopurification.journal of agricultural food and chemistry,2017,65:11020
‑ꢀ
11028)。如tomaszewska等在2012年就报道了采用解脂耶氏酵母(如yarrowialipolytica a-15strain or wratislavia k1)发酵葡萄糖合成赤藓糖醇,在分批或者补料发酵条件下除了得到主产物赤藓糖醇外,还得到少量的甘露醇与阿拉伯糖醇 (production of erythritol and mannitol by yarrowia lipolytica yeast inmedia containing glycerol,j ind microbiol biotechnol.2012,39:1333
–ꢀ
1343)。
9.虽然解脂耶氏酵母具备天然合成甘露醇的能力,但是由于主要的产物是赤藓糖醇,甘露醇的产量只占少部分(如有的不足赤藓糖醇的十分之一)。虽然通过改变发酵条件如添加表面活性剂,增加细胞的通透性(enhanced production of erythritol and mannitol by yarrowia lipolytica in media containing surfactants,braz. j.of microbiol.2016,47:417
–
423),甘露醇的含量有所提高,但赤藓糖醇仍然是主要产物,甘露醇的含量仍然远不及赤藓糖醇的含量,若要将甘露醇提取出来,就需要通过色谱分离,这将大幅提高分离成本,增加生产成本,并不具备实际应用的价值。但是本发明可以利用解脂耶氏酵母具备天然合成甘露醇的特性,对其进行基因工程的改良,使其能显著降低赤藓糖醇的合成能力,甚至完全抑制赤藓糖醇的合成,大幅提高合成甘露醇的能力,通过简单的分离步骤即能将甘露醇分离纯化出来,从而具备实际应用的潜力。
10.解脂耶氏酵母的生长与发酵生产温度在28-30
°
范围内,对中高温很敏感。目前也很少研究提高其热耐受性。上海交通大学程海荣研究小组对不合成甘露醇的解脂耶氏酵母进行了代谢工程的改良,将来自酿酒酵母的一种热激蛋白基因在合成赤藓糖醇的解脂耶氏酵母中进行过表达,使得能在34度生长。虽然能够在34度中温下生长,但是在34度发酵合成产物(生产赤藓糖醇)的能力显著降低(metabolic engineering ofyarrowia lipolytica for thermoresistance and enhanced erythritolproductivity.biotechnology for biofuels,2020,13:176)。因此为了更好的提高其在中高温下的耐受性,尤其是提高在中高温下如在35度及以上合成产物的能力,仍然需要进一步研究,以达到即能耐受中高温,又能保持良好合成产物的性能。
11.本发明进一步通过基因工程的方法或者artp诱变的方法提高解脂耶氏酵母的热耐受性,通过提高发酵温度,降低由葡萄糖、果糖、甘油等碳源合成赤藓糖醇的代谢流量,提高合成甘露醇的代谢流量,从而实现由解脂耶氏酵母直接发酵高效合成甘露醇的目的。发酵结束后,菌液分离,澄清发酵液脱色、离子交换、浓缩、结晶干燥得到甘露醇结晶体,不需要再经过移动模拟色谱分离,从而大幅减低了生产成本,减少了整个操作步骤,具有实际应用的价值。
技术实现要素:
12.本发明的目的在于克服现有的生产甘露醇方法的不足之处,提供一种提高解脂耶氏酵母耐热性的方法及用于发酵合成甘露醇。
13.本发明通过基因工程的方法,包括利用解脂耶氏酵母本身的热休克蛋白基因以及外源基因随机整合到基因组,或者采用artp诱变随机突变的手段,对解脂耶氏酵母基因组进行分子操作,将原有的合成赤藓糖醇的解脂耶氏酵母进行改良,获得的工程菌株进行发酵葡萄糖、甘油等碳源一步发酵合成甘露醇,再从发酵液中提取纯化得到甘露醇粉末性结晶体。更具体来说,是以合成赤藓糖醇的解脂耶氏酵母为合成底盘,该酵母底盘英文名为yarrowia lipolytica,之前也称为candida lipolytica,根据翻译不同,中文翻译名可以为:解脂耶氏酵母、解脂酵母、解脂亚罗威酵母、亚罗威解脂酵母、解脂耶罗维亚酵母、解脂假丝酵母、假丝解脂酵母等,这些解脂酵母的基因组中含有seq id no.1、seq id no.2、seq id no.3、seq id no.4、seq id no.5序列中的一种或一种以上序列,并与seq id no.1、seq id no.2、seq id no.3、seq idno.4、seq id no.5这些序列具有90%及以上同源性。基因组经测序含有seq idno.1,seq id no.2,seq id no.3,seq id no.4,seq id no.5序列的一种或一种以上且具有90%或以上同源性的酵母菌株均属于本发明使用的底盘微生物的保护范围。对这些酵母菌底盘进行分子操作如诱变,改变其基因组(如获得新的基因突变),获得热耐受性的工程菌株,并进行优选,获得一株典型的yarrowia lipolytica cgmccno.24239菌株,能够由葡萄糖直接发酵合成甘露醇。本发明还提供采用工程菌株由葡萄糖等碳源发酵合成与纯化甘露醇的方法。
14.本发明的目的是通过以下方案来实现的:
15.第一方面,本发明涉及一种提高解脂耶氏酵母热耐受性的方法,包括在解脂耶氏酵母中提高热激蛋白基因或热激蛋白基因调控因子的表达;或对解脂耶氏酵母进行诱变,获得热耐受性。
16.作为本发明的一个实施方案,所述热激蛋白基因选自内源性或外源性热激蛋白基因。
17.作为本发明的一个实施方案,所述内源性热激蛋白基因包括ylhsp12、ylhsp72、 ylhsp75、ylhsp90或ylhsp104;所述外源性热激蛋白基因包括schsp90、blhsp90。
18.作为本发明的一个实施方案,所述热激蛋白基因调控因子包括内源性或外源性热激蛋白基因调控因子。
19.作为本发明的一个实施方案,所述内源性热激蛋白基因调控因子包括ylmsn5、 yltps2、yltah1、ylhsf12或yltps1;所述外源性热激蛋白基因调控因子包括酿酒酵母的tah1热激蛋白调控因子、枯草芽孢杆菌热激蛋白调控因子或嗜热链球菌来源的转录调控因子。
20.作为本发明的一个实施方案,获得的热激蛋白基因或热激蛋白基因调控因子过表达菌株,经34-37℃耐热筛选,获得高热耐受性解脂耶氏酵母。
21.作为本发明的一个实施方案,耐热筛选选用的培养基为固体丰富培养基。该培养基含有酵母浸粉(质量体积百分比:0.2-2%),蛋白胨(质量体积百分比:0.2-2%),葡萄糖(质量体积百分比:1-5%),琼脂(质量体积百分比1.5%),其余为水,ph5-7。
22.作为本发明的一个实施方案,热激蛋白基因过表达菌株的构建包括如下步骤:
23.s1、构建热激蛋白hsp基因表达盒,含解脂酵母的启动子序列、hsp基因序列和终止子序列;
24.s2、构建hsp基因的表达载体序列,含上游同源臂序列、所述hsp基因表达盒和下游同源臂序列;
25.s3、合成的全序列连接到克隆载体,转化到大肠杆菌中扩增质粒;
26.s4、酶切质粒,转化出发菌株;34-37度培养筛选能长出单菌落。
27.作为本发明的一个实施方案,含hsp基因的表达载体为puc57-yl.hsp90;出发菌株为yarrowia lipolytica cgmcc no.7326。
28.作为本发明的一个实施方案,含hsp基因的表达载体还可以为puc57-yl.hsp12、 puc57-yl.hsp72、puc57-yl.hsp75、puc57-yl.hsp104或puc57-sc.hsp90;分别将优化后并体外合成的yl.hsp12、yl.hsp72、yl.hsp75、yl.hsp104、sc.hsp90序列用saci 与xhoi双切,克隆到saci与xhoi双切载体puc57-yl.hsp90中,分别构成puc57
‑ꢀ
yl.hsp12、puc57-yl.hsp72、puc57-yl.hsp75、puc57-yl.hsp104和puc57-sc.hsp90。
29.作为本发明的一个实施方案,所述酶切为用ecori单切线性化。
30.作为本发明的一个实施方案,热激蛋白基因调控因子过表达菌株的构建包括如下步骤:全序列合成热激蛋白基因调控因子,以saci与xhoi双切,克隆到saci与xhoi双切的步骤s3获得的载体中。
31.在一些实施例中,热激蛋白基因调控因子过表达菌株的构建包括如下步骤:
32.全序列合成热激蛋白基因调控因子,以saci与xhoi双切,克隆到saci与xhoi双切载体puc57-yl.hsp90中,分别构成载体puc57-yl.msn5、puc57-yltps2、puc57-yltah1、 puc57-ylhsf12、puc57-yltps1、puc57-sctah1、puc57-spx、puc57-rgg0182。
33.作为本发明的一个实施方案,所述诱变包括artp常温等离子体诱变;诱变后的菌株经34-37度高温培养,筛选有单菌落长出的突变株;经34-37℃耐热筛选,获得高热耐受性
解脂耶氏酵母。
34.第二方面,本发明还涉及一种前述的方法获得的高热耐受性解脂耶氏酵母菌株。该菌株能够耐受34-38℃。
35.第三方面,本发明还涉及一种耐热菌株yarrowia lipolytica cgmcc no.24239。
36.第四方面,本发明还涉及一种利用所述的菌株发酵合成甘露醇的方法。
37.作为本发明的一个实施方案,所述发酵采用的碳源包括葡萄糖、甘油、果糖。
38.作为本发明的一个实施方案,所述方法包括菌株的活化、摇瓶种子的培养、种子的逐级扩培和生产发酵罐的发酵。
39.作为本发明的一个实施方案,所述活化具体为将-80度低温保存的所述菌株于固体丰富培养基如ypd培养基中,35度培养20-30小时。
40.作为本发明的一个实施方案,所述方法还包括从菌株发酵液中提取纯化甘露醇的步骤。
41.作为本发明的一个实施方案,所述提取纯化包括:菌液的分离、含甘露醇清液的浓缩、甘露醇的结晶、结晶体的离心分离、结晶体的重溶与脱色、再次浓缩与重结晶和结晶体的离心与干燥。
42.本发明的解脂耶氏酵母yarrowia lipolytica man-9,该菌株已在中国微生物菌种保藏管理委员会普通微生物中心(cgmcc)保藏,保藏地址为北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,保藏日期是2022年01月04日,保藏号为cgmccno.24239。
43.与现有技术相比,本发明具有如下有益效果:
44.本发明通过对解脂耶氏酵母进行代谢工程的改造或对其进行诱变处理,提高其耐热性,降低由葡萄糖等碳源合成赤藓糖醇的代谢流量,提高合成甘露醇的代谢流量,从而能够直接发酵葡萄糖、甘油等单一或复合碳源一步发酵生产甘露醇,而不通过化学合成法或植物提取法生产甘露醇。
附图说明
45.通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
46.图1为酶法-化学法由葡萄糖合成甘露醇流程图;
47.图2为解脂耶氏酵母直接发酵法合成甘露醇的流程图;
48.图3为构建的含热休克蛋白基因(yl.hsp90)的解脂耶氏酵母质粒载体示意图;
49.图4为转化有热休克蛋白基因(yl.hsp90)的解脂耶氏酵母(a)与对比菌株(b) 在35度培养7天的对比图;
50.图5为将35度能良好生长的单菌落和对比菌落置于37度培养的对比图;
51.图6为构建的含热休克蛋白基因调控因子(hspr)的解脂耶氏酵母质粒载体示意图;
52.图7为artp诱变后在35度长出的单菌落示意图,单菌落如箭头所示;
53.图8为3台5升发酵罐发酵合成甘露醇的实物图;
54.图9为从发酵液中分离纯化的甘露醇结晶及其解剖镜下的形态(20倍放大);
55.图10为甘露醇结晶体色谱纯度检测示意图;由图10可知,只有甘露醇一种峰,纯度
bacillus subtilis stress response,curr genet.2019,65:871
‑ꢀ
876)、嗜热链球菌来源的转录调控因子(如rgg0182调控因子,详见参考文献:henryet al.the rgg0182 gene encodes a transcriptional regulator required for thefull streptococcus thermophilus lmg18311 thermal adaptation.bmc microbiol. 2011,11:223)。将这些调控因子基因及其调控序列(如启动子序列与终止子序列)整合到解脂耶氏酵母基因组中,能起到一定程度的参与解脂耶氏酵母的耐热性调控的作用。含调控基因的整合表达载体的构建、转化酵母细胞的方法、耐热筛选等方法详见实施例 2。
73.3、通过诱变随机突变解脂耶氏酵母基因组,从而获得热耐受性。本发明采用诱变专用仪器artp(常温常压等离子体,atmospheric and room temperature plasma,无锡应用技术研究院研制),以氦气为诱变工作气体,在常压室温下产生等离子体源,其中含有多种化学活性粒子成分,如oh、氮分子二正系统、氮分子一负系统、激发态氦原子、氢原子和氧原子等。artp产生富含活性能量的粒子会对解脂耶氏酵母的遗传物质造成损伤,并诱发酵母细胞启动sos修复机制。sos修复过程为一种高容错率修复,因此修复过程中会产生种类丰富的错配位点,并最终稳定遗传进而形成突变株。诱变后将细胞涂布在培养基上,在37度筛选培养一定时间,长出单菌落。对单菌落进一步耐高温试验以及甘露醇合成性能的测试。具体诱变操作过程详见实施例3。
74.对上述1-3获得的耐热解脂酵母进行筛选,获得一株典型的具有代表性的耐热解脂耶氏酵母菌株yarrowia lipolytica cgmcc no.24239,保存于中国微生物菌种保藏管理委员会普通微生物中心,地址北京朝阳区大屯路中国科学院微生物研究所所内。
75.第二方面,本发明涉及典型解脂耶氏酵母耐热菌株cgmcc no.24239发酵葡萄糖等碳源合成甘露醇的方法。以下以典型解脂耶氏酵母耐热菌株cgmcc no.24239为例,说明采用微生物发酵法直接由葡萄糖、果糖、甘油等碳源合成甘露醇的方法。由于获得耐热突变菌株数量众多,本发明不做一一保存,而是保存耐热性得到提高,同时合成甘露醇的产量显著提高,但是细胞量并没有显著提高的典型菌株。采用本发明获得的其它耐热突变菌株发酵葡萄糖等碳源直接合成甘露醇的方法与采用典型耐热菌株cgmccno.24239的方法相同。
76.典型的发酵合成甘露醇的方法包括:(1)菌株的活化、(2)摇瓶种子的培养、(3) 种子的逐级扩培、(4)生产发酵罐的发酵。活化一般指从冻存管中取出,使其从休眠状态恢复生长的过程。从冻存管中取出50-200微升划线接种到固体培养基表面,在30-35 度培养,直至恢复生长。再从中刮取一定量的菌泥接种到摇瓶中培养直到菌体密度达到 5-10,再接种到扩培罐中逐级扩大培养,一直到生产发酵罐中发酵培养。在发酵罐中的发酵温度控制在34-38度,优选35度。通气量为0.2-0.6vvm,优选0.4vvm。在100
‑ꢀ
500升的扩培罐中搅拌转速100-300转/分钟,优选250转/分钟。在1000-10000升的扩培罐转速为80-200转/分钟,优选120转/分钟。在30立方米及以上的发酵罐中搅拌转速为80-200转/分钟,优选120转/分钟。
77.(1)耐热突变菌株的活化
78.将典型解脂耶氏酵母耐热菌株cgmcc no.24239(含有热激蛋白基因hsp90基因)从
ꢀ‑
80度低温保存柜中取出,划线于固体ypd平板上(成分为:20克/升葡萄糖、10克/升酵母浸粉、5克/升胰蛋白胨,15克/升琼脂粉,ph6.0,121度灭菌20分钟后),在35 度培养36小时,以活化耐热突变株。此处仅以此培养基成分为例,依据需要可以进行任何形式的成分优化。
79.(2)摇瓶种子的培养
80-95℃真空浓缩到固形物含量450
±
20克/升。
90.(3)等度降温,由于甘露醇的溶解度较低,在25度下100毫升水只能溶解18克的甘露醇,而对于其它的多元醇如山梨醇,100毫升能溶解235克山梨醇,是甘露醇的 13倍。对于赤藓糖醇,在25度条件下100毫升水能溶解37克赤藓糖醇,是甘露醇的2 倍。正是由于甘露醇的溶解度低,在降温的过程中甘露醇很容易析出。等度降温,结晶器搅拌转速30-150转/分钟,优选50转/分钟,从80度降到10度,降温梯度每小时降温1-10度,优选3度。还可以采用非等度降温的方法,如从80度到50度每小时降低 3度,50度到10度每小时降低2度。随着温度的降低,甘露醇大量析出。
91.(4)甘露醇结晶体的分离,采用离心的方法,将甘露醇结晶体与母液分离,得到的结晶体用冷水洗晶,洗晶水进入母液。
92.(5)重结晶,晶体重新溶解,70-80度浓缩到固形物含量450
±
20克/升,加入粉末性活性炭吸附(活性炭加入量为浓缩液质量的0.5%-5%,优选2%的加入量),板框压滤分离活性炭得到无色的甘露醇溶液,再次等度降温,结晶,离心,干燥,得到甘露醇精制品。
93.本发明采用的由解脂耶氏酵母直接发酵法合成甘露醇的流程如图2所示。
94.具体示例如下:
95.实施例1
96.本实施例涉及含解脂耶氏酵母自身的热休克蛋白基因(yl.hsp)表达载体的构建、转化与筛选,以yl.hsp90为例。
97.首先设计含解脂耶氏酵母自身的热休克蛋白基因(hsp)的表达载体序列,该序列含有如下dna元件:上游同源臂序列、hsp基因表达盒(含解脂酵母的启动子序列、hsp基因序列、终止子序列)、下游同源臂序列。全序列如seq id no.19。合成的全序列连接到克隆载体如puc57中(该载体是克隆常用载体,序列在ncbi等数据库均能检索得到),得到puc57-yl.hsp90并转化到大肠杆菌中扩增质粒。构建的含hsp90基因的整合表达载体示意图如图3所示。用ecori酶切该质粒以线性化该载体,转化出发菌株cgmcc 7326,转化方法详见发明人发表的论文(如journal of functional foods,2017,32: 208~217)。转化后全部涂布在固体ypd平板上,在35度培养4-7天,同时用不转化的出发菌株cgmcc7326做对比,同样在35度培养。经过4-7天的培养,转化了yl.hsp90 基因的解脂耶氏酵母菌在35度培养能长出单菌落,而对比菌株则不能生长(如图4所示)。将长出的单菌落逐一转接到新鲜的ypd固体平板上,置于37度培养3-5天,大部分能耐受35度的单菌落不能在37度生长,少数单菌落能在37度继续良好生长,图 5显示挑取5个能在35度生长的只有1个能在37度良好生长;ck为对比菌,不能生长。转化与过表达yl.hsp90基因后,一共获得14个单菌落能在37度良好生长。对这 14个单菌落在35,36,37度逐一发酵葡萄糖合成甘露醇的试验。
98.其它含热激蛋白基因(yl.hsp12,yl.hsp72,yl.hsp75,yl.hsp104,sc.hsp90等) 表达载体的构建与上述含yl.hsp90基因的构建方法类似。用saci与xhoi双切载体 puc57-yl.hsp90,将优化后并体外合成的yl.hsp12,yl.hsp72,yl.hsp75,yl.hsp104, sc.hsp90等dna用saci与xhoi双切,克隆到saci与xhoi双切载体puc57-yl.hsp90 载体中,分别构成puc57-yl.hsp12,puc57-yl.hsp72,puc57-yl.hsp75,puc57
‑ꢀ
yl.hsp104,puc57-sc.hsp90,用ecori单切线性化分别转化解脂酵母cgmcc7326,在 35度培养。得到的耐高温菌株分别进行发酵合成甘露醇试验。
99.实施例2
100.本实施例涉及构建含解脂耶氏酵母自身的热休克蛋白调控因子(hspr)的酵母表达载体,以yl.msn5为例。
101.优化并全序列合成yl.msn5基因,以saci与xhoi双切,克隆到saci与xhoi双切载体puc57-yl.hsp90载体中,构成新载体puc57-yl.msn5,示意图如图6所示。用ecori 单切线性化分别转化解脂酵母cgmcc 7326或其它种类的解脂耶氏酵母,在35度培养。将得到的单菌落再转接到新的ypd固体培养基上,在37度继续培养,筛选能在37度良好生长的转化子,并进行发酵试验。对于其它的热休克蛋白调控因子(如yltps2,yltah1, ylhsf12,yltps1,sctah1,spx,rgg0182等)的表达载体构建与转化子的筛选,方法同上。一共获得12个在35度良好生长的转化子(含有ylmsn5,yltps1,yltah1或 ylhsf12),其中2个仍能在37度良好生长(含ylmsn5),初步说明过表达ylmsn5调控因子的效果较好。
102.实施例3
103.本实施例涉及通过artp诱变获得耐高温解脂耶氏酵母菌株。
104.除了通过过表达热激蛋白基因或者其调控因子基因来提高解脂酵母的耐热性外,还可以通过artp常温等离子体诱变来获得耐高温突变株。诱变前打开artp诱变仪,内腔用紫外线杀菌30分钟,在同一功率下设置8种诱变时间,第一个设置成10秒,每5秒增加梯度。将待诱变的出发菌株用无菌水进行稀释并取10微升点在诱变小铁片中央(灭菌处理后),涂开,一共8个圆形小铁片(直径约6mm)。将8个圆形小铁片放在诱变台上,开始诱变。诱变结束后将圆形小铁片置于含600微升无菌水的1.5毫升离心管中,振荡使铁片表面的菌充分洗涤下来,全部涂布在固体ypd平板上,置于35度培养5-8 天,观察是否有单菌落长出。经过8天的培养,发现有单菌落长出,其中一个平板上长出的菌落如图7所示。将获得的单菌落转接到新鲜的固体培养基上,在37度培养,只有2个单菌落能继续生长。
105.实施例4
106.本实施例涉及获得的耐高温解脂酵母发酵合成甘露醇的初步筛选。
107.耐高温发酵合成甘露醇的初步筛选试验在250毫升摇瓶中进行。将获得的能在35 度良好生长的单菌落接入含有30毫升发酵培养基的250毫升摇瓶中,共随机选取30个单菌落进行初步筛选。发酵培养基成分为(克/升):一水葡萄糖280,酵母浸粉8,胰蛋白胨2,磷酸氢二胺2,柠檬酸铵2,用自来水配置,起始ph6.0-6.7,灭菌。每瓶加入20微升消泡剂,置于摇床中,35度220转/分钟发酵,定时取样,并补充挥发减少的水分至初始重量,液相色谱检测甘露醇的产量。经过检测,发现含有yl.hsp90的转化子单菌落合成甘露醇的产量相对较高,达到102克/升。其余的单菌落甘露醇的产量在 70-85克/升之间。接着将温度提高到37度,其它条件一致,经过发酵,液相检测,含 yl.hsp90的转化子甘露醇的含量达到108克/升。所有摇瓶中菌的细胞密度(od
600
值) 在35
±
5之间。发酵时间方面,含yl.hsp90的转化子的发酵时间最短,95小时底物葡萄糖消耗完全,发酵结束。而其它转化子发酵时间均超过100小时,发酵时间长,细胞呼吸时间增加,则会消耗更多的底物葡萄糖,导致甘露醇的产量偏低。以下的实施例均以含yl.hsp90基因的转化子作为研究对象。
108.实施例5
109.本实施例涉及发酵果糖合成甘露醇的试验,分别在35与37度进行。
110.试验在250毫升摇瓶中进行。将含yl.hsp90的转化子单菌落接入含有30毫升发酵
培养基的250毫升摇瓶中。发酵培养基成分为(克/升):果糖280,酵母浸粉8,胰蛋白胨2,磷酸氢二胺2,柠檬酸铵2,用自来水配置,起始ph6.0-6.7,灭菌。每瓶加入 20微升消泡剂,置于摇床中,分别在35与37度220转/分钟发酵,定时取样,并补充挥发减少的水分至初始重量,液相色谱检测甘露醇的产量。经过检测,在35度与37度条件下合成甘露醇的产量分别达到105克/升与109克/升。说明该转化子能利用果糖发酵合成甘露醇。
111.实施例6
112.本实施例涉及发酵甘油合成甘露醇的试验,分别在35与37度进行。
113.试验在250毫升摇瓶中进行。将含yl.hsp90的转化子单菌落接入含有30毫升发酵培养基的250毫升摇瓶中。发酵培养基成分为(克/升):甘油150,酵母浸粉5,胰蛋白胨1,磷酸氢二胺1,柠檬酸铵2,用自来水配置,起始ph6.0-6.7,灭菌。每瓶加入 20微升消泡剂,置于摇床中,分别在35与37度220转/分钟发酵,定时取样,并补充挥发减少的水分至初始重量,液相色谱检测甘露醇的产量。经过检测,在35度与37度条件下合成甘露醇的产量分别达到65克/升与70克/升。说明该转化子能利用甘油发酵合成甘露醇。由于同等浓度甘油的渗透压比葡萄糖或者果糖要大,因此将甘油浓度降低为150克/升,超过200克/升甘油浓度酵母生长缓慢。
114.实施例7
115.本实施例涉及发酵葡萄糖与果糖的混合物合成甘露醇的试验,分别在35与37度进行。
116.试验在250毫升摇瓶中进行。将含yl.hsp90的转化子单菌落接入含有30毫升发酵培养基的250毫升摇瓶中。发酵培养基成分为(克/升):一水葡萄糖150,果糖150,酵母浸粉8,胰蛋白胨2,磷酸氢二胺2,柠檬酸铵2,用自来水配置,起始ph6.0-6.7,灭菌。每瓶加入20微升消泡剂,置于摇床中,分别在35与37度220转/分钟发酵,定时取样,并补充挥发减少的水分至初始重量,液相色谱检测甘露醇的产量。经过检测,在35度与37度条件下合成甘露醇的产量分别达到107克/升与113克/升。说明该转化子能利用葡萄糖与果糖的混合物发酵合成甘露醇,但是优先利用葡萄糖,然后再利用果糖。
117.实施例8
118.本实施例涉及发酵葡萄糖合成甘露醇的试验,在34度进行。
119.试验在250毫升摇瓶中进行。将含yl.hsp90的转化子单菌落接入含有30毫升发酵培养基的250毫升摇瓶中。发酵培养基成分为(克/升):葡萄糖280,酵母浸粉8,胰蛋白胨2,磷酸氢二胺2,柠檬酸铵2,用自来水配置,起始ph6.0-6.7,灭菌。每瓶加入20微升消泡剂,置于摇床中,在34度220转/分钟发酵,定时取样,并补充挥发减少的水分至初始重量,液相色谱检测甘露醇的产量。经过检测,在34度条件下合成甘露醇的产量为94克/升。
120.实施例9
121.本实施例涉及发酵葡萄糖合成甘露醇的试验,在38度进行。
122.试验在250毫升摇瓶中进行。将含yl.hsp90的转化子单菌落接入含有30毫升发酵培养基的250毫升摇瓶中。发酵培养基成分为(克/升):葡萄糖280,酵母浸粉8,胰蛋白胨2,磷酸氢二胺2,柠檬酸铵2,用自来水配置,起始ph6.0-6.7,灭菌。每瓶加入20微升消泡剂,置于摇床中,在38度220转/分钟发酵,定时取样,并补充挥发减少的水分至初始重量,液相色谱检测甘露醇的产量。经过检测,在38度条件下合成甘露醇的产量为64克/升,比在34,35,
36,37度要大幅降低,原因是在38度条件下细胞虽然能生长,但其生长受到明显抑制,细胞密度对数生长期仅为19,显著低于其它温度条件下的35
±
5,葡萄糖到170小时时仍未利用完毕。
123.根据实施例5-9的初步结果,在37度温度下合成甘露醇的产量要略高于在35度下的产量,35度发酵产量又高于在34度条件下的产量,其原因可能是随着温度的提高,细胞要合成更多的甘露醇来抵抗逆境条件来保护细胞。但是超过37度合成甘露醇的产量就显著降低,细胞的生长也受到抑制。已知甘露醇是一种在逆境条件下产生的多元醇,其它生物如植物、藻类在干旱、高温、高盐的环境下会积累更多的甘露醇,如生活在海水中的藻类一般含有较多的甘露醇。
124.实施例10
125.本实施例涉及发酵葡萄糖合成甘露醇的试验,在5升发酵罐分别于35,36,37度进行。
126.5升发酵罐中含3升发酵培养基,成分为:300克/升一水葡萄糖、8克/升酵母浸粉、2克/升胰蛋白胨,2克/升柠檬酸三铵,2克/升磷酸氢二铵,起始ph6.5,碳源与氮源单独于115度灭菌30分钟再混合。冷却后接入300毫升酵母种子液(含yl.hsp90 基因的转化子单菌落),在600转/分钟,35,36,37度,通气量1vvm条件下发酵。从第 48小时开始,不定时取样hplc测定产物与底物的浓度变化。35度条件下92小时发酵结束,甘露醇产量为135克/升。36度条件下98小时发酵结束,甘露醇产量为146克/ 升。37度条件下发酵107小时结束,甘露醇产量为155克/升。随温度的升高发酵结束时间要延长,甘露醇的产量有所增加。3台5升的发酵罐发酵合成甘露醇的实物图如图 8所示。
127.实施例11
128.本实施例涉及从发酵液中分离提取甘露醇
129.5升发酵罐发酵结束后,菌液分离可以采用离心的方法,在5000转/分钟下菌液离心10分钟。菌液分离后得到澄清透明的含甘露醇的清液。对该清液进行蒸发浓缩至固形物含量450克/升,折光46。置于4度冰箱,甘露醇晶体逐渐析出。离心分离晶体,再将晶体重溶,加入活性炭,加入量为溶液的0.5%(质量体积百分比),在70度脱色 60分钟。过滤脱除活性炭,对清液再次蒸发浓缩,结晶,得到针状晶体,置于放大镜下观察呈针状,如图9所示。取一颗干燥的晶体溶解,液相色谱测定纯度,结果为99.9%以上,只显示一个甘露醇的峰,如图10所示。
130.将实施例5-10使用的过表达yl.hsp90基因的解脂耶氏酵母转化子保存于中国微生物菌种保藏管理委员会普通微生物中心(中国科学院微生物研究所所内),保藏号为 cgmcc no.24239。
131.上面对本发明进行了详细的说明,从耐高温解脂耶氏酵母突变株的获得,到利用获得的耐高温菌株在高温条件下合成甘露醇,再到从发酵液中分离提取甘露醇整个过程进行了说明。发明人还可以对本发明说明书的内容进一步完善补充,以取得更好的实施效果,这些完善补充都属于本发明的技术范畴。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1