一种仿生消化联合体外发酵评估纤维原料发酵特性的方法
1.本发明涉及一种纤维原料发酵特性的快速评估方法,具体涉及一种仿生消化联合体外发酵评估纤维原料发酵特性的方法。
背景技术:
2.近年来,膳食纤维作为功能性物质受到广泛关注。短链脂肪酸(short-chain fatty acid,scfa)是膳食纤维发酵的主要产物,不仅为肠上皮细胞供能,也促进肠道健康和免疫功能。但是,膳食纤维类型众多、性质迥异,在生产应用上受到诸多限制。体外发酵技术是反刍动物营养研究中评价纤维降解率及发酵特性的有效方法,但在引入到猪营养研究中仍存在较多问题。首先是发酵底物选择的合理性。现有研究主要以原料或体外预消化残渣作为底物进行体外发酵。其中,以原料为发酵底物进行体外发酵,通常会导致原料特性的体外评价结果与体内不一致(见参考文献:赵金标2020.不同纤维原料在猪肠道发酵特征的研究.博士学位论文),这可能是由于纤维原料没有经过胃-小肠的预消化,进而影响纤维原料的发酵特性。以体外预消化残渣作为发酵底物,其获取方法基本是使用基于三角瓶的体外酶法(见参考文献:boisen,s.,and j.a.fernandez.prediction ofthe apparent ileal digestibility of protein and amino acid in feedstuffs and feed mixtures for pigs by in vitro analyses.anim.feed sci.technol.,1995,51:29-43),而此法中存在模拟消化液酶活性的重复性差,体外消化参数(如酶活性,消化时间等)缺乏体内数据参考以及操作自动化程度低等弊端,使其对养分的消化程度与体内有较大的差异。此外,接种物制备缺乏标准化的流程以及接种物供体数量的确定缺乏数据支持。由于个体间粪便微生物组成存在差异(david,l.a.et al.diet rapidly and reproducibly alters the human gut microbiome.nature,2013,505:559-563.),不同供体的粪便间的差异会引入到发酵过程中,从而增加发酵的变异程度。对来源于不同供体的粪便进行混合制备接种液是降低粪便间菌群差异的有效手段,但是缺乏相关的数据支持以及适宜的混合数量的定量研究。最后,体外发酵技术本身测定结果变异较大,重复性低(见参考文献:jang j c,zeng z,shurson g c,et al.effects of gas production recording system and pig fecal inoculum volume on kinetics and variation of in vitro fermentation using corn distiller's dried grains with solubles and soybean hulls.animals,2019,9(10):773-782.),主要是因为随着发酵的进行代谢产物不断累积,使现有发酵体系下发酵液环境难以维持在生理水平,如ph会急剧下降,从而导致发酵类型的转变。因此,需要进一步优化发酵体系,以提高发酵方法的准确性和重复性。
3.为解决上述问题,本发明设计提供一种基于仿生消化联合体外发酵的方法,以仿生消化后残渣作为发酵底物,更高程度还原纤维原料在后肠的发酵特性,从发酵培养基、接种物方面提高体外发酵方法的准密度和重复性,从而为指导纤维原料的应用提供方法和指导。
技术实现要素:
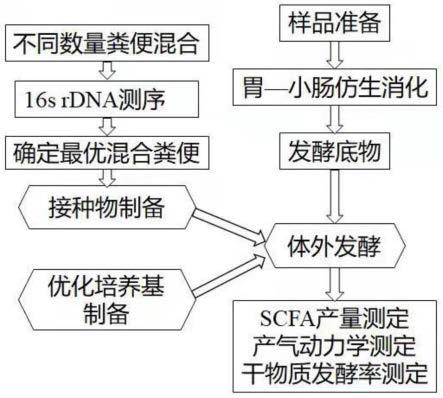
4.一种仿生消化联合体外发酵评评估纤维原料发酵特性的方法,包括如下步骤:
5.(1)将采集的粪便进行混合,制备粪便接种液;
6.(2)仿生模拟纤维原料胃—小肠消化,获取未消化残渣作为发酵底物;
7.(3)在厌氧操作箱中,将粪便接种液和培养基加入装有发酵底物的发酵瓶中作为试验组,并以不加发酵底物的发酵瓶作为空白对照组,将试验组和对照组于恒温培养中进行体外发酵;
8.(4)发酵过程中测定试验组发酵产气量;发酵结束后,测定试验组和对照组发酵液中短链脂肪酸含量和干物质发酵率。可选地,以对照组为基准进行校正,作为评估纤维发酵性能的指标。
9.进一步地,步骤(1)中将采集的粪便以最优化的混合数量进行等量混合,作为最优混合粪便,制备粪便接种液。
10.所述步骤(1)中,最优混合粪便及接种液制备的具体步骤为:
11.11)粪便的采集:选择品种相同、日龄一致、饲养管理一致的生长猪,在上午采食后同一时间段内用无菌密封袋收集粪便,并赶出所有的空气,冷冻储存;
12.12)粪便混合处理及其微生物16s rdna高通量测序:在无菌厌氧操作箱中(紫外线照射24h)将步骤11)采集的粪便制备成不同数量粪便等质量混合而成的混合粪便;进行微生物16s rdna测序;
13.13)最优化混合粪便的确定及接种液制备:根据粪便的不同混合数量对其微生物丰度的变异程度以及体外发酵结果的变异系数,确定接种液制备所需的最优的粪便混合数量;根据确定的最优粪便混合数量,制备混合粪便,用磷酸盐缓冲液以1:5(w/v)比例稀释,并用水浴恒温振荡器在39℃条件下进行水浴震荡,使其充分混合(使纤维相关菌悬浮于液体);在无菌厌氧操作箱中用5层无菌纱布和65目标准筛(250μm孔径)进行过滤,滤液即为接种液。
14.在所述最优混合粪便及接种液制备过程,所述步骤11)中,所述生长猪品种为三元商品猪,日龄为90~150天,饲粮为满足生长猪营养需要量的玉米-豆粕型饲粮;粪便采集时间为9:00~11:00,猪排出粪便后应立即收取至无菌密封袋,并赶出空气,密封;冷冻储存条件为-80℃;
15.在所述步骤12)中,所述混合粪便分别为3头猪的混合粪便,5头猪的混合粪便,10头猪的混合粪便,20头猪的混合粪便,并以不经混合处理的单头猪粪便为对照,共5组粪便;粪便处理过程通过持续充入co2气体维持厌氧环境,需在1h内操作完成。
16.所述步骤13)中,所述最优粪便混合数量为5~10头猪的粪便进行等质量混合;所述磷酸盐缓冲液由磷酸氢二钠,磷酸二氢钾组成,ph为6.8~7.0;其中,磷酸氢二钠浓度为100~102mm,磷酸二氢钾浓度为96~98mm。所述水浴震荡时间为30~60min,所述水浴温度37~39℃。
17.所述步骤(2)中,所述仿生模拟纤维原料胃—小肠消化过程使用程控单胃动物仿生消化系统进行(专利号:zl 201910360566.8);
18.所述仿生模拟纤维原料胃—小肠消化的具体操作步骤参见zl 201811503672.9:
19.其中,原料粉碎过筛后,装入程控猪仿生消化系统的模拟消化器的透析管内;加入
胃模拟消化液,泵入胃缓冲液到模拟消化器的透析管外,往复循环模拟胃消化,消化时间为4h;胃模拟消化结束后,泵入小肠缓冲液到模拟消化器的透析管外,往复循环;往透析管内注入浓缩小肠模拟消化液,开始小肠的模拟消化,消化时间为8h;整个模拟消化结束后清洗消化产物,每次清洗2~4h,重复清洗6次。
20.在所述步骤(2)中,所述未消化残渣的获取:仿生消化结束后,将所有物质转入恒重的培养皿中后,在65℃恒温鼓风干燥箱中烘至无水痕,冷却后转移至g4玻璃砂芯坩埚中,用30~35ml无水乙醇冲洗,共冲洗3~4次;冲洗结束后,放入65℃恒温鼓风干燥箱中烘干。
21.所述步骤(3)中,所述体外发酵的具体操作步骤为:
22.a)发酵底物预处理:将经预消化后烘干的发酵底物,用万能粉碎机粉碎后过筛,然后将样品装在自封袋中,低温储存备用;
23.b)粪便接种液制备:收集5~10头猪的粪便进行等质量混合,制备最优混合粪便;用磷酸盐缓冲液以1:5~1:5.5(w/v)比例稀释,并用水浴恒温振荡器进行水浴震荡,使其充分混合(使纤维相关菌悬浮于液体);在无菌厌氧操作箱中用5层无菌纱布和65目标准筛(250μm孔径)进行过滤,滤液即为接种液;
24.c)培养基的配制:以微量元素溶液,磷酸盐缓冲液和碳酸盐溶液和去离子水混合制备培养基,在高压灭菌锅中灭菌。其中,以二水合氯化钙,四水合氯化锰,六水合氯化钴,六水合氯化铁制备微量元素溶液;以磷酸氢二钠,磷酸二氢钾,硫酸镁制备磷酸盐缓冲液;以碳酸氢钠,碳酸氢铵制备碳酸盐溶液。
25.d)体外发酵步骤:称量一定重量的发酵底物,装入发酵瓶中;将装有发酵底物的发酵瓶放至厌氧操作箱中,向厌氧操作箱持续通入co2气体。向发酵瓶中加入培养基和接种液。塞上橡胶塞,拧紧瓶盖。将发酵瓶移入恒温培养箱中发酵。
26.e)样品采集与储存:发酵结束后,冰浴终止发酵。将发酵液离心,上清液和沉淀物在-80℃冻存;上清液待测短链脂肪酸,沉淀物待测微生物组成。
27.在所述体外发酵过程,步骤a)中,所述粉碎在万能粉碎机中进行。样品在万能粉碎机中粉碎时间为20~40s,过40目~60目标准筛。
28.在所述步骤b)中,所述生长猪品种为三元商品猪,日龄为90~150天,饲粮为满足nrc(2012)生长猪营养需要量的玉米-豆粕型饲粮;粪便采集时间为9:00~11:00,猪排出粪便后应立即收取至无菌密封袋,并赶出空气,密封;所述磷酸盐缓冲液由磷酸氢二钠,磷酸二氢钾组成,ph为6.8~7.0;其中,磷酸氢二钠浓度为100~102mm,磷酸二氢钾浓度为96~98mm。所述水浴温度37~39℃,水浴震荡时间为30~60min;
29.在所述步骤c)中,所述培养基中包含0.1~0.12ml微量元素溶液,230~237ml磷酸盐溶液,230~237ml碳酸盐溶液,用去离子水定容至1l;通入co2气体30~40min,使溶解达到无氧状态,ph6.8~7.0;121℃,灭菌10min。所述微量元素溶液中二水合氯化钙浓度为85~90mm,四水合氯化锰浓度为48~51mm,六水合氯化钴浓度为3.8~4mm,六水合氯化铁浓度为30~32mm;磷酸盐溶液中磷酸氢二钠浓度为100~102mm,磷酸二氢钾浓度为96~98mm,硫酸镁浓度为5~5.2mm;碳酸盐溶液中碳酸氢钠浓度为410~417mm,碳酸氢铵浓度为49~51mm。
30.在所述步骤d)中,所述发酵瓶规格为100ml,称量底物重量为0.2~0.5g。所述培养基添加体积为60ml,接种液添加体积为5ml。所述恒温培养箱温度为39℃,发酵时间为36h。
31.在所述步骤e)中,所述冰浴时间为30~40min;离心机为低温高速离心机,离心条件为10000~12000rmp,4℃,离心10min。
32.所述步骤(4)中,f)发酵过程中试验组发酵产气量的测定:利用压力传感器和注射器分别在发酵2,12,16,20,24,36h测定产气量;根据指数函数模型对累计产气量数据进行非线性拟合;
33.g)短链脂肪酸的测定:向步骤e)获取的上清液中加入偏磷酸,静置,离心后取上清液,用滤膜过滤后,加入上样瓶,使用气相色谱测定短链脂肪酸含量;
34.h)干物质发酵率的测定:发酵结束后,将发酵瓶中所有物质转移至已知绝干重的滤纸上,滤纸置于布氏漏斗中进行抽滤;用乙醇溶液和丙酮清洗;将滤纸及残渣转至鼓风干燥箱内烘干,计算干物质发酵率。
35.优选地,在所述步骤f)中,所述压力传感器型号为suay30(量程0~200kpa),所述注射器规格为20~50l;所述拟合模型为:
36.gpt=a/(1+(c/t)b)
37.agpr=(a
×
b)/(4
×
c)
38.式中,gpt为累计产气量(ml/g),a为理论最大产气量(ml/g dm),b为产气曲线峰度,c为达到最大产气量1/2时的时间(h),agpr产气量达到最大产气量1/2时的产气速率(ml/h)。
39.在所述步骤g)中,所用偏磷酸浓度为25%(w/v),上清液与偏磷酸的比例为8:2~9:1(v/v);静置时间为1~1.5h,静置后离心条件为12000~14000rmp,4℃,离心10~15min;滤膜为水系膜,孔径为0.22~0.45μm;上样瓶为棕色或透明玻璃瓶,规格为1.5ml;加入上样瓶的待测溶液体积为0.5~1ml。
40.在所述步骤h)中,滤纸为定性滤纸,孔径为30~50μm;乙醇溶液浓度为95%,丙酮纯度为99.5%,使用体积为20~25ml,清洗次数为1~2次;在105℃恒温鼓风干燥箱中烘至恒重,在干燥器中冷却后称重,计算干物质发酵率。
41.进一步地,所述步骤(4)还包括,以对照组为基准进行校正,作为评估纤维发酵性能的指标。
42.在所述步骤g)中,测定对照组和试验组发酵液中短链脂肪酸含量后,以对照组中短链脂肪酸含量的均值为基准,试验组中短链脂肪酸含量减去基准值作为校正后的纤维底物发酵后短链脂肪酸的净生成量。公式如下:
43.scfa=scfa1–
scfa044.式中,scfa为纤维底物发酵后短链脂肪酸的净产量,mmol/g;scfa1为对照组中短链脂肪酸的产量,mmol/g;scfa0为空白对照组中短链脂肪酸的产量,mmol/g。
45.在所述步骤h)中,称量对照组和试验组绝干后残渣及滤纸重量后,以对照组绝干重的均值为基准,试验组绝干重减去基准值作为校正后的纤维底物发酵后残渣的重量。公式如下:
46.m2=m1–
m247.m3=m
3-m448.ivdmf(%)=1
–
(m2–
m3)/m1×
100%;
49.式中:ivdmf为干物质发酵率;m1为发酵样品干物质重量,g;m2为试验组发酵后残渣
rdna测序,确定最优混合粪便,然后接种物制备。优化培养基制备。将发酵底物、接种物和培养基混合,进行体外发酵,然后进行scfa产量测定、产气动力学测定和干物质发酵率测定。
64.实施例1:最优混合粪便的确定
65.1.试验材料
66.选用60头体重相近、日龄一致和饲养管理一致的三元商品猪(体重50~60kg),上午猪采食后排出的粪便立即收集到充满co2的无菌收集袋中,赶出其中气体后,密封,-80℃冻存。生长猪饲喂满足nrc(2012)生长猪营养需要量的玉米-豆粕型饲粮,自由采食、饮水。
67.发酵底物收集自生长猪回肠末端食糜,选取高纤维含量的2个带壳稻谷饲粮(分别为早稻和晚稻)饲喂安装回肠瘘管的三元生长猪,每个饲粮饲喂5头猪,收集期内,每天上午饲喂后开始收集,连续收集8h,隔天重复收集一次。回肠食糜冻干、粉碎后,过40目标准筛;将采食同一饲粮的猪回肠食糜等量混合作为发酵底物,进行体外发酵。
68.2.试验设计
69.采用单因素随机设计,分别以3,5,10,20头猪的粪便混合制备成混合粪便,以单头猪的粪便为对照,共5个处理组,每个处理5个重复,分析微生物组成及丰度,阐明不同数量粪便混合对其微生物组成及丰度变异的影响。同时,5个处理组的粪便制备成对应的粪便接种液,进行3个批次的体外发酵,阐明不同数量粪便混合制备接种物对发酵结果变异的影响。综合以上两个方面,确定最优混合粪便。
70.3.粪便微生物组成分析方法
71.微生物16s rdna测序由上海美吉生物医药科技有限公司(上海,中国)完成。按照e.z.n.a.soil试剂盒(omega bio-tek,norcross,ga,u.s.)说明书从粪便样品中提取微生物群落基因组dna,用1%琼脂糖凝胶检测提取的dna质量,用nanodrop2000分光光度计测定dna数量(thermo fisher scientific,waltham,ma,usa)。提取的基因组dna a260:a280的比例为1.8~2.0,dna浓度为20~300ng/μl,则满足后续测序的要求。利用abi geneamp 9700pcr热循环仪(abi,ca,usa)对16s rrna基因的v3-v4高变区进行pcr扩增,引物序列为338f(5
’‑
gtgccagcmgccgcgg-3’)和806r(5
’‑
ccgtcaattcmtttragttt-3’)。pcr扩增通过thermocycler pcr system(geneamp9700,abi,usa)进行。每个样本2个重复,将同一个样本的pcr产物混合后,pcr产物从2%琼脂糖凝胶中提取。根据axyprep dna凝胶提取试剂盒(axygen biosciences,union city,ca,usa)制造商说明书进行纯化,并使用quantus荧光计(promega corporation,madison,wi,usa)进行定量。在基于majorbio-pharm技术(中国上海)的illumina miseq平台上对pcr扩增产物进行测序。原始16s rrna基因序列使用fastp(版本0.20.0)去噪、质检,使用flash(版本1.2.7)拼接。使用的uparse软件(version 7.1http://drive5.com/uparse/),根据97%的相似度对序列进行otu聚类,并在聚类的过程中去除单序列和嵌合体。利用rdp classifier(http://rdp.cme.msu.edu/)对每条序列进行物种分类注释,比对silva数据库(ssu123),设置比对阈值为0.7。
72.α多样性指标(sobs指数,shannon指数和chao1指数)以及β多样性指标(基于bray-curtis距离和anosim检验的主坐标分析,pcoa)在美吉生物云平台(www.i-sanger.com)进行统计分析。
73.4.体外发酵过程
74.发酵底物预处理:将回肠末端食糜用万能粉碎机粉碎20~40s,过40目标准筛,然
后将粉碎后的样品装在自封袋中,-20℃储存备用;
75.粪便混合处理及其微生物16s rdna高通量测序:选择品种为杜
×
大
×
长三元商品猪(体重50~60kg)60头,饲粮为满足nrc(2012)生长猪营养需要量的玉米-豆粕型饲粮;粪便采集时间为9:00~11:00,猪排出粪便后应立即收取至无菌密封袋,并赶出空气,密封。在无菌厌氧操作箱中,将上述采集的粪便分别制备成3个粪便的混合粪便,5个粪便的混合粪便,10个粪便的混合粪便,20个粪便的混合粪便,并以单一粪便为对照,共5组粪便;粪便处理过程通过持续充入co2气体维持厌氧环境,需在1h内操作完成。将上述5组分别进行微生物16s rdna高通量测序。
76.接种液制备:待进行体外发酵时,将上述5组混合粪便用磷酸盐缓冲液(ph 6.8~7.0)以1:5(w/v)比例稀释,并用水浴恒温振荡器在39℃条件下进行水浴震荡30min,使其充分混合(使纤维相关菌悬浮于液体)。在无菌厌氧操作箱中用5层无菌纱布和250μm孔径标准筛进行过滤,滤液即为接种液,分别为接种液1~5。
77.培养基的配制:培养基中包含0.1~0.12ml微量元素溶液,230~237ml磷酸盐溶液,230~237ml碳酸盐溶液,用去离子水定容至1l;通入co2气体30~40min,使溶解达到无氧状态,ph6.8~7.0;121℃,灭菌10min。其中,微量元素溶液中二水合氯化钙浓度为85~90mm,四水合氯化锰浓度为48~51mm,六水合氯化钴浓度为3.8~4mm,六水合氯化铁浓度为30~32mm;磷酸盐溶液中磷酸氢二钠浓度为100~102mm,磷酸二氢钾浓度为96~98mm,硫酸镁浓度为5~5.2mm;碳酸盐溶液中碳酸氢钠浓度为410~417mm,碳酸氢铵浓度为49~51mm。
78.体外发酵:称量0.2g回肠末端食糜装入到体积为100ml的发酵瓶中,以不添加任何底物的空白发酵瓶为对照组。将所有发酵瓶放至厌氧操作箱中,向厌氧操作箱持续通入co2气体。向发酵瓶中加入60ml培养基和5ml接种液。将发酵瓶移入恒温培养箱中发酵36h。
79.产气动力学测定:利用压力传感器(suay30)和50ml注射器分别在发酵2,12,16,20,24,36小时测定产气量。测定时先观察压力传感器上显示的环境压力,将压力传感器上的针头与注射器上的针头同时插入橡胶塞,此时压力传感器显示的气压值因为感受到的压力变化而升高。使用注射器抽取发酵瓶内的气体,当气压值恢复至初始值(即环境压力)时,读取注射器刻度,流入注射器中的气体体积即为发酵产气量。随后将压力传感器上的针头与注射器上的针头同时拔出橡胶塞。
80.根据产气时间t(h)和累计产气量gpt(ml/g),参照groot等(1996)提出的指数函数模型对累计产气量数据进行非线性拟合,拟合公式如下:
81.gpt=a/(1+(c/t)b)
82.agpr=(a
×
b)/(4
×
c)
83.式中:gpt为累计产气量(ml/g);a为理论最大产气量(ml/g);b为产气曲线峰度常数;c为达到最大产气量1/2时的时间(h);agpr产气量达到最大产气量1/2时的产气速率(ml/h)。
84.短链脂肪酸含量测定:体外发酵36h后,冰水浴终止发酵。将发酵液离心,取1.6ml上清液于2ml离心管中,加0.4ml 25%(w/v)偏磷酸溶液,静置30min。12000rpm,4℃,离心10min;取上清过0.45μm滤膜至1.5ml上样瓶中,使用气相色谱测定短链脂肪酸浓度。
85.体外干物质发酵率测定:体外发酵结束后,将体外发酵残渣全部转移至已绝干称重的定性滤纸(孔径30~50μm),基于布氏漏斗进行抽滤,然后用乙醇(95%,20ml)和丙酮
(99.5%,20ml)清洗。最后将抽滤后的残渣和滤纸置于105℃烘箱中烘干至恒重,计算体外发酵干物质发酵率(ivdmf)。公式如下:
86.ivdmf(%)=1
–
(m2–
m3)/m1×
100%;
87.式中:ivdmf为干物质发酵率(%);m1为饲料样品干物质重量(g);m2为残渣干物质重量(g);m3为空白中残渣干物质重量(g)。
88.5.不同个体猪粪便微生物组成差异及混合粪便对其差异的影响
89.猪粪便菌群α多样性差异统计表明,随着混合粪便数量的提高,sobs指数显著提高(图2a),ace指数在数值上也逐渐升高(图2b),simpson指数间没有显著差异(图2c)。同时,随着混合粪便数量的提高,多样性指数的变异程度(sd)降低。
90.猪粪便微生物β多样性分析见图3。基于unweighted unifrac算法在out水平对5个处理的粪便微生物组成进行了pcoa分析,结果表明5个处理组粪便微生物组成没有明显区分(p=0.493),但随着粪便混合数量的增加,组内微生物组成距离缩小,当5头猪及以上粪便混合后,组间微生物距离缩小的程度降低。
91.粪便菌群结构分析中,来源于不同猪个体的粪便,混合数量对其菌群结构在门水平上的影响见图4a。结果表明,粪便中微生物主要由firmicutes(厚壁菌门)、bacteroidetes(拟杆菌门)、spirochaetota(螺旋体门)、actinobacteria(放线菌门)和proteobacteria(变形菌门)组成,共占菌群组成的98.5%以上。组间差异分析显示,微生物在各组间没有显著差异(p》0.05)。但是,随着粪便混合数量的提高,处理组内微生物丰度的差异降低(误差线减小)。粪便混合数量对其菌群结构在科水平上的影响见图4b。结果表明,粪便中相对丰度前10微生物有firmicutes(厚壁菌门)中的lactobacillaceae(乳杆菌科),streptococcaceae(链球菌科),lachnospiraceae(毛螺菌科),peptostreptococcaceae(消化链球菌科),oscillospiraceae(颤螺菌科),clostridiaceae(梭菌科),ruminococcaceae(瘤胃球菌科),组成,bacteroidetes(拟杆菌门)中的prevotellaceae(普雷沃氏菌科),muribaculaceae(muri菌科)组成和spirochaetota(螺旋体门)中的spirochaetaceae(螺旋体科)组成。组间差异分析显示,微生物在各组间没有显著差异(p》0.05)。但是,随着粪便混合数量的提高,处理组内微生物丰度的差异降低。
92.以上表明:混合粪便能够减少样本间微生物的差异及丰度的变异;混合5头猪粪便,样本间微生物组成的差异明显减小,超过5头猪粪便混合后,样本间微生物组成差异不再明显减小,且丰度的变异也趋于稳定,说明菌群可能达到一个稳定的状态。
93.6.接种物对产气动力学参数、scfa产量及其变异系数的影响
94.接种物粪便混合数量对产气动力学参数、scfa产量的影响见表1-1。对于产气动力学参数,2种底物发酵,接种物对产气曲线峰度(b)无显著影响(p》0.05),而对最大产气量(ml/g)(a)、达到最大产气量1/2时的时间(h)(c)和产气量达到最大产气量1/2时的产气速率(ml/h)(agpr)均有显著影响(p《0.05)。两种底物发酵,接种物3进行体外发酵,产气参数c,agpr显著低于接种物1,而a显著高于接种物1,与其他各组无显著差异。对于发酵液短链脂肪酸产量,接种物对乙酸、丙酸、丁酸和bcfa(支链脂肪酸)均有显著影响(p《0.05),除乙酸外,接种物3产生的短链脂肪酸含量最高。早稻饲粮食糜体外发酵,接种物3发酵产生乙酸含量低于接种物1,高于接种物4和5(p《0.05),产生丙酸含量和接种物4无差异(p》0.05)而高于其他3组(p《0.05),产生丁酸和bcfa量和接种物4、5无显著差异(p》0.05)而高于接种物
1(p《0.05)。晚稻饲粮食糜体外发酵,接种物3产生的乙酸含量与1、2组无显著差异,高于3、4组,产生的丙酸、bcfa含量与2、4、5组均无差异而高于1组,产生的丁酸含量与1、2、4组均无显著差异而高于5组。随着接种物粪便混合数量的提高,批次间和总变异系数明显降低(表1-2)
95.以上结果显示,接种物粪便来源于5头猪以上,产气动力学参数和scfa谱的差异较小,且发酵结果变异系数明显降低,特别是批次间变异系数明显减小。表明,体外发酵技术中,接种液制备所需的接种物至少需要来源于5头猪及以上的混合粪便,能够降低发酵结果的变异,提高其重复性。
96.综合粪便微生物丰度变异及发酵结果变异的结果,确定最优混合粪便为5~10头猪的粪便进行等质量混合。
97.表1-1不同接种物处理下,体外发酵后发酵动力学参数和短链脂肪酸产量的差异
[0098][0099]
注:同行数据后所标字母相异表示差异显著(p《0.05),所标字母相同表示差异不显著(p》0.05)。a最大产气量(ml/g),b产气曲线峰度,c达到最大产气量1/2时的时间(h),agpr产气量达到最大产气量1/2时的产气速率(ml/h),ivmdf体外干物质发酵率,bcfa,支链脂肪酸(异丁酸+异戊酸+戊酸)。下表同。
[0100]
表1-2不同接种物处理下,体外发酵后发酵动力学参数和短链脂肪酸产量的变异系数
[0101]
[0102][0103]
实施例2:基于仿生消化与体外发酵评估纤维原料的发酵特性
[0104]
1.试验材料
[0105]
根据饲粮纤维水平选取2个全大麦饲粮(分别为法国大麦和澳洲大麦)及其对应的猪回肠末端食糜和仿生消化残渣作为试验材料。猪回肠末端食糜由动物试验获取,将每个饲粮饲喂5头瘘管猪(杜
×
长
×
大,30~50kg),收集回肠末端食糜;仿生消化残渣有仿生消化装置获取,将每个饲粮经体外仿生消化后,收集消化残渣。收集的回肠食糜和仿生消化残渣冻干后,分别以饲粮为单元等量混合,粉碎后过40目标准筛作为发酵底物。采用单因素试验设计,分别以高纤维饲粮以及采食该饲粮获取的猪回肠末端食糜和仿生消化技术获取预消化残渣为底物,探讨预消化的必要性以及消化残渣与回肠食糜发酵的相似性。
[0106]
2.仿生预消化过程
[0107]
原料的预处理:分别取200g上述2个全大麦饲粮,用万能粉碎机粉碎,过40目标准筛,然后将粉碎后的样品装在自封袋中后,-20℃储存备用;
[0108]
胃缓冲液的制备:配制盐酸的浓度为10mmol/l,氯化钠的浓度为88.6mmol/l,氯化钾的浓度为6.6mmol/l的混合溶液2000ml,用2mol/l的盐酸在39℃下调节溶液的ph至2.0。
[0109]
小肠缓冲液的制备:配制磷酸氢二钠浓度为29.3mmol/l,磷酸二氢钠浓度为170.7mmol/l,氯化钠浓度为98.8mmol/l,氯化钾浓度为16.4mmol/l的混合溶液2000ml。用2mol/l的盐酸或2mol/l的氢氧化钠在39℃下调节溶液的ph至6.44。
[0110]
胃模拟消化液液:根据胃蛋白酶活性的测定方法,测定试剂中胃蛋白酶的活性。称取223ku的胃蛋白酶溶解于250ml胃缓冲液,胃模拟消化液中胃蛋白酶活性浓度为892u/ml。
[0111]
浓缩模拟小肠液的制备:根据α-淀粉酶、胰蛋白酶、糜蛋白酶活性的测定方法,测定试剂级淀粉酶、胰蛋白酶、糜蛋白酶中相应消化酶的活性。配制的浓缩模拟小肠液中α-淀粉酶浓度为2436u/ml,胰蛋白酶浓度为760u/ml,糜蛋白酶浓度为95u/ml。
[0112]
上样:称取饲料样品2g装入程控猪仿生消化装置的模拟消化器的透析管内,加入20ml胃模拟消化液。
[0113]
胃模拟消化:将试剂瓶中的胃缓冲液泵入到模拟消化器的透析管外再回到胃缓冲液试剂瓶中往复循环,通过回旋震荡提供胃模拟消化液与饲料样品的混合动力,进行胃的模拟消化。消化结束后排出模拟消化器中的胃缓冲液,泵入去离子水清洗胃模拟消化阶段残留在透析管中的水解产物;清洗结束后排出模拟消化器中的清洗液;
[0114]
所述胃缓冲液用量为200ml/模拟消化器。消化温度为39℃;饲料样品与胃模拟消化液混合后的回旋震荡频率为180rmp;流经模拟消化器的缓冲液流速为60ml/min;胃的模拟消化时间为4h;胃模拟消化结束后清洗一次消化产物的清洗液量为300ml去离子水/模拟消化器,清洗时间为40min,清洗1次;
[0115]
小肠模拟消化:将小肠缓冲液泵入到所述模拟消化器的透析管外再回到小肠缓冲液试剂瓶中往复循环,在透析管中溶液的ph值变为小肠缓冲液的ph值后,往透析管内注入浓缩小肠模拟消化液,开始小肠的模拟消化;消化结束后排出模拟消化器中的缓冲液;泵入去离子水清洗整个模拟消化阶段残留在透析管中的水解产物;清洗结束后排出模拟消化器中的清洗液;反复进行多次,以便彻底清洗干净;
[0116]
所述小肠缓冲液用量为200ml/模拟消化器;消化温度为39℃;样品与浓缩模拟小肠液混合后的回旋震荡频率为180rmp;流经模拟消化器的缓冲液流速为60ml/min;小肠模拟消化8h。整个模拟消化结束后清洗一次消化产物的清洗液量为300ml去离子水/模拟消化器,每次清洗2h,重复清洗6次。
[0117]
未消化残渣的处理:将上述清洗后透析管内剩余的残渣转移到培养皿中,在65℃恒温鼓风干燥箱中干燥。无水乙醇冲洗后,再次65℃恒温鼓风干燥箱中干燥,将残渣混合,粉碎后作为发酵底物。
[0118]
3、体外发酵过程
[0119]
同实施例1
[0120]
4、饲粮、食糜和预消化残渣体外发酵scfa产量的差异
[0121]
如表2-1所示,大麦饲粮1与回肠食糜和消化残渣体外发酵产生scfa浓度有显著差异(p《0.05)。其中,饲粮发酵产生的总scfa,乙酸和丙酸低于食糜和消化残渣,而丁酸高于食糜和消化残渣。食糜和消化残渣体外发酵产生的乙酸,丙酸和总scfa无显著的差异,而食糜产生的丁酸浓度低于消化残渣。
[0122]
大麦饲粮2及其食糜和与消化残渣体外发酵的规律相似于大麦饲粮1及其食糜和与消化残渣。饲粮发酵产生的总scfa,乙酸和丙酸低于食糜和消化残渣,而食糜和消化残渣
体外发酵产生的乙酸,丙酸和总scfa无显著的差异。消化残渣发酵产生的丁酸最高,食糜发酵产生的丁酸最低。
[0123]
综上,食糜与预消化残渣体外发酵产生的scfa浓度接近,均显著高于饲粮发酵产生的scfa。表明,预消化是必要的且仿生预消化获取的消化残渣发酵特性一定程度上能代表体内获得的回肠食糜的发酵特性。这为纤维饲粮发酵特性的快速评价提供简单、有效的方法。
[0124]
表2-1饲粮、食糜和预消化残渣体外发酵scfa产量的差异
[0125][0126]
上述是本发明的较佳实施例及其所运用的技术原理,对于本领域的技术人员来说,在不背离本发明的精神和范围的情况下,任何基于本发明技术方案基础上的等效变换、简单替换等显而易见的改变,均属于本发明保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1