抑制饮食性肥胖的药物及其所用多肽
1.本发明涉及抑制饮食性肥胖的多肽及其应用。
背景技术:
2.肥胖的定义是身体质量指数(bmi)≥30kg/m2,自1975年以来全球肥胖患者已经增加了近两倍。据估计,2014年有超过19亿成年人是超重的,其中超过6亿人属于肥胖患者。现在,肥胖正成为一种全球流行病,有着极高的可发展为非传染性疾病(包括2型糖尿病(t2d)、心血管疾病、中风、癌症和抑郁症等)的高风险。人们已经制定了各种策略来对抗肥胖和超重,主要是通过减少能量摄入和增加代谢消耗这两种途径。
3.小肽是一类很有前途的分子,它们极具吸引力的药理特性以及卓越的安全性、耐受性和有效性,使其在医学和生物技术方面的应用越来越受到关注。目前市场上已开发出多种预防肥胖的肽,如神经肽y受体拮抗剂、胰高血糖素样肽-1(glp-1)、心房利钠肽和脑利钠肽、ghrelin11等。然而,除了它们都是注射剂外,上述这些肽的长度超过20个氨基酸,因此不太可能逃脱蛋白酶的降解。然而,小分子也有一些缺点:在器官中积累以及产生有毒的代谢产物等等,继而导致副作用的产生。因此,需要进一步的研究,寻找或修饰更多的内源性肽类,这些肽类要小得多,缺乏累积毒性,用于治疗肥胖。
技术实现要素:
4.本发明所要解决的技术问题是如何制备预防和/或治疗饮食性肥胖的药物,和/或如何制备饮食性肥胖抑制剂。
5.为了解决以上技术问题,本发明提供一系列多肽或其药用盐或其衍生物,所述多肽可统称为hd,为9肽,其氨基酸序列公式如下(n端至c端):
6.hd序列公式:x1tx2yx3rtgr;
7.其中,字母t代表苏氨酸(thr),字母y代表酪氨酸(tyr),字母r代表精氨酸(arg),字母g代表甘氨酸(gly);x1可以是甘氨酸(gly,g)和精氨酸(arg,r)中的一种;x2可以是精氨酸(arg,r)和半胱氨酸(cys,c)中的一种;x3可以是赖氨酸(lys,k)和半胱氨酸(cys,c)中的一种。
8.所述hd,具体氨基酸序列为如下中的任一:
9.d1:rtrykrtgr(如序列表中序列1所示);
10.d2:gtcykrtgr(如序列表中序列2所示);
11.d3:rtrycrtgr(如序列表中序列3所示);
12.d5:rtcykrtgr(如序列表中序列4所示);
13.d7:gtcycrtgr(如序列表中序列5所示);
14.d8:gtrykrtgr(如序列表中序列6所示);
15.d9:rtcycrtgr(如序列表中序列7所示);
16.d10:gtrycrtgr(如序列表中序列8所示)。
17.优选所述hd为d3:rtrycrtgr(如序列表中序列3所示)。
18.所述衍生物可为在所述多肽的氨基端连接氨基端保护基和/或所述多肽的羧基端连接羧基端保护基得到的连接物。所述氨基端保护基可为乙酰基、氨基、马来酰基、琥珀酰基、叔丁氧羰基或苄氧或其他疏水基团或大分子载体基团中的任一基团;所述羧基端保护基可为氨基、酰胺基、羧基、或叔丁氧羰基或其他疏水基团或大分子载体基团中的任一基团。
19.本发明还涉及一种编码上述多肽或其药用盐的核酸分子。所述核酸分子指任何根据公认的三联密码子翻译后编码含有上述多肽或其药用盐的核酸分子。
20.其中,所述核酸分子可以是dna,如cdna、基因组dna或重组dna;所述核酸分子也可以是rna,如mrna或hnrna等。
21.本发明还提供所述的多肽或其药用盐或其衍生物、或所述的核酸分子在制备预防和/或治疗动物肥胖的药物中的应用。
22.本发明提供了所述的多肽或其药用盐或其衍生物、或所述的核酸分子在制备动物肥胖抑制剂中的应用。
23.本发明提供了所述的多肽或其药用盐或其衍生物、或所述的核酸分子在制备抑制动物体重增长药物中的应用。
24.本发明提供了所述的多肽或其药用盐或其衍生物、或所述的核酸分子在制备抑制动物皮下和内脏脂肪沉淀药物中的应用。
25.本发明提供了所述的多肽或其药用盐或其衍生物、或所述的核酸分子在制备抑制动物食欲的药物中的应用。
26.本发明提供了所述的多肽或其药用盐或其衍生物、或所述的核酸分子在制备调整动物肠道共生菌群的药物中的应用。
27.本发明提供了所述的多肽或其药用盐或其衍生物、或所述的核酸分子在制备提高动物肠道共生菌艾克曼氏菌(akkermansia muciniphila)丰度的药物中的应用。
28.上述应用中,所述动物为哺乳动物,可为啮齿类动物(例如小鼠、大鼠等)、灵长类动物(例如猕猴、人等)等。
29.上述应用中,所述肥胖可为饮食性肥胖。
30.上述应用中,所述药物或所述抑制剂,可只为上述多肽,也可还含有载体或赋形剂。
31.这里的载体材料包括但不限于水溶性载体材料(如聚乙二醇、聚乙烯吡咯烷酮、有机酸等)、难溶性载体材料(如乙基纤维素、胆固醇硬脂酸酯等)、肠溶性载体材料(如醋酸纤维素酞酸酯和羧甲乙纤维素等)。其中具体的是水溶性载体材料。使用这些材料可以制成多种剂型,包括但不限于片剂、胶囊、滴丸、气雾剂、丸剂、粉剂、溶液剂、混悬剂、乳剂、颗粒剂、脂质体、透皮剂、口含片、栓剂、冻干粉针剂等。可以是普通制剂、缓释制剂、控释制剂及各种微粒给药系统。为了将单位给药剂型制成片剂,可以广泛使用本领域公知的各种载体。关于载体的例子是,例如稀释剂与吸收剂,如淀粉、糊精、硫酸钙、乳糖、甘露醇、蔗糖、氯化钠、葡萄糖、尿素、碳酸钙、白陶土、微晶纤维素、硅酸铝等;湿润剂与粘合剂,如水、甘油、聚乙二醇、乙醇、丙醇、淀粉浆、糊精、糖浆、蜂蜜、葡萄糖溶液、阿拉伯胶浆、明胶浆、羧甲基纤维素钠、紫胶、甲基纤维素、磷酸钾、聚乙烯吡咯烷酮等;崩解剂,例如干燥淀粉、海藻酸盐、琼脂
dibenzylethylene-diamine),氯普鲁卡因(chloroprocaine),二乙醇氨(diethanolamine),普鲁卡因(procaine),二乙胺(diethylamine),哌嗪(piperazine),三羟甲基氨基甲烷(tris(hydroxymethyl)aminomethane)和羟化四甲铵(tetramethylammonium hydroxide)等所形成。这些盐可以采用标准方法制备,例如通过游离酸与有机或无机碱的反应。在一个碱性基团如氨基存在的情况下,酸性盐如氢氯化物(hydrochloride)、氢溴化物(hydrobromide)、醋酸盐(acetate)、扑酸盐(pamoate)等等可用作剂型;在一个酸性基团(如-cooh)或醇基存在的情况下,可药用的酯如醋酸酯(acetate)、马来酸酯(maleate)、三甲基乙酸氯甲酯(pivaloyloxymethyl)等、以及文献中公知的用于改善可溶性和水解性的酯可以用作持续释放和前体药制剂。
33.本发明筛选了一系列名可统称为hd的高疏水性9肽(序列表序列1),其中d1-d10中除d4和d6以外均符合hd公式。动物实验结果表明,hd可以通过降低食欲明显抑制肥胖的形成,降低肥胖。口服hd约10周可使饮食诱导的肥胖(dio)动物体重降低10%以上,并进一步改善胰岛素/瘦素抵抗,提高肠道共生菌艾克曼氏菌(a.muciniphila)的丰度。
附图说明
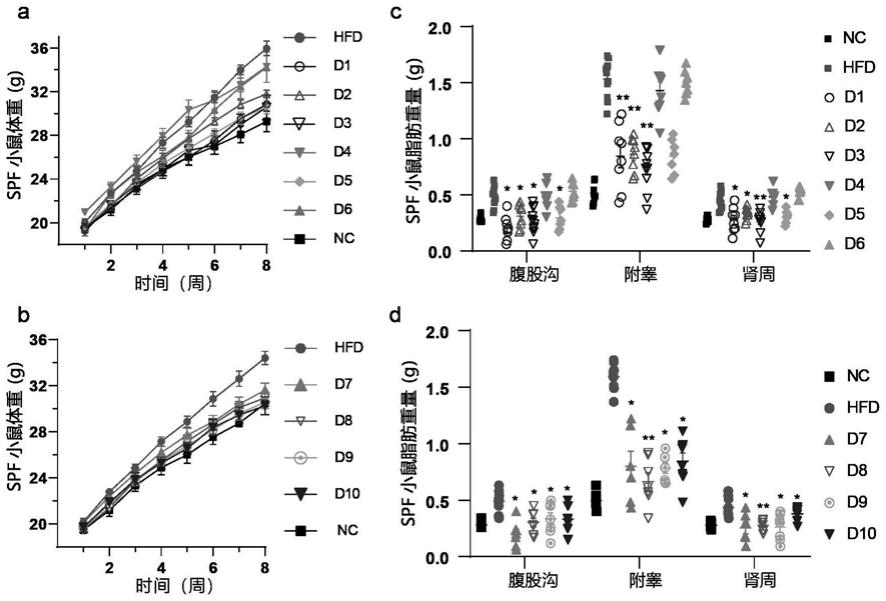
34.图1为本发明实施例1中小鼠饲喂实验结果。其中,图1的a和b图为spf小鼠不同序列饲喂处理的体重结果图;图1的c图和图1的d图为spf小鼠不同饲喂处理的不同部位脂肪重量结果图。图中所示数据为平均值
±
标准差,重复数为9-12,以wilcoxon test分析各组显著性差异,*代表显著性分析结果为p<0.05,**代表显著性分析结果为p《0.01。
35.图2的为本发明实施例1中spf小鼠采食量结果图。图2的a图和图2的b图为spf小鼠不同饲喂处理的采食量监测图;图2的c图和图2的d图为spf小鼠短期采食量测定结果图。图中所示数据为平均值
±
标准差,重复数为9-12,以wilcoxon test分析各组显著性差异,*代表显著性分析结果为p<0.05,**代表显著性分析结果为p《0.01,***代表显著性分析结果为p《0.001。
36.图3为本发明实施例1中spf小鼠饲喂d3处理8周后的体型照片。
37.图4为本发明实施例1中qpcr检测艾克曼氏菌(a.muciniphila)丰度的结果图。
38.图5为本发明实施例1中gf小鼠肠道菌群验证实验结果图。图5的a图为gf小鼠在饲喂d3处理的体重结果图;图5的b图为gf小鼠不同饲喂处理的不同部位脂肪重量结果图;图5的c图为gf小鼠不同饲喂处理的采食量监测图。图中所示数据为平均值
±
标准差,重复数为5-8,以wilcoxon test分析各组显著性差异,*代表显著性分析结果为p<0.05,**代表显著性分析结果为p《0.01。
39.图6为本发明实施例1中d3对小鼠的肠道菌群影响结果图。其中,图4的a图为多样性分析结果图;图4的b图为pcoa分析结果图;图4的c图为lefsc分析结果图,图2的d图为qpcr检测艾克曼氏菌(a.muciniphila)丰度的结果图,图中*代表显著性分析结果为p<0.05。
40.图7为本发明实施例2中d3对大鼠和恒河猴的使用效果图。图7的a图为大鼠实验取样时间点示意图;图7的b图为大鼠不同饲喂处理的体重增长率结果图;图7的c图为大鼠短期采食量测定结果图;图7的d图为不同饲喂处理大鼠肠道艾克曼氏菌(a.muciniphila)丰度qpcr检测结果图;图7的e图为恒河猴实验取样时间点示意图;图3的7图为恒河猴不同饲
喂处理的体重增长率结果图;图7的g图为恒河猴不同饲喂处理的采食量监测图;图7的h图为不同饲喂处理恒河猴肠道艾克曼氏菌(a.muciniphila)丰度qpcr检测结果图。图中所示数据为平均值
±
标准差,重复数为5-10,以wilcoxon test分析各组显著性差异,*代表显著性分析结果为p<0.05,**代表显著性分析结果为p《0.01。
具体实施方式
41.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
42.下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均为常规生化试剂,可从商业途径得到。
43.1小肽
44.发明人筛选了一系列名可统称为hd的高疏水性9肽,氨基酸序列公式如下(n端至c端):
45.hd:x1tx2yx3rtgr
46.其中,字母t代表苏氨酸(thr),字母y代表酪氨酸(tyr),字母r代表精氨酸(arg),字母g代表甘氨酸(gly);x1可以是甘氨酸(gly,g)和精氨酸(arg,r)中的一种;x2可以是精氨酸(arg,r)和半胱氨酸(cys,c)中的一种;x3可以是赖氨酸(lys,k)和半胱氨酸(cys,c)中的一种。
47.符合hd公式的9肽共8种,具体氨基酸序列如下:
48.d1:rtrykrtgr(如序列表中序列1所示);
49.d2:gtcykrtgr(如序列表中序列2所示);
50.d3:rtrycrtgr(如序列表中序列3所示);
51.d5:rtcykrtgr(如序列表中序列4所示);
52.d7:gtcycrtgr(如序列表中序列5所示);
53.d8:gtrykrtgr(如序列表中序列6所示);
54.d9:rtcycrtgr(如序列表中序列7所示);
55.d10:gtrycrtgr(如序列表中序列8所示)。
56.另外以两条不符合上述公式的相似9肽作为对照,具体氨基酸如下:
57.d4:atcyrrtgr
58.d6:atrycrtgr
59.下述实施例中所有的多肽均由公司合成,所合成多肽的纯度均大于95%。
60.2实验动物
61.c57/bl6j小鼠为标准品系,系斯贝福生物技术有限公司(北京,中国)产品。
62.无菌(gf)c57bl/6小鼠系中国重庆陆军医科大学实验动物科学系产品。
63.sprague dawley(sd)大鼠为标准品系,系斯贝福生物技术有限公司(北京,中国)产品。
64.恒河猴为标准品系,为北京中科灵瑞生物技术股份有限公司产品。
65.3饲料
66.#2150230401标准饲料为北京中科灵瑞生物技术股份有限公司产品,主要成分为:玉米、豆粕、面粉、鱼粉、油脂、食盐、磷酸氢钙、石粉、多种维生素、多种矿物质元素、氨基酸等。饲喂量为0.15kg/天/只
67.高脂日粮(45kcal%fat)由如下原料混合而成:豆粕300g、红皮鸡蛋250g(折合干物质55.5g)、玉米面150g、小麦面150g、全脂奶粉100g、白糖100g、猪油160g、食盐3g、碳酸钙2.5g(或葡萄酸钙8g)、酵母粉适量、泡打粉适量。总能量4646.4千卡、脂肪供能2107、8千卡、蛋白质供能797.6千卡、碳水化合物供能1713.2千卡,脂肪供能占45.3%。
68.下述实施例中的所有数据均采用wilcoxon test进行显著性分析。
69.下述实施例中的定量试验,如无特别说明,均设置三次重复实验,结果取平均值。
70.实施例1小鼠实验
71.1、spf小鼠实验
72.spf小鼠实验采用c57/bl6j小鼠,开始实验时c57/bl6j小鼠为4周龄,每只体重15
±
1g,在适宜控制温度和湿度的房间中饲养,光照/黑暗循环12小时,自由饮食饮水,饲喂标准实验室饲料(又名生长与繁殖饲料,货号spfslfz003,斯贝福(北京)实验动物科技有限公司产品),适应一周后,被随机分配到笼中,每笼4-6只。
73.1.1spf小鼠饲喂实验
74.共设置12个处理,每个处理2笼c57/bl6j小鼠,各处理进行不同的饲喂处理,具体如下:
75.nc组(即正常日粮组):饲喂标准实验室饲料(又名生长与繁殖饲料,spfslfz003),自由饮食饮水,每只每天灌胃0.2ml溶剂,持续8周。
76.hfd组(即高脂日粮组):饲喂高脂日粮,所用高脂日粮为啮齿动物饲料(含60%脂肪,d12492,配方参考文献le roy,t.,et al.dysosmobacter welbionis is a newly isolated human commensal bacterium preventing diet-induced obesity and metabolic disorders in mice.gut(2021).),自由饮食饮水,每只每天灌胃0.2ml溶剂,持续8周。
77.d1组(即高脂日粮+d1灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d1灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
78.d2组(即高脂日粮+d2灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d2灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
79.d3组(即高脂日粮+d3灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d3灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
80.d4组(即高脂日粮+d4灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d4灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
81.d5组(即高脂日粮+d5灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d5灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
82.d6组(即高脂日粮+d6灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d6灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
83.d7组(即高脂日粮+d7灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d7灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
84.d8组(即高脂日粮+d8灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d8灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
85.d9组(即高脂日粮+d9灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d9灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
86.d10组(即高脂日粮+d10灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d10灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
87.每周跟踪采食量,实验结束后称量小鼠体重,拍小鼠体型对比照片,之后用颈椎脱位法处死小鼠。取心、肝、脾、肺、肾、血、回肠、盲肠、结肠,立即置于液氮中,-80℃保存以备进一步分析。精确地解剖和称重皮下和内脏脂肪沉积。
88.小鼠体重结果见图1的a图和图1的b图:与hfd组相比,d1-d10组处理8周后spf小鼠的体重均下降,且除了d4(下降3.55%)和d6(下降3.78%)以外均呈现显著下降,具体d1组下降11.62%、d2组下降9.45%、d3组下降12.06%、d5组下降11.8%、d7组下降8.08%、d8组下降10.07%、d9组下降11.09%、d10组下降11.06%。
89.小鼠体型差距明显,药物特别是d3组处理8周后的小鼠体型小于hfd组(见图3)。
90.称重皮下以及内脏脂肪的结果见图1的c图和图1的d图,发现无论是在腹股沟皮下、附睾还是肾周脂肪,hd组(即d1组、d2组、d3组、d5组、d7组、d8组、d9组、d10组)显著低于hfd组,但略高于nc组。
91.每周跟踪统计采食量的结果见图2的a图和图2的b图,发现3-4周后hd组和对照hfd组采食量逐渐呈现显著的差距,以上说明hd(d1、d2、d3、d5、d7、d8、d9和d10)可能通过抑制小鼠食欲来发挥抑制肥胖形成的作用,特别是d3作用更为显著,而d4和d6没有显著效果。
92.1.2 spf小鼠短期采食量实验
93.共设置2个处理,每个处理1笼c57/bl6j小鼠,所用高脂日粮为啮齿动物饲料(含60千卡%脂肪,d12492),各处理进行不同的饲喂处理,具体如下:
94.hfd组(即高脂日粮组):饲喂高脂日粮。
95.d1组(即高脂日粮+d1灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d1灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
96.d2组(即高脂日粮+d2灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d2灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
97.d3组(即高脂日粮+d3灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d3灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
98.d4组(即高脂日粮+d4灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d4灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
99.d5组(即高脂日粮+d5灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d5灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
100.d6组(即高脂日粮+d6灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d6灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
101.d7组(即高脂日粮+d7灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d7灌胃,0.75mg-3mg/kg体重,0.2ml,1次/天,持续8周。
102.d8组(即高脂日粮+d8灌胃组):饲喂高脂日粮,自由饮食饮水。以合成的d8灌胃,
obesity through brown adipose tissue activation.gut 69,1239-1247(2020).)分析小鼠粪便菌群。spf小鼠粪便菌群的分析结果见图6:多样性分析(图6的a图)以及pcoa(图6的b图)发现d3处理之后的小鼠粪便菌群与hfd组有显著差异,lefsc分析(图6的c图)d3组中与肥胖呈负相关的拟杆菌和艾克曼氏菌(a.muciniphila)丰度显著提高,相反的是普氏菌门(prevotella)、脱硫弧菌门(desulfovibrio)和劳森氏菌(lawsonia)丰度显著下降,而这些细菌均已被证实可以促进肥胖的发生。同时,用qpcr验证发现d3处理后的小鼠肠道菌艾克曼氏菌(a.muciniphila)相对丰度显著提高(p《0.05)。
118.3、spf小鼠肠道中a.muciniphila丰度变化
119.为验证饲喂其它hd的小鼠肠道菌艾克曼氏菌(a.muciniphila)相对丰度的变化,进行小鼠肠道菌群变化的qpcr测定实验。
120.将前期spf小鼠实验中收集到的nc、hfd、d1、d2、d3、d5、d7、d8、d9和d10组的小鼠粪便提取粪便细菌dna后,利用qpcr方法测定a.muciniphila相对丰度。结果见图4,表明hd(d1、d2、d3、d5、d7、d8、d9和d10)处理后的小鼠肠道菌艾克曼氏菌(a.muciniphila)相对丰度均显著提高(p《0.05)。
121.实施例2大鼠实验和恒河猴实验
122.1、大鼠实验
123.1.1饲喂实验
124.大鼠实验采用sprague dawley(sd)大鼠,开始实验时大鼠为4周龄,每只体重137
±
5g,在适宜控制温度和湿度的房间中饲养,光照/黑暗循环12小时,自由饮食饮水,饲喂标准实验室饲料(生长与繁殖饲料,spfslfz003),适应一周后,被随机分配到笼中。hd处理以d3为代表,共设置3个处理,各处理进行不同的饲喂处理,具体如下(见图7的a图):
125.nc组(即正常日粮组):8只大鼠,饲喂标准实验室饲料(又名生长与繁殖饲料,spfslfz003),自由饮食饮水,持续10周。
126.hfd组(即高脂日粮组):8只大鼠,饲喂高脂日粮,所用高脂日粮为啮齿动物饲料(含60千卡%脂肪,d12492),自由饮食饮水,持续10周。
127.d3组(即高脂日粮+d3药物灌胃组):10只大鼠,饲喂高脂日粮,自由饮食饮水。hd(选用d3)灌胃0.5mg-2mg/kg体重,0.5ml,1次/天,持续10周。
128.每周监测体重。采集上述动物的新鲜排泄物并在-80℃下储存以供进一步采用扩增子测序方法分析实验结束后,安乐死处死大鼠。
129.结果见图3:d3处理10周后,处理组大鼠体重显著低于hfd组,体重增长率下降了8.96
±
3.11%(图7的b图)。hd处理后的猕猴肠道中的艾克曼氏菌(a.muciniphila)相对丰度显著提高(p《0.05)(图7的d图)
130.1.2大鼠短期采食量实验
131.共设置2个处理,每个处理5只大鼠,各处理进行不同的饲喂处理,具体如下:
132.hfd组(即高脂日粮组):8只大鼠,饲喂高脂日粮,所用高脂日粮为啮齿动物饲料(含60千卡%脂肪,d12492),自由饮食饮水,持续8周。
133.d3组(即高脂日粮+d3药物灌胃组):10只大鼠,饲喂高脂日粮,自由饮食饮水。hd(选用d3)灌胃0.5mg-2mg/kg体重,0.5ml,1次/天,持续8周。
134.按照以上的处理进行8周后在1周的时间内,大鼠被饥饿一天后给予饲料,记录接
下里的一天内动物的采食量。也即每隔一天记录食物重量(4次单独测量),并确定每2天时间内每天的平均摄入量,并在一周测量期间为每个个体计算平均摄入量。得到的即使短期采食量统计结果(单位:g/只/天)。
135.结果见图7的c图,表明d3组大鼠每天的采食量显著低于hfd组(p《0.05)。
136.2、猕猴实验
137.猕猴实验采用恒河猴,一共9只,开始实验时为18周龄,每只体重2.5
±
0.5kg,被单独安置在同一个环境中,在适宜控制温度和湿度的房间中饲养,光照/黑暗循环12小时,自由饮食饮水,饲喂标准实验室饲料(#2150230401),适应7天后,被随机分配为3组,每组3只,各组进行不同的饲喂处理,具体如下(见图7的e图):
138.nc组(即正常日粮组):饲喂标准实验室饲料(#2150230401),自由饮食饮水,持续6周。
139.hfd组(即高脂日粮组):饲喂高脂日粮(45kcal%fat),自由饮食饮水,持续6周。
140.d3组(即高脂日粮+d3药物灌胃组):饲喂高脂日粮(45kcal%fat)自由饮食饮水,持续6周。hd药物选用d3,d3灌胃0.5mg-1mg/kg体重,按照1.7ml/kg体重灌胃,1次/天。
141.每周监测食物摄入量(单位:g/只/周)和体重。采集上述动物的新鲜排泄物并在-80℃下储存以供进一步分析猕猴粪便菌群(方法同上)。
142.结果见图7:6周后d3处理组体重增长率显著下降(图7的f图),同时采食量结果类似但不显著(图7的g图)。另外,d3处理后的猕猴肠道中的艾克曼氏菌(a.muciniphila)相对丰度显著提高(p《0.05)(图7的h图)。
143.综上,9肽hd使实验动物体重增长率降低,皮下和内脏脂肪沉积减少,另通过d3的验证推测hd系列肽可以通过降低食欲明显抑制小鼠、大鼠和恒河猴等实验动物饮食性肥胖症的发生发展,hd处理后实验动物的肠道共生菌艾克曼氏菌(a.muciniphila)丰度显著提高。而不符合本公式的两条肽d4和d6没有上述效果。
144.以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1