希瓦氏菌株中葡萄糖代谢通路的构建方法
1.本发明属于基因工程和生物代谢技术领域,更具体的说是一种可以使希瓦氏菌以葡萄糖为唯一碳源进行生长代谢的菌株构建方法。
背景技术:
2.基因工程(genetic engineering)又称基因拼接技术和dna重组技术,是以分子遗传学为理论基础,以分子生物学和微生物学的现代方法为手段,将不同来源的基因按预先设计的蓝图,在体外构建杂种dna分子,然后导入活细胞,使外源基因能在受体细胞内复制、转录、翻译表达的操作,以改变生物原有的遗传特性、获得新品种、生产新产品。
3.葡萄糖(glucose)(化学式c6h
12
o6),简称为葡糖。化学名称:2,3,4,5,6-五羟基己醛,是自然界分布最广且最为重要的一种单糖,它是一种多羟基醛。纯净的葡萄糖为无色晶体,易溶于水,微溶于乙醇,不溶于乙醚。葡萄糖在生物学领域具有重要地位,植物可通过光合作用产生葡萄糖,是活细胞的能量来源和新陈代谢中间产物,即生物的主要供能物质。葡萄糖进入红细胞是协助扩散进入细胞内的,进入其他细胞的过程则是主动运输,均需要载体蛋白的参与。进入细胞内的葡萄糖经过emp途径
→
三羧酸循环
→
呼吸链完全氧化为二氧化碳和水,并从中产生能量。
4.希瓦氏菌(shewanella oneidensis)属是一种兼性厌氧菌,遗传背景清楚,且易于操作。模式产电微生物-奥奈达希瓦氏菌(shewanella oneidensis mr-1简称mr-1)是希瓦氏菌属中在基因组序列注释和遗传特性方面研究最广泛的菌株。该菌株能够在不添加外源媒介的情况下,将电子转移到微生物燃料电池中的阳极,成为研究微生物如何在mfc中产生电流的模型生物之一。野生型希瓦氏菌一般以乳酸为底物进行生长代谢,不能利用葡萄糖、木糖等糖类,使得菌种可利用底物谱过窄,胞外电子传递效率较低。
5.emp途径(embden-meyerhofpathway)是指在无氧条件下,葡萄糖被分解成丙酮酸,同时释放出少量atp的过程。大致可分为两个阶段:第一阶段只是生成两分子的主要中间代谢产物3-磷酸-甘油醛。第二阶段发生氧化还原反应,释放能量合成的atp,同时形成两分子的丙酮酸。通过emp途径,每氧化一个分子的葡萄糖净得两分子atp,为生物的生命活动提供能量和物质准备。ed途径又称2-酮-3-脱氧-6-磷酸葡糖酸(kdpg)途径。这是存在于某些缺乏完整emp途径的严格需氧细菌中的一种降解葡萄糖的替代途径,为微生物所特有。特点是葡萄糖只经过4步反应即可快速获得由emp途径须经10步反应才能形成的丙酮酸。这条途径的关键是2-酮-3-脱氧-6-磷酸葡萄糖酸的裂解,即分解为3-磷酸甘油醛和丙酮酸。3-磷酸甘油醛可进入emp途径转变成丙酮酸。(特征性酶:kdpg醛缩酶)
6.本发明公开了一种可以使希瓦氏菌以葡萄糖为唯一碳源进行生长代谢的菌株构建方法,旨在通过异源表达技术,结合基因工程等手段,构建13种可用重组质粒,将葡萄糖利用代谢的关键基因引入mr-1中,从“葡萄糖跨膜转运模块合成生物学改造及优化”和“葡萄糖转运模块结合ed模块增强葡萄糖代谢”两个模块来重构希瓦氏菌株的代谢通路,使工程希瓦氏菌能够在以葡萄糖为唯一碳源的改良m9液体培养基中进行生长代谢,从而拓宽希
瓦氏菌的可用底物谱。
技术实现要素:
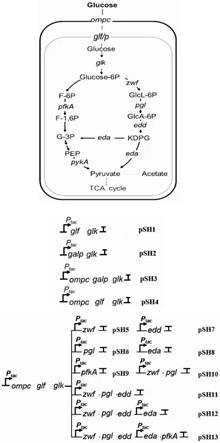
7.本发明旨在通过异源表达技术,结合基因工程等手段,将“葡萄糖跨膜转运模块合成生物学改造及优化”(ompc,galp,glf,glk)和“葡萄糖转运模块结合ed模块增强葡萄糖代谢”(zwf,pgl, edd,eda,pfka,pyka)两个模块的关键基因,通过biobrick的构建策略进行整合,构建重组质粒,并导入野生型shewanella oneidensis mr-1中,重构希瓦氏菌的代谢通路,使其能够以葡萄糖为唯一碳源进行生长代谢,从而拓宽希瓦氏菌的可用底物谱。
8.本发明的技术方案概述如下:
9.希瓦氏菌株中葡萄糖代谢通路的构建方法;将葡萄糖跨膜转运模块合成生物学改造及优化的基因ompc、galp、glf或/和glk;葡萄糖转运模块结合ed模块增强葡萄糖代谢基因zwf、pgl、 edd、eda、pfka或/和pyka;将两个模块的关键基因,通过biobrick的构建策略进行整合,构建重组质粒,并导入野生型shewanella oneidensis mr-1中,重构希瓦氏菌的代谢通路,以葡萄糖为唯一碳源进行生长代谢。
10.所述的构建方法;两个模块的关键基因连接到载体质粒pyydt上形成重组质粒,再引入 s.oneidensis mr-1中,得到13种含有重组质粒并能进行葡萄糖代谢和利用的工程希瓦氏菌株。
11.所述的构建方法;基因ompc优化后的核苷酸序列如seq id no.1所示;基因galp优化后的核苷酸序列如seq id no.2所示;基因glf优化后的核苷酸序列如seq id no.3所示;基因glk优化后的核苷酸序列如seq id no.4所示;基因zwf优化后的核苷酸序列如seq id no.5 所示;基因pgl优化后的核苷酸序列如seq id no.6所示;基因edd优化后的核苷酸序列如 seq id no.7所示;基因eda优化后的核苷酸序列如seq id no.8所示;基因pfka优化后的核苷酸序列如seq id no.9所示;基因pyka优化后的核苷酸序列如seq id no.10所示。
12.所述的构建方法;载体质粒pyydt核苷酸序列如seq id no.11所示。
13.所述的构建方法;将经过密码子优化后的基因通过ptac启动子和t1终止子完成表达,采用biobrick的构建策略,利用spei与xbai酶是同尾酶,经过处理后留下相同的粘性末端,在t4连接酶的作用下将所需要的外源基因逐个连接到基础质粒上。
14.本发明构建13种含有重组质粒并能进行葡萄糖代谢和利用的工程希瓦氏菌株如下:模块一:葡萄糖跨膜转运模块合成生物学改造及优化
15.①
psh1(pyydt-glf-glk);
16.②
psh2(pyydt-galp-glk);
17.③
psh3(pyydt-ompc-galp-glk);
18.④
psh4(pyydt-ompc-glf-glk);
19.模块二:葡萄糖转运模块结合ed模块增强葡萄糖代谢
20.⑤
psh5(pyydt-ompc-glf-glk-zwf);
21.⑥
psh6(pyydt-ompc-glf-glk-pgl);
22.⑦
psh7(pyydt-ompc-glf-glk-edd);
23.⑧
psh8(pyydt-ompc-glf-glk-eda);
24.⑨
psh9(pyydt-ompc-glf-glk-pfka);
和sbfi酶对pyydt质粒进行酶切;再通过t4连接酶进行连接,构建含有基因ompc的重组质粒pyydt-ompc。
45.用xbai和sbfi酶对基因glf进行酶切(核苷酸序列为seq id no.3),用spei和sbfi 酶对刚构建的含有基因ompc的重组质粒pyydt-ompc进行酶切,经过t4连接酶后,构建含有基因ompc,glf的重组质粒pyydt-ompc-glf。
46.用xbai和sbfi酶对基因glk进行酶切(核苷酸序列为seq id no.4),用spei和sbfi 酶对刚构建的含有基因ompc,glf的重组质粒pyydt-ompc-glf进行酶切,经过t4连接酶后,最终获得含有ompc,glf,glk三个目的基因的重组质粒:psh4(pyydt-ompc-glf-glk),
47.同样按照上述模块一重组质粒的构建方法,完成对模块二:葡萄糖转运模块结合ed 模块增强葡萄糖代谢的重组质粒构建:
48.⑤
psh5(pyydt-ompc-glf-glk-zwf);
49.用xbai和sbfi酶对模块一已经构建的重组质粒pyydt-ompc-glf-glk用spei和sbfi酶对进行酶切;用xbai和sbfi酶对目的基因zwf进行酶切(核苷酸序列为seq id no.5),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,zwf四个目的基因的重组质粒:psh5 (pyydt-ompc-glf-glk-zwf)。
50.⑥
psh6(pyydt-ompc-glf-glk-pgl)
51.用xbai和sbfi酶对模块一已经构建的重组质粒pyydt-ompc-glf-glk用spei和sbfi酶对进行酶切;用xbai和sbfi酶对目的基因pgl进行酶切(核苷酸序列为seq id no.6),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,pgl四个目的基因的重组质粒:psh6 (pyydt-ompc-glf-glk-pgl)。
52.⑦
psh7(pyydt-ompc-glf-glk-edd)
53.用xbai和sbfi酶对模块一已经构建的重组质粒pyydt-ompc-glf-glk用spei和sbfi酶对进行酶切;用xbai和sbfi酶对目的基因edd进行酶切(核苷酸序列为seq id no.7),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,edd四个目的基因的重组质粒:psh7 (pyydt-ompc-glf-glk-edd)。
54.⑧
psh8(pyydt-ompc-glf-glk-eda)
55.用xbai和sbfi酶对模块一已经构建的重组质粒pyydt-ompc-glf-glk用spei和sbfi酶对进行酶切;用xbai和sbfi酶对目的基因eda进行酶切(核苷酸序列为seq id no.8),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,eda四个目的基因的重组质粒:psh8 (pyydt-ompc-glf-glk-eda)。
56.⑨
psh9(pyydt-ompc-glf-glk-pfka)
57.用xbai和sbfi酶对模块一已经构建的重组质粒pyydt-ompc-glf-glk用spei和sbfi酶对进行酶切;用xbai和sbfi酶对目的基因pfka进行酶切(核苷酸序列为seq id no.9),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,pfka四个目的基因的重组质粒:psh9 (pyydt-ompc-glf-glk-pfka)。
58.⑩
psh10(pyydt-ompc-glf-glk-zwf-pgl)
59.用xbai和sbfi酶对模块二已经构建的重组质粒pyydt-ompc-glf-glk-zwf用spei和sbfi 酶对进行酶切;用xbai和sbfi酶对目的基因pgl进行酶切(核苷酸序列为seq id no.6),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,zwf,pgl五个目的基因的重
组质粒:psh10(pyydt-ompc-glf-glk-zwf-pgl)。
60.psh11(pyydt-ompc-glf-glk-zwf-pgl-edd)
61.用xbai和sbfi酶对模块二已经构建的重组质粒pyydt-ompc-glf-glk-zwf-pgl用spei和 sbfi酶对进行酶切;用xbai和sbfi酶对目的基因edd进行酶切(核苷酸序列为seq id no.7),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,zwf,pgl,edd六个目的基因的重组质粒:psh11(pyydt-ompc-glf-glk-zwf-pgl-edd)。
62.psh12(pyydt-ompc-glf-glk-zwf-pgl-edd-eda)
63.用xbai和sbfi酶对模块二已经构建的重组质粒pyydt-ompc-glf-glk-zwf-pgl-edd用spei 和sbfi酶对进行酶切;用xbai和sbfi酶对目的基因eda进行酶切(核苷酸序列为seq id no.8),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,zwf,pgl,edd,eda七个目的基因的重组质粒:psh12(pyydt-ompc-glf-glk-zwf-pgl-edd-eda)。
64.psh13(pyydt-ompc-glf-glk-zwf-pgl-edd-eda-pyka)
65.用xbai和sbfi酶对模块二已经构建的重组质粒pyydt-ompc-glf-glk-zwf-pgl-edd-eda用 spei和sbfi酶对进行酶切;用xbai和sbfi酶对目的基因pyka进行酶切(核苷酸序列为seq idno.10),再通过t4连接酶进行连接,最终获得含有ompc,glf,glk,zwf,pgl,edd,eda, pyka八个目的基因的重组质粒:psh13(pyydt-ompc-glf-glk-zwf-pgl-edd-eda-pyka)。
66.对应的质粒图谱分别如图1(2)-(14)所示。按照上述步骤方法,完成质粒的构建连接,最终得到了13种重组质粒。
67.本发明方法得到的代谢重组希瓦氏菌株用于在以葡萄糖为唯一碳源的改良后m9液体培养基中进行有氧发酵,并测定发酵液中的生物量和糖代谢量。
68.本发明方法得到的代谢重组希瓦氏菌株用于在以葡萄糖为唯一碳源的改良后m9液体培养基中进行厌氧发酵,并测定发酵液中的生物量和糖代谢量。
69.克服现有技术的不足,提供了一种可以使希瓦氏菌以葡萄糖为唯一碳源进行生长代谢的菌株构建方法。主要技术方案是利用异源表达技术,结合基因工程等手段,构建重组质粒,将促进葡萄糖摄取进入细胞(葡萄糖跨膜转运模块:ompc,galp,glf,glk)到促进胞内代谢(优化 ed途径:zwf,pgl,edd,eda,pfka,pyka)两个模块的关键基因引入shewanella oneidensis mr-1 菌中,重构s.oneidensis mr-1的代谢通路,使工程希瓦氏菌能够在以葡萄糖为唯一碳源的改良后m9液体培养基中进行生长代谢,从而拓宽希瓦氏菌的可用底物谱。将改造菌株进行有氧和厌氧发酵,并测定其在3g/l葡萄糖为唯一碳源的改良m9液体培养基中的生长曲线及残糖量。
70.在模块一中,数据显示,无论是有氧还是厌氧发酵,导入空质粒的对照菌株wt几乎不摄取代谢葡萄糖;构建的工程菌株能摄取一定量的葡萄糖,菌株psh3:pyydt-ompc-glf-glk的有氧和厌氧发酵生物量较对照菌株wt均相对较高,且摄取利用的葡萄糖量更多。psh3有氧发酵12h后到达生长平台期,生物量(od
600
=0.51333)是wt(od
600
=0.21467)的2.4倍,培养基中的葡萄糖在8h后几乎耗尽;psh3的厌氧发酵8h后到达生长平台期,生物量 (od
600
=0.19967)是wt(od
600
=0.12833)的约1.6倍,培养基中最终消耗了约45%的葡萄糖。因此我们得到“葡萄糖跨膜转运模块合成生物学改造”优化后工程菌株psh3:pyydt-ompc-glf-glk。
71.在模块二中,数据显示,在模块一优化后工程菌株psh3:pyydt-ompc-glf-glk的基础上继续进行改造的菌株,无论是有氧还是厌氧发酵,导入空质粒的对照菌株wt和工程菌psh9 几乎不摄取代谢葡萄糖;构建的其他8株工程菌株psh5,psh6,psh7,psh8,psh10,psh11, psh12,psh13均能摄取一定量的葡萄糖,其中菌株psh11:pyydt-ompc-glf-glk-zwf-pgl-edd 在3g/l葡萄糖为唯一碳源的改良m9液体培养基中的有氧和厌氧发酵生物量均相对较高,且摄取利用的葡萄糖量最多。psh11有氧发酵24h后到达生长平台期,生物量(od
600
=0.58267) 是wt(od
600
=0.19133)的3倍,培养基中的葡萄糖在16h后几乎耗尽;psh11的厌氧发酵 48h后到达生长平台期,生物量(od
600
=0.22467)是wt(od
600
=0.13300)的约1.7倍,培养基中消耗了约59%的葡萄糖。
72.本发明的效果如下:
73.1、本发明提供了一种可以使希瓦氏菌以葡萄糖为唯一碳源进行生长代谢的菌株构建方法。利用异源表达技术,结合基因工程等手段,从构建重组质粒,将“葡萄糖跨膜转运模块合成生物学改造及优化”和“葡萄糖转运模块结合ed模块增强葡萄糖代谢”两个模块的关键基因引入mr-1中,得到能13株能够进行葡萄糖生长代谢的工程菌株。
74.2、在构建的工程菌株中,psh11有氧发酵24h后到达生长平台期,生物量(od
600
=0.58267) 是wt(od
600
=0.19133)的3倍,培养基中的葡萄糖在16h后几乎耗尽;psh11的厌氧发酵 48h后到达生长平台期,生物量(od
600
=0.22467)是wt(od
600
=0.13300)的约1.7倍,培养基中消耗了约59%的葡萄糖。
75.3、本发明拓宽了模式产电菌mr-1的可用底物谱,为微生物燃料电池底物共利用的设计提供了现实依据,有利于提高菌株的胞外电子传递效率。
附图说明
76.图1:为构建的pyydt和重组质粒图谱及核苷酸序列
77.图2:为本发明基因片段生物砖设计示意图
78.图3:为本发明构建的工程希瓦氏菌葡萄糖代谢设计原理图
79.图4:为本发明工程菌株在有氧条件下,以葡萄糖为唯一碳源的改良后m9培养基中生长及糖耗情况
80.图5:为本发明工程菌株在无氧条件下,以葡萄糖为唯一碳源的改良后m9培养基中生长及糖耗情况
具体实施方式
81.本发明中构建的质粒是本实验室设计,在全合成过程中,需要将发明所需要的各外源基因连接到质粒载体上并保存。下面结合实施例,进一步阐述本发明。
82.首先在kegg上查询所需目的基因序列信息,目的基因包括促进葡萄糖摄取进入细胞 (葡萄糖跨膜转运模块)到促进胞内代谢(优化ed途径)两个模块的关键基因:ompc,galp, glf,glk,zwf,pgl,edd,eda,pfka,pyka(如seq id no.1-10所示);连接到载体质粒pyydt(质粒图谱见图1(1)所示,序列信息如seq id no.11所示),最终得到13个pyydt上连有目的基因的重组质粒,分别命名为:
83.模块一:葡萄糖跨膜转运模块合成生物学改造及优化
84.①
psh1(pyydt-glf-glk);重组质粒psh1图谱如图1(2)所示;
85.②
psh2(pyydt-galp-glk);重组质粒psh2图谱如图1(3)所示;
86.③
psh3(pyydt-ompc-galp-glk);重组质粒psh3图谱如图1(4)所示;
87.④
psh4(pyydt-ompc-glf-glk);重组质粒psh3图谱如图1(5)所示。
88.模块二:葡萄糖转运模块结合ed模块增强葡萄糖代谢
89.⑤
psh5(pyydt-ompc-glf-glk-zwf);重组质粒psh3图谱如图1(6)所示;
90.⑥
psh6(pyydt-ompc-glf-glk-pgl);重组质粒psh3图谱如图1(7)所示;
91.⑦
psh7(pyydt-ompc-glf-glk-edd);重组质粒psh3图谱如图1(8)所示;
92.⑧
psh8(pyydt-ompc-glf-glk-eda);重组质粒psh3图谱如图1(9)所示;
93.⑨
psh9(pyydt-ompc-glf-glk-pfka);重组质粒psh3图谱如图1(10)所示;
94.⑩
psh10(pyydt-ompc-glf-glk-zwf-pgl);重组质粒psh3图谱如图1(11)所示;
95.psh11(pyydt-ompc-glf-glk-zwf-pgl-edd);重组质粒psh3图谱如图1(12)所示;
96.psh12(pyydt-ompc-glf-glk-zwf-pgl-edd-eda);重组质粒psh3图谱如图1(13)所示;
97.psh13(pyydt-ompc-glf-glk-zwf-pgl-edd-eda-pyka);重组质粒psh3图谱如图1(14) 所示。
98.glk:来自大肠杆菌k-12中的葡萄糖激酶基因
99.galp:来自大肠杆菌k-12中的半乳糖转运蛋白基因
100.glf:来自大肠杆菌k-12中的udp-吡喃半乳糖变位酶基因
101.ompc:来自大肠杆菌k-12中的能够提高细胞膜透过性的外膜孔蛋白基因
102.zwf:来自大肠杆菌k-12中的葡萄糖-6-磷酸脱氢酶基因
103.pgl:来自大肠杆菌k-12中的6-磷酸葡萄糖酸内酯酶基因
104.pfka:来自大肠杆菌k-12中的6-磷酸果糖激酶基因
105.edd:来自希瓦氏mr-1中的磷酸葡萄糖酸脱水酶基因
106.eda:来自希瓦氏mr-1中的2-脱氢-3-脱氧磷酸葡萄糖醛酸醛缩酶基因
107.pyka:来自希瓦氏mr-1中的丙酮酸激酶基因
108.本发明将上述经过密码子优化后的基因通过ptac启动子和t1终止子完成表达,采用 biobrick的构建策略,利用spei与xbai酶是同尾酶,经过处理后留下相同的粘性末端,在t4 连接酶的作用下将所需要的外源基因逐个连接到基础质粒上,并且保证已连接的外源基因不受后续内切酶的影响,由此构建重组质粒,从而发挥不同的功能。
109.所选重组质粒扩增的工程菌为营养缺陷型菌株e.coil wm3064,最终宿主工程菌为s. oneidensis mr-1,wm3064的转化方法可采用本领域常规的方法,例如物理转化法。然后接合转移到mr-1菌中,得到构建的工程菌。导入pyydt空质粒的野生型菌株命名为wt,导入其他重组质粒的工程菌株命名为:
110.在上述构建方法中,本发明通过该重组质粒表达所实现的技术效果提出了希瓦氏菌株能够以葡萄糖为唯一碳源进行有氧和厌氧的生长代谢,从而拓宽希瓦氏菌的可用底物谱。
111.实施例1:重组质粒的构建
112.⑴
目的基因的获取和序列优化:
113.首先在kegg上查询所需目的基因序列信息(http://www.kegg.jp/kegg/genes.html),目的基因包括促进葡萄糖摄取进入细胞(葡萄糖跨膜转运模块:ompc,galp,glf,glk)到促进胞内代谢(优化ed途径:zwf,pgl,edd,eda,pfka,pyka)两个模块的关键基因;利用jcat (http://www.jcat.de/)对coding sequence进行密码子优化以及定点突变掉序列中所存在的生物砖酶切位点,选择在shewanella oneidensis mr-1中进行优化,并避免以后实验所需要用到的酶切位点ecori,xbai,spei和psti。
114.⑵
利用biobrick方法,构建重组质粒:
115.得到优化后的序列,在各目的基因片段的5’端添加xbai酶切位点,3’端依次添加spei, sbfi酶切位点,并合成。利用biobrick方法,将上述基因通过酶切连接的方式,构建重组质粒
①
psh1(pyydt-glf-glk)。
116.首先利用xbai和sbfi酶(公知)对基因glf进行酶切(核苷酸序列为seq id no.3),利用spei和sbfi酶(公知)对自带该酶切位点的pyydt质粒(质粒图谱如图1(1)所示,核苷酸序列如seq id no.11所示,参考文献enhancing bidirectional electron transfer ofshewanella oneidensis by a synthetic flavin pathway)进行酶切。由于xbai和spei酶是同尾酶,酶切后会产生相同的粘性末端,再通过t4连接酶进行连接,构建含有基因glf的重组质粒。
117.利用xbai和sbfi酶对基因glk进行酶切(核苷酸序列为seq id no.4),利用spei和 sbfi酶对刚构建的含有基因glf的重组质粒进行酶切,经过t4连接酶后,最终获得含有glf, glk两个目的基因的重组质粒:
①
psh1(pyydt-glf-glk),质粒图谱如图1(2)所示。
118.同样按照上述步骤
⑵
中的方法,完成其它质粒的构建连接,最终得到了13种重组质粒模块一:葡萄糖跨膜转运模块合成生物学改造及优化
119.①
psh1(pyydt-glf-glk),
②
psh2(pyydt-galp-glk),
③
psh3(pyydt-ompc-galp-glk),
④
psh4(pyydt-ompc-glf-glk);
120.模块二:葡萄糖转运模块结合ed模块增强葡萄糖代谢
121.⑤
psh5(pyydt-ompc-glf-glk-zwf),
⑥
psh6(pyydt-ompc-glf-glk-pgl),
⑦
psh7 (pyydt-ompc-glf-glk-edd),
⑧
psh8(pyydt-ompc-glf-glk-eda),
⑨
psh9 (pyydt-ompc-glf-glk-pfka),
⑩
psh10(pyydt-ompc-glf-glk-zwf-pgl),psh11 (pyydt-ompc-glf-glk-zwf-pgl-edd),psh12(pyydt-ompc-glf-glk-zwf-pgl-edd-eda),psh13(pyydt-ompc-glf-glk-zwf-pgl-edd-eda-pyka)。
122.质粒图谱分别如图1(2)-(14)所示。
123.按照上述步骤依次完成重组质粒的构建,构建质粒的生物砖设计原理如图2所示,由于 pyydt作为基础质粒载体含有卡那霉素抗性基因序列,可用于后期工程菌株的定向筛选。
124.实施例2:重组希瓦氏菌株的构建
125.①
转化:将上述得到的重组质粒通过物理转化法导入e.coliwm3064中,用于后续工程希瓦氏菌的构建。
126.从-80℃冰箱取出e.coliwm3064感受态细胞50μl,置于冰盒内自然解冻后加入重组质粒psh33μl,冰上静置30min,42℃热击90s,再冰上静置2-3min,向ep管中加入1ml lb+
glf-glk-pfka);
⑩
psh10(pyydt-ompc-glf-glk-zwf-pgl);psh11 (pyydt-ompc-glf-glk-zwf-pgl-edd);psh12(pyydt-ompc-glf-glk-zwf-pgl-edd-eda);psh13(pyydt-ompc-glf-glk-zwf-pgl-edd-eda-pyka)。
138.如图3所示,为本发明构建的工程希瓦氏菌葡萄糖代谢设计的原理图,从源头开始设计,包括促进葡萄糖摄取进入细胞的葡萄糖跨膜转运模块的合成生物学改造及优化(ompc,galp,glf, glk)到促进胞内代谢(优化ed途径:zwf,pgl,edd,eda,pfka,pyka)的全过程,得到能进行葡萄糖代谢的工程希瓦氏菌。
139.实施例3:希瓦氏工程菌wt,psh1-13在含有浓度为3g/l葡萄糖溶液的改良后m9培养液中发酵培养(包含有氧和厌氧)
140.先将各工程菌株接种(1:100)到lb+kana的液体培养基(5g/l酵母提取物、10g/l胰蛋白胨、10g/lnacl,50mg/ml卡那霉素(kana,1:1000))中活化培养,然后在发酵瓶中进一步进行有氧和厌氧发酵,并加入适量iptg(1m,1:2000)诱导外源基因的表达。每隔2h在超净工作台中取发酵液适量用于检测各菌株的od
600
值并记录;用液相色谱仪检测每次取样发酵液中的残糖含量。选取导入空质粒(pyydt)的野生型菌株wt作为空白对照组,且每株菌做三组平行实验。
141.工程希瓦氏菌葡萄糖代谢生长曲线及残糖测定:
142.1.菌种活化:早上取经过高压蒸汽灭菌的10ml ep管若干,在超净工作台中分别加入3mllb+kana的液体培养基,接菌,30℃,200rpm/min,培养12h。
143.2.一级种子:将活化的各菌液按1%接种至含有100ml lb+kana液体培养基的250ml三角瓶中,30℃,200rpm/min,培养12h。
144.3.二级种子,发酵:测定一级种子液od
600
,并将各菌株调至同一生长状态,按2%接种至含有90ml m9+10ml glucose+100μl kana+50μl iptg液体培养基的250ml三角瓶中, 30℃,200rpm/min进行有氧发酵培养并定时取样4℃保存待用。
145.同时准备一批厌氧环境下菌株的吃糖实验组:取经过高压蒸汽灭菌的10ml ep管若干(白管的溶氧效果差),10ml管内分别加入7885μlm9+1ml glucose+10μlkana+5μl iptg+100 μl菌液+1ml反丁烯二酸(电子受体),放入30℃培养箱中静置,进行厌氧发酵培养并定时取样4℃保存待用。
146.4.测定0-24h发酵液的od
600
,记录数据,并每组预留1ml发酵样液离心取上清液过液相测残糖含量。
147.该实验中,配制30g/l葡萄糖溶液足量,在超净工作台中过0.25μm滤膜,4℃保存待用;配制5
×
m9溶液足量,加dh2o稀释至1
×
m9溶液,经过高压蒸汽灭菌,冷却后4℃保存待用。
148.其中,
[0149]5×
m9母液(1l):2.5gnacl、5g nh4cl、15g kh2po4、30gna2hpo4,灭菌。
[0150]
卡那霉素母液(50mg/ml):0.5g kana粉末,ddh2o定容至10ml,用0.22μm滤膜除菌,分装为1ml/管,-20℃保存。
[0151]
iptg母液(1m):1.9064g iptg、ddh2o定容至8ml,用0.22μm滤膜除菌,分装为1ml/ 管,-20℃保存。
[0152]
工程菌株在有氧(无氧)条件下,以葡萄糖为唯一碳源的改良后m9培养基中生长及
糖耗情况如图4(图5)所示:数据显示,在模块一中,无论是有氧还是厌氧发酵,导入空质粒的对照菌株wt几乎不摄取代谢葡萄糖;构建的工程菌株能摄取一定量的葡萄糖,菌株psh3: pyydt-ompc-glf-glk的有氧和厌氧发酵生物量较对照菌株wt均相对较高,且摄取利用的葡萄糖量更多。psh3有氧发酵12h后到达生长平台期,生物量(od
600
=0.51333)是wt (od
600
=0.21467)的2.4倍,培养基中的葡萄糖在8h后几乎耗尽;psh3的厌氧发酵8h后到达生长平台期,生物量(od
600
=0.19967)是wt(od
600
=0.12833)的约1.6倍,培养基中最终消耗了约45%的葡萄糖。因此我们得到“葡萄糖跨膜转运模块合成生物学改造”优化后的工程菌株psh3:pyydt-ompc-glf-glk。模块二中,在模块一优化后工程菌株psh3: pyydt-ompc-glf-glk的基础上继续进行改造的菌株。无论是有氧还是厌氧发酵,导入空质粒的对照菌株wt和工程菌psh9几乎不摄取代谢葡萄糖;构建的其他8株工程菌株psh5,psh6, psh7,psh8,psh10,psh11,psh12,psh13均能摄取一定量的葡萄糖,其中菌株psh11: pyydt-ompc-glf-glk-zwf-pgl-edd在3g/l葡萄糖为唯一碳源的改良m9液体培养基中的有氧和厌氧发酵生物量均相对较高,且摄取利用的葡萄糖量最多。psh11有氧发酵24h后到达生长平台期,生物量(od
600
=0.58267)是wt(od
600
=0.19133)的3倍,培养基中的葡萄糖在16h 后几乎耗尽;psh11的厌氧发酵48h后到达生长平台期,生物量(od
600
=0.22467)是wt (od
600
=0.13300)的约1.7倍,培养基中消耗了约59%的葡萄糖。
[0153]
所选重组质粒扩增的工程菌为营养缺陷型菌株e.coilwm3064(市售可得,coli geneticstock center http://cgsc.biology.yale.edu/),最终宿主工程菌为s.oneidensis mr-1(市售可得, atcc 700550);以上所用限制性内切酶、dna连接酶和分子生物学试剂从thermo公司购买(http://www.thermoscientificbio.com/fermentas);所用其他生化试剂从生工生物工程(上海) 股份有限公司购买(http://www.sangon.com/)。
[0154]
本发明公开和提出的技术方案,本领域技术人员可通过借鉴本文内容,适当改变条件路线等环节实现,尽管本发明的方法和制备技术已通过较佳实施例子进行了描述,相关技术人员明显能在不脱离本
技术实现要素:
、精神和范围内对本文所述的方法和技术路线进行改动或重新组合,来实现最终的制备技术。特别需要指出的是,所有相类似的替换和改动对本领域技术人员来说是显而易见的,他们都被视为包括在本发明精神、范围和内容中。本发明未尽事宜属于公知技术。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1