基于微孔恒温反应检测肠道RNA病毒核酸的引物组、试剂盒及其应用
基于微孔恒温反应检测肠道rna病毒核酸的引物组、试剂盒及其应用
技术领域
1.本发明属于分子生物技术领域,尤其是涉及一种基于微孔恒温反应检测肠道 rna病毒核酸的引物组、试剂盒及其应用。
背景技术:
2.诺如病毒(norovirus,nv)属于杯状病毒科诺如病毒属,无包膜单股正链的 rna病毒。感染人的诺如病毒包括gⅰ、gⅱ、gⅳ、g
ⅷ
及g
ⅸ
,而最为常见的为gⅰ和gⅱ。诺如病毒是导致儿童急性病毒性腹泻的第2位病原,尚无有效的疫苗。而诺如病毒具有高变异性,对诺如病毒的检测和监测有助于诺如病毒感染的预防和控制。
3.甲型肝炎病毒(hepatitis a virus,hav)属于小核糖核酸科肝病毒属,基因组由一个7.5千碱基的无包膜单股正链rna分子组成。甲型肝炎病毒的传播途径为粪口传播,主要通过摄入受污染的食物或水,或直接在人与人之间传播。与甲型肝炎病毒相关的食物包括牡蛎和蛤蜊、草莓等。对食品、环境、粪便等样品中的hav 检测有助于hav的预防和控制。
4.手足口病是肠道病毒引起的传染病之一,常发于5岁及其以下的儿童,手、足以及口腔等部位出现小疱疹,手足口病通常是因肠道病毒引起。coxa16(ca16) 与ev71感染交替出现成为手足口病的主要病原体。
5.nv、hav、ca16和ev71作为流行性肠道病毒,对健康造成了威胁,及时检测出环境、食品或者传播源中的病原体,有助于防控工作。
6.目前常用的检测病毒方法除了耗时长、步骤复杂的分离和培养法外,核酸检测成为主流检测方法。常见的核酸检测方法有pcr或其相关衍生技术,比如多重 pcr,巢式pcr,荧光定量pcr。pcr或其相关衍生技术,都涉及升温降温过程,对扩增设备的要求较高,并且在高通量实验时,所有引物组的tm值均要相近才能达到高效得扩增,无论是对仪器设备还是引物设计均有较高的要求。近年来各种恒温扩增技术不断得发展起来。常见的恒温扩增有滚环核酸扩增、环介导等温扩增、链替代扩增、聚合酶螺旋扩增、依赖核酸序列扩增和解链酶扩增等,恒温扩增产物产量大,对反应极其敏感。与恒温技术相结合的微流控最近几年开始成为微生物检测的主流,其中以(loop-mediated isothermal amplification,lamp)这种恒温扩增技术与微流控技术相结合的较为常见。但由于lamp引物设计复杂,每个靶标引物数量多,容易产生引物二聚体而使本底荧光值过高,容易产生假阳性结果。
技术实现要素:
7.本发明的目的在于提供基于微孔恒温反应检测肠道rna病毒核酸的引物组、试剂盒及其应用。
8.基于本发明的技术方案,可以同时检测诺如病毒gⅰ/gⅱ(norovirus,nv)、甲型肝炎病毒(hapatitis a virus,hav)、ca16、ev71这4种肠道rna病毒核酸。
9.本发明提供的技术方案应对rna病毒变异具有很高的兼容性,使用微孔反应高效
又节约成本,恒温反应使操作更简单,可以在基层现场就能进行4种肠道rna 病毒检测。
10.本发明的目的可以通过以下技术方案来实现:
11.本发明第一方面,提供用于检测肠道rna病毒核酸的引物组,选自用于检测诺如病毒gⅰ(nv gι)、诺如病毒gⅱ(nv gⅱ)、甲型肝炎病毒(hapatitis a virus,hav)、ca16或ev71的引物组中的一组或几组;
12.其中,用于检测诺如病毒gⅰ的引物组包括检测引物ft-ι和bt-ι,ft-ι的核苷酸序列如seq id no.1所示,bt-ι的核苷酸序列如seq id no.2所示;
13.用于检测诺如病毒gⅱ的引物组包括检测引物ft-π和bt-π,ft-π的核苷酸序列如seq id no.5所示,bt-π的核苷酸序列如seq id no.6所示;
14.用于检测甲型肝炎病毒的引物组包括检测引物ft-h和bt-h,ft-h的核苷酸序列如seq id no.9所示,bt-h的核苷酸序列如seq id no.10所示;
15.用于检测ca16的引物组包括检测引物ft-c和bt-c,ft-c的核苷酸序列如seq id no.13所示,bt-c的核苷酸序列如seq id no.14所示;
16.用于检测ev71的引物组包括检测引物ft-e和bt-e,ft-e的核苷酸序列如seqid no.17所示,bt-e的核苷酸序列如seq id no.18所示。
17.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的引物组,除了包括用于检测诺如病毒gⅰ、诺如病毒gⅱ、甲型肝炎病毒(hapatitis avirus,hav)、 ca16或ev71的引物组中的一组或几组作为基本检测引物以外,还包括加速引物。
18.具体的,用于检测诺如病毒gⅰ的引物组还包括加速引物为if
‑ⅰ
和ib
‑ⅰ
, if
‑ⅰ
的核苷酸序列如seq id no.3所示,ib
‑ⅰ
的核苷酸序列如seq id no.4所示;
19.用于检测诺如病毒gⅱ的引物组还包括加速引物为if
‑ⅱ
和ib
‑ⅱ
,if
‑ⅱ
的核苷酸序列如seq id no.7所示,ib
‑ⅱ
的核苷酸序列如seq id no.8所示;
20.用于检测甲型肝炎病毒的引物组还包括加速引物为if-h和ib-h,if-h的核苷酸序列如seq id no.11所示,ib-h的核苷酸序列如seq id no.12所示;
21.用于检测ca16的引物组还包括加速引物为if-c和ib-c,if-c的核苷酸序列如 seq id no.15所示,ib-c的核苷酸序列如seq id no.16所示;
22.用于检测ev71的引物组还包括加速引物为if-e和ib-e,if-e的核苷酸序列如 seq id no.19所示,ib-e的核苷酸序列如seq id no.20所示。
23.具体地,
24.ft-ι,seq id no.1:
25.ctgccaatgccatttgcctgaaacccagcatgatgcagac
26.bt-ι,seq id no.2:
27.aagtccgtttaccgtaaccgtctggggatcttccaaaggtca
28.if-ι,seq id no.3:tgggggacggaagtgtcag
29.ib-ι,seq id no.4:acacccgtctggctcccaa
30.ft
‑ⅱ
,seq id no.5:
31.cgtcactcgacgccatcttcatcagatctgagcacgtggga
32.bt
‑ⅱ
,seq id no.6:
33.tacttctaccgcagctcactgcatagcggcaccaacaacg
34.if
‑ⅱ
,seq id no.7:gccagattgcgatcaccc
35.ib
‑ⅱ
,seq id no.8:gtcccagaggtcaacaatgagg
36.ft-h,seq id no.9:
37.gacagtcaatccactcaatgcatcgagttgttaagacaaaaaccatt
38.bt-h,seq id no.10:
39.ctacgtaactcacctaactgacagcctctcacagaatcccatt
40.if-h,seq id no.11:tcagtcctccggcgttg
41.ib-h,seq id no.12:gacctctctgtgcttggggc
42.ft-c,seq id no.13:
43.agtgctggtacaacaccagtgcactacctacagctgcyaaya
44.bt-c,seq id no.14:
45.cgtgaccacaacatggtcgtgatgtctcttgcgtggartgrt
46.if-c,seq id no.15:ctaatctgtgactacttgcctcag
47.ib-c,seq id no.16:attgagactagatgtgtgttgaacc
48.ft-e,seq id no.17:
49.gccctgacgtgcttcattctcagactgtggggacywcyaa
50.bt-e,seq id no.18:
51.actcttacttcgtgcagtcccggcaccagttggcttaatrgd
52.if-e,seq id no.19:ctaaccactaaagggtacttggac
53.ib-e,seq id no.20:ctacctattcaaagccaacccaaat
54.本发明第二方面,提供用于检测肠道rna病毒核酸的的试剂盒,包括有检测诺如病毒gⅰ(nv gⅰ)、诺如病毒gⅱ(nv gⅱ)、甲型肝炎病毒(hapatitis avirus,hav)、ca16或ev71的引物组中的一组或几组。
55.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的的试剂盒,除了包括有检测诺如病毒gⅰ(nv gⅰ)、诺如病毒gⅱ(nv gⅱ)、甲型肝炎病毒 (hapatitis a virus,hav)、ca16或ev71的引物组中的一组或几组以外,还包括有检测诺如病毒gⅰ(nv gⅰ)、诺如病毒gⅱ(nv gⅱ)、甲型肝炎病毒 (hapatitis a virus,hav)、ca16或ev71的加速引物。
56.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒,包括以下组分:反应试剂混合液、微孔板、阳性对照、阴性对照和微孔板封膜;所述微孔板的孔中分别包埋用于检测诺如病毒gⅰ(nv gⅰ)、诺如病毒gⅱ(nv gⅱ)、甲型肝炎病毒(hapatitis a virus,hav)、ca16或ev71的引物组。
57.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒,包括以下组分:反应试剂混合液、微孔板、阳性对照、阴性对照和微孔板封膜;所述微孔板的孔中分别包埋用于检测诺如病毒gⅰ(nv gⅰ)、诺如病毒gⅱ(nv gⅱ)、甲型肝炎病毒(hapatitis a virus,hav)、ca16或ev71的引物组。
58.在本发明的一个实施方式中,所述微孔板里进行引物包埋:孔1-5分别包埋:诺如病毒gⅰ(nv gⅰ)、诺如病毒gⅱ(nv gⅱ)、甲型肝炎病毒(hapatitis avirus,hav)、ca16、ev71的靶标引物组,所述诺如病毒gⅰ的引物组靶标为 seq id no:1-seq id no:4所示序列的引物;所述诺如病毒gⅱ的引物组靶标为seq id no:5-seq id no:8所示序列的引物;所
述hav的引物组靶标为seqid no:9-seq id no:12所示序列的引物;所述ca16的引物组靶标为seq id no: 13-seq id no:16所示序列的引物;所述的ev71引物组靶标为seq id no: 17-seq id no:20所示序列的引物。
59.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,检测引物ft与检测引物bt的浓度均为40μm,加速引物if和ib的浓度为10μm,配置引物使用浓度为10%海藻糖去离子水进行稀释,稀释后的每组引物按照比例进行混合。
60.在本发明的一个实施方式中,优选的,所述反应试剂混合液包含有bst dna 聚合酶、聚合酶逆转录酶、dntps、荧光染料、mgso4、反应缓冲液。使用逆转录酶、bst dna聚合酶混合使用,可以使逆转录酶对rna病毒转录成dna的同时, bst dna聚合酶进行扩增反应。
61.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,所述反应试剂混合液包括如下组分:
62.a、10
×
isothermal amplification buffer,100mm的mgso4,10mm dntp mix,
63.b、bst dna聚合酶,逆转录酶
64.c、10
×
primer mix
65.d、荧光染料
66.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,所述 bst dna聚合酶为浓度为8u/μl的bst dna聚合酶水溶液;
67.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,所述逆转录酶浓度为15u/μl。
68.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,所述 10
×
primer mix包含浓度均为40μm的检测引物ft与bt,浓度均为10μm的加速引物if和ib,均使用10%海藻糖去离子水进行稀释。
69.在本发明的一个实施方式中,在终体系中,检测引物ft或bt的终浓度均为1.6μm,加速引物if或ib的终浓度均为0.4μm,所述bst dna聚合酶的终浓度为 0.32u/μl,逆转录酶的终浓度为0.6u/μl,dntps的终浓度为1.4mm,荧光染料终浓度为1
×
,mgso4的终浓度为8mm,反应缓冲液终浓度为1
×
。
70.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,所述荧光染料为50
×
钙黄绿素(calcein),50
×
孔雀石绿(malachite green),或者50
×
sybrgreen 1中的一种。
71.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,所述 50
×
荧光染料,优选通过如下方法制备得到:
72.取5μl荧光染料(10000
×
)浓缩原液(溶解于二甲基亚砜dmso中)与995μl的去离子水混合均匀进行稀释,得到(50
×
)的浓度。
73.在本发明的一个实施方式中,用于检测肠道rna病毒核酸的试剂盒中,所述阳性对照为含105copies/μl含有ev71体外转录rna片段,所述阴性对照为无rna 酶的去离子水。
74.本发明技术方案提供的引物组或试剂盒可对nv gⅰ、nv gⅱ、hav、ca16 和ev71的各种变异株进行快速精准的检测,能在各种环境中使用,针对nv gⅰ、 nv gⅱ、hav、ca16和ev71各种保守区的特异性引物组在恒温的条件下对靶目标模板进行扩增,扩增产物与荧光染料相结合产生荧光信号,可以根据每个微孔里的荧光曲线检测并区分这4种病毒。由于微
孔内腔体小,对于样本量要求低,并节约了经济成本,并且微孔内液体更加集中,有效增加了引物和模板之间的有效识别和结合机会。整个反应不需要开盖,避免了污染和泄露。所有操作仅仅为试剂混合液和样本混合液进行混合后加入加样孔这一步操作,操作简单,检测速度快,可以在20-45分钟内完成4种靶标检测。灵敏度达到10copies/μl。
75.本发明第三方面,提供用于检测肠道rna病毒核酸的引物组或用于检测肠道 rna病毒核酸的试剂盒在非医疗诊断目的的检测样品中是否含有nv gⅰ、nvgⅱ、hav、ca16或ev71上的应用。
76.用于检测肠道rna病毒核酸的引物组或用于检测肠道rna病毒核酸的试剂盒适合在非医疗诊断目的的检测人群中离体样本或者环境样本中是否感染nvgⅰ、nv gⅱ、hav、ca16或ev71的情况时使用。
77.本发明第四方面,提供一种微孔恒温扩增检测肠道rna病毒核酸的方法,利用一对检测引物ft/bt和一对加速引物if/ib,进行等温扩增反应。当只选择检测引物对时,特别是低拷贝浓度的模板,检测时间会被延长。每种靶标进行检测同时选择检测引物和加速引物会使检测时间大大缩短,扩增效率更高。
78.其中nv gⅰ,检测引物为ft
‑ⅰ
/bt
‑ⅰ
,加速引物为if
‑ⅰ
/ib
‑ⅰ
,ft
‑ⅰ
的核苷酸序列如seq id no.1所示,bt
‑ⅰ
的核苷酸序列如seq id no.2所示,if
‑ⅰ
的核苷酸序列如seq id no.3所示,ib
‑ⅰ
的核苷酸序列如seq id no.4所示;
79.nv gⅱ检测引物为ft
‑ⅱ
/bt
‑ⅱ
,加速引物为if
‑ⅱ
/ib
‑ⅱ
,ft
‑ⅱ
的核苷酸序列如seq id no.5所示,bt
‑ⅱ
的核苷酸序列如seq id no.6所示,if
‑ⅱ
的核苷酸序列如seq id no.7所示,ib
‑ⅱ
的核苷酸序列如seq id no.8所示;
80.hav检测引物为ft-h/bt-h,加速引物为if-h/ib-h,ft-h的核苷酸序列如seq id no.9所示,bt-h的核苷酸序列如seq id no.10所示,if-h的核苷酸序列如seq id no.11所示,ib-h的核苷酸序列如seq id no.12所示;
81.ca16检测引物为ft-c/bt-c,加速引物为if-c/ib-c,ft-c的核苷酸序列如seq id no.13所示,bt-c的核苷酸序列如seq id no.14所示,if-c的核苷酸序列如seq id no.15所示,ib-c的核苷酸序列如seq id no.16所示;
82.ev71检测引物为ft-e/bt-e,加速引物为if-e/ib-e,ft-e的核苷酸序列如seq idno.17所示,bt-e的核苷酸序列如seq id no.18所示,if-e的核苷酸序列如seqid no.19所示,ib-e的核苷酸序列如seq id no.20所示。
83.在本发明的一个实施方式中,微孔恒温扩增检测肠道rna病毒核酸的方法,包括如下步骤:
84.(1)提取待检样品的核酸作为模板;
85.(2)引物包埋:每个靶标的4种引物分别混合为一管primer mix,吸取每种靶标primer mix到微孔区,一个样本对应6个微孔区,5个靶标按照顺序分别加样到不同的微孔区,最后的一个微孔为阴性空白对照不加引物靶标;阳性对照区的微孔和样本微孔区的引物靶标一样进行引物包埋和阴性空白对照微孔,将加好引物的微孔板放置在真空恒温箱里进行干燥,干燥完毕后进行贴膜封闭,备用;
86.(3)配置微孔反应体系:10
×
isothermal amplification buffer 5μl,10mm dntps 7μl,100mm mgso
4 3μl,8u/μl bst 2.0 2μl,15u/μl逆转录酶2μl,h2o 22 μl,荧光染
料1μl,1u/μl dutp(非反应必要成分,为防止污染加入,实验中可以采用h2o取代不影响扩增效率)2μl总体积为43μl;阳性对照组也相同的体系;
87.(4)将步骤(1)抽提的核酸模板加入步骤(3)的反应总体系内,进行震荡混匀,瞬时离心,阳性对照组方法相同,将阳性rna模板加入步骤(3)的阳性对照反应总体系内,进行轻微震荡混匀,瞬时离心;
88.(5)上样,封膜,检测:将步骤(4)的核酸与体系的混合液加入到加样孔里,阳性对照与体系混合物加入到对照孔里,低速3000rpm 1分钟离心,使步骤(4) 的混合反应液流向分支的微孔里,微孔充满后,将微孔板放入荧光检测通道的仪器上,进行荧光信号测定。
89.在本发明的一个实施方式中,所述结果判读方法为:设置阈值为45分钟或45 个循环。根据对应微孔信号中的检测曲线是否出现指数期与平台期的扩增曲线进行定性结果判定。
90.在本发明的一个实施方式中,所述检测结果的判定采用以下标准:当阳性对照孔所有靶标≤35分钟出现扩增曲线且阴性对照未出现扩增曲线,判定样本孔检测有效;当判定有效的情况下,如果样本孔靶标中有呈现明显指数期和平台期的扩增曲线时且扩增时间在45分钟以内,判定为阳性;当判定有效的情况下,如果样本靶标中没有扩增曲线时且扩增时间大于45分钟判定为阴性。
91.在本发明的一个实施方式中,所述检测方法的反应温度条件和时间为:65℃45 分钟或65℃1分钟45个循环。
92.在本发明的一个实施方式中,所述检测方法是在微孔板中进行,信号检测根据使用染料的检测波长进行调整。使用sybr green和钙黄绿素时,波长 495nm-520nm范围。使用孔雀绿时波长范围为425nm-615nm。
93.在本发明的一个实施方式中,微孔恒温扩增检测肠道rna病毒核酸的方法,具体包括如下步骤:
94.(1)使用常规核酸抽提方法提取待检样品的核酸作为模板,并对抽提的总核酸进行常规的浓度、纯度和完整性检测;
95.(2)引物包埋:配置10%的海藻糖,称量10克的固体海藻糖加入到10ml的无rna酶去离子水里,根据引物干粉的每od的nmol数,分别加入适量的10%的海藻糖水,配置检测引物ft与bt浓度为40μm,加速引物if和ib浓度为10μm,并进行同体积1:1:1:1混合成10
×
primer mix,每个靶标的4种引物混合为一管 10
×
primer mix,并根据靶标的名字进行标记备用;吸取每种靶标1μl 10
×
primer mix 到微孔区,5个靶标按照顺序分别加样到不同的微孔区,最后的一个微孔为阴性空白对照不加引物靶标。阳性对照区的微孔和样本微孔区的引物靶标一样进行引物包埋和阴性空白对照微孔,将加好引物的微孔板放置在真空恒温箱里,程序设定为 37℃,1.5小时,气压《10pa,干燥完毕后进行贴膜封闭,备用,由于是干粉状态,按照干粉引物通常的保质期为1年。
96.(3)配置微孔反应体系:10
×
isothermal amplification buffer 5μl,10mm dntps7μl,100mm mgso
4 3μl,8u/μl bst 2.0 2μl,15u/μl逆转录酶2μl,h2o 22 μl,荧光染料1μl,1u/μl dutp(非反应必要成分,为防止污染加入,实验中可以采用h2o取代不影响扩增效率)2μl,总体积为43μl;阳性对照组也采用相同的体系。
97.(4)将步骤(1)抽提的核酸模板7μl加入步骤(3)的反应总体系内,进行轻微震荡混
匀,瞬时离心。阳性对照组方法相同,将7μl阳性rna模板加入步骤 (3)的阳性对照反应总体系内,进行轻微震荡混匀,瞬时离心。
98.(5)上样,封膜,检测。将步骤(4)的核酸与体系的混合液加入到加样孔里,阳性对照与体系混合物加入到对照孔里。3000rpm低速离心1分钟,使步骤(4) 的混合反应液流向分支的微孔里。每微孔的容量为5μl,微孔充满后,多余液体将残留在加样孔中,加样孔位置高于微孔,液体不会倒流。将微孔板放入相应荧光检测通道的仪器上,设置反应温度条件程序65℃45分钟进行荧光信号测定。
99.在本发明的一个实施方式中,所述样本为离体的粪便、肛拭子样本或环境样本等类型样本。
100.本发明建立的4种肠道rna病毒核酸恒温扩增体系通过对nv gⅰ/gⅱ、 hav、ca16和ev71每种病毒多个保守基因区设计多套引物,并对每种靶标筛选出灵敏度和特异性最好的一组引物作为快速检测使用的引物组。
101.本发明采用在微孔中进行恒温扩增的方法同时检测4种肠道rna病毒。只需要将反应体系和rna病毒核酸进行混匀后,离心流向包埋有5组引物组靶标的微孔,在荧光检测仪上进行65℃加热反应的同时即可进行检测,加热反应时间为 20-45分钟。本发明中涉及的仪器为荧光检测仪,一般实验室的荧光定量pcr仪或者恒温扩增仪等均可通用,不需要特殊的大型设备。本发明的技术方案对于操作者来说,仅仅将试剂混合液和待检核酸进行混合这一步实验步骤,操作简便并且不需要特别专业的知识背景就可以解读结果。本发明引物数量等同于特异性高的巢式 pcr,但相对于巢式pcr仅仅只需要一步,而灵敏性比普通pcr高,等同于荧光定量pcr的灵敏性,且单独微孔反应不用像多重荧光定量pcr那样考虑多组引物之间的交叉反应,在一些基层现场能快速高通量进行检测,具有很好的发展前景。
102.本发明每组靶标4条引物针对肠道的每种rna病毒的保守区进行引物设计,相对于普通pcr的2条引物具有更高的特异性。并且每个靶标均设计了多组引物针对不同保守基因区的扩增效率和敏感性进行对比,筛选出了灵敏性较高的一套引物组作为该靶标的检测引物,同时与以往肠道检测相关文献或专利中的方法进行了对比,达到灵敏度和检测时间短等优势才作为最终的引物靶标。每种引物靶标的扩增效率高于普通pcr。扩增反应结果根据扩增曲线和ct值就可以进行可视化判读。本发明系首次采用离心式微孔法恒温扩增同时进行4种肠道rna病毒核酸的检测,具有特异性强、灵敏度高、操作简单快速、不依赖大型实验设备可在基层现场开展检测工作等优势。
103.本发明使用改进的每种靶标仅需要4条引物进行的恒温扩增技术,与微孔反应技术相结合,对4种肠道rna病毒核酸进行高通量检测,每组引物靶标单独为一孔,引物之间没有交叉反应,使用离心的方式使试剂和模板混合物进入包埋有引物组靶标的微孔中。在工艺要求上,相比微流控来说较为简单,通用性很高,检测灵敏度可以达到10个拷贝,降低了加样的复杂性,在临床检测中具有优势。特别适合现场条件艰苦的地区,对操作人员的要求也较低。
104.与现有技术相比,本发明具有如下的优点及有益效果:
105.(1)本发明中所提供的针对4种肠道rna病毒核酸检测的反应体系和反应条件,灵敏度高,微孔成本低,不依赖精密设备,操作步骤简单,能快速得在基层现场开展高通量的检测。
106.(2)本发明的方法可以将检测时间减少至45分钟内,同传统金标准荧光定量 rt-pcr技术相比,缩短了检测周期。特别是针对rna病毒的检测,rt-pcr相关技术需要先进行30分钟以上的逆转录过程后才开始扩增,而本发明方法的逆转录酶和bst dna扩增酶具有相同的反应温度,可以rna逆转录过程和dna扩增过程无缝衔接交替同时进行。这种方法对新型恒温扩增技术的开发及微生物的现场检测具有重要的意义。
107.(3)由于每组引物靶标使用了4条引物,覆盖5个引物区,相对普通pcr的 2条引物特异性更好,可以和巢式pcr的特异性等同。并且本发明通过对每种rna 毒株多个保守区域的特异性选择,从多套引物组里筛选出灵敏度和特异性最佳的一组作为最终检测使用的引物靶标。特异性实验证明,每组引物能特异性得识别其对应的毒株。通过扩增曲线或ct值(反应时间)即可判定待测样本的目标基因是否存在,从而完成待测样品中该靶标的定性检测。本发明的敏感性高于普通rt-pcr,等同于荧光定量rt-pcr,但比荧光定量rt-pcr的反应时间更短。操作简便,快速,对基层现场进行肠道rna病毒的检测工作的开展具有很好应用前景。
108.(4)本发明在荧光检测仪上等温条件下扩增,和rt-pcr相关技术相比,省去逆转录酶单独的反应时间段和pcr升降温过程的时间,耗时短,45分钟内就可完成结果判读。
109.(5)相对于其他多重检测技术手段来说,比如实时多重rt-pcr或相近技术来说,本发明的每种引物靶标在单独的微孔里进行反应,引物之间既减少了交叉反应产生的引物二聚体,而引物二聚体在任何荧光检测中容易造成假阳性的产生。同样与常用的其他恒温反应相比,比如lamp一般需要6条引物,而本发明中引物数量的缩减至4条,同样减少了引物二聚体产生的风险,避免了荧光检测中假阳性的产生。这里特别强调的是,虽然部分lamp技术中仅有4条引物(缺少一对环引物lf/lb),没有环引物的lamp恒温扩增速度和效率会大大降低,和本发明中的4条引物的意义不同。本发明的检测引物ft/bt在功能上等同于lamp法的 fip/bip/f3/b3这4条引物,if/ib的功能等同于lamp法的环引物lf/lb。本发明的检测引物ft/bt在缺失加速引物if/ib可单独进行扩增,扩增时间会被延长,这和lamp法是完全不同的。
110.(6)该技术不需要特殊、昂贵的仪器和试剂,扩增产物不需要凝胶电泳和基因测序,不用开盖防止了气溶胶污染,直接根据反应曲线图和ct值即可判断结果,操作简便快捷。微孔反应对检测样本量要求低,同时检测试剂成本也大大下降。本发明的试剂盒及方法特别适用基层现场检测。
111.(7)相对于与微流控技术来说,本发明对反应微孔的工艺要求不高,液体流动的驱动依赖于通用的掌上离心设备,通用性更高。相对于其他大多数针对rna 病毒的检测方法,使用大多为dna质粒或假病毒(dna片段),本发明使用的是rna片段,在计算扩增灵敏性和特异性上更为精准。
附图说明
112.图1为针对nv gⅰ的a、b、c、d共4组引物,对10copies/μl浓度的nv gⅰ模板进行的扩增反应曲线图,4组引物中b组的扩增曲线出现时间更早。
113.图2为针对nv gⅱ的a、b共2组引物,对10copies/μl浓度的nv gⅱ模板进行的扩增反应曲线图,2组引物中b组的扩增曲线出现时间更早。
114.图3为针对hav的a、b、c共3组引物,对10copies/μl浓度的hav rna 模板进行的扩增反应曲线图,3组引物中b组的扩增曲线出现时间更早。
115.图4为针对ca16的a、b、c共3组引物,对10copies/μl浓度的ca16的 rna模板进行的扩增反应曲线图,3组引物中c组的扩增曲线出现时间更早。
116.图5为针对ev71的a、b共2组引物,对10copies/μl浓度的ev71的rna 模板进行的扩增反应曲线图,5组引物中b组的扩增曲线出现时间更早。
117.图6为nv gⅰ特异性实验,5种模板和去离子水分别针对nv gⅰ的b组引物组,6个孔里均为nv gⅰ靶标,仅加入的模板nv gⅰ发生了扩增反应,产生了1条扩增曲线。
118.图7为nv gⅱ特异性实验,5种模板和去离子水针对nv gⅱ的b组引物组, 6个孔里均为nv gⅱ靶标,仅加入的模板nv gⅱ发生了扩增反应,产生了1条扩增曲线。
119.图8为hav特异性实验,5种模板和去离子水对hav的b组引物组,6个孔里均为hav靶标,仅加入的hav模板发生了扩增反应,产生了1条扩增曲线。
120.图9为ca16特异性实验,5种模板和去离子水针对ca16的c组引物组,6 个孔里均为ca16靶标,仅加入的ca16模板发生了扩增反应,产生了1条扩增曲线。
121.图10为ev71特异性实验,5种模板和去离子水针对ev71的b组引物组,6 个孔里均为ev71靶标,仅加入的模板ev71发生了扩增反应,产生了1条扩增曲线。
122.图11微孔排列示意图,1~5孔依次分别使用10%海藻糖稀释过的引物组,进行包埋nv gⅰ、nv gⅱ、hav、ca16、ev71这5组经过筛选后最佳的引物组,孔0留空白为阴性对照。
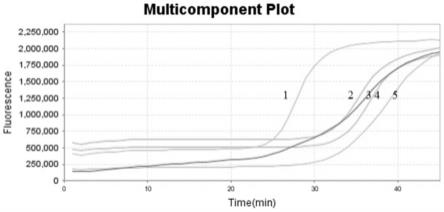
123.图12为微孔恒温扩增nv gⅰ、nv gⅱ、hav、ca16、ev71这5种肠道rna 病毒模板混合物,除了阴性空白对照外,其他孔里均发生了扩增反应。曲线1为 nv gⅰ、曲线2为ev71、曲线3为nv gⅱ、曲线4为ca16、曲线5为hav。
具体实施方式
124.下面结合附图和具体实施例对本发明进行详细说明。
125.除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。除非特别说明,本发明所用试剂和材料均可通过市售获得。
126.实施例1
127.5个引物组靶标的筛选
128.1.设计引物
129.根据bst dna扩增酶的反应原理,针对nv gⅰ/gⅱ、hav、ca16和ev71 的特异性靶序列分别多个保守区进行引物设计。以靶序列能产生一对检测引物 ft/bt,和加速引物if/ib中的至少一条为限定条件确定扩增区域。在ft/bt引物的5’有一段互为相反的序列。
130.表1:nv gⅰ引物名称序列(5’~3’)
[0131][0132]
表2:nv gⅱ引物名称序列(5’~3’)
[0133][0134]
表3:hav引物名称序列(5’~3’)
[0135][0136][0137]
表4:ca16引物名称序列(5’~3’)
[0138][0139]
表5:ev71引物名称序列(5’~3’)
[0140][0141]
其中,除了以上引物序列外,本发明同时合成了参考文献或其他专利中已有类似恒温扩增的引物组和扩增方法进行扩增效率对比。
[0142]
2.单孔恒温扩增荧光检测方法的建立和引物灵敏度筛选
[0143]
(1)反应体系
[0144]
①
引物mix:每种靶标配置检测引物ft与bt浓度为40μm,加速引物if和ib 浓度为10μm,并进行同体积1:1:1:1混合成10
×
primer mix。
[0145]
②
单孔反应体系:在进行多靶标高通量检测之前,引物筛选和体系调整均采用微孔板上每微孔的4倍体积在100μl体积的透光性ep管里进行操作, 10
×
isothermal amplification buffer 2μl(购自neb公司),10mm dntps 3μl(购自neb公司),100mm mgso
4 1.5μl(购自neb公司),8u/μl bst 2.0 1μl (购自neb公司),15u/μl逆转录酶1μl(购自takara公司),步骤
①
中的 10
×
primer mix 2μl,h2o 6μl(购自takara公司),荧光染料0.5μl,1u/μl dutp1μl((非反应必要成分,为防止污染加入,实验中可以采用h2o取代不影响扩增效率,购自neb公司)总体积为18μl。
[0146]
(2)rna模板准备
[0147]
a.针对nv gⅰ/gⅱ、hav、ca16和ev71进行引物设计的保守靶序列区进行基因合成(华大基因),nv gⅰ基因片段合成的序列如seq id no.21所示, nv gⅱ基因片段序列如seq id no.22所示,hav基因片段序列如seq id no.23 所示,ca16基因片段序列如seq id no.24所示,ev71基因片段序列如seq idno.25所示。每段序列的前端添加t7启动子区“taatacgactcactataggg”,为了区分用下划线
“‑”
进行标记这段启动子序列。对合成的序列酶切dna并连接到载体pmv上。转化到dh5a中,涂板,培养并抽提质粒dna。
[0148]
nv gⅰ基因片段合成的序列,seq id no.21所示:
[0149]
taatacgactcactatagggtggtcggtgcactctggatggccgcctggttgg caccaccccagtttcattgtcacatgttgccaagataagagggacctccaat ggcactgcaatcaaccttactgaattggatggcacacccttccacccttttg agggccctgcccccattgggcttccagacctcggtggctgcgatcggcacat caatatgacacagtttggccactccagccagacccagcatgatgcagacac cacccctgacacttccgtcccccatcttggttcaattcaggcaaatggcatt ggcagtggtaattatgttggtgttcttagctggatttcccccccatcacacc cgtctggctcccaagttgacctttggaagatccccaattatgggtcaagtat tacggaggcaacacatctagccccttctgtatacccccctggtttcggagag gtattggtctttttcatgtcaaaaatgccaggtcctggtgcttataatttg
[0150]
nv gⅱ基因片段序列,如seq id no.22所示:
[0151]
taatacgactcactatagggcaatgattccacattcccaaagacccatacaa ttgatgtccctactgggggaggccgctctccacgaacaaacattttacagta agattagcaaattggtcattgcagagctaaaagaaggtggtatggattttt acgtgcccagacaagagccaatgttcagatggatgagattctcagatctga gcacgtgggagggtgatcgcaatctggctcccagttttgtgaatgaagatg gcgtcgagtgacgccaacccatctgatgggtccgcagccaacctcgtccca gaggtcaacaatgaggttatggctctggagcccgttgttggtgccgctattg cggcacctgtagcgggccaacaaaatgtaattgacccctggattagaaaca attttgtac
[0152]
hav基因片段序列如seq id no.23所示
[0153]
taatacgactcactatagggccctaggctctggccgttgcgcctggcggggtc aactccatgattagcatggagctgtaggagtctaaattggggacacagatgtt tggaacgtcaccttgcagtgttaacttggctttcatgaatctctttgatcttcc acaaggggtaggctacgggtgaaacctcttaggctaatacttctatgaagag atgccttggatagggtaacagcggcggatattggtgagttgttaagacaaaa accattcaacgccggaggactgactctcatccagtggatgcattgagtggat tgactgtcggggctgtctttaggcttaattccagacctctctgtgcttggggc aaacatcatttggccttaaatgggattctgtgagaggggatccctccattgcc agctggactgttctttggggccttatgtggtgtttgccgctgaggtactcagg ggcatttaggtttttcctcattcttaaataataatgaacatgtctagacaaggt attttccagactgttgggagtggtcttgaccacatcctgtctttggcagacat tgaggaaga
[0154]
ca16基因片段序列如seq id no.24所示:
[0155]
taatacgactcactatagggtaatacgactcactatagggcaaactgtaaaca atcaagtgaatcgctcgttgactgcgatgcaagtactacctacagctgccaac actgaggcaagtagtcacagattaggcactggtgttgtaccagcactacaag ccgcggagacaggggcgtcgtctaatgctagtgacaagaatctcattgagac tagatgtgtgttgaaccatcactccacgcaagagacagccattgggaatttct ttagccgtgctggtcttgtcagcatcattacaatgcccaccacgggtacacag aatacagatggttatgttaattgggacattgatttgatgggatatgctcagctg cggcggaaatgcgagttattcacctacatgcgctttgatgctgaattcacatt tgtcgtagccaaacccaatggtgagttagtcccccaattactgcagtacatgt atgtcccgccaggggctccgaaacctacttccagagattcgtttgcttggca gacagccaccaacccatctgtgtttgtgaaaatgacggacccgccagctcaa gtgtcagt
[0156]
ev71基因片段序列如seq id no.25所示:
[0157]
taatacgactcactatagggtaatacgactcactatagggatatgtttgtgcca cctggagcccctaagccagattcaagggaatcccttgcatggcaaaccgcca ccaacccctcagtttttgtcaagctgtcagaccctccagcgcaggtttcagt gccattcatgtcacctgcgagtgcttatcaatggttttatgacggatatcccac attcggagaacacaaacaggagaaagatcttgaatacggggcatgtcctaat aacatgatgggcacgttctcagtgcgg
actgtggggacctccaagtccaagt accctttagtggttaggatctacatgagaatgaagcacgtcagggcgtgcata cctcgcccgatgcgtaaccagaactacctattcaaagccaacccaaattatgc tggcaactccattaagccaactggtgccagtcgcacagcgatcaccactctt gggaaatttggacaacagtctggggct
[0158]
b.使用上游引物为t7启动子“taatacgactcactataggg”,下游引物为每种质粒3’端20bp的碱基反序列的引物,对质粒上目标靶序列进行pcr扩增。25μl 反应体系:2x taq酶mixture(takata公司)12.5μl,上游引物1μl,下游引物1μl,水8.5μl,步骤a抽提的质粒dna 2μl。反应条件:94℃5分钟;94℃8 秒,55℃20秒,72℃1分钟,30个循环;72℃10分钟。
[0159]
c.体外转录,使用体外转录试剂盒(neb公司)配置20μl体系:1x rnapol 反应缓冲液[40mm tris-hcl(ph 7.9),6mm mgcl2,2mm亚精胺,1mm dtt] 1μl,atp、utp、gtp、ctp各1μl,t7 rna聚合酶2μl,水10μl,步骤b 里的含有启动子序列的pcr产物作为模板dna 3μl。在37℃温育1小时进行体外转录。
[0160]
d.消化多余dna:10x dnase i reaction buffer 10μl,2u/μl dnase i 1μl, nuclease-free h2o 69μl,步骤c中的体外转录产物20μl。37℃温育10分钟。
[0161]
e.rna提纯:使用试剂盒rna cleanup kit(neb)对步骤d的产物进行rna纯化。首先,将纯度大于≥95%酒精和试剂盒提供的5x rna cleanupwash buffer进行4:1体积混合稀释成1x的浓度。将50μl步骤d消化过dna的体外转录产物中加入到100μl rna cleanup binding buffer(1x),接着加入150μl 纯度≥95%的乙醇,通过移液管或轻弹试管进行混合,不要震荡。将所有混合液转移到柱子上离心1分钟,丢弃下面收集废液的管,加入500μl rna cleanup bindingbuffer(1x)离心1分钟,并重复一次,并不加液体离心一次使前面步骤残留液体全部去除。最后,使用无rna酶的1.5ml或者2ml ep管收集纯化后rna,加入 20μl的无rna酶去离子水到离心柱子上,离心1分钟,丢弃柱子,盖上ep管进行标记。rna浓度、纯度检测,并根据产物的长度使用公式计算出拷贝数,并进行浓度梯度倍比稀释到10个拷贝进行备用。
[0162]
(3)将步骤(1)配置的反应体系里加入2μl步骤(2)中检测浓度纯度合格的rna模板(通过倍比梯度稀释后,使用10copies/μl浓度的rna模板)。盖好盖子放入荧光检测仪中65℃80-90分钟进行反应和实时检测,由于灵敏度低的引物组出现扩增曲线时间需要的时间比较久,为了让灵敏度不同的引物组能够尽量产生扩增反应,延长扩增反应时间最长为90分钟或1分钟90个循环。结果如图1~图5,图1为针对nv gⅰ所设计引物组a、b、c、d共计4组引物(引物序列如上表1),扩增浓度为10copies/μl rna模板时,引物组b更早出现了扩增曲线,所需反应时间较短,灵敏度更高。而引物组a、c未能成功扩增该浓度的模板。引物组b被选作为后续微孔实验的引物组。图2为针对nv gⅱ基因所设计的引物(引物序列如上表2),扩增浓度为10copies/μl nv gⅱrna模板时通过2组引物结果比较证明引物组b的灵敏度高,所需反应时间最短。针对nv gⅱ选引物组b作为后续微孔实验的引物组。图3为针对hav基因所设计的a、b、c共3组引物(引物序列如上表3),扩增浓度为10copies/μlhav rna模板时,通过3组引物结果比较证明引物组b的灵敏度高,所需反应时间最短,引物组b作为后续微孔实验的引物组。图4为针对ca16所设计的a、b、c共3组的引物(引物序列如上表4),扩增浓度为10copies/μl ca16 rna模板时,通过几组引物结果比较证明引物组c的灵敏度高,所需反应时间最短,作为后续微孔实验的引物组。图5为针对ev71所设计的a、b共2组引物(引物序列如上表5),扩增浓度为10copies/μl ev71 rna 模板时,通过比较证明引物组b的灵
敏度更高,所需反应时间最短,作为后续微孔实验的引物组。
[0163]
实施例2
[0164]
特异性实验
[0165]
以下5组特异性实验除了primer mix不同以外,为方便描述相同的试剂体系被暂命名为c-mix:10
×
isothermal amplification buffer 2μl(购自neb公司),10 mm dntps 3μl(购自neb公司),100mm mgso4 1.5μl(购自neb公司), 8u/μl bst 2.0 1μl(购自neb公司),15u/μl逆转录酶1μl(购自takara公司), h2o 6.5μl(购自takara公司),1u/μl dutp 1μl((非反应必要成分,为防止污染加入,实验中可以采用h2o取代不影响扩增效率,购自neb公司)总体积为 16μl。特异性实验为了观察不同模板是否会与与不同的引物靶标之间发生非特异性反应,使用相对较高浓度的105copies/μl rna模板,加强引物与模板之间的反应机会。
[0166]
nv gⅰ特异性实验:配置6份上述反应体系c-mix并加入nv gⅰ的引物组b 组primer mix 2μl*6份,后分装到6管里,每管分别加入2μl 105copies/μl rna 模板nv gⅰ、nv gⅱ、hav、ca16、ev71和去离子水。结果如图6,仅模板 nv gⅰ针对特异性引物组管里发生了扩增反应,其余均未发生扩增反应。
[0167]
nv gⅱ基因特异性实验:配置6份(管)上述反应体系c-mix,并在每份中加入nv gⅱ基因引物组b组primer mix 2μl,每管中的模板分别加入2μl 10
5 copies/μl rna模板nv gⅰ、nv gⅱ、hav、ca16、ev71和去离子水。65℃45 分钟,结果如图7,仅nv gⅱ针对特异性引物组管里发生了扩增反应,其余rna 病毒均未发生扩增反应。
[0168]
hav基因特异性实验:配置6份上述反应体系c-mix并分别加入hav引物组 b组靶标primer mix 2μl,每份中模板加入2μl 105copies/μl rna模板分别是nvgⅰ、nv gⅱ、hav、ca16、ev71和去离子水。65℃45分钟,结果如图8,仅hav 针对特异性引物组管里发生了扩增反应,其余肠道rna病毒均未发生扩增反应。
[0169]
ca16特异性实验:配置6份上述反应体系c-mix并分别加入ca16引物组c 组primer mix 2μl,每管中模板加入2μl 105copies/μl rna分别是nv gⅰ、nvgⅱ、hav、ca16、ev71和去离子水。65℃45分钟,结果如图9,仅加入了ca16 模板的针对特异性引物组管里发生了扩增反应,其余肠道rna病毒均未发生扩增反应。
[0170]
ev71特异性实验:配置6份上述反应体系c-mix并加入ev71引物组b组 primer mix 2μl,每管中模板加入2μl 105copies/μl rna分别是nv gⅰ、nv gⅱ、 hav、ca16、ev71和去离子水。65℃45分钟,结果如图10,仅加入了ev71的模板针对特异性引物组管里发生了扩增反应,其余肠道rna病毒均未发生扩增反应。
[0171]
实施例3
[0172]
引物简并:针对各个靶标筛选出来的灵敏度高的引物组进行基因库比对。下载常见流行毒株序列,并将引物与序列进行匹配,在引物区发生变异的位点,进行引物简并,未发生变异的位点进行保留。简并参考r:ag,y:ct,m:ac,k:gt,s:gc, w:at,h:atc,b:gtc,v:gac,d:gat,n:atgc。对引物进行简并的原因为, rna病毒变异大,经常会出现引物区发生个别碱基突变而使引物与模板无法真实匹配,发生漏检,而简并碱基可以使引物更加适合变异大的rna病毒。修改后的引物序列参照seq id no.1~seq id no.20。
[0173]
实施例4
[0174]
基于微孔反应的恒温扩增实验
[0175]
1.引物包埋及海藻糖浓度
[0176]
使用10%浓度的海藻糖稀释在去离子水中,配置成海藻糖水,用于稀释引物。经海藻糖稀释过的引物按组进行混合,混合后,将1μl引物混合液primer mix分别加入微孔中,放入真空干燥箱中37℃1小时干燥,气压《10pa。干燥结束使用盖膜进行封闭。海藻糖的作用是将引物干燥后的干粉粘在孔壁上,在干燥过程或者盖膜过程减少损失。
[0177]
2.微孔实验
[0178]
将5个微孔进行引物包埋,制成微孔板,1~5孔依次分别使用10%海藻糖稀释过的引物组,进行包埋nv gⅰ、nv gⅱ、hav、ca16、ev71这5组经过筛选后最佳的引物组,孔0留空白为阴性对照,微孔排列见图11。阳性对照仅有2孔,孔1包埋ev71的引物靶标,孔0留空白为阴性对照。37℃1小时干燥,气压《10pa。干燥结束使用盖膜进行封闭。
[0179]
反应体系和混合模板配置:1.将104copies/μl nv gⅰ、nv gⅱ、hav、ca16、 ev71分别取5μl rna,加水15μl补足到总体积为50μl,使每种rna模板在混合模板中的浓度为105copies/μl,从而模拟多种rna病毒混合的样品。2.体系和模板混匀:提前预混体系[10
×
isothermal amplification buffer 5μl,10mm dntps 7 μl,100mm mgso4 3μl,8u/μl bst 2.0 2μl,15u/μl逆转录酶2μl,荧光染料 1ul,1u/μl dutp 2μl(非反应必要成分,为防止污染加入,实验中可以采用h2o 取代不影响扩增效率)],h2o 21μl,步骤1的模板7ul,总体积为50μl。3.将步骤 2的混合液加入微孔板的加样孔中,3000rpm离心1分钟后放入荧光检测仪中,65℃45分钟或65℃1分钟45个循环。结果如图12,空白对照里面没有扩增信号,其余 5孔模板出现了5种扩增曲线,ct值或者曲线出现时间与单孔同样rna模板浓度的接近,图12中曲线1为nv gⅰ、曲线2为ev71、曲线3为nv gⅱ、曲线4 为ca16、曲线5为hav,说明从单孔到微孔实验的技术嫁接扩增效率接近或者等同。
[0180]
上述的对实施例的描述是为便于该技术领域的普通技术人员能理解和使用发明。熟悉本领域技术的人员显然可以容易地对这些实施例做出各种修改,并把在此说明的一般原理应用到其他实施例中而不必经过创造性的劳动。因此,本发明不限于上述实施例,本领域技术人员根据本发明的揭示,不脱离本发明范畴所做出的改进和修改都应该在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1