一种用于定量检测EB病毒Cp启动子甲基化的试剂盒
一种用于定量检测eb病毒cp启动子甲基化的试剂盒
技术领域
1.本发明属于基因甲基化检测技术领域。更具体地,涉及一种用于定量检测eb病毒cp启动子甲基化的试剂盒。
背景技术:
2.甲基化修饰是生物体内最广泛的表观遗传学修饰方式之一,是指在特定的酶的作用下将甲基基团催化转移到其他化合物的过程,主要包括dna甲基化、rna甲基化和蛋白质甲基化。dna甲基化一般出现于dna的cpg岛,即胞嘧啶5号碳位甲基化(m5c)。当甲基化发生于基因启动子区域时,通常会抑制基因的转录,导致其对应基因的表达量降低。dna异常甲基化则几乎出现在所有肿瘤的癌前病变和癌症癌变早期,因此,是肿瘤早期诊断的理想标志物。
3.eb病毒(epstein-barr virus),又称人类疱疹病毒第四型(human herpesvirus4,hhv-4),是最常见的能引起人类疾病的病毒之一,该病毒主要感染人b淋巴细胞。eb病毒的感染是鼻咽癌发生的主要危险因素,eb病毒相关甲基化检测能有效预测鼻咽癌的发生发展。
4.目前,甲基化定量检测的方法包括焦磷酸测序(pyrosequencing)、飞行时间质谱法(massarray)、甲基化敏感性高分辨率溶解曲线分析(ms-hrm)和甲基化特异性pcr(ms-pcr)等,但上述方法均存在检测所需样本量高(需达到μg级别),检测时间长以及检测成本高等问题。当检测样本的dna含量低时,上述方法还需进行巢式扩增以提高目标基因含量,而巢式扩增引起的扩增偏好可能会使定量结果产生偏移,且巢式扩增后开盖加样容易引物引起因扩增带来的气溶胶污染,进而造成检测结果的假阳性。
5.基于实时荧光定量pcr的methylight是一种低成本的甲基化检测方法,但该方法需要借助一个参比基因进行结果校正,其结果的稳定性和准确性会受参比基因表达量影响。中国专利《一种dna甲基化定量系统》在methylight方法的基础上,提出了一种依靠rt-qpcr反应的ct值进行定量,不需参比基因的定量检测方法。但由于该专利所述方法的ct值是由rt-qpcr仪自动生成,在实际反应中,rt-qpcr仪自动生成的ct值易受探针荧光基团发光强度、反应体系、反应条件等多因素影响,检测结果并非完全稳定。
技术实现要素:
6.本发明要解决的技术问题是克服现有上述技术的缺陷和不足,提供一种用于定量检测eb病毒cp启动子甲基化的试剂盒。
7.本发明的第一个目的是提供一种用于定量检测eb病毒cp启动子甲基化的试剂盒。
8.本发明的第二个目的是提供所述试剂盒在制备鼻咽癌早筛产品中的应用。
9.本发明上述目的通过以下技术方案实现:
10.本发明提供了一种用于定量检测eb病毒cp启动子甲基化的试剂盒,所述试剂盒包括一对用于扩增eb病毒cp启动子序列的特异性引物、甲基化检测探针、未甲基化检测探针、
eb病毒cp启动子100%甲基化标准品、eb病毒cp启动子100%未甲基化标准品、50%甲基化标准品以及亚硫酸氢盐转化质控品。
11.具体地,所述探针为taqman探针。
12.本发明所述试剂盒的原理为:eb病毒dna经亚硫酸氢盐处理后,甲基化的胞嘧啶不会发生转化,而未甲基化的胞嘧啶c则会被转化成尿嘧啶u,因此未甲基化的胞嘧啶会在pcr反应中被替换成胸腺嘧啶t。在此基础上,本发明利用亚硫酸氢盐转化质控品监控转化效果,利用设计的特异性pcr引物同时无偏差地扩增甲基化和未甲基化的eb病毒cp启动子序列,而甲基化和未甲基化taqman探针能高效、100%特异识别甲基化和未甲基化的eb病毒cp启动子序列,随后通过taq酶水解taqman探针发出荧光,对来源于甲基化和未甲基化探针水解后发出的不同通道的荧光进行计算,并通过标准品对结果进行校正后即可得出反应体系中甲基化序列与未甲基化序列的比值,定量检测eb病毒cp启动子的甲基化。
13.本发明所述用于扩增eb病毒cp启动子序列的特异性引物包括上游引物和下游引物,上游引物的序列如seq id no.1所示,下游引物的序列如seq id no.2所示。
14.本发明所述甲基化检测taqman探针的序列如seq id no.3所示,未甲基化检测taqman探针的序列如seq id no.4所示。
15.此外,本发明所述甲基化与未甲基化检测taqman探针的5'端带有不同的荧光基团,所述荧光基团为fam、tet、joe、vic、rox、texas red或cy5;所述甲基化与未甲基化检测taqman探针的3'端带有淬灭基团,所述淬灭基团为mgb、bhq1、bhq2或bhq3。
16.具体地,甲基化检测taqman探针的5'端带有fam荧光基团,未甲基化检测taqman探针的5'端带有texas red荧光基团,甲基化与未甲基化检测taqman探针的3'端均带有mgb淬灭基团。
17.本发明所述eb病毒cp启动子100%甲基化标准品的序列如seq id no.7所示;100%未甲基化标准品的序列如seq id no.8所示。
18.本发明所述50%甲基化标准品序列内含有一个拷贝甲基化eb病毒cp启动子序列和一个拷贝未甲基化eb病毒cp启动子序列,可用于对甲基化检测数据进行校正,其序列如seq id no.9所示。当rt-qpcr仪生成检测结果时,只需将标准品孔的甲基化和未甲基化两个通道的荧光ct阈值线调整为一致即可对其他被测样本进行校正。
19.本发明所述亚硫酸氢盐转化质控品的序列如seq id no.10所示,该质控品序列经转化后能被用于扩增eb病毒cp启动子序列的特异性引物扩增,将所述质控品与其他待测样本进行同样的亚硫酸氢盐转化操作和后续的rt-qpcr实验,若rt-qpcr实验只检测到质控品孔有未甲基化探针所发出的荧光则代表转化成功。
20.具体地,试剂盒中所述特异性引物的使用浓度为10μm,所述taqman探针的使用浓度为10μm。
21.具体地,本发明所述试剂盒中还包含qpcr所需试剂,具体包括热启动taq酶、mg
2+
、datp、dgtp、dttp、dctp、ddh2o和缓冲液。
22.具体地,利用本发明所述试剂盒进行甲基化定量检测时,检测样本来源为鼻咽拭子、口腔拭子、鼻咽或口咽活检组织、血浆或血清。
23.具体地,利用本发明所述试剂盒进行甲基化定量检测时,扩增反应体系为20μl,包括:10μl qpcr mixture,1μl上游引物,1μl下游引物,0.5μl甲基化taqman探针,0.5μl未甲
基化taqman探针,5μl样本dna,ddh2o补足余量;其中,引物和探针的浓度均为10μm。
24.具体地,利用所述试剂盒进行甲基化定量检测时,扩增反应程序为:95℃预变性5分钟,1个循环;变性95℃15秒,60℃退火延伸50秒,45个循环。
25.具体地,利用本发明所述试剂盒进行甲基化定量检测时,在退火延伸阶段采集荧光信号,同时收集甲基化/未甲基化taqman探针水解所对应的荧光。
26.具体地,利用本发明所述试剂盒进行甲基化定量检测时,甲基化比例或甲基化率的定义为:甲基化率=甲基化序列含量/(甲基化序列含量+未甲基化序列含量)。
27.具体地,甲基化率计算公式为:甲基化率=(2x)
δct
/((2x)
δct
+1),其中,x为pcr扩增效率,δct为未甲基化探针与甲基化探针的ct值之差;x值需要根据使用者的rt-qpcr仪进行调整,默认情况下该值为1。
28.利用本发明所述试剂盒定量检测eb病毒cp启动子甲基化的具体步骤为:
29.s1.提取待测样品基因组dna;
30.s2.使用亚硫酸氢盐试剂盒对提取所得基因组dna和亚硫酸氢盐转化质控品分别进行相同的亚硫酸氢盐转化处理,保存转化后的dna;
31.s3.分别以转化后的dna和质控品、50%甲基化标准品为模板,配制rt-qpcr反应体系进行定量实验,反应结束后利用50%甲基化标准品校正待测样品的ct阈值线;
32.s4.使用qpcr仪自带的分析软件导出每个样本孔的甲基化和未甲基化通道的ct值,计算甲基化率。
33.本发明还申请保护所述试剂盒在制备鼻咽癌早筛产品中的应用。
34.本发明具有以下有益效果:
35.本发明提供了一种用于定量检测eb病毒cp启动子甲基化的试剂盒,所述试剂盒无需进行巢式预扩增反应,也不需要分开检测甲基化和未甲基化序列,只需将转化后的dna加入到反应体系中,即可在一管反应中同时检测甲基化和未甲基化序列,可快速、简便检测cpg位点甲基化比例,克服了现有鼻咽癌筛查指标阳性预测值低、灵敏度低、特异度低的问题。所述试剂盒的检测下限低至101~102拷贝。
36.本发明所述eb病毒cp启动子甲基化定量试剂盒适用于鼻咽癌筛查现场或基层医院的鼻咽癌早期筛查/精准筛查,相较于传统的甲基化芯片、甲基化测序和甲基化特异性pcr等方法,具有方便快捷,成本低廉等优点,仅需进行一次反应即可准确定量甲基化比例,可大大节约实验时间和实验成本,有助于在鼻咽癌高发区普及鼻咽癌早期筛查,提高鼻咽癌筛查率。本发明所述试剂盒也可用于鼻咽癌高危人群,如eb病毒抗体阳性人群的分流筛查,可进一步“浓缩”高危人群,减少有创检查,提高鼻咽癌筛查依从性。
附图说明
37.图1为表1所示三对扩增引物用于扩增甲基化序列和未甲基化序列的测试结果。
38.图2为使用本发明所述试剂盒用于检测不同甲基化程度的eb病毒cp启动子的结果。
39.图3为使用固定甲基化率为63%的测试样本进行倍比稀释后,使用本发明所述试剂盒进行检测的结果。
40.图4为图3所示结果的分析及量化结果。
41.图5为使用本发明所述试剂盒和焦磷酸测序所得甲基化检测结果的比较。
42.图6为使用本发明所述试剂盒检测鼻咽癌患者和正常对照人之间的eb病毒cp启动子甲基化比例的差异。
具体实施方式
43.以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
44.除非特别说明,以下实施例所用试剂和材料均为市购。
45.实施例1用于定量检测eb病毒cp启动子甲基化的试剂盒
46.本发明所述用于定量检测eb病毒cp启动子甲基化的试剂盒中包括:一对用于扩增eb病毒cp启动子序列的特异性引物、甲基化检测taqman探针、未甲基化检测taqman探针、eb病毒cp启动子100%甲基化标准品和100%未甲基化标准品、50%甲基化标准品以及亚硫酸氢盐转化质控品。
47.1、标准品的制备
48.本发明所述试剂盒中,eb病毒cp启动子100%甲基化标准品、100%未甲基化标准品、50%甲基化标准品和亚硫酸氢盐转化质控品标准的序列均是通过人工合成方式获得,合成后插入puc57质粒中构成重组质粒,再经感受态大肠埃希菌大量复制后进行提纯并进行测序,测序结果正确的即为标准品,合成和测序工作均由北京擎科生物科技有限公司完成。
49.具体地:
50.eb病毒cp启动子100%甲基化标准品的序列如下(seq id no.7)所示:
51.gtgcgtcgagtgttatttttggaatagtagaaaattgaattttgttggcgggagaaggaataacgttttatttgggaggagcgacggattatagttaataagagagtttaagacgtagggttcgtaaagtatagtggtttcgtgggattttagaggtggagtaacgtttaaagtggtaataatattaggcggggttgggtaaaggggttttacgggcgggattaattacgttttgtttacgtaagtttagttaattcgtttacgatttgaaaaatgtagtttttaattaattggcggttt
52.eb病毒cp启动子100%未甲基化标准品的序列如下(seq id no.8)所示:
53.gtgtgttgagtgttatttttggaatagtagaaaattgaattttgttggtgggagaaggaataatgttttatttgggaggagtgatggattatagttaataagagagtttaagatgtagggtttgtaaagtatagtggttttgtgggattttagaggtggagtaatgtttaaagtggtaataatattaggtggggttgggtaaaggggttttatgggtgggattaattatgttttgtttatgtaagtttagttaatttgtttatgatttgaaaaatgtagtttttaattaattggtggttt
54.eb病毒cp启动子50%甲基化标准品的序列如下(seq id no.9)所示:
55.gtgtgttgagtgttatttttggaatagtagaaaattgaattttgttggtgggagaaggaataatgttttatttgggaggagtgatggattatagttaataagagagtttaagatgtagggtaacgttttatttgggaggagcgacggattatagttaataagagagtttaagacgtagggtttgtaaagtatagtggttttgtgggattttagaggtggagtaatgtttaaagtggtaatgtcacgtagaaaggactaccgacgaaggaacttgggtcgccggtgtgttcgtatatggaggtagtaagacctccctttacaacc
56.eb病毒cp启动子亚硫酸氢盐转化质控品序列如下(seq id no.10)所示:
57.gagtgctatctttggaacagtagtaacgccttatctgggaggagcgacggattatagccaataagagag
ctcaagacgcagggcgtgggaccttagaggtggagca
58.2、用于扩增eb病毒cp启动子序列的特异性引物的设计
59.本发明基于eb病毒cp启动子序列(v01555.2:11041~11217)设计引物和探针等,所述启动子序列如下(seq id no.5)所示:
60.taacgccttatctgggaggagcgacggattatagccaataagagagctcaagacgcagggctcgcaaagtatagtggccccgtgggaccttagaggtggagcaacgtctaaagtggtaataacaccaggcggggctgggcaaaggggtcctacgggcgggattaattacgccttgct
61.其中,能发生甲基化的cpg位点序列如下(seq.no.6)所示:
62.taacgttttatttgggaggagcgacggattatagttaataagagagtttaagacgtagggttcgtaaagtatagtggtttcgtgggattttagaggtggagtaacgtttaaagtggtaataatattaggcggggttgggtaaaggggttttacgggcgggattaattacgttttgtt
63.本发明设计的用于扩增eb病毒cp启动子的引物要保证能扩增出v01555.2:11062和v01555.2:11065两个位点,且扩增产物长度不宜过长,150bp左右为宜;为防止引起扩增偏移,扩增引物序列不得包含cpg序列。本发明设计得到了三对符合上述要求的引物,序列信息具体如表1所示,所有引物均由北京擎科生物科技有限公司合成。
64.表1用于扩增eb病毒cp启动子序列的引物
[0065][0066]
为验证所设引物的检测效果,本发明分别将三对扩增引物与相同浓度的100%甲基化标准品和100%未甲基化标准品混合,配制反应体系后进行qpcr实验,结果如附图1所示。由图1可知,扩增引物2(即本发明所述用于扩增eb病毒cp启动子序列的特异性引物,seq id no.1~2所示)对于甲基化和未甲基化的序列均具有最佳的扩增效果,所需扩增循环数最少,故后续选择使用扩增引物2进行实验。
[0067]
其中,扩增引物2-f(seq id no.1)位于eb病毒基因组(b95-8,genbank:v01555.2)的第10988~11010位之间,扩增引物2-r(seq id no.2)位于eb病毒基因组的第11123~11143位之间。
[0068]
3、eb病毒cp启动子甲基化和未甲基化taqman探针的设计与筛选
[0069]
为增强探针的特异性,设计的甲基化和未甲基化taqman探针应能同时检测v01555.2:11062和v01555.2:11065两个位点,探针长度不超过20nt。同时为提高探针的退火温度,本发明选择将taqman探针的3'端设计为mgb修饰,甲基化taqman探针5'端设计为fam修饰,未甲基化taqman探针5'端设计为texas red修饰。本发明共设计了7条符合条件的
taqman探针,包括1条未甲基化taqman探针和6条甲基化taqman探针,taqman探针序列信息具体如表2所示,探针序列均由苏州泓迅生物科技股份有限公司合成。
[0070]
表2taqman探针序列
[0071][0072]
为进一步验证不同探针组合间的性能差异及筛选最优探针组合,本发明使用高浓度100%甲基化标准品和100%未甲基化标准品混合成约50%甲基化的混合测试样本,并对该测试样本进行10倍梯度稀释以测试探针组合在相同甲基化比例、不同浓度情况下的检测结果稳定性。结果如表3所示,经组合以上6组探针测试后,未甲基化探针1(seq id no.4)与甲基化探针6(seq id no.3)组合的效果最好,其标准差和变异系数均为最低,即该探针组合的稳定性最强,且两个探针的特异度均能达到100%,即甲基化探针仅能结合并检测甲基化序列,未甲基化探针仅能结合并检测未甲基化序列。
[0073]
表3taqman探针组合测试
[0074][0075][0076]
因此,本发明选择扩增引物2,未甲基化探针1、甲基化探针6与eb病毒cp启动子100%甲基化标准品、eb病毒cp启动子100%未甲基化标准品、50%甲基化标准品以及亚硫酸氢盐转化质控品构成本发明所述试剂盒。
[0077]
实施例2试剂盒检测性能测试
[0078]
本发明对实施例1所述试剂盒的检测性能进行了测试。利用本发明所述试剂盒定量检测eb病毒cp启动子甲基化的具体步骤为:
[0079]
s1.使用qiagen公司的qiaamp dna mini kit 250提取鼻咽拭子中的基因组dna,
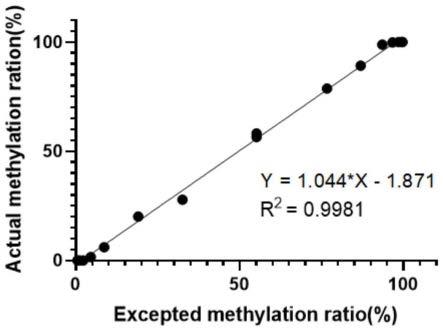
操作流程完全按照试剂盒提供的说明书进行;
[0080]
s2.使用zymo公司的ez dna methylation-gold(d5006)试剂盒对提取所得基因组dna和亚硫酸氢盐转化质控品进行相同的亚硫酸氢盐转化处理,操作流程完全按照试剂盒提供的说明书进行,4℃短暂保存或-20℃长期保存转化后的dna;
[0081]
s3.参照表4配制rt-qpcr反应体系进行定量实验,反应结束后利用50%甲基化标准品的ct值校正待测样品的ct阈值线,随后导出每孔对应的fam和texas red通道的ct值进行下一步的计算;
[0082]
s4.通过公式“甲基化率=(2x)
δct
/((2x)
δct
+1)”计算甲基化率,其中,x为pcr扩增效率,δct为未甲基化探针与甲基化探针的ct值之差。
[0083]
本实施例的荧光定量体系是利用北京擎科生物科技有限公司的2
×
t5 fast qpcr mix混合液进行配制,具体反应体系如表4所示:
[0084]
表4荧光定量反应体系
[0085][0086][0087]
依据探针上所修饰的基团的不同,检测时需要在至少带有两个荧光通道的荧光pcr仪上进行使用,采集荧光通道为fam(最大发射波长518nm)和texas red(最大发射波长615nm),具体反应条件如表5所示:
[0088]
表5荧光定量反应程序
[0089][0090]
本发明首先将经定量后的100%甲基化标准品和100%未甲基化标准品进行混合,得到甲基化比例不同的16个样本用于模拟真实检测样本,然后使用实施例1所示试剂盒进
行检测,结果如表6和附图2所示。其中,图2横坐标表示使用定量方法测定的甲基化率,纵坐标为使用本发明试剂盒测定的甲基化率,图中每一个圆点代表一个样本,直线表示两种方法测定的甲基化率之间的回归方程。
[0091]
由实验结果可知,本发明试剂盒的检测结果与定量检测结果之间具有很强的一致性,证明本发明试剂盒准确度高,实验结果可靠性高。
[0092]
表6
[0093][0094][0095]
本发明用高浓度的100%甲基化标准品和100%未甲基化标准品混合得到了甲基化比例约为65%的测试样本,再对所得测试样本进行倍比稀释,得到浓度范围为101~106拷贝/μl的梯度测试样本,对所有浓度的测试样本均进行定量检测。实验结果如附图3和附图4所示,其中,图3为固定甲基化率为63%的测试样本样本进行倍比稀释后的检测结果;红线表示未甲基化探针水解后释放的荧光(最大发射波长615nm),蓝线代表甲基化探针水解后释放的荧光(最大发射波长518nm)。图4为图3结果的分析及量化结果,每一个圆点代表不同投入稀释梯度拷贝数的测试样本样本。由图3和图4所示实验结果可知,本发明试剂盒能检测总投入量低至101~102拷贝,且在不同的浓度范围内,试剂盒均具有很强的稳定性,实验结果精密度高。
[0096]
实施例3甲基化定量结果比较
[0097]
焦磷酸测序为甲基化定量的金标准,本实施例使用焦磷酸测序验证了本发明所述试剂盒的准确性。将100%甲基化标准品和100%未甲基化标准品混合成甲基化比例为0%~100%的6个样本,再分别各取7例鼻咽癌患者和7例正常人的鼻咽拭子,使用qiagen公司的qiaamp dna mini kit 250提取鼻咽拭子中的dna,使用zymo公司的ez dna methylation-gold kit对提取的dna进行dna甲基化转化,dna提取和转化完全按照试剂盒提供的说明书进行。
[0098]
将亚硫酸氢盐转化后的dna样本分为两份,一份用于焦磷酸测序,焦磷酸测序的引物设计、测序、数据分析工作全部由新开源晶锐(广州)生物医药科技有限公司完成;另一份dna样本利用本发明所述试剂盒进行定量检测,检测后将分别使用专利cn109385465a所述方法及本发明所述的标准品校正法进行pcr结果的判读。
[0099]
甲基化定量比较结果如下表7所示,其中较正前为专利cn109385465a中的定量方法所得结果,校正后为使用本发明所述标准品定量所得结果。由差值可计算出,校正前的甲基化比例与金标准焦磷酸测序结果平均差值为8.52%,标准差为10.92%;校正后的甲基化比例与焦磷酸结果平均差值仅为0.64%,标准差仅为3.75%。由二者差值和标准差可得出结论:经50%标准品校正后的结果准确性高于仪器自动生成的结果。
[0100]
表7
[0101]
[0102][0103]
利用本发明所述试剂盒检测经校正后的测试结果与焦磷酸测序结果的比较结果如附图5所示,其中,图中每个圆点代表一个样本,横坐标为焦磷酸测序所测得的甲基化比例,纵坐标为本发明所述试剂盒所测得的甲基化比例。由相关性系数r2可知,本发明所述试剂盒的实验结果与焦磷酸测序结果高度一致,证明本发明所述试剂盒的准确性高,结果稳定性强。
[0104]
本发明通过设计了一个用于监控亚硫酸氢盐转化效果的质控品,一对可同时、无偏移扩增甲基化和未甲基化序列的pcr扩增引物,一对能100%特异识别甲基化和未甲基化序列的taqman探针,通过构建了一个50%甲基化标准品并基于该标准品提出了新的ct值划定方法,从而避免了由于实验操作或仪器误差而导致的ct值偏移,大大提高了检测结果的准确性和可重复性。
[0105]
实施例4本发明所述试剂盒对于鼻咽癌的诊断效能
[0106]
另取不同于实施例3的7例鼻咽癌患者(npc)和7例正常对照人(control)鼻咽拭子,使用qiagen公司的qiaamp dna mini kit 250提取鼻咽拭子中的dna,使用zymo公司的ez dna methylation-gold kit对样本dna进行dna甲基化转化,dna提取和转化完全按照试剂盒提供的说明书进行。
[0107]
使用本发明所述试剂盒对7例鼻咽癌样本和7例正常对照样本进行检测,检测流程和方案按照实施例2进行。实验检测结果如表8和图6所示,表8及图6所示结果表明,本发明试剂盒对鼻咽癌患者具有极好的诊断效果,鼻咽癌患者与正常对照人之间的eb病毒cp启动子甲基化比例具有统计学上的显著性差异(p《0.0001),当设置甲基化比例的阳性诊断界值(cutoff值)为80%时,基于本发明试剂盒检测的甲基化指标灵敏度和特异度均可达100%,诊断效果优异。
[0108]
表8
[0109]
[0110][0111]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1