一种右美沙芬半抗原、人工抗原、抗体及其制备方法和应用
1.本发明涉及食品检测技术领域,更具体地,涉及一种右美沙芬半抗原、人工抗原、抗体及其制备方法和应用。
背景技术:
2.右美沙芬(dextromethorphan,dxm),又名右甲吗喃,为吗啡类左吗喃甲基醚的右旋异构体。临床上是一种高效且使用广泛的非处方镇咳药,通过抑制延髓咳嗽中枢而产生作用,多用于治疗感冒、咽喉炎、急性或慢性支气管炎及由上呼吸道感染引起的咳嗽等。在治疗剂量下未见耐受性和成瘾性,作用快且安全。尽管在临床治疗上表现出显著优点,但随着右美沙芬广泛使用,在人群中逐渐出现右美沙芬依赖和滥用现象。超剂量服用右美沙芬会引起人体欣快、幻觉、兴奋冲动和解离性镇静,而停用后则出现头晕、焦虑、失眠及认知情绪障碍等戒断症状,表现出明显的药物依赖。
3.最近报道发现,不法商贩为提高凉茶的功效以获得更大商业利润,将右美沙芬非法掺入声称具有强效镇咳作用的凉茶中。现场制售凉茶的非法添加药物剂量随意、多种混合,亦不注意配伍禁忌,销售时没有专业药师指导使用和用量限制。消费者在不知情的情况下大量或长期饮用,可能会出现重复或过量用药的情况,安全隐患大。这一非法行为严重违反《食品安全法》,同时在不知情的情况下给消费者带来潜在健康威胁。
4.目前,针对右美沙芬的检测方法主要包括高效液相色谱法、毛细管气相色谱法和液相色谱-质谱联用法等仪器分析方法,具有准确性好、灵敏度高等优点,但仪器设备昂贵,且需要专业人员操作,无法满足现场快速检测的需求,难以在基层普及。因此建立简便易、行灵敏度高、特异性强的凉茶中右美沙芬的检测方法,是保障食品安全的重要技术支撑,对保障人民身体健康具有重要意义。免疫方法成本低,且操作简便,在现场快速筛查领域起着不可替代的作用,其关键技术在于获得高灵敏度和特异性的抗体。然而目前还缺少高灵敏度和特异性的右美沙芬抗体及可用于产生高灵敏度和特异性的抗体的右美沙芬半抗原和人工抗原。
技术实现要素:
5.本发明要解决的技术问题是克服现有技术中右美沙芬检测方法的缺陷和不足,提供一种右美沙芬半抗原、人工抗原、抗体及其制备方法和应用。
6.本发明的目的在于提供一种右美沙芬半抗原。
7.本发明的目的还在于提供所述右美沙芬半抗原的制备方法。
8.本发明的目的还在于提供所述右美沙芬半抗原在制备右美沙芬人工抗原中的应用。
9.本发明的目的还在于提供一种右美沙芬人工抗原。
10.本发明的目的还在于提供所述右美沙芬人工抗原的制备方法。
11.本发明的目的还在于提供所述右美沙芬人工抗原在制备右美沙芬人工抗体中的
应用。
12.本发明的目的还在于提供一种右美沙芬抗体。
13.本发明的目的还在于提供一种检测右美沙芬的试剂盒。
14.本发明的目的还在于提供一种检测右美沙芬的免疫分析方法。
15.本发明的上述目的通过以下技术方案实现:
16.本发明提供了一种右美沙芬的半抗原dxm-2c,所述半抗原dxm-2c的结构式如式(i)所示:
[0017][0018]
所述半抗原dxm-2c采用系统命名法命名为:2-(((4bs,8as,9s)-11-methyl-6,7,8,8a,9,10-hexahydro-5h-9,4b-(epiminoethano)phenan thren-3-yl)oxy)acetic acid,即2-(((4bs,8as,9s)-11-甲基-6,7,8,8a,9,10-六氢化-5h-9,4b-(亚氨基乙醇)菲胺-3-基)氧基)乙酸。
[0019]
本发明所述半抗原dxm-2c的制备方法,是将右羟吗喃与溴乙酸乙酯于溶剂中反应,分离纯化反应物,于碱性环境中水解,即得半抗原dxm-2c。
[0020]
所述右羟吗喃的结构式为:
[0021][0022]
所述溴乙酸乙酯的结构式为:
[0023][0024]
具体地,是将右羟吗喃、碳酸钾和溴乙酸乙酯溶于溶剂中,搅拌,在40℃冷凝回流反应4~8h,分离纯化反应物,并将分离纯化的反应物溶解于甲醇中,然后加入氢氧化钠水溶液在室温下搅拌4~6h,反应结束后用盐酸溶液调酸,即得半抗原dxm-2c。
[0025]
优选地,所述右羟吗喃与溴乙酸乙酯的摩尔比为1:1~2。
[0026]
进一步优选地,所述右羟吗喃与溴乙酸乙酯的摩尔比为1:1.2
[0027]
优选地,所述右羟吗喃与碳酸钾的摩尔比为1~1.5:4~6。
[0028]
进一步优选地,所述右羟吗喃与碳酸钾的摩尔比为1:4。
[0029]
优选地,所述溶剂为丙酮、甲醇或乙腈。
[0030]
优选地,所述氢氧化钠水溶液浓度为1mol/l。
[0031]
优选地,所述调酸为用1mol/l盐酸溶液调节ph为6~7。
[0032]
所述右美沙芬半抗原在制备右美沙芬人工抗原中的应用也在本发明的保护范围之内。
[0033]
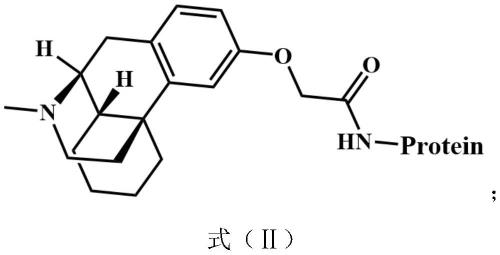
一种右美沙芬人工抗原,所述右美沙芬人工抗原的结构式如式(ⅱ)所示:
[0034][0035]
其中,protein为载体蛋白。
[0036]
优选地,所述载体蛋白为牛血清白蛋白(bovine serum albumin,bsa)、钥孔血蓝蛋白(keyhole limpet hemocyanin,klh)、乳铁蛋白(lactoferrin,lf)或者鸡卵清白蛋白(ovalbumin,ova)任意一种或几种。
[0037]
所述右美沙芬人工抗原的制备方法,是在式(i)所述右美沙芬半抗原dxm-2c的羧基上偶联载体蛋白得到。
[0038]
优选地,是通过活泼酯法偶联载体蛋白。
[0039]
作为上述方法的一个具体实施方式,所述右美沙芬人工抗原的制备方法,包括如下步骤:
[0040]
(1)将dxm-2c与n-羟基丁二酰亚胺(nhs)、1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(edc)溶解于n,n-二甲基甲酰胺(dmf)中,室温下避光搅拌2~4h,得到dxm-2c活化液;
[0041]
(2)将载体蛋白加入到pbs缓冲液(0.01mol/l,ph=7.4)中;
[0042]
(3)将步骤(1)的dxm-2c活化液缓慢逐滴加入步骤(2)的载体蛋白缓冲溶液中,4℃反应12h;
[0043]
(4)用pbs缓冲液透析步骤(3)所得反应液,即得右美沙芬人工抗原。
[0044]
优选地,步骤(1)中所述dxm-2c、nhs与edc的质量比为1~2:1~2:2~3。
[0045]
更优选地,步骤(1)中所述dxm-2c、nhs与edc的质量比为1:1.6:2。
[0046]
优选地,步骤(2)中所述载体蛋白与pbs缓冲液的质量体积比为10mg:1ml。
[0047]
优选地,步骤(1)中所述dxm-2c与步骤(2)中所述载体蛋白的质量比为1~5:3~8。
[0048]
更优选地,步骤(1)中所述dxm-2c与步骤(2)中所述载体蛋白的质量比为1:4。
[0049]
优选地,步骤(4)中所述透析为三天,每天3次。
[0050]
所述右美沙芬人工抗原在制备右美沙芬抗体中的应用也在本发明的保护范围之内。
[0051]
一种右美沙芬抗体,是以上述任一所述右美沙芬人工抗原免疫动物制备得到。
[0052]
优选地,所述右美沙芬抗体是利用以载体蛋白为钥孔血蓝蛋白(klh)的右美沙芬人工抗原(dxm-2c-klh)免疫动物制备得到。
[0053]
优选地,所述右美沙芬抗体为单克隆抗体或多克隆抗体。
[0054]
作为上述方法的一个具体实施方式,右美沙芬多克隆抗体的制备方法包括如下步骤:
[0055]
(1)将制备好的半抗原dxm-2c偶联钥孔血蓝蛋白的人工抗原(dxm-2c-klh)作为免疫原与等量的免疫佐剂(第一次免疫用完全弗氏佐剂,以后加强免疫均用弗氏不完全佐剂)乳化均匀,免疫动物。将2.5~3kg的新西兰大白兔分别采用背部皮下、各部位皮下、腿部肌肉和耳缘静脉多种注射方式免疫,4周后第二次免疫,以后每间隔3周加强免疫一次。第三次加强免疫后1周耳缘静脉取血,并利用间接竞争elisa测定血清效价。当效价不再上升时,采用耳缘静脉加强免疫;
[0056]
(2)加强免疫一周后心脏采血,水浴0.5~1h,4℃、10000rpm/min离心15min,取上清即为抗血清。抗血清采用硫酸铵沉淀法纯化的到多克隆抗体。
[0057]
由上述方法制备得到的右美沙芬多克隆抗体也在本发明的保护范围之内。
[0058]
所述右美沙芬人工抗原、右美沙芬抗体在检测右美沙芬和/或制备检测右美沙芬的产品中的应用也在本发明的保护范围之内。
[0059]
一种右美沙芬胶体金快速检测卡,包括pvc底板和依次排列在底板上的样品垫、金标结合物垫、硝酸纤维素膜和吸水垫,所述金标结合物垫内吸附有胶体金标记的人工抗原(dxm-2c-klh)免疫动物制备得到的特异性抗体,所述硝酸纤维素膜上喷涂了质控线和检测线,所述检测线用包被抗原溶液喷涂所得,所述质控线用羊抗兔抗体喷涂所得。
[0060]
优选地,所述金标结合物垫内吸附有胶体金标记的人工抗原dxm-2c-klh免疫动物制备得到的特异性抗体。
[0061]
优选地,所述包被抗原为以载体蛋白为鸡卵清蛋白的人工抗原dxm-2c-ova。
[0062]
一种检测右美沙芬的免疫分析方法,以上述任一所述右美沙芬人工抗原为包被抗原,以上述任一所述右美沙芬抗体为检测抗体进行检测。
[0063]
优选地,是以载体蛋白为鸡卵清蛋白的人工抗原dxm-2c-ova作为包被抗原,以载体蛋白为钥孔血蓝蛋白的人工抗原dxm-2c-klh免疫动物制备得到的特异性抗体进行检测。
[0064]
所述免疫分析方法包括但不局限于酶免疫分析、免疫层析、免疫传感、免疫胶体金等。
[0065]
与现有技术相比,本发明具有以下效益:
[0066]
本发明提供了一种右美沙芬半抗原,应用该半抗原制备得到了右美沙芬人工抗原、并进一步免疫动物制备得到用于检测右美沙芬的特异性抗体,应用人工抗原作为包被原,该抗体对右美沙芬具有良好的特异性和检测灵敏度,其对右美沙芬半抑制浓度为4.42ng/ml,检测限为0.18ng/ml,定量检测范围为0.59~33.37ng/ml,对其他结构类似物和功能类似物均无交叉反应,利用所述抗体建立了一种高灵敏、稳定、快速检测右美沙芬的免疫分析方法,实现了对右美沙芬快速检测目的;同时本发明还开发了基于所述右美沙芬人工抗原、抗体的胶体金快速检测试剂盒,能够特异性识别右美沙芬,具有灵敏度高,特异性强的特点。
附图说明
[0067]
图1为本发明实施例1的右美沙芬半抗原(dxm-2c)的合成路线图。
(((4bs,8as,9s)-11-甲基-6,7,8,8a,9,10-六氢化-5h-9,4b-(亚氨基乙醇)菲胺-3-基)氧基)乙酸。
[0085]
实施例2右美沙芬人工抗原的制备与鉴定
[0086]
1、右美沙芬人工抗原的制备
[0087]
将实施例1制备的右美沙芬半抗原(dxm-2c),通过活泼酯法偶联钥孔血蓝蛋白(klh)、鸡卵清白蛋白(ova)和乳铁蛋白(lf);
[0088]
(1)分别称取10mg实施例1制备的dxm-2c,2mg的nhs和3mg的edc溶解于50~100μl dmf中,室温下避光搅拌2~4h得到右美沙芬半抗原活化液;
[0089]
(2)分别称取10mg钥孔血蓝蛋白(klh)、鸡卵清白蛋白(ova)和乳铁蛋白(lf)加入到1ml的pbs缓冲液(0.01mol/l,ph=7.4)中;
[0090]
(3)将步骤(1)所得右美沙芬半抗原活化液逐滴缓慢加入到步骤(2)所得载体蛋白缓冲溶液中,4℃搅拌12h;
[0091]
(4)用pbs缓冲液透析三天,每天3次,透析结束后得到右美沙芬人工抗原(dxm-2c-klh、dxm-2c-ova、dxm-2c-lf),分装于离心管中,于-20℃保存,以供使用。
[0092]
其中,磷酸盐缓冲溶液的配方:na2hpo4·
12h2o2.90g,nacl 8.50g,kcl 0.20g,kh2po
4 0.20g,加蒸馏水定容至1000ml。
[0093]
2、右美沙芬人工抗原的鉴定
[0094]
取上述合成的右美沙芬人工抗原(dxm-2c-klh、dxm-2c-ova、dxm-2c-lf),进行紫外全波长扫描,结果如图2、图3、图4所示。
[0095]
具体地,klh、dxm-2c、dxm-2c-klh分别进行紫外(200~400nm)扫描鉴定,并通过比较偶联前后的各物质的最高吸光值,发现右美沙芬免疫原dxm-2c-klh的吸收曲线与载体蛋白klh明显不同,dxm-2c在320nm处有一个特征峰,而偶联反应后,在280nm处,dxm-2c-klh的吸收峰明显比klh高,且对比dxm-2c的曲线可看出发生显著位移(图2)。由于在偶联后的透析过程已经将未反应的药物等小分子成分全部透析去除,因此偶联产物出现的药物特征峰是由蛋白结合的药物分子贡献的,故说明反应产物是载体蛋白klh与dxm-2c的复合物,dxm-2c-klh偶联成功。
[0096]
具体地,ova、dxm-2c、dxm-2c-ova分别进行紫外(200~400nm)扫描鉴定,并通过比较偶联前后的各物质的最高吸光值,发现右美沙芬人工抗原dxm-2c-ova的吸收曲线与载体蛋白ova明显不同,dxm-2c在320nm处有一个特征峰,而偶联反应后,在280nm处,dxm-2c-ova的吸收峰明显比ova高,且对比dxm-2c的曲线可看出发生显著位移(图3)。由于在偶联后的透析过程已经将未反应的药物等小分子成分全部透析去除,因此偶联产物出现的药物特征峰是由蛋白结合的药物分子贡献的,故说明反应产物是载体蛋白ova与dxm-2c的复合物,dxm-2c-ova偶联成功。
[0097]
具体地,lf、dxm-2c、dxm-2c-lf分别进行紫外(200~400nm)扫描鉴定,并通过比较偶联前后的各物质的最高吸光值,发现右美沙芬人工抗原dxm-2c-lf的吸收曲线与载体蛋白lf明显不同,dxm-2c在320nm处有一个特征峰,而偶联反应后,在280nm处,dxm-2c-lf的吸收峰明显比lf高,且对比dxm-2c的曲线可看出发生显著位移(图4)。由于在偶联后的透析过程已经将未反应的药物等小分子成分全部透析去除,因此偶联产物出现的药物特征峰是由蛋白结合的药物分子贡献的,故说明反应产物是载体蛋白lf与dxm-2c的复合物,dxm-2c-lf
偶联成功。
[0098]
实施例3抗体的制备
[0099]
1、多克隆抗体的制备
[0100]
将实施例2制备的dxm-2c偶联钥孔血蓝蛋白(klh)的右美沙芬人工抗原dxm-2c-klh和dxm-2c偶联乳铁蛋白(lf)的右美沙芬人工抗原dxm-2c-lf分别作为免疫原,与等量的免疫佐剂(第一次免疫用完全弗氏佐剂,以后加强免疫均用弗氏不完全佐剂)乳化均匀,免疫动物。将2.5~3kg的新西兰大白兔分别采用背部皮下、各部位皮下、腿部肌肉和耳缘静脉多种注射方式免疫,4周后第二次免疫,以后每间隔3周加强免疫一次。第三次加强免疫后1周耳缘静脉取血,并利用间接竞争elisa测定血清效价。当效价不再上升时,采用耳缘静脉加强免疫。加强免疫一周后心脏采血,水浴0.5~1h,4℃、10000rpm/min离心15min,取上清即为抗血清。抗血清采用硫酸铵沉淀法纯化后得到多克隆抗体,于-20℃冻存备用。
[0101]
2、单克隆抗体的制备
[0102]
将实施例2制备的dxm-2c偶联钥孔血蓝蛋白klh的右美沙芬人工抗原dxm-2c-klh和dxm-2c偶联乳铁蛋白lf的右美沙芬人工抗原dxm-2c-lf分别作为免疫原,与等量的免疫佐剂(第一次免疫用完全弗氏佐剂,以后加强免疫均用弗氏不完全佐剂)乳化均匀,免疫巴比西小鼠,采用腹部皮下多点注射法免疫小鼠,每次加强免疫1周后,采小鼠尾部静脉血检测血清效价,待抗体效价不再升高后,再进行一次加强免疫,7天后取小鼠脾细胞与小鼠骨髓瘤细胞进行融合。采用hat培养基中筛选出杂交瘤细胞后用完全培养基进行细胞培养。用ic-elisa方法对细胞上清进行检测,将检测结果为强阳性的孔内细胞进行有限稀释法克隆培养,一周后再次检测、挑孔、再克隆。经3次克隆培养检测后,获得单克隆抗体的杂交瘤细胞。将杂交瘤细胞放大培养后,接种至小鼠腹腔,产生含抗体的腹水。腹水用辛酸-硫酸铵沉淀法纯化后得到单克隆抗体,-20℃冻存备用。
[0103]
实施例4右美沙芬免疫原和包被原的筛选
[0104]
分别利用实施例3的dxm-2c-klh和dxm-2c-lf作为免疫原免疫动物后得到的抗体,通过间接竞争elisa方法进行包被原的筛选,以实施例2制备得到的人工抗原dxm-2c-klh、dxm-2c-lf和dxm-2c-ova作为包被原;通过间接竞争elisa方法获得的血清效价和抑制率来选择最佳的免疫原和包被原。
[0105]
一种筛选右美沙芬免疫原和包被原的间接竞争elisa方法,包括以下步骤:
[0106]
(1)分别将实施例2制备的人工抗原dxm-2c-klh、dxm-2c-ova和dxm-2c-lf作为包被原,用包被液稀释至1μg/ml,包被96孔酶标板,每孔加入100μl,37℃温育过夜(12h);
[0107]
(2)弃去包被液,洗涤2次,拍干;
[0108]
(3)每孔加入120μl封闭液(即1%鱼皮胶原蛋白),37℃封闭3h;
[0109]
(4)弃去封闭液,拍板,37℃烘干30min后取出;
[0110]
(5)用pbst将实施例3制备的右美沙芬多克隆抗体倍比稀释成七个梯度,即1:8000、1:16000、1:32000、1:64000、1:128000、1:256000、1:512000,同时设置空白对照孔(用pbst代替);并将右美沙芬药物稀释至1μg/ml;
[0111]
(6)效价列:每孔加50μl的pbst,再将倍比稀释得到抗体按每孔50μl依次加入孔内,最后一个孔不加抗体,用50μl pbst代替;
[0112]
抑制列:每孔加50μl的药物,再将倍比稀释得到抗体按每孔50μl依次加入孔内,最
后一个孔不加抗体,用50μl pbst代替;在37℃温育40min,洗涤5次,拍干;
[0113]
(7)加入羊抗兔二抗-hrp(5000倍稀释)100μl/孔,37℃孵育30min,洗涤五次,拍干;
[0114]
(8)加入显色液,每孔100μl,显色10min;
[0115]
(9)加入50μl 2mol/l的h2so4溶液终止反应,并在450nm处读取od值。
[0116]
效价是od
450
为1.0左右所对应的抗体稀释倍数。
[0117]
抑制率=(效价的od值-抑制的od值)/抑制的od值*100%。
[0118]
不同免疫原与包被原组合的血清效价和抑制率结果如表1所示。
[0119]
表1不同免疫原与包被原组合的血清效价和抑制率
[0120][0121][0122]
从表1中可以看出,不同的右美沙芬人工抗原作为免疫原免疫的新西兰大白兔产生的抗体均有一定的效价;同时,所得抗体对目标分析物右美沙芬均有不同程度的抑制效果。其中,编号1的免疫原和包被原组合所示的效价1:256000和抑制率88.43%,高于编号2、3、4的免疫原和包被原组合的效价和抑制率,由此可以说明编号1的免疫原和包被原不仅能特异性识别目标分析物右美沙芬,而且抗体灵敏度好,故将dxm-2c-klh作为最佳的免疫原、dxm-2c-ova作为最佳的包被原。
[0123]
实施例5右美沙芬的间接竞争elisa检测方法的建立
[0124]
1、实验方法
[0125]
一种检测右美沙芬的间接竞争elisa方法,包括以下步骤:
[0126]
(1)将实施例2制备的人工抗原dxm-2c-ova作为包被原,用包被液稀释至50μg/l,包被96孔酶标板,每孔加入100μl,37℃温育过夜(12h);
[0127]
(2)弃去包被液,洗涤2次,拍干;
[0128]
(3)每孔加入120μl封闭液(即6%脱脂奶粉),37℃封闭3h;
[0129]
(4)弃去封闭液,拍板,37℃烘干30min后取出;
[0130]
(5)用pbst将实施例3制备的右美沙芬多克隆抗体稀释16000倍,并将右美沙芬标准品稀释至1000μg/l,200μg/l,40μg/l,8μg/l,1.6μg/l,0.32μg/l,0.064μg/l,0.0128μg/l;
[0131]
(6)每行加50μl右美沙芬药物稀释液(三组平行),再加入50μl/孔实施例3制备的右美沙芬多克隆抗体稀释液,在37℃温育40min,洗涤5次,拍干;
[0132]
(7)加入羊抗兔二抗-hrp(5000倍稀释)100μl/孔,37℃孵育30min,洗涤五次,拍干;
[0133]
(8)加入显色液,每孔100μl,显色10min;
[0134]
(9)加入50μl 2mol/l的h2so4溶液终止反应,并在450nm处读取od值。
[0135]
2、实验结果
[0136]
用于检测右美沙芬的抗体间接竞争elisa标准曲线如图5所示,从图5可知实施3制备的右美沙芬多克隆抗体对右美沙芬的半抑制浓度ic
50
为4.42ng/ml,检测限为0.18ng/ml,定量检测范围为0.59~33.37ng/ml,说明本发明制备得到的用于检测右美沙芬的抗体可以满足检测要求,且对右美沙芬的识别能力强。
[0137]
实施例6用于检测右美沙芬的抗体的特异性评价
[0138]
1、实验方法
[0139]
将实施例5中的药物右美沙芬换成地塞米松、泼尼松龙、倍他米松和福尔可定,并以同样的稀释倍数进行上述试验,测定实施例3制备的多克隆抗体对其他结构及功能类似物的交叉反应率。
[0140]
通过右美沙芬与其结构及功能类似物进行交叉反应实验来确定用于检测右美沙芬的特异性,其抗体的特异性用交叉反应率(cr)表示,交叉反应率越小,特异性越强。将右美沙芬结构及其功能类似物(地塞米松、泼尼松龙、倍他米松和福尔可定)分别作倍比稀释,采用间接竞争elisa法进行测定,步骤同实施例5的灵敏度验证方法,得到各结构及功能类似物的ic
50
值,按照以下公式计算右美沙芬交叉反应率(cr):
[0141]
cr(%)=ic
50
(右美沙芬)/ic
50
(结构及功能类似物)
×
100%
[0142]
2、实验结果
[0143]
右美沙芬与其结构及功能类似物的交叉反应结果如表2所示。
[0144]
表2右美沙芬与其结构及功能类似物的交叉反应结果
[0145][0146]
注:nr表示无反应。
[0147]
从表2可知,用于检测右美沙芬的抗体对地塞米松、泼尼松龙、倍他米松和福尔可定均无交叉反应;说明用于检测右美沙芬的实施例3制备的多克隆抗体对右美沙芬的特异性强,可有效地排除其结构及功能类似物(地塞米松、泼尼松龙、倍他米松和福尔可定)对右美沙芬的干扰,能够专门用于对右美沙芬的检测。
[0148]
实施例7检测右美沙芬的elisa试剂盒的开发
[0149]
1、组建检测右美沙芬的试剂盒,所述试剂盒包含下述各部分:
[0150]
(1)包被有包被原的酶标板的制备:将实施例2制备的人工抗原dxm-2c-ova作为包被原,用包被缓冲液将包被原稀释成50μg/l,每孔加入100μl,37℃避光孵育过夜,倾去孔中液体,用洗涤液洗涤2次,每次30s,拍干,然后在每孔中加入200μl封闭液,25℃避光孵育2h,倾去孔内液体拍干,干燥后用铝膜真空密封保存;包被缓冲液为ph值为9.6,0.05mol/l的碳酸盐缓冲液,封闭液为ph值为7.1~7.5,含有1%~3%酪蛋白、0.1~0.3mol/l的磷酸盐缓
冲液;
[0151]
(2)右美沙芬标准品溶液:8个浓度梯度,分别为1000μg/l,200μg/l,40μg/l,8μg/l,1.6μg/l,0.32μg/l,0.064μg/l,0.0128μg/l;
[0152]
(3)实施例3制备的右美沙芬多克隆抗体;
[0153]
(4)酶结合物:辣根过氧化物酶标记的实施例3制备的右美沙芬多克隆抗体;
[0154]
(5)底物显色液:由a液和b液组成,a液为过氧化脲,b液为四甲基联苯胺;
[0155]
(6)终止液为2mol/l的h2so4;
[0156]
(7)洗涤液为ph值为7.4,含有0.5%~1.0%吐温-20、0.01%~0.03%叠氮化钠防腐剂、0.1~0.3mol/l的磷酸盐缓冲液,所述百分比为重量体积百分比。
[0157]
2、实际样品检测
[0158]
将样品和标准品对应微孔按序编号,每个样品和标准品做2孔平行,并记录标准孔和样品孔所在的位置。根据需要量将酶结合物浓缩液用酶结合物稀释液按1:10体积比进行稀释(即一份酶结合物浓缩液加入10份酶结合物稀释液,现配现用)。加入标准品/样品50μl到对应的微孔中,然后加入酶结合物工作液50μl,轻轻震荡混匀,用盖板膜盖板后置25℃避光环境中反应30min。将孔内液体甩干,加入洗涤工作液250μl/孔。充分洗涤4~5次,每次间隔10s,泼掉板孔内洗涤液,用吸水纸拍干(拍干后未被清楚的气泡可食用未使用过的枪头戳破)。加入底物显色液a液50μl/孔,再加入底物显色液b液50μl/孔,轻轻振荡混匀,用盖板膜盖板后置25℃避光环境中反应10min.加入终止液50μl/孔,轻轻振荡混匀,设定酶标仪与450nm处,测定每孔od值。
[0159]
3、检测结果分析
[0160]
标准品或样本的百分吸光率等于标准品或样本的吸光度值的平均值(双孔)除以第一个标准品(0标准)的吸光度值的平均值,再乘以100%。以标准品百分吸光率为纵坐标,以右美沙芬标准品浓度(μg/l)的对数为横坐标,绘制标准曲线图。将样本的百分吸光率代入标准曲线中,从标准曲线上读出样本所对应的浓度,乘以其对应的稀释倍数即为样本中右美沙芬的实际浓度。
[0161]
实施例8右美沙芬胶体金快速检测试纸条的开发
[0162]
1、胶体金快速检测试纸条的组装
[0163]
胶体金快速检测试纸条是由硝酸纤维素膜(nc膜)1、金标结合物垫4、样品垫3、吸水垫5和pvc底板2叠加而成。具体来讲,用xyz三维喷点划膜仪将包被原(dxm-2c-ova)和羊抗兔igg以0.8μl/cm的喷量喷涂在nc膜上,用作测试线6和控制线7(t线和c线),两线位于nc膜1的中间并且彼此间隔7mm,37℃下干燥12h后,把nc膜1粘贴在衬板中间部位上,样品垫2与nc膜t线5端重叠1mm,吸水垫5粘贴在nc膜1上侧与其1重叠1mm,组装好的试纸板用斩切机切成3.50mm宽的试纸条。图6为右美沙芬胶体金快速检测试纸条的结构示意图。
[0164]
2、金标抗体的制备
[0165]
采用柠檬酸三钠还原氯金酸的方法制备平均直径在30nm的胶体金悬浮液。取1ml胶体金溶液,加入0.2mol/l的k2co3溶液调节ph到8.5左右,加入10μg抗体孵育30min,再加入10%bsa溶液孵育30min后在4℃10000rpm离心20min,并去上清,用200μl 0.2mol/l ph 7.4的磷酸盐缓冲溶液(包含0.5%吐温-20、0.5%bsa、5%蔗糖、0.3%pvp、0.03%procline-300)重悬,4℃保存。
[0166]
3、凉茶样品的检测
[0167]
(1)凉茶样品提取和净化
[0168]
吸取0.5ml凉茶,加入4.5ml 0.2mol/l ph 7.4的磷酸盐缓冲溶液进行稀释,涡旋混合30s,作为待测液。
[0169]
(2)检测步骤
[0170]
取150μl样品待测液加入微孔中,加入3μl金标抗体反复吸打混合均匀,室温孵育5min,随后将试纸条插入微孔中反应3min,随后取出试纸条去除样品垫,进行结果判定。
[0171]
(3)检测结果判定
[0172]
如图7所示,如果样品中不含有待测物右美沙芬,则金标抗体与快速检测是纸条上测试线(t线)上的包被原结合,使测试线显示一条清晰的红色线即表示检测样品为阴性(如图7a);如果样品中含有待测物右美沙芬,则右美沙芬与金标抗体进行结合而不能被快速检测试纸条上的测试线捕获,进而测试线不显色即表示为阳性(如图7b);同样,金标抗体也与纤维素膜上的质控线(c线)上的羊抗兔igg结合,使质控线显红色,质控线颜色的有或无分别表示此试纸条的有效或无效(如图7a、b为有效c、d为无效)。3~5分钟判定检测结果。
[0173]
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1