一种乙醇发酵过程中二氧化碳原位固定的方法
al.engineered yeast with a co
2 fixation pathway to improve the bio-ethanol production from xylose-mixed sugars.scientific reports,2017,7:43875)
5.甲酸脱氢酶(fdh)可将二氧化碳还原为可溶性的甲酸,目前已经被用于体外电化学方法固定二氧化碳的研究中,但是体外的二氧化碳固定需要电解水来提供额外的能量,且二氧化碳固定效率有待于进一步提高。
技术实现要素:
6.本发明提供了一种能够将乙醇生产过程中产生的二氧化碳原位固定的方法,是将甲酸脱氢酶在酿酒酵母中进行表达,并利用该重组酿酒酵母saccharomyces cerevisiae-fdh将葡萄糖发酵乙醇生产过程中生产的二氧化碳进行原位固定。二氧化碳固定过程是直接将细胞内产生的二氧化碳进行转化为甲酸,无需二氧化碳捕捉及额外供能,不影响菌体生长的情况下,加快了葡萄糖发酵过程,提高了乙醇产量,提高了总碳源回收率。
7.本发明的技术方案为:
8.一种乙醇发酵过程中二氧化碳原位固定的方法,包括以下步骤:
9.步骤1)pcr扩增甲酸脱氢酶并转化至乙醇发酵微生物中,获得重组菌株;
10.乙醇发酵微生物是酿酒酵母、其他微生物细菌、酵母菌、真菌的出发菌株及经基因工程改造过的菌株;过表达的关键酶是甲酸脱氢酶;很多种微生物中都存在甲酸脱氢酶,虽编码氨基酸不同,但均具有固定二氧化碳的作用;甲酸脱氢酶进行随机突变或定点突变,可进一步提高其固定二氧化碳的能力。
11.所述的过表达甲酸脱氢酶,可采用任何一种将甲酸脱氢酶过表达的方法,包括基因组整合或使用质粒;质粒选自天然的或重组质粒、黏粒、病毒或噬菌体。通过更换强启动子、提高拷贝数、密码子优化、添加利于表达的增强子,以在微生物发酵菌株中过表达甲酸脱氢酶。
12.步骤2)将重组菌株和对照菌株进行活化、种子培养、扩大培养;
13.步骤3)制备不同葡萄糖浓度的培养基(g/l):ynb 6.7,葡萄糖10-100,不含trp的氨基酸补充溶液;
14.制备不同(2-甲基咪唑锌盐maf-4)zif-8浓度的培养基(g/l):ynb 6.7,葡萄糖10-100,zif-8 0-1不含trp的氨基酸补充溶液;
15.步骤4)将经过步骤2)种子培养、扩大培养后的菌种接种至步骤3)中获得的培养基中进行发酵,其中,初始菌种浓度od
620
=1-10,发酵温度30-50℃,转速100-300rpm/min;
16.本发明的有益效果:
17.1.本发明利用fdh过表达的酿酒酵母发酵葡萄糖生产乙醇,可将副产物二氧化碳进行原位固定为甲酸盐。
18.2.与其他二氧化碳固定途径相比,在微生物体系中进行二氧化碳固定无需额外能量供应,且对氧气不敏感,有氧或无氧条件下均可以进行二氧化碳的转化。
19.3.fdh不仅可以将二氧化碳进行原位固定,还可以加快葡萄糖发酵速率,提高乙醇得率,提高碳源利用率。
附图说明
20.图1a和图1b显示过表达甲酸脱氢酶菌株和对照菌株在不同葡萄糖浓度下的发酵结果。从结果可以看出,在过表达甲酸脱氢酶后,将发酵过程中的部分二氧化碳转化为甲酸,且葡萄糖浓度越高甲酸产量越高。
21.图2a和图2b显示过表达甲酸脱氢酶菌株和对照菌株在不同接种量下的发酵效果。从结果可以看出,接种量越大,甲酸脱氢酶越多,甲酸产量越高。
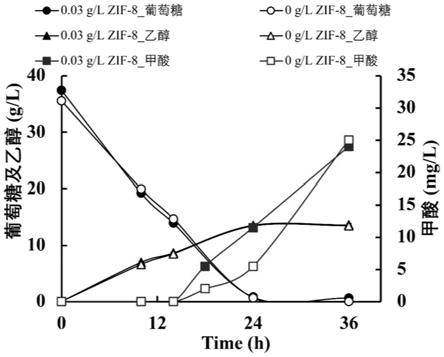
22.图3显示过表达甲酸脱氢酶菌株在添加zif-8下的发酵效果。从结果可以看出,通过zif-8增加培养基中的二氧化碳溶解度后,过表达甲酸脱氢酶菌株生产甲酸的效率提高。
具体实施方式
23.以下结合附图,通过实施例进一步说明本发明,但不作为对本发明的限制。以下提供了本发明实施方案中所使用的具体材料及其来源。但是,应当理解的是,这些仅仅是示例性的,并不意图限制本发明,与如下试剂和仪器的类型、型号、品质、性质或功能相同或相似的材料均可以用于实施本发明。甲酸脱氢酶的来源有很多,还可以通过随机突变和定点突变的方法提高其转化二氧化碳为甲酸的能力,这些内容亦属于本发明范畴。下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
24.实施例1:菌株s.cerevisiae-fdh的构建
25.以马克斯克鲁维酵母的基因组为模板进行pcr扩增得到fdh基因片段,pcr扩增所用试剂盒为hsdna polymerase(code no.:r010a)购于宝生物工程大连有限公司pcr反应按照试剂盒说明书进行。pcr扩增条件为99℃变性5min98℃15s60℃15s 72℃60s 30个循环后,72℃延伸7min,获得的fdh基因片段使用限制性核酸内切酶not i和sal i进行双酶切后接到prs424上,获得表达载体prs424-fdh,然后转化入酿酒酵母s288c中,得到过表达甲酸脱氢酶的重组菌株s.cerevisiae-fdh
26.实施例2:在20g/l葡萄糖下的发酵效果及甲酸产量
27.1)活化培养基的制备:活化培养基:ynb 6.7g/l,葡萄糖10g/l,不含trp的氨基酸补充溶液。
28.2)菌株的活化:取冰箱保藏的s.cerevisiae-fdh和对照菌株s.cerevisiae s288c接种至活化培养基中,置于摇床中30℃,150rpm培养48h。
29.3)种子培养基的制备:种子培养基:ynb 6.7g/l,葡萄糖20g/l,不含trp的氨基酸补充溶液。
30.4)步骤2)中取活化后的菌体转接至步骤3)中制备的种子培养基中,置于摇床中30℃,150rpm培养48h。
31.5)发酵培养基的制备:ynb 6.7g/l,葡萄糖20g/l,不含trp的氨基酸补充溶液。
32.6)菌种经活化、种子扩大培养后,离心收集细胞,使各个菌种初始od
620
保持一致(=0.3)接种至发酵培养基中,30℃,150rpm培养1-5d。
33.实验结果如图1a所示,在20g/l葡萄糖的情况下,过表达了甲酸脱氢酶基因的s.cerevisiae-fdh较对照菌株生产了更多的甲酸,分别产生了12.5mg/l和8.5mg/l,甲酸产量提高近50%。说明fdh具有原位固定乙醇生产中释放的二氧化碳的能力。而且在相同葡萄
糖浓度下,过表达了甲酸脱氢酶基因的s.cerevisiae-fdh,与对照菌株相比,s.cerevisiae-fdh发酵葡萄糖速度更快,发酵终点由72小时缩短到48小时;乙醇得率更高,分别为0.30g/g和0.32g/g,以上实验结果说明,过表达甲酸脱氢酶基因后,重组菌株s.cerevisiae-fdh不仅提高了对二氧化碳的原位固定能力,产物乙醇得率也有明显提高。
34.实施例2:在40g/l葡萄糖下的发酵效果及甲酸产量
35.1)取冰箱保藏的s.cerevisiae-fdh和对照菌株s.cerevisiae s288c接种至活化培养基中,本实施例采用与实施例1中相同的活化、种子扩大培养。不同之处在于本实施例中发酵培养基葡萄糖浓度为40g/l。
36.2)菌种经活化、种子扩大培养后,离心收集细胞,使各个菌种初始od
620
=0.3接种至发酵培养基中,30℃,150rpm培养1-5d。
37.实验结果如图1b所示,在40g/l葡萄糖的情况下,过表达了甲酸脱氢酶基因的s.cerevisiae-fdh较对照菌株生产了更多的甲酸。实验结果表明,与实施例1相比,随葡萄糖浓度升高,产生的二氧化碳量增加,生产的甲酸量随之增加。进一步说明fdh具有原位固定乙醇生产中释放的二氧化碳的作用。在相同葡萄糖浓度下,过表达了甲酸脱氢酶基因的s.cerevisiae-fdh会生产更多的甲酸,分别为31.5mg/l和24mg/l;与对照菌株相比,s.cerevisiae-fdh发酵葡萄糖速度更快、乙醇得率更高,分别为0.30g/g和0.33g/g。以上实验结果说明,过表达甲酸脱氢酶基因后,重组菌株s.cerevisiae-fdh不仅提高了对二氧化碳的原位固定能力,产物乙醇得率也有明显提高,提高了10%左右,发酵时间缩短1/3。
38.实施例3:接种量od
620
=1下的发酵效果及甲酸产量
39.1)活化培养基的制备:活化培养基:ynb 6.7g/l,葡萄糖10g/l,不含trp的氨基酸补充溶液。
40.2)菌株的活化:取冰箱保藏的s.cerevisiae-fdh和对照菌株s.cerevisiae s288c接种至活化培养基中,置于摇床中30℃,150rpm培养48h。
41.3)种子培养基的制备:种子培养基:ynb 6.7g/l,葡萄糖20g/l,不含trp的氨基酸补充溶液。
42.4)步骤2)中取活化后的菌体转接至步骤3)中制备的种子培养基中,置于摇床中30℃,150rpm培养48h。
43.5)发酵培养基的制备:鉴别培养基:ynb 6.7g/l,葡萄糖40g/l,不含trp的氨基酸补充溶液。
44.6)菌种经活化、种子扩大培养后,离心收集细胞,使各个菌种初始od
620
保持一致为1,接种至发酵培养基中,30℃,150rpm培养1-5d。
45.实施例4:接种量od
620
=3下的发酵效果及甲酸产量
46.1)取冰箱保藏的s.cerevisiae-fdh和对照菌株s.cerevisiae s288c接种至活化培养基中,本实施例采用与实施例3中相同的活化、种子扩大培养。不同之处在于本实施例中,发酵接种量为od
620
=3。
47.2)菌种经活化、种子扩大培养后,离心收集细胞,使各个菌种初始od
620
=3接种至发酵培养基中,30℃,150rpm培养1-5d。
48.实验结果如图2所示,在40g/l葡萄糖的情况下,过表达了甲酸脱氢酶基因的s.cerevisiae-fdh在不同接种量(即不同的甲酸脱氢酶酶量)的情况下(od
620
=1,图2a;
od
620
=3,图2b),较对照菌株均生产了更多的甲酸,分别生产了13.5mg/l和7mg/l,33mg/l和14mg/l;s.cerevisiae-fdh在不同接种量(即不同的甲酸脱氢酶酶量)的情况下,甲酸产量由od
620
=1时的13.5mg/l提高到od
620
=3时的33mg/l,乙醇得率由0.35g/g提高至0.38g/g,说明甲酸脱氢酶酶量越多,不仅固定下来的二氧化碳越多且乙醇得率更高,减少乙醇发酵过程中产生的二氧化碳损失。
49.实施例5:添加zif-8对二氧化碳固定的影响
50.1)活化培养基的制备:活化培养基:ynb 6.7g/l,葡萄糖10g/l,不含trp的氨基酸补充溶液。
51.2)菌株的活化:取冰箱保藏的s.cerevisiae-fdh和对照菌株s.cerevisiae s288c接种至活化培养基中,置于摇床中30℃,150rpm培养48h。
52.3)种子培养基的制备:种子培养基:ynb 6.7g/l,葡萄糖20g/l,不含trp的氨基酸补充溶液。
53.4)步骤2)中取活化后的菌体转接至步骤3)中制备的种子培养基中,置于摇床中30℃,150rpm培养48h。
54.5)发酵培养基的制备:鉴别培养基:ynb 6.7g/l,葡萄糖35g/l,zif-8 0.03g/l,不含trp的氨基酸补充溶液。
55.6)菌种经活化、种子扩大培养后,离心收集细胞,使各个菌种初始od
620
保持一致为3,接种至发酵培养基中,30℃,150rpm培养1-5d。
56.实验结果如图3所示,在通过添加适量zif-8增加培养基中的二氧化碳后,过表达甲酸脱氢酶菌株生产甲酸的速度有所提高。在前24h内,与不添加zif-8相比,添加0.03g/lzif-8时,甲酸产量提高了6mg/l,生产效率提高了1.1倍。实验结果说明,zif-8可以吸附乙醇发酵过程中生产的二氧化碳,提高培养基中的二氧化碳溶解度,从而提高甲酸生产效率。有助于提高二氧化碳的固定量。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1