一种嵌合体抗原和抗金环蛇蛇毒制剂的制备方法及其应用与流程
活性片段,并以免疫扩散、酶联免疫吸附法(elisa)测定其抗体特异性和小鼠试验法测定其中和金环蛇蛇毒能力,得到了高纯度的抗金环蛇蛇毒血清(抗金环蛇蛇毒血清生产工艺的研究,2007)。但是,在我国还没有抗金环蛇蛇毒血清的生产。临床一般会采用抗银环蛇毒血清来治疗金环蛇咬伤,但抗银环蛇毒血清对金环蛇蛇毒的中和效价较低且血清使用量大。
5.根据蛋白质组学测定,金环蛇蛇毒主要含有蛇毒金属酶(snake venom metalloprotease,svmp)、磷酸二酯酶(phospholipase a2,pla2)和l-氨基酸氧化酶(l-amino acid oxidase,laao)等等。本发明的申请人在前期金环蛇抗血清的研究中发现,svmp和laao蛋白的分子量大,所产生的抗体中容易检测到结合抗体。一些毒性较高但分子量较低的小分子蛋白或多肽类物质,不能很好的激发免疫应答反应,如磷酸二酯酶,它们的平均长度是100aa,分子量偏低,可能是产生抗体的效价低的原因。
6.抗毒素生产中最常使用的免疫佐剂是铝盐和弗氏佐剂。弗氏佐剂可以分为弗氏完全佐剂(fca)和弗氏不完全佐剂(fia),前者是由液体石蜡油、无水羊毛脂和磷酸缓冲盐制成,后者是在弗氏完全佐剂中加入杀死的分枝杆菌或卡介苗制成。弗氏完全佐剂被认为是最有效的,但它常引起注射部位的损伤、易残留,因此用于动物免疫的起始阶段。后续增强型免疫常使用fia、铝盐佐剂或盐溶液。目前研究发现的具有免疫佐剂效应的细胞因子有干扰素(interferon,ifn)、淋巴因子(il-2、il-3、il-10等)、单核因子(il-1、il-12等)及其他细胞因子如肿瘤坏子因子(tumor necrosis factor,tnf)、巨噬细胞集落刺激因子(macrophage colony—stimulating factor,gm—csf)等。赛伦生物在细胞因子增强马匹的免疫效果的生产上取得了较好的效果,见专利cn201110090267.0(重组马gmcsf的制备方法及相关马gmcsf核苷酸序列)和cn201710468372.0(一种免疫马用的免疫佐剂)。
7.在lgg、f(ab’)2片段或fab片段纯化的历史中,硫酸铵或硫酸钠盐析的工艺是使用最悠久的纯化方法。但是,沉淀法所获得的免疫球蛋白收率低(大约40%~50%)且终产品中不仅会含有较多的非lgg蛋白(如白蛋白),而且在目标蛋白沉淀分离的过程中势必会引起蛋白的聚集。近40年来,基于色谱包括阴阳离子交换层析(如deae-sepharose或q-sepharose快速离子交换柱)和疏水柱层析的纯化方法已用于抗蛇毒免疫球蛋白产品的生产。这些介质对于去除血浆中的大分子效果较沉淀法较差。对于药品的疗效和安全都是很大的隐患(抗蛇毒免疫球蛋白药物研发的现状和策略,田靖2015)。
技术实现要素:
8.为了获得能够激发免疫应答反应获得高效价抗金环蛇蛇毒的f(ab’)2或抗体,本发明公开了一种嵌合体抗原。该嵌合体抗原为马igg的fc和4个金环蛇蛇毒磷酸二酯酶的嵌合体蛋白;所述马igg选自马igg4、igg1-3或igg5-7;所述4个金环蛇蛇毒磷酸二酯酶为pa2b1突变截短体、pa2b2突变截短体、pa2b6突变截短体和pa2a截短体;
9.所述pa2b1突变截短体为序列号q90wa7的第49位k突变为a并去除前端27个氨基酸残基;所述pa2b2突变截短体为序列号q90wa8的第49位k突变为a并去除前端27个氨基酸残基;所述pa2b6突变截短体为序列号p00627的第23位k突变为a并去除前端17个氨基酸残基;所述pa2a截短体为序列号p0c551去除前端17个氨基酸残基。
10.在一些实施方案中,包括i链和ii链;所述i链由fc的i链和分设在所述fc的i链两端的pla2组成;所述ii链由fc的ii链和分设在所述fc的ii链两端的pla2组成;所述fc的i链
和所述fc的ii链的核苷酸序列分别如seq id no:13和seq id no:15所示;
11.所述pla2选自第一pla2、第二pla2、第三pla2或第四pla2;所述第一pla2、所述第二pla2、所述第三pla2和所述第四pla2的核苷酸序列分别如seq id no:3、seq id no:4、seq id no:5和seq id no:6所示;所述嵌合体抗原有且仅有一个拷贝的所述第一pla2、所述第二pla2、所述第三pla2和所述第四pla2。
12.在一些实施方案中,所述i链的核苷酸序列如seq id no:16所示;所示ii链的核苷酸序列如seq id no:17所示。
13.在一些实施方案中,所述嵌合体抗原通过cho细胞系表达获得。
14.本发明还公开了一种马抗金环蛇蛇毒制剂的制备方法,所述马抗金环蛇蛇毒制剂包含马抗金环蛇蛇毒f(ab’)2;所述马抗金环蛇蛇毒f(ab’)2通过以灭活金环蛇蛇毒和如上所述的嵌合体抗原混合物作为抗原,辅以佐剂,免疫马匹来制备获得;
15.所述佐剂包括seb+il-4+il-6;所述seb+il-4+il-6为金黄色葡萄球菌的seb氨基酸序列、马il-4的氨基酸序列和马il-6的氨基酸序列通过链接肽连接组成的重组蛋白;所述金黄色葡萄球菌的seb氨基酸序列、马il-4的氨基酸序列和马il-6的氨基酸序列分别如seq id no:21、seq id no:18和seq id no:19所示;所述链接肽的氨基酸序列为5
’‑
ggggsggggsggggs-3’(seq id no:23)。
16.在一些实施方案中,所述seb+il-4+il-6的核苷酸序列如seq id no:22所示。
17.在一些实施方案中,所述seb+il-4+il-6通过大肠杆菌表达获得。
18.在一些实施方案中,所述佐剂还包括羊毛脂、花生油中的一种或多种。
19.在一些实施方案中,所述佐剂还包括羊毛脂、花生油,且所述佐剂中羊毛脂与花生油的体积比为1:3,所述佐剂中所述seb+il-4+il-6的浓度为10-20μg/ml。进一步地,所述佐剂中所述seb+il-4+il-6的浓度为10μg/ml。
20.在一些实施方案中,所述灭活金环蛇蛇毒与如上所述的嵌合体抗原的混合比例为1:0.5-1,所述灭活金环蛇蛇毒与如上所述的嵌合体抗原的总蛋白浓度为0.2mg/ml。进一步地,所述灭活金环蛇蛇毒与如上所述的嵌合体抗原的混合比例为1:0.75。
21.在一些实施方案中,所述抗原(灭活金环蛇蛇毒和如上所述的嵌合体抗原混合物,所述灭活金环蛇蛇毒与如上所述的嵌合体抗原的混合比例为1:0.5-1,其蛋白浓度0.2mg/ml)与所述佐剂(包括seb+il-4+il-6、羊毛脂、花生油,且所述佐剂中羊毛脂与花生油的体积比为1:3,所述seb+il-4+il-6的浓度为10-20μg/ml)的体积比为1:0.5-2。进一步地,所述抗原与所述佐剂等体积。
22.在一些实施方案中,还包括第一纯化步骤,即从被免疫的所述马匹得到的抗血清中纯化出所述马抗金环蛇蛇毒f(ab’)2;所述第一纯化步骤包括:
23.s1、将-nh(ch2)mnh
2-nh2偶联到epoxy预活化偶联介质上得到偶联了配基的阴离子混合胶,其中m>2(优选地,m=7);
24.s2、胃酶消化被免疫马匹的血浆,得到胃酶消化后的样品;
25.s3、用所述步骤s1得到的偶联了配基的阴离子混合胶装柱后以柱层析的方式纯化所述步骤s2得到的胃酶消化后的样品,得到柱层析后的样品;
26.s4、超滤所述步骤s3得到的柱层析后的样品,得到所述马抗金环蛇蛇毒f(ab’)2。
27.在一些实施方案中,所述步骤s3中柱层析所用的上样缓冲液为含2%辛酸钠的
ph8.5
±
0.2的tris-cl。
28.进一步地,tris-cl的浓度是50mm。
29.在一些实施方案中,所述步骤s3中柱层析所用的洗脱缓冲液是10mm ph3.5
±
0.2的磷酸氢二钠-柠檬酸。
30.在一些实施方案中,所述马抗金环蛇蛇毒制剂还包含马抗金环蛇蛇毒fc;由所述马抗金环蛇蛇毒f(ab’)2和所述马抗金环蛇蛇毒fc组成完整的马抗金环蛇蛇毒抗体;所述完整的马抗金环蛇蛇毒抗体以灭活金环蛇蛇毒和如上所述的嵌合体抗原混合物作为抗原,辅以佐剂,免疫马匹来制备获得。
31.在一些实施方案中,还包括第二纯化步骤,即从被免疫的所述马匹得到的抗血清中纯化出完整的马抗金环蛇蛇毒抗体。
32.在一些实施方案中,免疫马匹的流程是:先进行前期免疫,再进行基础免疫,最后进行超免疫;
33.所述前期免疫是先用浓缩破伤风类毒素进行2次免疫;
34.所述基础免疫是按每匹马0.5ml所述抗原与所述佐剂的混合物/次,注射2次,首次和第二次之间间隔3周;
35.所述超免疫是将所述抗原与所述佐剂的混合物按照1ml、2ml、3ml、4ml、5ml、6ml、7ml 7个剂量梯度,剂量由小到大,每个剂量梯度间免疫间隔为2周,每个剂量梯度的注射部位均为马颈部或臀部皮下,分4点注射。
36.鼠kappa链的前导肽序列氨基酸序列如seq id no:1所示;鼠kappa链的前导肽序列核苷酸序列如seq id no:2所示。
37.本发明还提供如上所述的嵌合体抗原在制备马抗金环蛇蛇毒制剂方面的应用。
38.在一些实施方案中,所述马抗金环蛇蛇毒制剂还包含马抗金环蛇蛇毒f(ab’)2。
39.在一些实施方案中,所述马抗金环蛇蛇毒制剂还包含马抗金环蛇蛇毒fc;由所述马抗金环蛇蛇毒f(ab’)2和所述马抗金环蛇蛇毒fc组成完整的马抗金环蛇蛇毒抗体。
40.本发明采用新的制备方法研发特异性中和金环蛇蛇毒的抗金环蛇蛇毒血清,以取得对金环蛇咬伤后救治的良好效果。本发明重组表达了pla2不同形式,然后在小鼠水平上比较重组表达的pla2不同形式产生抗体的能力,选择较优形式fc-4pla2再用于马匹免疫。在本发明中,制作了il-4融合il-6、金色葡萄球菌的肠毒素b(seb)基因融合il-4和il-6,制作了新的佐剂,用于马匹免疫。混合模式层析是一种生物分离新方法,有效结合静电、疏水和氢键等相互作用,具有选择性好、吸附容量大、耐盐性强、洗脱温和等优点。在前期摸索实验中,发明人合成了多种化合物,偶联到基质上,测试它们纯化f(ab’)2的效果。在本发明中,采用7c3nmmc介质纯化胃酶消化后的产物,取得了良好的效果。
41.本发明的有益效果在于:首先,本发明筛选到的嵌合体抗原(比如fc-4pla2)和灭菌金环蛇蛇毒混合seb+il-4+il-6免疫马匹,比传统灭活金环蛇蛇毒用弗氏佐剂免疫马匹,其中和抗体效价增高了3倍以上,具有显著的效果。最后,自制了阴离子疏水性混合介质(即偶联了配基的阴离子混合胶),只需一步纯化就可以获得回收率达到55%且纯度90%以上的f(ab’)2,比传统的盐析和离子柱层析有显著的提高,该操作简单且成本低。因此本发明公开的抗原和免疫佐剂,以及由此制备f(ab’)2的方法设计巧妙,且抗血清采用高效介质纯化,从而可以高表达、高纯度(达到90%以上)地获得具有生物学活性的马抗金环蛇蛇毒的f
(ab’)2,该制备方法适合推广到其他抗血清的大生产中。
42.磷脂是细胞膜的重要组成,pla2能酶解磷脂,表达的pla2酶解细胞膜上的磷脂可导致细胞破裂。但是,pla2的活性位点是第49位赖氨酸(k),将其突变为a而失去活性就不会降解细胞膜了。
43.本发明在cho细胞系中分别表达且获得了产物:
①
pa2b1+pa2b2;
②
fc-4pla2,将它们分别免疫小鼠后,测定其抗体效价,发现fc-4pla2所产生的抗体具有最高的活性。
44.本发明在大肠杆菌中分别表达且获得了产物:
①
il-4+il-6;
②
seb+il-4+il-6,将它们分别混合灭活金环蛇蛇毒一起免疫小鼠。seb+il-4+il-6具有最佳刺激免疫反应效果。
45.在1体积的羊毛脂、3体积花生油中加入20μg/ml seb+il-4+il-6混合后作为佐剂,在每毫升佐剂中,加入等体积的0.2mg/ml抗原(按照质量比1:0.75混合的金环蛇蛇毒和fc-4pla2),将混合物免疫马匹,所产生的抗金环蛇蛇毒的抗血清其效价增高了3倍以上。
46.合成-nh(ch2)7nh-nh2并偶联了琼脂糖凝胶上,对胃酶消化后的血清进行纯化,竞争法elisa检测活性抗体的回收率可到了55%,hplc分析显示马抗金环蛇蛇毒f(ab’)2的纯度达到90%以上。
47.以下将结合附图对本发明的构思、具体结构及产生的技术效果作进一步说明,以充分地了解本发明的目的、特征和效果。
附图说明
48.图1是金环蛇蛇毒9个pla2蛋白序列比对。其中,高度保守区域用标识。:和.均表示保守性差。
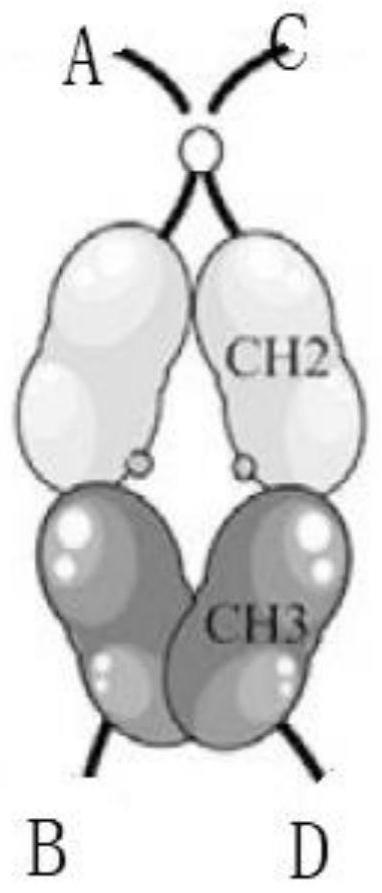
49.图2是fc-4pla2嵌合体结构示意图。其中a、b、c和d代表fc-4pla2嵌合体上四个可连接pa2b1突变截短体、pa2b2突变截短体、pa2b6突变截短体和pa2a截短体的位置。作为对称性,pa2b1突变截短体、pa2b2突变截短体、pa2b6突变截短体和pa2a截短体可在a、b、c和d这四个位置间互换。
50.图3是重组表达产物的sds-page图谱。其中泳道1-5依次为:1泳道:seb+il-4+il-6。2泳道:fc-4pla2。3泳道:蛋白marker(bio-rad,catalog#161-0374)从上至下:250kd、150kd、100kd、75kd、50kd、37kd和25kd。4泳道:pa2b1+pa2b2。5泳道:il-4+il-6。
51.图4是马抗金环蛇蛇毒的f(ab’)2制备过程血浆稀释液的hplc图谱。
52.图5是马抗金环蛇蛇毒的f(ab’)2制备过程胃酶消化后的hplc图谱。
53.图6是马抗金环蛇蛇毒的f(ab’)2制备过程偶联了配基的阴离子混合胶纯化后的hplc图谱。
具体实施方式
54.为了使发明实现的技术手段、创造特征、达成目的和功效易于明白了解,下结合具体图示,进一步阐述本发明。但本发明不仅限于以下实施的案例。
55.实施例1:pla2嵌合体的获得
56.1.1金环蛇pla2的核心保守序列区域
57.在uniprotkb库中(www.uniprot.org)以“pla2 fasciatus and reviewed:yes”为检索词,一共搜寻到12个pla2,经过分析发现有9个是蛇毒毒素中的pla2,包含1个a型和8个b
型,其相应的名称和蛋白序列见表1。
58.表1金环蛇蛇毒9个pla2基因名称及相应的蛋白序列
59.[0060][0061]
将这9个蛇毒毒素中的pla2采用多重序列比对(www.uniprot.org),以发现其高度保守序列(图1),根据图1中pla2序列的保守型,选取3个b型(pa2b1、pa2b2和pa2b6)和1个a型(pa2a)进一步研究。
[0062]
1.2pla2嵌合体载体构建
[0063]
1.2.1pa2b1(序列号q90wa7)
[0064]
q90wa7有145个氨基酸(aa),除去前面信号肽mnpahllvllavcvsllgaanippqpl端,将原序列第49位k(见表1q90wa7序列方框处)突变为a,最后将序列优化成适合哺乳动物细胞系表达,得到seq id no:3。
[0065]
1.2.2pa2b2(序列号q90wa8)
[0066]
q90wa8有145个氨基酸,除去前面信号肽mnpahllvllavcvsllaaanippqsl端,将原序列第49位k(见表1q90wa8序列方框处)突变为a,最后将序列优化成适合哺乳动物细胞系表达,得到seq id no:4。
[0067]
1.2.3pa2b6(序列号p00627)
[0068]
p00627有135个氨基酸,除去前面一部分信号肽avcvsllgaanippqsl端,将原序列第23位k(见表1p00627序列方框处)突变为a,最后将序列优化成适合哺乳动物细胞系表达,得到seq id no:5。
[0069]
1.2.4pa2a(序列号:p0c551)
[0070]
p0c551有142个氨基酸,除去前面一部分信号肽avcvsllgasiippqpl端,最后将序列优化成适合哺乳动物细胞系表达,得到seq id no:6。
[0071]
1.2.5pa2b1+pa2b2载体构建
[0072]
将seq id no:3和seq id no:4用seq id no:8连接,并在seq id no:35’端依次加上kozak序列、去掉5’端a碱基的编码鼠kappa链前导肽核苷酸序列和编码标签蛋白6*his的核苷酸序列,得到pa2b1+pa2b2的核苷酸序列(如seq id no:10所示)。采用bamhi和noti装入pcdna3.1(+)载体(购自invitrogem公司,usa)中,得到含pa2b1+pa2b2核苷酸序列的质粒。编码鼠kappa链前导肽的氨基酸序列如seq id no:1所示,核苷酸序列如seq id no:2所
示。
[0073]
1.2.6fc-4pla2嵌合体载体构建
[0074]
1.2.6.1马fc knobs-into-holes的构造
[0075]
由于马血清中igg4的含量最多,因此选择igg4的fc用于融合表达,从ncbi数据库中查得序列号:ay445518.1(见序列seq id no:11),该蛋白由327aa组成,其中第5-98的氨基酸组成ch1,第116-215的氨基酸组成ch2,第24-327的氨基酸组成ch3。
[0076]
在本发明中,去除第1-98aa而保留hinge和fc结构,并突变。其中一条链是双突变体(s189c/t203w),其氨基酸序列如seq id no:12所示,相应的核苷酸序列为seq id no:13;另一条是四突变体(y185c、t203s、e205a和y218v),其氨基酸序列如seq id no:14所示,相应的核苷酸序列为seq id no:15。
[0077]
1.2.6.2fc-4pla2质粒的构成
[0078]
依次将seq id no:3、seq id no:8、seq id no:13、seq id no:8和seq id no:4连接后,得到序列seq id no:16(该链的表达产物命名为i链)用bamhi和noti装入pcdna3.1(+)载体中,得到含i链核苷酸序列的质粒。也依次将seq id no:5、seq id no:8、seq id no:15、seq id no:8和seq id no:6连接后,得到序列seq id no:17(该链的表达产物命名为ii链)。采用bamhi和noti装入pcdna4.1(+)载体(购自invitrogem公司,usa)中,得到含ii链核苷酸序列的质粒。其表达产物(fc-4pla2嵌合体)的示意图见图2,作为对称性,seq id no:3、seq id no:4、seq id no:5和seq id no:6这四条序列可分别出现在表达产物的a、b、c、d四个位置上任意位置,只要保证这四个位置上序列不空缺且不重复出现某一条序列即可,即有4的阶乘(4!)种组合,见表2。
[0079]
表2四条序列与表达产物四个位置的对应方式
[0080]
[0081][0082]
本实施例中seq id no:3、seq id no:4是i链的组成部分,分别对应表达产物的a、b位置;seq id no:5和seq id no:6是ii链的组成部分,分别对应表达产物的c、d位置。由i和ii链组成的产物被命名为fc-4pla2。
[0083]
将2个序列pa2b1+pa2b2和fc-4pla2的序列送上海捷瑞生物,按照要求进行基因合成。
[0084]
1.3pla2单体和嵌合体的表达及纯化
[0085]
1.3.1pla2单体和嵌合体的表达
[0086]
参考质粒抽提试剂盒说明书,利用无内毒素大抽提试剂盒(cw2107北京康为世纪)进行3个质粒(含pa2b1+pa2b2核苷酸序列的质粒、含i链核苷酸序列的质粒和含ii链核苷酸序列的质粒)提取。同时,参考说明书,将cho-s细胞(购自gibco公司,usa)培养在cd cho培养基(gibco,10743-029)中,置于37℃,5%co2细胞培养箱中进行培养,准备好细胞后,使用伯乐电转仪将质粒转染到cho-s细胞中,其中fc-4pla2的2个质粒(含i链核苷酸序列的质粒和含ii链核苷酸序列的质粒)同时转染。
[0087]
分别在转染后第2天,培养温度下调到32℃,fc-4pla2转染的细胞采用zeocin和neomycin双抗体筛选,而转染pa2b1+pa2b2的细胞用neomycin加压筛选,培养14天后,1000*
g离心收获表达上清。
[0088]
1.3.2pa2b1+pa2b2表达产物纯化
[0089]
参考ge ni-sepharose层析柱纯化手册,其简略的流程如下:
[0090]
a取20毫升ni-sepharose 6fast flow(ge)装入1.6
×
10cm层析柱,凝胶先后用5倍柱体积纯水、5倍柱体积预处理缓冲液(ph8.0,含20mm tris-hcl、100mm nacl、20mm咪唑)洗涤。
[0091]
b细胞培养上清用0.45微米微孔滤膜过滤后以2ml/min流速过ni-sepharose层析柱。上样结束后,用10倍柱体积洗涤缓冲液(ph7.0,含20mm tris-hcl、100mm nacl、20mm咪唑)洗涤至od
280
值低于0.05,然后用第一洗脱缓冲液(ph7.0,含20mm tris-hcl、100mm nacl、250mm咪唑)洗脱,收集洗脱蛋白峰。
[0092]
c洗脱至od
280
值低于0.01,凝胶柱依次用2倍柱体积0.5n氢氧化钠,5倍柱体积纯化水,5倍柱体积20%乙醇清洗,凝胶柱保存在20%乙醇溶液中,2-8℃保存。
[0093]
1.3.3fc-4pla2的纯化
[0094]
表达上清用0.45微米滤膜过滤,利用protein g亲和层析柱(ge公司,美国)从表达上清中捕获所有带fc结构域的抗体,用平衡缓冲液(20mm磷酸缓冲液(pb),ph7.0)平衡层析柱后,过亲和层析柱,用第二洗脱缓冲液(20nm gly-cl,ph3.2)洗脱。通过sp阳离子交换层析(上海博格隆公司),用平衡缓冲液a(20mm pb,ph 6.0)平衡层析柱后,样品用双纯水稀释电导至3.0-3.5ms之间,过sp阳离子交换层析柱子结合后,用洗脱缓冲液b(20mm pb,1.5m nacl,ph 6.0)线性洗脱;最后浓缩,并用缓冲液pbs置换。
[0095]
结果:纯化后的2个质粒(含pa2b1+pa2b2核苷酸序列的质粒、fc-4pla2质粒)的表达产物进行了sds-page检测,所得蛋白分子大小符合理论值(图3),参考nano(thermo公司)操作手则,测定各表达产物的蛋白浓度,可以进行下一步实验。
[0096]
实施例2:重组马白介素单体和嵌合体的获得
[0097]
2.1载体构建
[0098]
2.1.1构建il-4+il-6表达质粒
[0099]
马il-4蛋白序列(genebank序列号:np_001075988.1)有127aa(见seq id no:18),其中前24个aa即片段mgltyqlipalvcllactsnfiqg是信号肽。类似地,马il-6蛋白序列(genebank序列号:np_001075965.2)有208aa(见seq id no:19),其中前25个aa即片段mnslftstvtpvafslglllvmata是信号肽。
[0100]
为了构建il-4+il-6表达载体,将seq id no:18和seq id no:19中的信号肽去除后,再根据大肠杆菌密码子偏好性优化,并用序列seq id no:9连接起来,得到序列seq id no:20。然后用ndei和xhoi酶将片段seq id no:20装入载体pet30a(+)(购自novagen公司,usa)。
[0101]
2.1.2seb+il-4+il-6质粒构建
[0102]
将序列seq id no:18、seq id no:19和seq id no:21(genbank:ay852244.1,ncbi中金黄色葡萄球菌的seb氨基酸序列)按照大肠杆菌密码子偏好性优化后,再用两段seq id no:9连接起来,得到序列seq id no:22。然后用ndei和xhoi酶将片段seq id no:22装入载体pet30a(+)。
[0103]
将2个质粒il-4+il-6和seb+il-4+il-6的序列送上海捷瑞生物,按照要求进行基
因合成。
[0104]
2.2在大肠杆菌中的表达和纯化
[0105]
1.挑取细胞株接种到50毫升含100微克/ml氨苄霉素的lb培养基中,37℃220rpm震荡培养过夜。
[0106]
2.在2l三角烧瓶加入500毫升lb培养基,均接种5毫升上述培养过夜的细胞液至含lb培养基500ml的锥形瓶,37℃摇床培养至od600=0.6-0.8,加入0.4mm iptg,温度调至30℃,220rpm培养6小时。
[0107]
3.离心收集菌体,加入100ml缓冲液(ph 8.0,含20mm tris-hcl、100mm nacl、20mm咪唑),重悬菌体,然后置冰浴超声破碎10min。
[0108]
4.超声破碎后的细胞裂解液4℃、12000g离心20min,取上清。
[0109]
5.参照实施例1的1.3.2的a、b、c三步常规性纯化执行。
[0110]
参考nano(thermo公司)操作手则,测定各表达产物的蛋白浓度。
[0111]
实施例3:pla2嵌合体、马白介素嵌合体免疫小鼠及效价检测
[0112]
3.1pa2b1+pa2b2和fc-4pla2的小鼠免疫
[0113]
参考文献(andreas h laustsen,exploration of immunoglobulin transcriptomes from mice immunized with three-finger toxins and phospholipases a2 from the central american coral snake,micrurus nigrocinctus,peerj preprints(2016)doi:10.7287/peerj.preprints.2364;laustsen ah,engmark m,clouser c,timberlake s,vigneault f,guti
é
rrez jm,lomonte b.2017.exploration of immunoglobulin transcriptomes from mice immunized with three-finger toxins and phospholipases a2from the central american coral snake,micrurus nigrocinctus.peerj 5:e2924https://doi.org/10.7717/peerj.2924),选取6只balb/c小鼠,随机分为两组,将2个重组表达的蛋白pa2b1+pa2b2和fc-4pla2分别作为抗原,弗氏佐剂作为佐剂,免疫小鼠,每只小鼠的免疫剂量8μg,一共免疫4次,然后取血按照实施例3的3.2的elisa法检测效价。
[0114]
3.2elisa法检测pa2b1+pa2b2和fc-4pla2的效价
[0115]
在96孔板中,每孔加入100μl含金环蛇蛇毒(购自广州蛇所)的5μg 0.05mol/l ph 9.6碳酸盐缓冲液,4℃包被过夜;用250μl封闭液37℃封闭2h;阳性血清以ph 7.4的磷酸盐缓冲液稀释100、200、400、800、1600倍,阴性血清(未进行抗原免疫小鼠血清)按阳性血清同倍稀释,每孔中加入100μl,每个稀释度重复3孔,检测取平均值,选择阳性血清与阴性血清a450比值(p/n值)最大的反应组,即为最好的抗原。
[0116]
结果:fc-4pla2比pa2b1+pa2b2有显著的提高,其od值可以到达2倍以上。因此,fc-4pla2被作为抗原,用于后续的马匹免疫。
[0117]
3.3il-4+il-6和seb+il-4+il-6的小鼠免疫
[0118]
参考赛伦生物专利《一种蛇毒灭活方法及由此制得的灭活蛇毒》(cn201110133500.9)所提供的方法,将金环蛇蛇毒灭活。
[0119]
以灭活金环蛇蛇毒作为抗原,以il-4+il-6和seb+il-4+il-6分别作为佐剂免疫小鼠,其流程同上实施例3的3.1。
[0120]
3.4elisa法检测il-4+il-6和seb+il-4+il-6的增强免疫效果
[0121]
检测方法同3.2。
[0122]
结论:
①
seb+il-4+il-6比il-4+il-6具有更好的效果,其od值可以到达1.5倍以上。可能是seb、il-4、il-6三者具有协同效应,用于后续的马匹免疫。
[0123]
实施例4:马匹免疫及中和效价检测
[0124]
4.1马匹免疫
[0125]
将灭活金环蛇蛇毒和fc-4pla2按照1:0.5、1:0.75和1:1混合后分别作为抗原,且三组抗原的总蛋白质浓度均为0.2mg/ml。1体积羊毛脂、3体积精制花生油经充分混匀后,加入seb+il-4+il-6使得seb+il-4+il-6的浓度各20μg/ml和10μg/ml作为佐剂。抗原与佐剂按照10:1的比例配合,一共形成6个样品,为实验组。对照组用灭活金环蛇蛇毒浓度0.2mg/ml混合弗氏佐剂。这7个样品用超声波细胞破碎仪超声处理至抗原与佐剂充分混匀呈乳胶状,见表3。
[0126]
表3、7个样品的组成和获得的抗体滴度
[0127][0128]
选21匹马,随机分7组,每组各3匹马,马匹免疫前先用浓缩破伤风类毒素进行2次前期免疫。基础免疫是按每匹马0.5ml/次,注射2次,首次和第二次之间间隔3周。基础免疫后测免疫马的血浆效价。有明显抗体应答反应的马匹再进行超免疫。超免疫剂量为1ml、2ml、3ml、4ml、5ml、6ml、7ml 7个剂量梯度,剂量由小到大,每个剂量梯度间免疫间隔为2周,每个剂量梯度的注射部位均为马颈部或臀部皮下,分4点注射。
[0129]
4.2小鼠法测定免疫马匹血清的抗金环蛇蛇毒的中和抗体滴度
[0130]
参考赛伦生物之前的专利《一种蛇毒灭活方法及由此制得的灭活蛇毒》(cn201110133500.9)所提供的方法,对4.1得到的免疫马匹血清的抗金环蛇蛇毒的抗体滴度进行测定。
[0131]
结果:对照组获得的抗体的滴度为80iu/mg,而实验组可达240-260iu/mg,见表3。
[0132]
结论:将灭活金环蛇蛇毒和fc-4pla2按照1:0.75混合作为抗原,在1体积羊毛脂、3体积精制花生油中加入10μg/ml或20μg/ml seb+il-4+il-6作为佐剂免疫马匹,获得的抗体的滴度是对照组的3倍左右(20μg/ml时为3倍以上)。这表明采用实验组的方案免疫马匹效果明显好于对照组。
[0133]
实施例5:阴离子混合胶的制备
[0134]
本发明采用配基是aminoalkyl型的阴离子型混合胶,虽然-nh(ch2)mnh-nh2(m》2)均可,本发明经过前期选择,发现-nh-ch
2-ch
2-ch
2-ch
2-ch
2-ch
2-ch
2-nh-nh2(即-nh(ch2)7nhnh2,申请人将之命名为7c3n mmc介质,是aminoalkyl型的阴离子型混合胶中的一种类型)具有优秀的性能,适合用于本发明的纯化。将-nh(ch2)7nhnh2请吉尔生化合成后,参考博格隆(上海)生物技术有限公司提供的epoxy偶联使用说明书操作手册,将-nh(ch2)7nhnh2偶联到epoxy预活化偶联介质上。
[0135]
制备过程:
①
清洗:用10-20倍去离子水冲洗保存于异丙醇中的环氧活化胶(一种epoxy预活化偶联介质,购自博格隆(上海)生物技术有限公司),除去异丙醇并抽干(重复5次以上),将10ml(约7.5g)抽干的凝胶加入到30ml的反应器;
②
偶联:称取100mg-nh(ch2)7nhnh2,溶解于5m1 0.lm碳酸钠碳酸氢钠缓冲液(ph10.5),加入到抽干的活化胶中,在37℃摇床中振摇,20-24h;
③
封闭:偶联结束后抽干凝胶,加入到100ml体积的三角瓶中,加入30ml 1mol/l乙醇胺溶液,反应温度恒定在37℃,搅拌速度120rpm,反应4h;
④
清洗:偶联的介质依次用5倍的去离子水、0.1m含0.5m nacl的醋酸钠缓冲液(ph4.0)充分洗涤,抽干,去除未反应的配基,得到偶联了配基的阴离子混合胶,本实施例中为偶联了7c3n mmc介质的阴离子混合胶;
⑤
保存:将偶联了7c3n mmc介质的阴离子混合胶于4℃、20%乙醇溶液中保存。
[0136]
实施例6:马抗金环蛇蛇毒的f(ab’)2的制备过程
[0137]
6.1胃酶消化
[0138]
取将灭活金环蛇蛇毒和fc-4pla2按照1:0.75混合作为抗原,在1体积羊毛脂、3体积精制花生油中加入10ug/ml seb+il-4+il-6作为佐剂免疫马匹所获得的血浆1l,加2升注射用水,以200rpm/min搅拌,将温度升至30℃,取样1ml用于高效液相色谱(hplc)检测。用2m hcl调节ph至3.0
±
0.2,200rpm/min搅拌,待ph值稳定后,按照每毫升血浆(稀释前的血浆)加入1.5mg的胃酶,200rpm/min搅拌消化1h,然后将ph值调至8.5,离心取上清,并取1ml样品用于hplc检测。
[0139]
6.2阴离子混合胶纯化
[0140]
a取实施例6的6.1所得样品100ml,加入2%辛酸钠,调节ph至8.5
±
0.2、电导《30。
[0141]
b取10ml实施例5得到的偶联了7c3n mmc介质的阴离子混合胶装入规格为16/20xk层析柱子(ge life science)中,并在akta avant 150蛋白纯化系统上运行。
[0142]
c用3倍柱体积(cv)的含2%辛酸钠的50mm tris-cl(ph8.5
±
0.2)平衡柱子。
[0143]
d按照每毫升凝胶的载量20mg蛋白的比例上样。
[0144]
e上样完毕用3cv的含2%辛酸钠的50mm tris-cl(ph8.5
±
0.2)洗涤。
[0145]
f用10mm磷酸氢二钠-柠檬酸(ph3.5
±
0.2)洗脱,出峰时,取1ml用于hplc。
[0146]
g用0.5naoh清洗柱子,然后加纯化水冲洗,待ph到了中性,泵入20%乙醇保存凝胶。
[0147]
结果:血浆稀释液的hpcl检测图谱见图4。胃酶消化后,上样纯化前hplc检测图谱见图5。上样纯化后,洗脱样品的hplc检测图谱见图6,其产物f(ab’)2的纯度用hplc检测可到达90%。
[0148]
6.3超滤
[0149]
参考pall life science的操作手册,将实施例6的6.2所得样品,用30kd的超滤膜包用pbs替换掉20mm naac缓冲液。
[0150]
6.4抗体活性回收率及纯度的检测
[0151]
6.4.1竞争法elisa检测活性抗体f(ab’)2的回收率
[0152]
6.4.1.1辛酸沉淀得到马抗金环蛇igg
[0153]
a取血浆原液100ml,加入超纯水200ml,缓慢滴加正辛酸原液,使终浓度为5%,并调节ph值保持在5-6之间;在室温下搅拌均匀后静置1小时。
[0154]
b上清液用4℃,20分钟,8000rpm/min条件进行离心取上清;将过滤的蛋白液上清用50kd的超滤膜包超滤3次,同时替换成pbs缓冲液。
[0155]
6.4.1.2过碘酸钠法辣根过氧化物酶(hrp)标记马抗金环蛇igg
[0156]
a称取30mg hrp溶解于6ml蒸馏水中,加入1.2ml新配的0.1m naio4溶液,室温下避光搅拌20分钟。将上述溶液装入透析袋中,对1mm ph4.4的醋酸钠缓冲液透析,4℃过夜。
[0157]
b加120μl 0.2m ph9.5碳酸盐缓冲液,使以上醛化hrp的ph升高到9.0~9.5,然后立即加入60mg马抗金环蛇igg(抗体)在6ml 0.01m碳酸盐缓冲液中,室温避光轻轻搅拌2小时。
[0158]
c加0.6ml新配的4mg/ml nabh4液,混匀,再置4℃2小时。将上述液装入透析袋中,对0.15m ph7.4 pbs透析,4℃过夜。
[0159]
d在搅拌下逐滴加入等体积饱和硫酸铵,置4℃1小时。
[0160]
e 3000rpm离心半小时,弃上清。沉淀物用半饱和硫酸铵洗二次,最后沉淀物溶于少量0.15m ph7.4的pbs中。
[0161]
f将上述溶液装入透析袋中,对0.15m ph7.4的pb缓冲盐水透析,去除铵离子后(用萘氏试剂检测),10,000rpm离心30分钟去除沉淀,上清液即为酶结合物(hrp标记马抗金环蛇igg),分装后,冰冻保存。
[0162]
6.4.1.3竞争法elisa检测活性抗体的回收率
[0163]
参考(酶免手册(2
nd
),2010,wily),用hrp标记马抗金环蛇igg与消化或纯化的中间产物,与底物竞争,确定其含量。
[0164]
a抗原包被:将灭活金环蛇蛇毒和重组表达的fc-4pla2按照1:0.75混合后,每孔包被5μg/ml,4℃过夜;
[0165]
b加入待测品:将马抗金环蛇血浆、胃酶消化步骤得到的样品、阴离子混合胶纯化步骤得到的样品、超滤步骤得到的样品按照1:400到1:40000比例稀释(即这四种样品的稀释比例下限是1:400,上限是1:40000)后加入抗原包被平板中。使得这四种样品分别与抗原包被平板中的抗原结合。
[0166]
c向抗原包被平板中继续加入hrp标记马抗金环蛇igg:将抗体浓度稀释为1.0mg/ml,并将抗体分别从1:1000开始倍半稀释(即2倍稀释)。用于结合未与待测品结合的抗原。
[0167]
d加入hrp的底物并终止读数,根据50%计算竞争度od450和稀释倍数计算含量。根据hrp与其底物反应来判断待测品的量,即计算抗体的回收率。
[0168]
结果显示:整个工艺操作简单,其超滤步骤得到的样品的抗体回收率可达55-60%,显著的高于目前的硫酸铵的40-50%和辛酸沉淀法的50%左右,而且是一步法纯化,操作简单且时间短。
[0169]
6.4.2hplc检测f(ab’)2的纯度
[0170]
参考安捷伦1200infinity ii的说明书及中国药典2015版,使用色谱柱g3000sw(tosoh公司,日本)。
[0171]
1、开启hplc,待仪器自检,进入工作站,选择方法(设置波长280nm,柱温25℃,流速0.6ml/min,运行时间为40min)。
[0172]
2.走基线:先用10%乙腈冲洗,再换上流动相含(含1%异丙醇的ph7.0、0.2mol/l磷酸盐缓冲液),平衡走基线。
[0173]
3.供试品溶液的制备:用流动相将供试品(这里指超滤步骤得到的样品)稀释至每1ml含蛋白质12mg的溶液。
[0174]
4.各取20μl稀释后的供试品溶液注入高效液相色谱仪进行分析,运行时间为40min,以保留时间定性,用面积归一法计算含量。
[0175]
结果:超滤步骤得到的样品的f(ab’)2纯度可到90%以上,合符药典的要求,比文献报道如综述(田靖等,药学学报2015,50(12):1573-1580)中提到所有的方法的高。
[0176]
以上详细描述了本发明的较佳具体实施例。应当理解,本领域的普通技术无需创造性劳动就可以根据本发明的构思作出诸多修改和变化。因此,凡本技术领域中技术人员依本发明的构思在现有技术的基础上通过逻辑分析、推理或者有限的实验可以得到的技术方案,皆应在由权利要求书所确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1