一种不依赖基因型的除虫菊遗传转化方法
1.本发明涉及除虫菊遗传转化技术领域,尤其涉及一种不依赖基因型的除虫菊遗传转化方法。
背景技术:
2.除虫菊(tanacetum cinerariifolium,syn.chrysanthemum cinerariif olium)为菊科宿根花卉,其含有的天然除虫菊酯对昆虫具有广谱的杀灭活性,对哺乳动物毒性较小,并且在光和空气中很容易降解为无毒物质,因其高效、低毒、低残留、环境友好等特点,受到农业领域和室内环保市场的广泛认可。为了满足市场需求,人们展开了以提高除虫菊酯含量为目的的科研及育种工作。然而,因缺乏一个稳定的遗传转化体系,当前对除虫菊酯的研究十分有限。
3.常规的农杆菌介导的遗传转化法,既利用根癌农杆菌侵染植物细胞,然后诱导转基因细胞再生为植物。该过程涉及细胞的脱分化、外源dna整合、细胞的再分化以及转基因芽的筛选。这些过程漫长且繁琐,往往外植体还未能完成再分化过程,就在农杆菌及抗生素双重胁迫下衰老死亡。到目前为止,只有一份利用该方法转化叶盘获得转基因除虫菊的报告,然而,该方法依赖一种具有很强再生能力的辐射突变体,绝大多数商业种植的除虫菊品系因再生困难,该方法难以实现。
4.植物种子中的芽分生组织可不经历脱分化及再分化过程而直接形成芽,其易于在体外培养且出芽迅速,变异率低。传统的利用种子分生组织作为转化材料的基因枪转化法,既利用基因枪将外源基因打入芽尖分生组织,然后分生组织分化为转基因芽,芽进一步筛选及成长形成转基因植物。目前,该方法已应用在许多植物的某些再生困难的品系中,如棉花、蓖麻、小麦、玉米。然而,以上案例中的植物均为自交系,其种子的基因背景一致。而除虫菊和大多数园艺植物一样,是一种自交不亲和的杂合植物,其种子遗传背景并不一致。因此,依赖这种方法的转化体系不适合用于除虫菊的生物学和功能基因组学研究。
5.除虫菊是一种再生困难且种子遗传背景复杂的植物,目前常用的两种方法,既利用无性系营养组织作为转化材料的转化法(依赖直接再生或间接再生的转化法)及利用基因枪介导的种子芽尖转化法(原位转化法)均不能很好的应用于除虫菊的遗传转化研究。一个可行的解决办法是用一个种子同时获得包括实验组与空载对照组在内的多种不同的转基因株系。虽然利用芽尖作为外植体可以攻克再生的难题,但基因枪法获得的转基因细胞其外源基因拷贝数高,如将实验载体与对照载体同时打入一个芽尖,这种情况下,一个细胞就极有可能同时含有两种载体的插入,这样就很难分离实验组与对照组植物。而根癌农杆菌介导的转化中,绝大多数转基因细胞只含有一个t-dna的插入(valvkes et al.,1988),同时,一个损伤的顶端分生组织可以通过损伤而缀化形成许多芽(nguyen et al.,2016),因此,如果使用含有实验载体和对照载体两种农杆菌的混合菌液转化芽尖顶端分生组织,则有可能获得实验组与对照组植物。
6.迄今为止,对再生困难且种子遗传背景复杂的植物的遗传转化研究相对较少,目
前已有的经典的转化方法在除虫菊的遗传转化中均存在一定的局限性。
7.为了解决上述问题,在现有技术的基础上提供了一种不依赖基因型的除虫菊遗传转化方法。
技术实现要素:
8.本发明的目的是提供一种不依赖基因型的除虫菊遗传转化方法,本发明取材容易,对材料的基因型要求不高,实验周期短,成本低,转基因过程中不易发生体细胞突变,可直接用于各种除虫菊栽培品系的转基因及各种要求的分子研究。
9.本发明的上述技术目的是通过以下技术方案得以实现的:
10.一种不依赖基因型的除虫菊遗传转化方法,步骤如下:
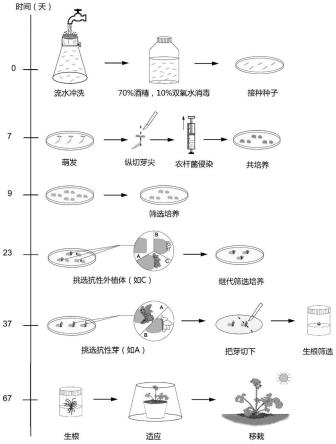
11.s1、将除虫菊种子置于流水中漂洗过夜,将除虫菊种子滤出并用70%的乙醇消毒1min,然后用无菌蒸馏水冲洗3次;再用10%的过氧化氢溶液对除虫菊种子进行40min的消毒,然后用无菌蒸馏水冲洗5次;将冲洗完毕的除虫菊种子接种在ms培养基中,萌发获得幼苗;
12.s2、从步骤s1获得的幼苗中选取无真叶幼苗,并在无菌的条件下切除无真叶幼苗的下胚轴,然后将其顶端分生组织纵切,获得残留1/2顶端分生组织的子叶;
13.s3、将处理好的子叶转移至注射器中,封堵注射器底端的注射口,从注射器顶端开口倒入od600=0.5的农杆菌菌液,然后向上拉动活塞,直至子叶完全沉入注射器底部;
14.s4、将经步骤s3中农杆菌菌液侵染后的子叶捞出,放置在无菌滤纸上吸除子叶表面多余的菌液,将子叶近轴面朝上接种于芽诱导培养基中,在黑暗培养2天;
15.s5、将子叶转移至筛选培养基中,14天后进行继代培养,继代培养14天后即可获得抗性芽;
16.s6、用无菌的手术刀将抗性芽与子叶分离,然后将抗性芽转移至生根筛选培养基中,30天后,生根的组培苗既是获得的转基因除虫菊。
17.进一步地,步骤s4中,所述芽诱导培养基包括ms基本培养基、1.5mg/l 6-ba和0.03mg/l naa。
18.进一步地,步骤s5中,所述筛选培养基包括ms基本培养基、1.5mg/l 6-ba、0.03mg/l naa、30mg/l卡那霉素和400mg/l头孢噻肟。
19.进一步地,步骤s6中,所述生根筛选培养基包括ms基本培养基、30mg/l卡那霉素和400mg/l头孢噻肟。
20.进一步地,所述ms培养基、芽诱导培养基、筛选培养基和生根筛选培养基均含有0.7%琼脂和3%蔗糖。
21.进一步地,所述ms培养基、芽诱导培养基、筛选培养基和生根筛选培养基均置于温度为24-26℃、光照时间为16h/d和光强为1200lux的条件下培养。
22.综上所述,本发明具有以下有益效果:本发明取材容易,对材料的基因型要求不高,即不依赖特定的除虫菊基因型,体细胞变异低,实验周期短,成本低,稳定转化频率约为0.33%-0.66%,可直接用于各种除虫菊栽培品系的转基因及各种要求的分子研究。
1;2:t
1-0-5;3:t
1-0-7);图4d为t
0-0、t
1-0-1、t
1-0-5和t
1-0-7的dna印迹杂交(m:marker;p:细菌质粒dna;wt ecori:野生型植物dna;0:t
0-0;1:t
1-0-1;2:t
1-0-5;3:t
1-0-7);图4e为未转化植物的组织化学染色;图4f为卡那霉素抗性幼苗的组织化学染色;图4g为染色叶片的放大图;标尺长度为1.0厘米。
40.实施例2:除虫菊标记基因gus的转化,步骤如下:
41.s1、将在4℃冰箱中储存两年的除虫菊种子(来自云南玉溪除虫菊生产基地)在1mg/l硝酸银溶液中浸泡一夜后,将除虫菊种子滤出并用70%的乙醇消毒2min,然后用无菌蒸馏水冲洗3次;再用10%的过氧化氢溶液对除虫菊种子进行40min的消毒,然后用无菌蒸馏水冲洗5次;将冲洗完毕的除虫菊种子接种在ms培养基中,萌发获得幼苗;
42.s2、从步骤s1中获得的幼苗中选取无真叶幼苗,并在无菌的条件下,用锋利的飞鹰刀片切除无真叶幼苗的下胚轴,然后将其顶端分生组织纵切,获得残留1/2顶端分生组织的子叶;
43.s3、用yep液体培养基培养含有经构建的pbi121载体的农杆菌至od
600
为0.5,用含有100um乙酰丁香酮的液体ms基本培养基重悬农杆菌;
44.将处理好的子叶转移至50ml注射器中,封堵注射器底端的注射口,从注射器顶端开口倒入od
600
=0.5的农杆菌菌液,然后向上拉动活塞,直至子叶完全沉入注射器底部;
45.s4、将经步骤s3侵染后的子叶捞出,放置在无菌滤纸上吸除子叶表面多余的菌液,将子叶近轴面朝上接种于芽诱导培养基中,在黑暗培养2天;
46.s5、将子叶转移至筛选培养基中,培养14天后继代一次,继代培养14天后即可获得抗性芽;
47.s6、将外植体进行组织化学染色,如图5所示,芽呈现gus基因经染色后特有的蓝色。
48.实施例3:除虫菊tcchs酶基因过表达的稳定转化,其步骤如下:
49.s1、将除虫菊种子(来自肯尼亚的除虫菊生产基地)在自来水中浸泡一夜后,将除虫菊种子滤出并用70%的乙醇消毒1min,然后用无菌蒸馏水冲洗3次;再用10%的过氧化氢溶液对除虫菊种子进行40min的消毒,然后用无菌蒸馏水冲洗5次;将冲洗完毕的除虫菊种子接种在ms培养基中,萌发获得幼苗;
50.s2、从步骤s1中获得的幼苗中选取无真叶幼苗,并在无菌的条件下,用锋利的飞鹰刀片切除无真叶幼苗的下胚轴,然后将其顶端分生组织纵切,获得残留1/2顶端分生组织的子叶;
51.s3、用yep液体培养基培养含有经构建的pbinplus载体的农杆菌至od
600
为0.5,用含有100um乙酰丁香酮的液体ms基本培养基重悬农杆菌;该载体来自hu等(2018),启动子为菊花的rbcs1启动子,超量表达tcchs基因,如图6a所示,图6a为pbinplus载体结构示意图。
52.将处理好的子叶转移至50ml注射器中,封堵注射器底端的注射口,从注射器顶端开口倒入od
600
=0.5的农杆菌菌液,然后向上拉动活塞,直至子叶完全沉入注射器底部;
53.s4、将经步骤s3侵染后的子叶捞出,放置在无菌滤纸上吸除子叶表面多余的菌液,将子叶近轴面朝上接种于芽诱导培养基中,在黑暗培养2天;
54.s5、将子叶转移至筛选培养基中,培养14天后继代一次,继代培养14天后即可获得抗性芽;
55.s6、用无菌的手术刀将抗性芽与子叶分离,舍弃无抗性的芽,然后将抗性芽转移至生根筛选培养基中,30天后,生根的组培苗既是获得的转基因除虫菊。
56.将生根的植株(t
0-0)在组培条件下分株扩繁,并利用dna印迹杂交区分不同的转基因株系。
57.将不同的转基因株系(t
0-0-1、t
0-0-5、t
0-0-7)移栽到浇灌ms溶液的无菌蛭石中,在高湿下保持30天后,将适应后的幼苗转移到土壤中。种植1年后,分别收获不同转基因株系的种子,进一步利用pcr、dna印迹杂交及组织化学染色进行验证。
58.在含30mg/l卡那霉素的ms培养基中继代筛选近一年后,选取如图6b所示的抗性植物ox
0-1和ox
0-2;进一步利用pcr及qrt-pcr进行验证,如图6c和6d所示;其中,图6b为在添加30mg/l卡那霉素的ms培养基上筛选ox
0-1和ox
0-2转基因株系(nt:未转化的植物)。图6c为从ox
0-1和ox
0-2的pcr阳性检测(m:marker;+:细菌质粒dna;-:野生型植物dna;1:ox
0-1;2:ox
0-2);图6d为对ox
0-1和ox
0-2中的tcchs表达水平进行qrt-pcr分析。
59.通过上述技术方案,本发明取材容易,对材料的基因型要求不高,即不依赖特定的除虫菊基因型,体细胞变异低,实验周期短,成本低,稳定转化频率约为0.33%-0.66%,可直接用于各种除虫菊栽培品系的转基因及各种要求的分子研究。
60.本具体实施例仅仅是对本发明的解释,其并不是对本发明的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本发明的权利要求范围内都受到专利法的保护。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1