一种仿生功能化蛋白基膜材料及其应用
1.本发明属于医学材料制备技术领域,具体涉及一种仿生功能化蛋白基膜材料及其应用。
背景技术:
2.膜生物材料属于生物支架材料,是组织工程与再生医学领域的基础材料。理想的膜生物材料不仅具备良好的生物相容性,可调控的生物降解性及易加工性等组织工程支架材料的一般特性,还可为细胞生长提供良好的三维空间,促进和维持细胞的生理活性。
3.目前膜生物材料主要有天然来源和合成来源两个方向,而不同来源的膜具有不同的特点和缺陷。天然来源的膜如壳聚糖膜、丝素蛋白膜和胶原蛋白膜等具有良好的生物相容性,但是其降解速率往往不可控,力学性能、加工性能也较差,常难以符合医学应用的要求。而pla、pga和plga等合成高分子膜材料虽然可以弥补天然材料所存在的缺点,但是大多数合成材料的安全性能有待考量。因此,能够模拟细胞外基质环境、基于仿生学生物设计理念的天然来源蛋白材料就成为生物材料的研究重点。
4.天然蛋白基膜材料不仅具有良好的生物可降解性和生物相容性、分子可修饰性等应用优势,而且具有调整机体间相互作用的生物学活性功能特征。随着海洋资源的开发与利用,海洋仿生蛋白材料的发掘与研究成为全球瞩目的焦点。来源于鱼类、海藻、海绵和水母等海洋生物的胶原蛋白材料,与哺乳动物胶原蛋白相比,具有高吸水性、弹性强、耐高温、耐细菌攻击、无动物病毒等优点,广泛应用于生物医学领域,如药物和基因传递系统,也可作为干细胞再生医学中的支架。
技术实现要素:
5.本发明的目的是提供一种仿生功能化蛋白基膜材料及其应用,所制备的仿生功能化蛋白基膜材料具有更好的缓释型,并可与抗菌肽相连接,使制备的膜具有抗菌性。
6.本发明首先提供用于制备生物膜的多肽,所述的多肽包含有:
7.1)氨基酸序列为seq id no:1的多肽:
8.dectskgqctaldgvtcvslgqqrlekcntytcrrsnnvlkykivknllkckrpdgtsmdigvgekdetkctteicrrarnsdgtftltyrekpygcpltdgscllfgkrnkirnenkcldttctrrknkkgqyisrlknkyygcpnngvcedaeatrnnsctsymcvlskrrtlmkweilktgcktdegckydtdewtdpdasscvtrrcdvtfnptdktynsvnrvarhgcrasngtcyynsetwlendcytrrcdvtttdkgesmaaikiesgickdadgsckgygeamqyrsgaatlncvcdeaistqgypqgrpvcksp(seq id no:1)
9.2)在1)中取代、缺失、添加一个或几个氨基,由1)所衍生的多肽;
10.用于编码上述多肽的基因,其一种具体的序列为seq id no:2;
11.gatgaatgcaccagcaaaggtcagtgcaccgccctggatggcgtgacctgcgttagcctgggtcagcagcgcctggagaaatgcaatacctacacctgccgccgtagcaacaatgtgctgaaatataaaattgttaaaaatctgctgaaatgcaaacgcccggatggcactagcatggatattggcgtgggcgaaaaggacgaaaccaagtgcaccaccg
agatttgtcgccgtgcccgcaatagcgatggcaccttcaccctgacctatcgcgaaaaaccgtatggctgtccgctgaccgatggcagctgcctgctgttcggcaaacgcaacaagatccgcaacgaaaacaagtgcctggacaccacatgcacccgccgcaaaaacaaaaaaggtcagtatattagccgcctgaaaaacaaatattacggctgcccgaacaatggcgtgtgcgaagatgcagaagccacccgtaataatagttgcacctcatatatgtgtgttctttcgaaaaggcgtaccttgatgaagtgggaaatacttaagacaggttgtaaaacggacgaaggttgtaagtacgatacggacgagtggacggatccggacgcgtcttcctgtgttaccagacgctgtgacgtgaccttcaaccccaccgacaaaacatacaacagcgtcaacagagtcgcaaggcatggatgccgtgcttccaacggtacgtgttactataacagtgagacttggctggagaatgactgttacactaggcgctgtgacgtcactactacagataaaggtgaatcaatggcggcaattaaaattgaaagtggcatttgcaaggacgctgatggatcttgtaagggctacggggaggccatgcagtatcggtcgggtgctgctacgttgaactgtgtttgtgatgaagcaatatctacccagggttacccacaaggaagaccagtgtgtaaaagtccg(seq id no:2);
12.本发明所提供的多肽用于制备生物膜;
13.本发明再一个方面还提供一种生物膜,是使用所述多肽制备的。
14.更进一步,所述的多肽,其中还结合有具有抗菌活性的功能多肽片段;
15.所述的功能多肽片段,作为实施例的一种具体记载,为hbd1多肽,其氨基酸序列如下:
16.dhyncvssggqclysacpiftkiqgtcyrgkakcck(seq id no:3);
17.编码hbd1多肽的核酸序列如下:
18.gatcactacaactgcgttagcagcggtggccagtgcctgtacagcgcgtgcccgatcttcaccaaaatccagggcacctgctaccgtggcaaagcgaaatgctgcaaa(seq id no:4);
19.本发明所提供的生物膜可以在临床抗菌敷料中有广泛应用,包括体内外受损组织的修复及引导再生等。
20.本发明通过基因工程的方法将抗菌肽hbd1与扇贝足丝来源蛋白sbp5-2-f结合,在把抗菌肽负载于材料表面并且保持其活性的同时,又通过材料的固有属性降低抗菌肽的生理毒性。所制备的生物膜柔软透明、抗菌、湿环境下维持高延展性和抗拉强度,有效促进小鼠感染伤口的愈合。其有望成为在皮肤感染伤口治疗和伤口愈合中发挥卓越效果的可视化抗菌敷料,为感染伤口的管理和治疗开发新策略。
附图说明
21.图1:sbp5-2-f-pet32a重组克隆示意图;
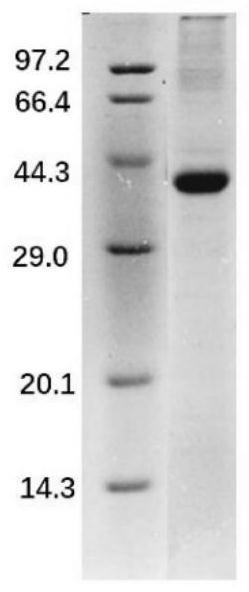
22.图2:sbp5-2-f纯化后sds-page电泳图;
23.图3:sbp5-2-f蛋白膜的照片图;
24.图4:sbp5-2-f蛋白膜交联前后的微观结构照片图;
25.图5:蛋白膜的机械性能稳定性图,其中图a为sbp5-2-f蛋白膜的机械性能图,图b为sbp5-2-f交联膜的机械性能图;
26.图6:rhb标准曲线的绘制图,其中a为rhb的最大吸收峰值,b为标准曲线;
27.图7:膜在不同条件下药物释放速率图;
28.图8:sbp-hbd1重组克隆结构示意图;
29.图9:sbp-hbd1纯化后sds-page电泳图;
30.图10:sbp-hbd1体外抗菌率图。
31.图11:小鼠感染伤口愈合情况图。
具体实施方式
32.在之前的研究中发明人发现sbp5-2蛋白的160-324位的多肽具有制备成丝纤维的功效。而通过进一步研究,发现sbp5-2蛋白的21-344位的多肽能够制成生物膜,从而促成了本发明。
33.sbp5-2蛋白的21-344位的多肽sbp5-2-f的氨基酸序列如seq id no:1所示,但本领域的普通技术人员在本发明公开内容的基础上,可以在seq id no:1的序列上通过取代、缺失、添加一个或几个氨基酸来获得衍生多肽,能够制备生物膜的衍生多肽也应属于本发明的保护范围。
34.在制备生物膜过程中,将sbp5-2-f多肽(或其衍生蛋白)溶于溶液中,再经过自然扩散均匀摊开后,待溶液挥发后制成生物膜。其中溶液浓度可以是60—120mg/ml,溶液的种类可以是水溶液或醇溶液;本发明实施例中使用的是六氟异丙醇溶液(hfip)。
35.在sbp5-2-f多肽的3
′
端或5
′
端可以通过多肽的连接接头来连接具有抗菌活性的多肽,从而使制备的生物膜具有抗菌活性。
36.在不影响膜的力学性能的情况下,可以选择任一抗菌肽。本发明实施例中使用了抗菌肽hbd-1。
37.下面结合实施例和附图对本发明进行详细的描述。
38.实施例1:多肽的重组表达
39.1.1蛋白重组克隆
40.利用一步克隆法获得sbp5-2-f重组克隆,实验室保存质粒50194-1-pet32a与50194-2-pet32a,以50194-2-pet32a作为载体,将50194-1插入到50194-2-pet32a的5’端。从50194-1的5’端和3’端分别设计正向引物和反向引物(含有50194-2-pet32a 5’端部分重复序列),扩增所需引物信息如下:
41.50194-1线性化引物(插入片段):
42.primer f:ccgatatcctgcagggtaccgatgaatgcaccagcaaaggtc
43.primer r:atatatgaggtgcaactgttattacgggtggcttctgcatc
44.50194-2-pet32a线性化引物(载体):
45.primer f:aacagttgcacctcatatatgtgtgt
46.primer r:ggtaccctgcaggatatcgga
47.将纯化后的pcr产物分别作为重组载体和插入片段,通过重组酶clonexpress构造了sbp5-2-f-pet32a表达载体。将构建好的重组载体转化入大肠杆菌bl21(de3)感受态细胞中,挑阳性克隆进行测序。测序结果显示插入的目的基因序列与预期一致。
48.1.2、sbp5-2-f蛋白的原核表达与纯化
49.1.2.1、sbp5-2-f-pet32a蛋白的原核表达
50.将sbp5-2-f-pet32a表达载体转化入大肠杆菌bl21(de3)感受态细胞中,将阳性克隆进行测序。测序结果显示基因序列与预期一致。挑取阳性克隆接种于含有卡那霉素抗性的5ml lb培养基中,将其作为种子液转接于含有卡那霉素抗性的1l lb培养基中,当菌液浓
度达到od
600
=0.6~0.8时加入0.2mm iptg进行蛋白诱导,37℃培养20h。在收集的菌体中加入1
×
pbs进行菌体重悬,利用超声波细胞破碎仪将菌体超声破碎,目标蛋白表达在包涵体中。
51.1.2.2、sbp5-2-f-pet32a蛋白包涵体纯化
52.1)每克菌体加入10ml 1
×
pbs缓冲液悬浮超声破碎,作用3s,间隔3s,功率50%,超声时间25min。12,000g,4℃离心15min后弃上清,留取沉淀。
53.2)沉淀加入等量1
×
pbs缓冲液悬浮超声洗涤,按照以上条件进行超声洗涤15min。12,000g,4℃离心15min留取沉淀。重复三次
54.3)沉淀加入等量1m尿素/1%甘油/1%tritonx-114/1mm edta,按照以上条件进行超声洗涤15min。12,000g,4℃离心15min留取沉淀。重复两次
55.4)使用8m尿素/20mm tris-hcl(ph 8.5)/10mm dtt变性缓冲液将纯化后的蛋白沉淀溶解。室温下于盘旋混合仪上溶解1h以上。12,000g,25℃离心15min,收集上清。
56.5)加入超纯水将蛋白浓度稀释至约1mg/ml,透析于20mm tris-hcl(ph 8.5),1mm dtt中(使用截留分子量8-14kda的透析袋),通过透析获得复性成功的蛋白。
57.6)将复性后的蛋白溶液进行sds-page电泳检测,检测结果如图所示;sbp5-2-f-pet32a理论分子量为39.5kda,电泳结果显示蛋白得到正确表达,且纯度较高。
58.实施例2:sbp5-2-f蛋白膜的制备
59.透析后的蛋白溶液冻干获得蛋白冻干粉;蛋白冻干粉以60-120mg/ml的浓度添加1,1,1,3,3,3-六氟-2-丙醇(六氟异丙醇,hfip)溶解,移液器取10μl蛋白hfip溶液滴于载玻片上,溶液自然扩散均匀摊开,静置2min待六氟异丙醇挥发后滴加1
×
pbs缓冲液于载玻片上直至膜全部浸泡在液体里,膜在缓冲液中静置2min后即可用镊子揭下。所得膜如图所示,sbp5-2-f蛋白膜柔软透明,膜的形状可控,可在不同形状模具中制造多种形状的膜材料。
60.实施例3:蛋白膜的延展性测试和表面形貌观察
61.1、sbp5-2-f-pet32a蛋白膜表面形貌观察(sem)
62.100mg/ml sbp5-2-f蛋白溶液利用浇铸法制备成膜,膜用液氮速冻后置于冻干机冻干,在样品完全冻干之后利用真空喷镀法在膜表面镀一层铂金,使用扫描电子显微镜(hitachi s-4800)观察膜的孔径形态和大小。
63.图4中结果表明sbp5-2-f蛋白膜较为致密,表面呈现粗糙质感,局部有孔径不均匀的孔隙出现;0.5%戊二醛交联后膜的表面出现分布均匀,大小约为0.2μm左右的孔隙。随着膜孵育时间的延长,膜表面的结构趋于紧密,孔隙消失,在孵育第七天时两种膜表面均呈现光滑致密的状态。
64.2、sbp5-2-f-pet32a蛋白膜力学性能
65.移液枪吸取10μl蛋白溶液制成尺寸为15mm*6mm的矩形蛋白膜,膜在pbs中分别孵育1天,3天和7天。每组在相应的时间点取出6个薄膜,使用螺旋测微仪测量其厚度,膜两端固定于湿水的5mm切口的纸片上后立即固定在拉力机上,剪断两侧连接纸片,设定原始长度5mm,拉伸速度0.2mm/s和5hz的记录频率进行拉伸检测,计算断裂强度和断裂伸长率,记录应力-应变曲线。
66.断裂强度(mpa)=断裂荷载(n)/横截面积(mm2)
67.断裂伸长率(%)=伸长(cm)/原长(cm)*100%
68.结果如图5,sbp5-2-f蛋白膜具有优异的湿环境延展性,断裂伸长率达170%,拉伸强度为2.185
±
0.267mpa。sbp5-2-f蛋白膜的机械性能在湿环境中能维持3天的稳定性,0.5%戊二醛虽然交联处理后膜的应变大幅降低,应力明显增大,但是膜的机械性能可以维持7天的稳定。相较于胶原膜材料,sbp5-2-f蛋白膜湿环境下的延展性与稳定性为其在人体中的应用奠定了基础。
69.实施例4:sbp5-2-f蛋白膜的药物缓释效果
70.1.1、制备罗丹明b(rhb)pbs溶液的标准曲线
71.rhb用pbs溶解为2mg/ml,稀释至5μg/ml后置于96孔板中在酶标仪中测其在400-700nm的光吸收,得到最大的吸收峰即为检测波长。然后将rhb稀释成2mg/l、4mg/l、6mg/l、8mg/l、10mg/l,检测在最大吸收峰处的吸光度值为,得到以药物浓度为横坐标,吸光度为纵坐标的标准曲线。如图6所示,罗丹明pbs溶液的最大吸收峰值为550nm,得到标准曲线公式为y=0.0936x-0.0099,r2=0.9977。
72.1.2制备药物包埋膜
73.将rhb以1.5mg/ml的浓度溶解在六氟异丙醇中,稀释至500μg/ml后去溶解蛋白粉,制备成膜,膜在6ml pbs中浸泡10分钟,取浸泡液测其550nm处的吸光度值计算包封率。
74.1.3药物缓释速率的测定
75.sbp5-2-f蛋白膜浸泡在3ml的浸泡缓冲液中,37℃转速100rpm恒温振荡,于特定时间点吸取1ml浸泡缓冲液检测介质的吸光度值,并补加相同体积缓冲液。根据不同时间点吸光度值来计算药物释放速率。浸泡缓冲液设定两组,一组为1
×
pbs,另一组为含0.1u/ml蛋白酶xiv的1
×
pbs。
76.结果如图7所示,无酶条件下,膜上rhb在24h内呈现爆裂释放的状态,随着膜的浸泡降解,膜以较为平稳的速度缓慢释放药物,直至150h后,rhb的释放速率减缓,此时药物的释放量达到70%。而酶存在的条件下,膜的降解速率加快,对药物的缓释速率也随之加快,在50h内完成了90%药物的释放。膜的缓释药物速率可以通过酶的加入进行调节,稳定可控,可以满足临床不同的给药需求。
77.实施例5:制备具有抗菌活性的生物膜
78.1、sbp-hbd1-pet32a的重组克隆
79.将sbp5-2-f多肽与抗菌肽hbd1通过一段(gs)4的linker相连接,将其插入载体pet32a中,构建重组表达载体sbp-hbd1-pet32a(图8)。将构建好的重组载体转化入大肠杆菌bl21(de3)感受态细胞中,挑阳性克隆进行测序。测序结果显示插入的目的基因序列与预期一致;其中融合蛋白sbp-hbd1核酸序列如下所示:
80.gatgaatgcaccagcaaaggtcagtgcaccgccctggatggcgtgacctgcgttagcctgggtcagcagcgcctggagaaatgcaatacctacacctgccgccgtagcaacaatgtgctgaaatataaaattgttaaaaatctgctgaaatgcaaacgcccggatggcactagcatggatattggcgtgggcgaaaaggacgaaaccaagtgcaccaccgagatttgtcgccgtgcccgcaatagcgatggcaccttcaccctgacctatcgcgaaaaaccgtatggctgtccgctgaccgatggcagctgcctgctgttcggcaaacgcaacaagatccgcaacgaaaacaagtgcctggacaccacatgcacccgccgcaaaaacaaaaaaggtcagtatattagccgcctgaaaaacaaatattacggctgcccgaacaatggcgtgtgcgaagatgcagaagccacccgtaataatagttgcacctcatatatgtgtgttctttcgaaaaggcgtaccttgatgaagtgggaaatacttaagacaggttgtaaaacggacgaaggttgtaagtacgatacggacgagtggacggat
ccggacgcgtcttcctgtgttaccagacgctgtgacgtgaccttcaaccccaccgacaaaacatacaacagcgtcaacagagtcgcaaggcatggatgccgtgcttccaacggtacgtgttactataacagtgagacttggctggagaatgactgttacactaggcgctgtgacgtcactactacagataaaggtgaatcaatggcggcaattaaaattgaaagtggcatttgcaaggacgctgatggatcttgtaagggctacggggaggccatgcagtatcggtcgggtgctgctacgttgaactgtgtttgtgatgaagcaatatctacccagggttacccacaaggaagaccagtgtgtaaaagtccgggcagcggcagcggctctggtagcgatcactacaactgcgttagcagcggtggccagtgcctgtacagcgcgtgcccgatcttcaccaaaatccagggcacctgctaccgtggcaaagcgaaatgctgcaaa(seq id no:5)。
81.3.2.2sbp-hbd1-pet32a蛋白的原核表达与纯化
82.将sbp-hbd1-pet32a质粒转化入大肠杆菌bl21(de3)感受态细胞中,将阳性克隆进行测序。测序结果显示基因序列与预期一致。挑取阳性克隆接种于含有卡那霉素抗性的5ml lb培养基中,将其作为种子液转接于含有卡那霉素抗性的1l lb培养基中,当菌液浓度达到od
600
=0.6~0.8时加入0.2mm iptg进行蛋白诱导,16℃培养22h。在收集的菌体中加入1
×
pbs进行菌体重悬,利用超声波细胞破碎仪将菌体超声破碎,目标蛋白表达在包涵体中。
83.纯化步骤同sbp5-2-f蛋白的纯化方法,得到如图9所示纯度达标的重组蛋白。
84.3.2.3膜的制备
85.sbp-hbd1蛋白冻干粉按60mg/ml的浓度添加1,1,1,3,3,3-六氟-2-丙醇(六氟异丙醇,hfip)溶解。取40μl溶好的蛋白hfip溶液滴加于直径1cm,厚度为1mm的聚四氟乙烯圆形模具中,静置2min待hfip挥发干净后,在膜表面滴加pbs缓冲液于,直至膜全部浸泡在液体里,膜在缓冲液中静置2min后即可用镊子揭下。
86.3.2.4抗菌膜的活性研究
87.3.2.4.1体外抗菌活性
88.5ml试管中接30μl大肠杆菌菌液,37℃,180rpm培养5h。稀释成od
600
=0.15的菌悬液,将已做灭菌处理的sbp5-2-f蛋白膜和sbp-hbd1蛋白膜放入制得的菌悬液中共混培养1.5h后取出用水冲洗3遍。离心管中加入1ml pbs,然后将冲洗后的单张膜浸入其中,超声功率180w清洗10min使得膜上的菌与膜分离。取50μl pbs清洗液涂布平板,培养12h后对平板上的菌落计数统计。根据以下公式计算样品的抑菌率,估算样品的抗菌活性。每组进行3次平行实验。
89.抗菌率=(对照组菌落-实验组菌落)/对照组菌落*100%
90.结果表明,sbp-hbd1蛋白膜对大肠杆菌具有显著的抗菌效果,抗菌率高达84%。
91.3.2.4.2体内抗菌活性
92.7周龄c57雄性小鼠喂养驯化一周,腹腔注射0.1ml 4%水合氯醛麻醉小鼠。待麻醉完全后背部做剃毛处理,用碘伏和75%酒精对目标区域进行消毒。随后,用直径为6mm的活检穿孔器在小鼠背部皮肤上创建创面,将小鼠随机分为三组:
93.对照组(创面不做处理)
94.感染组(伤口处滴加20μl大肠杆菌菌悬液,悬液细胞数为1*108cfu/ml)
95.sbp-hbd1组(伤口处滴加20μl菌悬液,创面覆盖sbp-hbd1膜材料)
96.术后一天在sbp-hbd1组的小鼠伤口处滴加20μl浓度为1u/ml的蛋白酶xiv,对照组和感染组滴加等量无菌pbs,持续3天。术后第7天、14天用数字卡尺测量伤口直径并随机处死3只小鼠,从创面处取皮肤组织,用4%多聚甲醛溶液固定24h后做组织切片进行he染色。
97.结果如图11所示,对照组和sbp-hbd1组的伤口愈合速度明显快于感染组,说明sbp-hbd1有效抑制了伤口处感染菌的生长繁殖,促进了感染伤口的愈合。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1