抗CD38的抗体及其应用
抗cd38的抗体及其应用
技术领域
1.本发明属于细胞生物技术、免疫学领域,涉及抗cd38的抗体及其应用。
背景技术:
2.白细胞分化群表面抗原(cluster of differentiation,cd)38,简称cd38,是分子量为46kd的二类跨膜糖蛋白,包括含257个氨基酸残基的胞外区(extracellular domain,ecd结构域、含23个氨基酸残基的单次跨膜结构及含20个氨基酸的胞浆区(liu qun,kriksunov irina.a,graeff richard,et a1.crystal structure of human cd38 extracellular domain[j].structure,september,2005,13:1331-1339)。cd38基因跨度大约80kb,位于染色体4p15,包含8个外显子,其中外显子1编码胞浆区氨基酸、跨膜区、及胞外区的大约33个氨基酸(along sandy w.,comenzo raymond l.cd38 monoclonal antibody therapies for multiple myeloma[j].clinical师mphom,myeloma&leukemia,2015,15,no.l l:635-645)。
[0003]
cd38是一种在免疫细胞中广泛表达的多功能跨膜蛋白。在淋巴细胞、单核细胞、巨噬细胞、树突状细胞、粒细胞和自然杀伤细胞中,细胞表面cd38的表达水平取决于细胞的成熟和活化水平(kar a,mehrotra s,chatterjee s.cd38:tcell immuno-metabolic modulator[j].cells,20209(7).),现有证据表明,cd38在生理和病理环境中的各种细胞中都扮演着重要的角色。早期研究表明,人cd38可与多种膜蛋白/复合物建立侧向联系,如nk细胞中的cd16,t细胞中的tcr复合物与cd4,b淋巴细胞中的膜免疫球蛋白(ig)与b细胞共受体复合物(cd19/cd81),以及单核细胞中的ii类mhc复合物,研究认为cd38对这些复合体下游的细胞信号有潜在的贡献。基因敲除小鼠实验证明,cd38缺失将导致小鼠出现免疫系统损害、代谢紊乱等一系列生理变化。近年来研究发现cd38可能参与了多种自身免疫性疾病的发病过程(partida-sanchezs,rivero-naval,shi g,et a1.cd38:an ecto enzyme at the crossroads of innate and adapive immune responses.adv exp med biol.2007;590:171-183)。因此,研究抗cd38的抗体对于实现疾病的检测和治疗具有重要的意义。
技术实现要素:
[0004]
为了弥补现有技术的不足,本发明的目的在于提供一种抗cd38的单克隆抗体及其应用。
[0005]
具体方案如下:
[0006]
本发明的第一方面提供了一种抗cd38的单克隆抗体,所述单克隆抗体包括含有三个cdr的重链可变区和三个cdr的轻链可变区;其中,所述重链可变区cdr1、cdr2、cdr3的氨基酸序列如seq id no.1、2、3所示,轻链可变区cdr1、cdr2、cdr3的氨基酸序列如seq id no.9、10、11所示。
[0007]
在一些实施方案中,所述重链可变区还包括重链可变区框架区fr1、fr2、fr3和fr4;轻链可变区还包括轻链可变区框架区fr1、fr2、fr3和fr4,其中,重链可变区框架区
fr1、fr2、fr3和fr4的氨基酸序列如seq id no.4、5、6、7所示;轻链可变区框架区fr1、fr2、fr3和fr4的氨基酸序列如seq id no.12、13、14、15所示。
[0008]
在一些实施方案中,所述单克隆抗体包含:
[0009]
(a)与seq id no.8的氨基酸序列具有至少90%,优选95%序列同一性的重链可变区序列;
[0010]
(b)与seq id no.16的氨基酸序列具有至少90%,优选95%序列同一性的轻链可变区序列;或者
[0011]
(c)如(a)中的重链可变区序列和如(b)中的轻链可变区序列。
[0012]
在优选的实施方案中,所述单克隆抗体重链可变区的氨基酸序列如seq id no.8所示,轻链可变区的氨基酸序列如seq id no.16所示。
[0013]
在进一步的实施方案中,所述单克隆抗体包含抗体重链恒定区和/或抗体轻链恒定区的全部或者部分。
[0014]
在一些实施方案中,所述单克隆抗体重链的亚型为igm亚型。
[0015]
在一些实施方案中,所述单克隆抗体轻链的亚型为κ亚型。
[0016]
本发明的第二方面提供了核酸分子,所述核酸分子编码本发明第一方面所述的单克隆抗体或其功能片段。
[0017]
进一步,编码重链可变区的cdr1、cdr2、cdr3核酸分子具有与seq id no.17、18、19所示的核苷酸序列至少90%,优选95%序列的同一性的序列;
[0018]
编码轻链可变区的cdr1、cdr2、cdr3核酸分子具有与seq id no.25、26、27所示的核苷酸序列至少90%,优选95%序列的同一性的序列。
[0019]
进一步,编码重链可变区框架区fr1、fr2、fr3和fr4的核酸分子具有与seq id no.20、21、22、23所示的核苷酸序列至少90%,优选95%序列的同一性的序列;编码轻链可变区框架区fr1、fr2、fr3和fr4的核酸分子具有与seq id no.28、29、30、31所示的核苷酸序列至少90%,优选95%序列的同一性的序列。
[0020]
进一步,编码重链可变区的核酸分子具有与seq id no.24所示的核苷酸序列至少90%,优选95%序列同一性的序列;编码轻链可变区的核酸分子具有与seq id no.32所示的核苷酸序列至少90%,优选95%序列同一性的序列。
[0021]
优选地,编码重链可变区的核苷酸序列如seq id no.24所示,编码轻链可变区的核苷酸序列如seq id no.32所示。
[0022]
本发明的第三方面提供了载体,所述载体包含本发明第二方面所述的核酸分子。
[0023]
在一些实施方案中,所述载体包含与抗体可操作性地连接的信号肽。
[0024]
本发明的第四方面提供了一种宿主细胞,所述宿主细胞包含本发明第二方面所述的核酸分子或本发明第三方面所述的载体。
[0025]
在一些实施方案中,所述宿主细胞选自原核细胞或真核细胞。
[0026]
在一些实施方案中,所述宿主细胞为真核细胞。
[0027]
在一些实施方案中,所述真核细胞为哺乳动物细胞。
[0028]
本发明第五方面提供了一种药物偶联物,所述偶联物包含本发明第一方面所述的单克隆抗体。
[0029]
在一些实施方案中,所述药物偶联物还包含选自下组的偶联部分:可检测标记物、
药物、毒素、细胞因子或酶。
[0030]
本发明第六方面提供了一种组合物,所述组合物包含本发明第一方面所述的单克隆抗体、本发明第二方面所述的核酸分子、本发明第三方面所述的载体、本发明第四方面所述的宿主细胞或本发明第五方面所述的药物偶联物。
[0031]
在进一步的实施方案中,所述组合物还包括药学上可接受的载体。
[0032]
本发明的第七方面提供了一种用于检测或测定样本中cd38的产品,所述产品包含本发明第一方面所述的单克隆抗体。
[0033]
在一些实施方案中,所述产品还包括处理样本的试剂。
[0034]
本发明的第八方面提供了一种制备本发明第一方面所述单克隆抗体的方法,所述方法包括步骤:
[0035]
培养本发明第一方面所述的细胞,回收单克隆抗体。
[0036]
在进一步的实施方案中,所述方法还包括对所述单克隆抗体进行纯化。
[0037]
本发明第九方面提供了一种检测样品中cd38的方法,使本发明第一方面所述的抗cd38的单克隆抗体接触待测样本;确定所述待测样本中cd38的存在或水平。
[0038]
本发明第十方面提供了如下任一项所述的应用:
[0039]
1)本发明第一方面所述的单克隆抗体、本发明第二方面所述的核酸分子、本发明第三方面所述的载体、本发明第四方面所述的宿主细胞、本发明第七方面所述的产品在检测cd38中的应用;
[0040]
2)本发明第一方面所述的单克隆抗体、本发明第二方面所述的核酸分子、本发明第三方面所述的载体、本发明第四方面所述的宿主细胞、本发明第七方面所述的产品在制备诊断cd38相关的疾病的产品中的应用;
[0041]
3)本发明第一方面所述的单克隆抗体、本发明第二方面所述的核酸分子、本发明第三方面所述的载体、本发明第四方面所述的宿主细胞、本发明第五方面所述的药物偶联物、本发明第六方面所述的组合物在制备预防和/或治疗与cd38相关的疾病的药物中的应用。
[0042]
在一些实施方案中,所述疾病为肿瘤或免疫性疾病。
[0043]
所述免疫性疾病选自:类风湿性关节炎、牛皮癣、强直性脊柱炎、关节银屑病、皮炎、系统性硬皮病及硬化症、炎症性肠病、克罗恩氏病、溃疡性结肠炎、呼吸窘迫综合征、脑膜炎、脑炎、胃炎、葡萄膜炎、肾小球肾炎、湿疹、哮喘、动脉硬化、白细胞粘附缺陷病、raynaud症候群、sjogren症候群、青少年糖尿病、reiter病、behcet病、免疫复合物性肾炎、iga肾病、igm多发性神经病、免疫介导的血小板减少症状、溶血性贫血、重症肌无力、狼疮性肾炎、系统性红斑狼疮、风湿关节炎、异位性皮炎、天疱疮、graves病、桥本氏甲状腺炎、wegener肉芽肿、omenn症候群、慢性肾功能衰竭、急性传染性单核细胞增多征、多发性硬化症、hiv和疱疹病毒相关的疾病、严重急性呼吸综合征和脉络视网膜炎、移植物对抗宿主疾病、以及病毒感染引起的免疫性疾病。
[0044]
在进一步的实施方案中,所述免疫性疾病选自:类风湿性关节炎、系统性红斑狼疮、哮喘、炎症性肠病、多发性硬化症、克罗恩氏病、胃炎、桥本氏甲状腺炎、强直性脊柱炎、移植物对抗宿主疾病、免疫介导的血小板减少症状。
[0045]
在一些实施方案中,所述免疫介导的血小板减少症状是急性特发性血小板减少性
紫癜或慢性特发性血小板减少性紫癜。
[0046]
所述肿瘤选自:白血病、b细胞淋巴瘤、t细胞淋巴瘤、nk细胞淋巴瘤、浆细胞恶性瘤和骨髓瘤。
[0047]
在一些实施方案中,所述b细胞淋巴瘤选自:成熟b细胞肿瘤、前体b细胞成淋巴细胞白血病/淋巴瘤、b细胞非霍奇金淋巴瘤、b细胞霍奇金淋巴瘤。
[0048]
在一些实施方案中,所述肿瘤选自:急性淋巴细胞白血病、急性成淋巴细胞白血病、急性早幼粒细胞白血病、慢性淋巴细胞白血病、急性或慢性骨髓型白血病、多发性骨髓瘤、前髓细胞肿瘤、轻链淀粉样变性、b细胞慢性淋巴细胞性白血病、小淋巴细胞性白血病、b细胞急性淋巴细胞性白血病、b细胞前淋巴细胞白血病、淋巴浆细胞样淋巴瘤、套细胞淋巴瘤、滤泡性淋巴瘤、皮肤滤泡中心淋巴瘤、边缘区b细胞淋巴瘤、毛细胞白血病、弥漫性大b细胞淋巴瘤、伯基特淋巴瘤、浆细胞瘤、浆细胞骨髓瘤、浆细胞白血病、移植后淋巴增生性疾病、waldenstrom巨球蛋白血症、浆细胞白血病和间变性大细胞淋巴瘤、多毛细胞淋巴瘤。
附图说明
[0049]
图1是elisa检测抗体与抗原的结合能力图;
[0050]
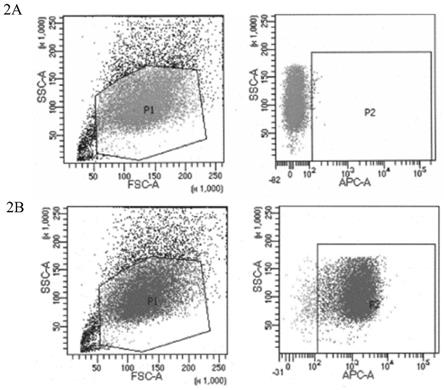
图2是流式细胞检测技术检测抗体与抗原的结合能力图,其中,2a是对照;2b是70b5抗体。
具体实施方式
[0051]
本发明通过广泛而深入的研究,发现了一个抗cd38的单克隆抗体,所述单克隆抗体具有较高的亲和活性。
[0052]
术语“单克隆抗体”在用于本文时指从一群基本上同质的抗体获得的抗体,即构成群体的各个抗体相同和/或结合相同表位,除了生产单克隆抗体的过程中可能产生的可能变体外,此类变体一般以极小量存在。此类单克隆抗体典型的包括包含结合靶物的多肽序列的抗体,其中靶物结合多肽序列是通过包括从众多多肽序列中选择单一靶物结合多肽序列在内的过程得到的。例如,选择过程可以是从众多克隆诸如杂交瘤克隆、噬菌体克隆或重组dna克隆的集合中选择独特克隆。应当理解,选定的靶物结合序列可进一步改变,例如为了提高对靶物的亲和力、将靶物结合序列人源化、提高其在细胞培养物中的产量、降低其在体内的免疫原性、创建多特异性抗体等,而且包含改变后的靶物结合序列的抗体也是本发明的单克隆抗体。与典型的包含针对不同决定簇(表位)的不同抗体的多克隆抗体制备物不同,单克隆抗体制备物的每种单克隆抗体针对抗原上的单一决定簇。在它们的特异性以外,单克隆抗体制备物的优势在于它们一般未受到其它免疫球蛋白的污染。修饰语“单克隆”指示抗体从基本上同质的抗体群获得的特征,不应解释为要求通过任何特定方法来生成抗体。
[0053]
在本发明中,单克隆抗体涵盖与所述抗体的氨基酸序列或者编码该抗体的任何核苷酸序列具有一定程度的序列一致性或序列同源性的序列,本发明中,“同源性”可等同于“一致性”。
[0054]
本领域技术人员还将理解的是,抗体可以进行各种翻译后修饰。这些修饰的类型和程度常常取决于用于表达抗体的宿主细胞系以及培养条件。这样的修饰可以包括在糖基
化、甲硫氨酸氧化、哌嗪二酮形成、天冬氨酸异构化和天冬酰胺脱酰胺化中的变化。常见修饰是由于羧肽酶的作用导致的羧基末端碱性残基(诸如赖氨酸或精氨酸)的缺失。
[0055]
如本发明所用,“同一性”指示在比对的序列的任何特定位置上,序列之间的氨基酸残基是相同的。如本文所用,“相似性”指示在比对的序列的任何特定位置上,序列之间的氨基酸残基为相似类型。例如,亮氨酸可被置换成异亮氨酸或缬氨酸。可通常彼此置换的其它氨基酸包括(但不限于):苯丙氨酸、酪氨酸和色氨酸(具有芳族侧链的氨基酸),赖氨酸、精氨酸和组氨酸(具有碱性侧链的氨基酸),天冬氨酸和谷氨酸(具有酸性侧链的氨基酸),天冬酰胺和谷氨酰胺(具有酰胺侧链的氨基酸),以及半胱氨酸和甲硫氨酸(具有含硫侧链的氨基酸)。
[0056]
通常,一个蛋白质中一个或多个氨基酸的修饰不会影响蛋白质的功能。本领域技术人员会认可改变单个氨基酸或小百分比的氨基酸或对氨基酸序列的个别添加、缺失、插入、替换是保守修饰,其中蛋白质的改变产生具有相似功能的蛋白质。提供功能相似的氨基酸的保守替换表是本领域公知的。
[0057]
可利用取代、缺失、插入或其任意组合来实现最终的衍生物或变体。通常,这些变化在几个氨基酸上进行以使分子的改变最小化,特别是抗原结合蛋白的免疫原性和特异性。然而,在某些情况下可以容忍更大的变化。氨基酸取代通常是单个碱基的;插入通常将为大约一个至大约二十个氨基酸残基的数量级,虽然可能容忍显著更大的插入。缺失的范围为大约一个至大约二十个氨基酸残基,虽然在一些情况下,缺失可以大得多。
[0058]
进一步,包括但并不限于构架区域、高可变区域、尤其是cdr3区域的可变区域的氨基酸序列被改性。通常,轻链或重链区域包括三个高可变区域(包括三个cdr)和更保守的区域(所谓的构架区域(fr))。高可变区域包括来自cdr的氨基酸残基和来自高可变环的氨基酸残基。可将本领域技术人员已知的计算机算法诸如gap或bestfit用于最优化地比对要对比的氨基酸序列,且定义相似或相同的氨基酸残基。可通过本领域已知的通用的分子生物学方法(包括pcr、寡核苷酸定点诱变(oligonucleotide-directed mutagenesis)和定点诱变(site-directed mutagenesis))改变亲本单克隆抗体或其部分,或通过有机合成方法获得功能性变异体。
[0059]
本发明公开的抗体和片段从宿主细胞以良好水平表达。因此,抗体和/或结合片段的性质适合用于商业规模的表达。
[0060]
抗体片段的例子包括fab、fab
′
、f(ab
′
)2和fv片段;双抗体;线性抗体;单链抗体分子;及由抗体片段形成的多特异性抗体。“fab”是指含有一条轻链的可变区和恒定区和一条重链的可变区和恒定区经二硫键结合起来的抗体分子的一部分;“fab
′”
是指包含了部分铰链区的fab片段;“f(ab
′
)2”指的是fab’的二聚体;“fv”指的是含有抗体重链可变区、轻链可变区并具有全部抗原结合位点的最小抗体片段,并且可以来源自任何哺乳动物,包括人、小鼠、大鼠、骆驼科动物或兔子,但不限于此。抗体的功能性部分,例如本文所述的一个或多个cdr,可以通过共价键与二级蛋白质或小分子化合物连接,并用作针对特定靶标的靶标治疗剂。
[0061]
本发明中使用的术语“核酸分子”是指dna分子和rna分子。核酸分子可以是单链或双链的,但优选是双链dna。当将核酸与另一个核酸序列置于功能关系中时,核酸是“有效连接的”。例如,如果启动子或增强子影响编码序列的转录,那么启动子或增强子有效地连接
至所述编码序列。
[0062]
本发明对表达载体没有特别的限制,其选择取决于所期望的功能。载体的非限制性实例包括质粒、黏粒、病毒、噬菌体和其他常规用于例如遗传工程的载体。本领域技术人员众所周知的方法可以用于构建各种质粒和载体。
[0063]
在一个实施方案中,载体是表达载体。根据本发明的表达载体能够指导本发明的核酸分子在宿主中的复制和表达,并因此保证由此编码的本发明的抗igg抗体的可变链结构域在选择的宿主中的表达。在进一步的实施方案中,一种或多种载体包含进一步的序列以确保不仅表达本发明的所述可变链结构域,而且也表达包含本发明的所述可变链结构域的全长igg抗体。
[0064]
表达载体可以例如是克隆载体、双元载体或整合型载体。表达包括核酸分子的转录,例如转录成可翻译的mrna。
[0065]
载体的非限制性实例包括pqe-12、puc-系列、pbluescript(stratagene)、pet-系列表达载体(novagen)或pcrtopo(invitrogen)、λgt11、pjoe、pbbr1-mcs系列、pjb861、pbsmul、pbc2、pucpks、ptact1、ptre、pcal-n-ek、pesp-1、pop13cat、e-027pcag kosak-cherry(l45a)载体系统、prep(invitrogen)、pcep4(invitrogen)、pmc1neo(stratagene)、pxt1(stratagene)、psg5(stratagene)、ebo-psv2neo、pbpv-1、pdbpvmmtneo、prsvgpt、prsvneo、psv2-dhfr、pizd35、okayama-berg cdna表达载体pcdv1(pharmacia)、prc/cmv、pcdna1、pcdna3(invitrogen)、pcdna3.1、psport1(gibco brl)、pgemhe(promega)、plxin、psir(clontech)、pires-egfp(clontech)、peak-10(edgebiosystems)ptriex-hygro(novagen)和pcineo(promega)。适合于巴斯德毕赤氏酵母(pichia pastoris)的质粒载体的非限制性实例包括例如质粒pao815、ppic9k和ppic3.5k(全部为invitrogen)。适合于在爪蟾属(xenopus)胚胎、斑马鱼胚胎以及各种各样的哺乳动物和禽类细胞中表达蛋白质的另一种载体是多用途表达载体pcs2+。
[0066]
通常,载体可含有一种或多种用于克隆或表达的复制起点(ori)和遗传系统、一种或多种用于在宿主中选择的标记(例如,抗生素抗性)和一种或多种表达盒。另外,可以使用已确立的方法将载体中包含的编码序列与转录调控元件和/或与其他氨基酸编码序列连接。这种调控序列是本领域技术人员众所周知的,并且包括但不限于确保转录起始的调控序列、内部核糖体进入位点(ires)和任选的确保转录终止和转录物稳定的调控元件。确保转录起始的这种调控元件的非限制性实例包括启动子、翻译起始密码子、增强子、绝缘子和/或确保转录终止的调控元件,其包括在本发明的核酸分子的下游。进一步的例子包括kozak序列和侧翼为用于rna剪接的供体和受体位点的间插序列,编码分泌信号的核苷酸序列,或取决于所用的表达系统的信号序列,其能够将表达的蛋白质引导至细胞区室或培养基。载体也可含有编码一种或多种蛋白伴侣的另外的可表达多核苷酸,以促进正确的蛋白质折叠。
[0067]
合适的复制起点的额外的例子包括,例如,全长cole1、截短的colei、sv40病毒和m13复制起点,而合适的启动子的额外的例子包括但不限于巨细胞病毒(cmv)启动子、sv40-启动子、rsv-启动子(劳斯肉瘤病毒)、lacz启动子、四环素启动子/操纵基因(tetp/o)、鸡β-肌动蛋白启动子、cag-启动子(鸡β-肌动蛋白启动子和巨细胞病毒立即早期增强子的组合)、gai10启动子、人延伸因子1α-启动子、aox1启动子、gal1启动子cam-激酶启动子,lac,
trp或tac启动子,t7或t5启动子,lacuv5启动子,苜蓿银纹夜蛾(autographa californica)多核型多角体病毒(acmnpv)多角体启动子或哺乳动物和其他动物细胞中的珠蛋白内含子。增强子的一个例子是例如sv40-增强子。确保转录终止的调控元件的非限制性的额外例子包括sv40-聚腺苷酸化位点、tk-聚腺苷酸化位点、不依赖ρ因子的lpp终止子或acmnpv多角体聚腺苷酸化信号。选择标记的进一步的非限制性实例包括dhfr,其赋予了对氨甲蝶呤的抗性,npt,其赋予对氨基糖苷类新霉素、卡那霉素和巴龙霉素(paromycin)的抗性和hygro,其赋予对潮霉素的抗性。已经描述了额外的选择基因,即trpb,其允许细胞利用吲哚代替色氨酸;hisd,其允许细胞利用组氨醇(histinol)代替组氨酸;甘露糖6-磷酸异构酶,其允许细胞利用甘露糖和odc(鸟氨酸脱羧酶),其赋予对鸟氨酸脱羧酶抑制剂2-(二氟甲基)-dl-鸟氨酸dfmo的抗性或赋予对杀稻瘟素s抗性的来自土曲霉(aspergillus terreus)的脱氨酶。
[0068]
在进一步的实施方案中,载体是真核表达质粒,其含有由包括内含子a的5`cmv启动子和3`bgh聚腺苷酸化序列组成的表达盒。
[0069]
合适的细菌表达宿主包括例如衍生自jm83、w3110、ks272、tg1、k12、bl21(例如bl21(de3)、bl21(de3)plyss、bl21(de3)ril、bl21(de3)prare)或rosettaa的菌株。
[0070]
可以设计本发明的核酸分子和/或载体以通过例如基于化学的方法(聚乙烯亚胺、磷酸钙、脂质体,deae-葡聚糖、核转染、非化学方法(电穿孔、声孔效应、光转染、基因电转移、流体递或细胞与本发明的核酸分子接触时自然发生的转化)、基于粒子的方法(基因枪、磁转染、穿刺转染)、基于噬菌体载体的方法和病毒方法引入细胞。例如,衍生自诸如反转录病毒、牛痘病毒、腺伴随病毒、疱疹病毒、semliki病毒或牛乳头瘤病毒的表达载体可用于将核酸分子递送至靶向的细胞群体中。另外,杆状病毒系统也可以用作本发明核酸分子的真核表达系统中的载体。
[0071]
为了促进本发明的核酸分子的纯化,可将标签(tag)序列插入表达载体中。标签的实例包括(但不限于)六个组氨酸标签、myc标签或flag标签。可在本发明中使用本领域的技术人员已知的促进纯化的任何标签。
[0072]
在本发明中,任何适当的宿主细胞/载体系统可用于编码本发明的抗体分子的dna序列的表达。可使用细菌(例如大肠杆菌)及其它微生物系统,或还可使用真核生物(例如哺乳动物)宿主细胞表达系统。上述细胞包含(但并不限于)哺乳动物细胞、植物细胞、昆虫细胞、真菌细胞或细菌来源的细胞。作为哺乳动物细胞,可优选使用选自(但并不限于)由cho细胞、f2n细胞、cso细胞、bhk细胞、bowes黑色素瘤细胞、hela细胞、911细胞、at1080细胞、a549细胞、hek293细胞和hek293t细胞组成的组中的一种作为宿主细胞。在本领域中可使用本领域的技术人员已知的可用作哺乳动物宿主细胞的任何细胞。
[0073]
本发明的重组细胞接着可以用于表达以及培养目的,用于大量药物生产的抗体表达。还可以用作药物组合物的活性成分。可以使用任何适当的培养技术,包括但是不局限于静置培养、转瓶培养、腹水流体、中空纤维型生物反应盒、模块化小型发酵罐、搅拌槽、微载体培养、陶瓷芯灌注等等。
[0074]
作为一种可选择的实施方式,本发明中的产品包括本发明所制备的抗体或其功能片段。作为另外一种可选择的实施方式,本发明的产品包括诊断组合物,所述诊断组合物包括至少一种可检测的标签,诸如可检测的部分/试剂。标签可非共价地缀合至本发明的单克
隆抗体。标签还可通过共价键直接缀合至单克隆抗体。可选择地,标签可利用一种或多种连接化合物缀合至上述单克隆抗体。用于将标签缀合至单克隆抗体的技术对本领域的技术人员是公知的。作为标签的可检测的部分/试剂优选为选自由(但并不限于)酶、辅基、荧光材料、发光材料、生物发光材料、放射性材料、正电子发射材料和非放射性的顺磁金属离子组成的组中的一种。合适的酶包括辣根过氧化物酶、碱性磷酸酶、β半乳糖苷酶或乙酰胆碱酯酶;合适的辅基包括抗生蛋白链菌素、抗生物素蛋白和生物素;合适的荧光物质包括但不限于fitc,5-羧基荧光素,6-羧基荧光素;罗丹明类型的标记,包括tamra;丹磺酰;丽丝胺;花菁;藻红蛋白;德克萨斯红;及其类似物。荧光标记可以使用本文公开的技术与靶分子中包含的醛基缀合。合适的发光物质包括鲁米诺,吖啶化合物,腔肠素和类似物,二氧杂环丁烷,基于过氧草酸的系统及其衍生物;合适的生物发光物质包括荧光素酶、荧光素和水母素;并且合适的放射性核素包括125i、131i、111in和99tc。
[0075]
在本发明中,用于检测或测定目标抗原(例如cd38)的量的方法可以是任何已知方法。例如,它包括免疫检测或测定方法。
[0076]
免疫检测或测定方法是使标记的抗原或抗体检测或测定抗体量或抗原量的方法。免疫检测或测定方法的实例包括放射性物质标记的免疫抗体方法(ria)、酶免疫测定法(eia或elisa)、荧光免疫测定法(fia)、发光免疫测定法、蛋白质免疫印迹法、流式细胞技术、物理化学方法等。
[0077]
与cd38相关的疾病可以通过用本发明的抗体或抗体片段检测或测定表达cd38的细胞来诊断。
[0078]
在本发明中,对用于检测或测定目标抗原(例如cd38)的样品没有特别限制,只要它具有包含表达目标抗原(例如cd38)的细胞的可能性即可,例如组织细胞、血液、血浆、血清、胰液、尿液、粪便、组织液或培养液。
[0079]
本发明中的药物组合物包括本发明的单克隆抗体,以及药学上可接受的载体。药学上可接受的载体可另外含有液体,诸如水、生理盐水、甘油和乙醇。另外,诸如湿润剂或乳化剂或ph缓冲物质的辅助物质可存在于所述组合物中。这些载剂使得药物组合物能够配制成片剂、丸剂、糖衣丸、胶囊、液体、凝胶、糖浆、浆液和悬浮液,以便患者摄入。
[0080]
合适的施用形式包括适用于肠胃外施用的形式,例如通过注射或输注,例如通过快速注射或连续输液、静脉内、可吸入或皮下形式。在产品用于注射或输注的情况下,其可采用在油性或水性媒介物中的悬浮液、溶液或乳液的形式并且其可含有配制试剂,诸如悬浮剂、防腐剂、稳定剂和/或分散剂。可替代地,根据本发明的抗体或其抗原结合片段可呈干燥形式,用于在使用之前用合适的无菌液体重构。还可制备适于在注射前溶解或悬浮于液体媒介物中的固体形式。
[0081]
一旦配制,本发明的组合物可直接施用至受试者。因此,本文提供根据本发明的抗体或其抗原结合片段用于制造药剂的用途。
[0082]
待治疗的受试者可以是动物。优选地,根据本发明的药物组合物经调整以用于向人受试者施用。
[0083]
在本发明中,“cd38相关的疾病”是存在表达cd38的细胞的疾病或病症。非限制性地,例如由表达cd38的b细胞、浆细胞、单核细胞和t细胞参与的免疫性疾病,疾病的特征之一为存在表达cd38的肿瘤细胞的肿瘤疾病,例如表达cd38的白血病、b细胞淋巴瘤、浆细胞
恶性瘤、t/nk细胞淋巴瘤和骨髓瘤。本发明在一些实施方案中,所述白血病选自:急性淋巴细胞白血病、急性成淋巴细胞白血病、急性早幼粒细胞白血病、慢性淋巴细胞白血病、急性和慢性骨髓型白血病。在一些实施方案中,所述骨髓瘤选自:多发性骨髓瘤、前髓细胞肿瘤和轻链淀粉样变性。在一些实施方案中,所述淋巴瘤为非何杰金淋巴瘤或何杰金淋巴瘤。在一些实施方案中,所述肿瘤可选自b细胞淋巴瘤/白血病,包括但不限于:前体b细胞成淋巴细胞白血病/淋巴瘤、b细胞非霍奇金淋巴瘤或b细胞霍奇金淋巴瘤、成熟b细胞肿瘤。在一些实施方案中,所述肿瘤选自:b细胞慢性淋巴细胞性白血病(cll)、小淋巴细胞性白血病(sll)、b细胞急性淋巴细胞性白血病、b细胞前淋巴细胞白血病、淋巴浆细胞样淋巴瘤、套细胞淋巴瘤(mcl)、滤泡性淋巴瘤(包括低级、中级或高级fl)、皮肤滤泡中心淋巴瘤、边缘区b细胞淋巴瘤(包括malt型、淋巴结mzbl型、脾mzbl型)、毛细胞白血病、弥漫性大b细胞淋巴瘤、伯基特淋巴瘤(burkitt淋巴瘤)、浆细胞瘤、浆细胞骨髓瘤、浆细胞白血病、移植后淋巴增生性疾病、waldenstrom巨球蛋白血症、浆细胞白血病和间变性大细胞淋巴瘤(alcl)、多毛细胞淋巴瘤。在一些实施方案中,所述肿瘤为多发性骨髓瘤。在一些实施方案中,所述免疫性疾病选自:类风湿性关节炎、牛皮癣、强直性脊柱炎、关节银屑病、皮炎、系统性硬皮病及硬化症、炎症性肠病(ibd)、crohn病(克罗恩氏病)、溃疡性结肠炎、呼吸窘迫综合征、脑膜炎、胃炎、脑炎、葡萄膜炎、肾小球肾炎、湿疹、哮喘、动脉硬化、白细胞粘附缺陷病、raynaud症候群、sjogren症候群、青少年糖尿病、reiter病、behcet病、免疫复合物性肾炎、iga肾病、igm多发性神经病、免疫介导的血小板减少症状(如急性特发性血小板减少性紫癜、慢性特发性血小板减少性紫癜)、溶血性贫血、重症肌无力、狼疮性肾炎、系统性红斑狼疮、风湿关节炎(ra)、异位性皮炎、天疱疮、graves病、桥本氏甲状腺炎、wegener肉芽肿、omenn症候群、慢性肾功能衰竭、急性传染性单核细胞增多征、多发性硬化症、hiv和疱疹病毒相关的疾病、严重急性呼吸综合征、脉络视网膜炎(choreoretinitis)、移植物对抗宿主疾病、以及病毒感染引起的免疫性疾病(如伊波病毒(ebv)感染b细胞引起或介导的疾病)。在一些实施方案中,所述免疫性疾病选自类风湿性关节炎、系统性红斑性狼疮、哮喘、炎症性肠道疾病、多发性硬化、克罗恩氏病、胃炎、桥本氏甲状腺炎、强直性脊柱炎和移植物对抗宿主疾病。在一些实施方案中,其中所述免疫疾病是类风湿性关节炎。
[0084]
下面结合附图和实施例对本发明作进一步详细的说明。以下实施例仅用于说明本发明而不用于限制本发明的范围。
[0085]
实施例1单克隆抗体70b5的制备
[0086]
合成表1所示的70b5抗体的序列,并克隆至真核表达载体中。
[0087]
表1抗体70b5的序列
[0088]
[0089][0090]
具体步骤如下:
[0091]
1、酶切实验:
[0092]
采用表2所示的试剂和条件进行酶切反应。
[0093]
表2酶切反应体系和反应条件
[0094][0095][0096]
2、酶切产物的胶回收
[0097]
将上面酶切的载体用1%琼脂糖凝胶跑电泳,然后切取目的条带的胶块,胶块尽量
切小一点,利用全式金的试剂盒回收目的dna。
[0098]
3、pcr产物扩增
[0099]
进行pcr扩增的体系和条件分别如表3和表4所示。
[0100]
表3扩增体系
[0101][0102]
表4扩增条件
[0103][0104]
4、pcr产物纯化
[0105]
利用全式金试剂盒进行pcr产物纯化,具体操作见试剂盒说明书。
[0106]
5、连接
[0107]
根据表5中的ligation reaction,输入相应的值得到相应的体系,37℃水浴30min。
[0108]
表5连接反应体系
[0109][0110]
6、连接产物转化stbⅰ3
[0111]
从-80℃冰箱取出感受态细胞冰上融化,吸取50μl转移至预冷的ep管中,加入2.5μl连接产物,轻轻弹匀,冰浴30min,42℃水浴热激60s,迅速放回冰上并静置2min。向离心管中加入200μl lb液体培养基(无amp),37℃、180rpm摇床培养1h,吸取适量转化产物加到lb(amp)琼脂板上,均匀涂开。将平板倒置于37℃生化培养箱培养过夜。
[0112]
7、colony pcr鉴定
[0113]
挑取4-8个单菌落到100μl lb(amp)液体培养基中,37℃、220rpm摇床培养1-3h,取菌液进行pcr鉴定反应结束后琼脂糖凝胶电泳,pcr产物大小约600bp,挑选1个阳性菌落送测序
[0114]
8、质粒提取和保存
[0115]
测序正确后,将菌落扩增至15ml培养基培养过夜,制作甘油菌,用无内毒素质粒提取试剂盒提取质粒,具体步骤参照无内毒素质粒中提试剂盒(天根)说明书进行,测定质粒浓度,用于抗体生产。
[0116]
9、将质粒转染到细胞中生产并纯化抗体。
[0117]
实施例2单克隆抗体的elisa检测
[0118]
一、实验材料
[0119]
1、主要试剂与耗材
[0120][0121]
2、主要仪器设备
[0122]
名称
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公司
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
型号
[0123]
酶标仪
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
labserv
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
3530917540
[0124]
二、实验方法
[0125]
1、将未标记抗原(human cd38 protein(ecd,his tag))在elisa coating buffer(1x)包被缓冲液(用d.l water稀释elisa coating buffer(5x))稀释至0.5μg/ml,并将100μl转移到nunc
tm maxisorp
tm elisa plates uncoated单孔中,密封板,防止蒸发,在4℃孵化过夜。
[0126]
2、将nunc
tm maxisorp
tm elisa plates uncoated置于常温,甩掉捕获抗体溶液,用elisa wash buffer(1x)(用d.l water稀释elisa wash buffer(20x))洗涤三次,每孔加入200μl封闭液(将bsa用elisa wash buffer(1x)配置1%浓度)封闭非特异性结合位点,室温孵育1h。
[0127]
3、用elisa wash buffer(1x)洗涤三次,用干净的纸巾牢牢地擦干。
[0128]
4、将标准品(标准品purified anti-human cd38用封闭液稀释)和样品(单克隆抗体封闭液稀释)设置若干个浓度梯度并每组取一个复孔,nunc
tm maxisorp
tm elisa plates uncoated每孔添加100μl,室温孵化2h。
[0129]
5、用elisa wash buffer(1x)洗涤三次,用干净的纸巾牢牢地擦干。
[0130]
6、将生物标记的检测抗体hrp goat anti-mouse igg与hrp goat anti-mouse igm在封闭液中稀释至0.4μg/ml(0.25-2μg/ml),分别以每孔100μl添加到标准孔和样品孔中,室温孵育1h。
[0131]
7、用elisa wash buffer(1x)洗涤三次,用干净的纸巾牢牢地擦干。
[0132]
8、将2ml tmb substrate a和2ml tmb substrate b混合均,将100μl转移到nunc
tm maxisorp
tm elisa plates uncoated单孔中,并在室温孵育10min(4-60min),孵育完成后加入100μl stop solution终止反应。
[0133]
9、用酶标仪在450nm条件下测取每个孔od值,将读取标准孔绘制标准曲线,以此计算样品抗体的浓度。
[0134]
三、结果
[0135]
结果如图1所示,实验组的抗体检出度远远大于阴性对照组,说明抗体对cd38有很好的亲和力。
[0136]
实施例3单克隆抗体的流式细胞检测
[0137]
一、实验材料
[0138]
apc goat anti-mouse igm antibody(biolegend:406509),pbs(gibco:c20012500bt),rpmi1640(gibco:c11875500bt),青霉素-链霉素双抗溶液(hyclone:sv30010),特级胎牛血清(美森:ctcc-002-001-50_10),mono-mac-6细胞,1.5ml ep管(泰坦:ts018-032)
[0139]
二、实验方法
[0140]
1、培养mono-mac-6细胞,进行细胞计数,然后取5
×
105个细胞置于1.5ml ep管中,1000rpm,5min离心,去上清;
[0141]
2、加500μl pbs重悬细胞,然后1000rpm,5min离心,去上清;
[0142]
3、将空白细胞培养上清与抗体生产上清分别重悬待测细胞,置于4℃,避光反应30min,然后1000rpm,5min离心,去上清;
[0143]
4、加500μl pbs重悬细胞,然后1000rpm,5min离心,去上清;
[0144]
5、加100μl二抗(apc anti-human igm fc antibody,原液用pbs经过1:600稀释后使用)重悬细胞,置于4℃,避光反应30min,然后1000rpm,5min离心,去上清;
[0145]
6、加500μl pbs重悬细胞,然后1000rpm,5min离心,去上清;
[0146]
7、加400μl pbs重悬细胞,然后上机检测。
[0147]
三、结果
[0148]
结果如图2所示,相比空白细胞培养上清(2a),抗体生产上清能与mono-mac-6细胞表面的cd38结合(2b)。
[0149]
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1