一种用于海水鱼鱼肉新鲜度指示的近红外发射荧光探针及其制备的双通道指示卡和应用
1.本发明涉及一种用于海水鱼鱼肉新鲜度指示的近红外发射荧光探针及其制备的双通道指示卡和应用。
背景技术:
2.我国海产品资源丰富,特别是海水鱼味道鲜美、营养价值高,是人们餐桌上不可缺少的美食,但海水鱼在远途运输、加工储存过程中极易发生腐败变质,消费者食用会给身体带来损害,因此,需要监测其新鲜度。目前,深海鱼多以切片、切段处理后进行销售,为了延长鱼肉保质期,一般用塑料袋密封或真空包装,而判断鱼肉新鲜度往往需要打开包装,利用电子鼻、电子舌或其他仪器测试鲜度指标来综合判定是否腐败,而这些操作必须破坏产品包装,使用复杂仪器,耗费时间长,无法满足现场检测等,因此,需要开发简单便捷的检测方法来实现新鲜度的检测。
3.目前,利用胺含量变化以及ph检测鱼肉新鲜程度结果更加准确,但测定组织样本中tvb-n含量及ph标准方法费力耗时,且需要破坏样品进行提取检测,并且依靠仪器来辅助检测。
4.指示标签是一种新型的鱼肉新鲜度的方法,其包括荧光检测法和比色法,具有操作简单、响应速度快、成本低、灵敏度高、选择性好的优点,只需要对比指示标签的变化情况就可以判断鱼肉的新鲜程度,大大降低了监测成本,使检测更加便利。但现有的制备的指示标签并不完美,仍存在一定的缺陷,例如dyes and pigments,2020,186(7):108963,虽然也可以在溶液中识别胺类化合物,而且也同样制作了指示标签用于鱼类样品的检测,但是合成的探针存在发射波长短,响应时间长等缺点。food chemistry,2007,102:466
–
470和food chemistry,2020,307:125580,虽然也制备可作为鱼类新鲜度监测的传感标签,但是只有比色识别,而没有实现荧光和比色双识别的效果。sensorsactuatorsb.chemical,2020,323,128694,虽然制作的传感标签能够实现鱼类新鲜度监测荧光和比色的双识别,但是荧光变化不够明亮,比色识别的颜色变化不够鲜明,在实际的应用中容易造成辨别误差。因此,用于海水鱼鱼肉新鲜度指示的双响应荧光探针亟待开发,特别是灵敏性好、响应时间短、发射波长位于600nm~800nm范围内的近红外荧光探针,这类探针受到背景荧光干扰小,荧光变化更显著,更有利于消费者的观察。
技术实现要素:
5.本发明要解决的技术问题是提供一种用于海水鱼鱼肉新鲜度指示的近红外发射荧光探针及其制备的双通道指示卡和应用,该探针可在纯水体系中对多种胺类化合物进行比色和荧光双响应识别,灵敏度高,响应时间快,具有近红外发射;将探针制备成指示标签,可实现对包装盒内海水鱼鱼肉新鲜度定性分析,且无需破坏样品及复杂的前处理,结果准确可靠,可用于海水鱼鱼肉新鲜度无损快速实时检测。
6.本发明的技术方案是:
7.一种用于海水鱼鱼肉新鲜度指示的近红外发射荧光探针,该荧光探针结构式如下:
[0008][0009]
进一步的,该荧光探针具体合成步骤如下:
[0010]
以乙醇为溶剂,将苯并吡喃衍生物与对氨基苯甲酸按照摩尔比1:(1~2)进行投料,所述苯并吡喃衍生物为6-(二乙胺基)-1,2-二氢环戊烷[b]苯并吡喃-3-甲醛然后,按照苯并吡喃衍生物与乙酸的质量比100:2加入乙酸;在油浴中加热回流搅拌5小时~12小时,冷却至室温,抽滤,收集固体用乙醇或正己烷洗涤,得到近红外发射荧光探针
[0011]
一种上述近红外发射荧光探针制备的海水鱼鱼肉新鲜度双通道指示卡,所述指示卡由面积相同的三个正方形比色卡和一个正方形指示标签拼接而成的正方形,三个正方形比色卡分别为新鲜比色卡、合格比色卡和腐败比色卡,其特殊之处在于:比色卡分为自然光比色区域和紫外光比色区域,在指示卡靠近中心区域分别为新鲜自然光比色区、合格自然光比色区和腐败自然光比色区,在指示卡远离中心区域分别为新鲜紫外光比色区、合格紫外光比色区和腐败紫外光比色区;
[0012]
指示标签具体制备过程如下:
[0013]
向10mg荧光探针中加入3.6ml~4ml乙醇和0.8ml~1ml浓度为0.1mol/l盐酸的混合液,然后边搅拌边加入1.2ml~1.4ml硅酸乙酯(teos)、0.6ml~0.8ml甲基三乙氧基硅烷(mteos)以及0.5g~0.7g聚乙二醇二甲醚(pegdme),室温下持续搅拌1小时,得到溶胶溶液,然后将切好2cm
×
2cm正方形滤纸片浸泡在溶胶溶液中,过夜后,取出干燥,得到监测海水鱼鱼肉新鲜度的指示标签。
[0014]
进一步的,新鲜产品自然光比色区对应的色相为蓝绿色,新鲜产品紫外光比色区对应的色相为荧光亮粉色;合格产品自然光比色区对应的色相为黄绿色,合格产品紫外光比色区对应的色相为荧光暗粉色;不合格产品自然光比色区对应的色相为浅褐色,不合格产品紫外光比色区对应的色相为黑色。
[0015]
一种海水鱼鱼肉新鲜度双通道指示卡在判定海水鱼新鲜度中的应用。
[0016]
一种海水鱼鱼肉新鲜度双通道指示卡在判定海水鱼新鲜度中的应用,将指示卡粘贴在包装内使用,且指示标签不与食品直接接触,根据指示标签颜色变化与标准比色卡进行对比,对海水鱼新鲜度进行实时的监测,识别海水鱼鱼肉的新鲜度;
[0017]
在可见光下,指示标签颜色为蓝绿色表明为新鲜,指示标签颜色为黄绿色表明为合格,指示标签颜色为浅褐色表明为不合格;
[0018]
在365nm的紫外光照射下,当指示标签颜色为强烈粉红色荧光时表明为新鲜,当指示标签颜色为中等强度的暗粉色荧光时表明为合格,当指示标签颜色为微弱或无荧光时表明为不合格。
[0019]
本发明的有益效果:
[0020]
(1)该荧光探针具有发射波长位于660nm处近红外发射的特点,受到散射和荧光背景干扰小,量子效率高,荧光信号稳定,在纯水中实现了对多种胺类化合物的检测,在纯水中加入探针溶液后,用于检测溶液,溶液颜色发生明显变化,且最大吸收强度蓝移,并且荧光强度显著淬灭,在纯水中对多种胺类化合物响应速度快。
[0021]
(2)荧光探针制备的指示卡可以比色和荧光双通道检测,指示标签配合标准比色卡,可实时监测海水鱼鱼肉的新鲜度。
[0022]
综上,本发明所设计合成的荧光探针不仅可以在纯水体系下快速识别多种胺类化合物,也可以制备成指示标签识别挥发性胺。所设计的指示标签制备过程简单,可以实现比色和荧光双重通道检测鱼肉新鲜度,定性分析更准确可靠。该指示标签可非接触、无损化对海水鱼鱼肉新鲜度进行快速实时监测,能为生产商、零售商以及消费者及时提供有效的新鲜度信息,具有较好的实际应用价值。
附图说明
[0023]
图1是本发明荧光探针pal的1h nmr谱图;
[0024]
图2是本发明荧光探针pal的
13
c nmr谱图;
[0025]
图3是本发明荧光探针pal的高分辨质谱图;
[0026]
图4是本发明荧光探针pal加入二乙胺后荧光强度随时间的变化;
[0027]
图5是本发明荧光探针pal对胺类化合物作用前后的荧光发射光谱图;
[0028]
图6是本发明荧光探针pal对胺类化合物作用前后的紫外吸收光谱图;
[0029]
图7是本发明荧光探针pal与不同倍数二乙胺作用后的荧光发射光谱图;
[0030]
图8是本发明荧光探针pal识别二乙胺后计算的检测限;
[0031]
图9是本发明荧光探针pal在不同ph中加入二乙胺后的荧光强度变化;
[0032]
图10是普通滤纸、探针pal浸渍滤纸及本发明制备的指示标签扫描电镜图;
[0033]
图11是本发明制备的指示标签识别挥发性胺前后的颜色变化和荧光颜色照片;
[0034]
图12是大菱鲆鱼肉在4℃下随着贮藏时间的延长,鱼肉的tvb-n含量与对应的指示标签在自然光和紫外光照射下的颜色;
[0035]
图13是根据鱼肉的tvb-n值与对应的指示标签在自然光和紫外光照射下的颜色制作的标准比色卡;
[0036]
图14是本发明制备的指示标签随贮藏时间延长而呈现的颜色变化,根据标准比色卡进而监测三文鱼鱼肉的新鲜度;
[0037]
图15是标准比色卡与指示标签集成,制备的可以快速辨别鱼肉新鲜度的指示标签;
[0038]
图16是集成的指示标签监测三文鱼鱼肉的新鲜度;
具体实施方式
[0039]
下面结合具体实施例对本发明的技术方案作进一步详细地说明。
[0040]
实施例1
[0041]
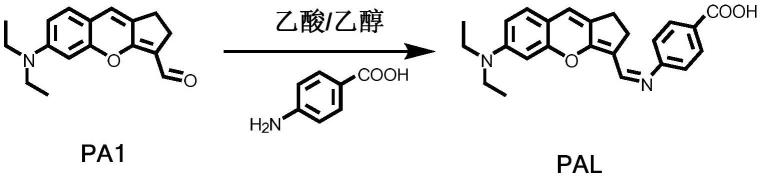
荧光探针pal的具体合成步骤如下:
[0042][0043]
加入溶于10ml乙醇的化合物pa1(538mg,2mmol)和对氨基苯甲酸(274mg,2mmol),然后加入10.78mg乙酸,得到反应混合物;将反应混合物在油浴中加热至50℃,回流搅拌6小时,冷却至室温,抽滤,收集粗产物紫黑色固体,用乙醇洗涤,得到荧光探针pal,该荧光探针产率为76%;1h nmr谱、
13
c nmr谱和质谱图如图1-3所示。
[0044]1h nmr(400mhz,dmso-d6)δ9.85(s,1h),8.52(s,1h),7.89(d,j=8.3hz,2h),7.58(d,j=8.5hz,2h),7.21(d,j=8.1hz,1h),6.79(s,1h),6.51(d,j=8.5hz,1h),6.45(s,1h),2.72(s,4h),2.48(s,4h),1.07(t,j=6.9hz,6h).
[0045]
13
c nmr(101mhz,dmso-d6)δ182.50,167.91,167.56,153.86,153.57,153.41,131.64,131.02,128.44,126.93,121.08,117.25,112.96,108.70,98.05,44.32,25.44,24.38,12.90.
[0046]
hrms(esi-)for c
24h24
n2o3[m-h]-calcd:387.1714,found:387.1614。
[0047]
实施例2
[0048]
加入溶于20ml乙醇的化合物pa1(2.6934g,10mmol)和对氨基苯甲酸(2.0571g,15mmol)然后加入53.9mg乙酸,将反应混合物在油浴中加热至60℃,回流搅拌12小时,冷却至室温,抽滤,收集产生的粗产物,用正己烷洗涤,得到荧光探针pal,产率为55%;本实施例荧光探针pal的1h nmr谱图如图1,
13
c nmr谱图如图2,高分辨质谱如图3所示。
[0049]
实施例3
[0050]
加入溶于50ml乙醇的化合物pa1(13.467g,50mmol)和对氨基苯甲酸(13.714g,100mmol),然后加入269.5mg乙酸,将反应混合物加热至55℃,回流搅拌5小时,冷却至室温,抽滤,收集产生的粗产物,用乙醇洗涤,得到荧光探针pal,产率为79%;本实施例荧光探针pal的1h nmr谱图如图1,
13
c nmr谱图如图2,高分辨质谱如图3所示。
[0051]
一、荧光探针pal对胺类化合物的响应时间
[0052]
探究荧光探针识别胺类化合物的响应时间,在含有荧光探针的溶液中加入胺溶液后,随即手动震荡测试液1秒钟,即可发现测试液立刻发生了明显颜色变化和荧光信号减弱的改变,达到了快速灵敏比色识别的效果。将盛有荧光探针的比色皿放置荧光光谱仪中,加入二乙胺(dea)溶液后立即进行时间扫描,测试的谱图见图4。发现在3秒内,荧光强度就猝灭完全,说明响应速度非常迅速,无需耗费时间等待,为后续制备海水鱼鱼肉新鲜度指示标签实现快速实时检测奠定了基础。
[0053]
二、荧光探针pal对胺类化合物的选择性
[0054]
在2ml纯蒸馏水加入荧光探针pal溶液配置成10μmol/l的溶液待用,再分别加入20
μmol/l环己二胺、二乙胺、正丙胺、异丙胺、三乙胺、乙胺、精胺、尸胺、腐胺、2-苯乙胺、酪胺和色胺,观察其荧光强度变化,如图5所示,12种胺类化合物溶液均引起660nm处荧光强度减弱,强烈的粉红色荧光信号消失。测试的紫外-可见光谱图如图6所示,加入多种胺类化合物后,12种胺类化合物最大吸收波长明显蓝移,颜色变化明显。
[0055]
以上结果表明荧光探针pal在纯水溶液中可对多种胺类化合物实现比色和荧光双通道识别,具有优良的选择性。
[0056]
三、荧光探针pal对胺类化合物的滴定测试
[0057]
以二乙胺为例,测试了10μmol/l的荧光探针pal在纯蒸馏水中的荧光强度与二乙胺溶液浓度之间的关系,如图7所示,当加入二乙胺溶液浓度(0~5倍)逐渐变大时,荧光探针pal的荧光强度逐渐减弱,当加入50μmol/l的二乙胺溶液时荧光强度不再变化,说明达到了饱和状态。其他胺类(环己二胺、正丙胺、异丙胺、三乙胺、乙胺、精胺、尸胺、腐胺、2-苯乙胺、酪胺和色胺)具有类似效果,加入不同的胺溶液,荧光探针pal的荧光强度均减弱。
[0058]
四、荧光探针pal对二乙胺的检测限
[0059]
用纯蒸馏水配置10μmol/l的荧光探针pal溶液,测试不少于11个平行样的荧光强度,根据公式:∑(x
i-x)2=(x
1-x)2+(x
2-x)2+
……
+(x
n-x)2求出平方差的总和(xi为每次测量受体本身荧光强度值,x为荧光强度平均值,n为测试次数,n≥11),然后根据公式:s=[∑(x
i-x)2/(n-1)]
0.5
求出灵敏度s,再根据检测限公式:检测限=3s/k,k为所选直线部分的斜率(注:直线是根据滴定做点图,横坐标为离子浓度,纵坐标为荧光强度),求出检测限为7.968
×
10-7
mol/l(见图8),这说明该探针在水溶液中可检测含量较低浓度的二乙胺,具有较高的灵敏度,有较好的实际应用潜力。
[0060]
五、荧光探针pal检测胺类化合物的ph范围
[0061]
探究了ph对检测胺类化合物的影响,以二乙胺为例,不同ph条件下pal的荧光强度如图9所示,探针pal在ph为3-10范围内具有较好的荧光强度,说明探针在弱酸性、中性、弱碱性中均具有较好的稳定性。探针中加入二乙胺溶液后均引起了荧光显著淬灭,结合识别前后荧光变化的显著程度,我们可得出ph在4-10范围内,荧光探针pal对二乙胺具有显著的识别效果,说明该探针具有较宽的ph适用范围。
[0062]
实施例4
[0063]
称取10mg的荧光探针pal,加入3.6ml乙醇与0.8ml浓度为0.1mol/l盐酸的混合溶液,同时在搅拌的条件下将成膜剂1.2ml的硅酸乙酯(teos)和0.8ml的甲基三乙氧基硅烷(mteos)加到所述混合溶液中,再加入0.5g聚乙二醇二甲醚(pegdme)成膜剂,室温下搅拌1小时,得到含荧光探针的成膜溶液,然后将直径为2cm
×
2cm正方形滤纸片浸泡在成膜溶液中,过夜后,取出干燥,得到指示标签,该指示标签裸眼观察是深蓝绿色,紫外光下呈现粉红色强荧光。
[0064]
实施例5
[0065]
称取10mg的荧光探针pal,加入4ml乙醇与0.9ml浓度为0.1mol/l盐酸的混合溶液,同时在搅拌的条件下将成膜剂1.4ml的硅酸乙酯(teos)和0.7ml的甲基三乙氧基硅烷(mteos)加到所述混合溶液中,再加入0.6g聚乙二醇二甲醚(pegdme)成膜剂,室温下搅拌1小时,得到含荧光探针的成膜溶液,然后将直径为2cm
×
2cm正方形滤纸片浸泡在成膜溶液中,过夜后,取出干燥,得到指示标签,该指示标签裸眼观察是深蓝绿色,紫外光下呈现粉红
色强荧光。
[0066]
实施例6
[0067]
称取10mg的荧光探针pal,加入3.8ml乙醇与1.0ml浓度为0.1mol/l盐酸的混合溶液,同时在搅拌的条件下将成膜剂1.3ml的硅酸乙酯(teos)和0.6ml的甲基三乙氧基硅烷(mteos)加到所述混合溶液中,再加入0.7g聚乙二醇二甲醚(pegdme)成膜剂,室温下搅拌1小时,得到含荧光探针的成膜溶液,然后将直径为2cm
×
2cm正方形滤纸片浸泡在成膜溶液中,过夜后,取出干燥,得到指示标签,该指示标签裸眼观察是深蓝绿色,紫外光下呈现粉红色强荧光。
[0068]
六、指示标签的表面微观形态分析
[0069]
我们用扫描电镜研究了指示标签与普通滤纸及浸渍荧光探针pal的滤纸在微观上的区别。图10显示了三个样品(从左到右分别为普通滤纸、直接浸渍pal的滤纸(浸渍液:用10毫升dmso溶解3.87mg的pal,配置成浓度为1mmol/l的pal溶液)和实施例6制备的指示标签)放大600倍、9k倍和40k倍(从上到下)的扫描电镜图像。
[0070]
由图10中的(a)、(d)、(g)可看出三个样品的表面在放大600倍后是相似的,看起来像蓬松的纤维,可提供较大表面积来与挥发性胺气体相互作用。当三个样品的表面被放大9.0k倍时,三种样品显示出不同的微观形貌。普通滤纸(图10b)仍显示蓬松的纤维结构,浸渍pal的滤纸可看到许多球形颗粒固定在纤维之间(图10e),孔洞明显减少。与浸渍pal的滤纸和普通滤纸相比,指示标签的表面更光滑(图10h)。三个样品放大40.0k倍后表面微结构差异更明显,本发明实施例6指示标签显示出更加致密平滑的表面结构(图10i),更有利于吸收挥发性的胺。
[0071]
七、指示标签在模拟环境中(高65mm,直径18mm的圆柱形玻璃瓶),对挥发性胺的识别效果
[0072]
在鱼肉变质过程中会产生一些代谢挥发物,如三乙胺、正丙胺、二乙胺等,检测这些代谢挥发物可以监测鱼肉新鲜度。为了验证制作的指示标签对挥发性胺是否具有选择性,我们将指示标签置于0.5%挥发性胺水溶液的顶部空间,模拟鱼肉变质环境下,指示标签对挥发性胺是否有响应。
[0073]
首先,取500ml浓度为50mmol/l挥发性胺,加入100ml蒸馏水中,配制成50mmol/l挥发性胺溶液;分别选用乙胺、二乙胺、三乙胺、正丙胺和异丙胺五种挥发性胺作为实验组,指示标签的空瓶作为空白对照组。五个实验组和空白对照组指示标签自然光下观察是深蓝绿色的,紫外光下呈现粉红色。接触挥发性胺1小时后,在自然光下,五个实验组指示标签颜色由深蓝绿色变为不同程度的黄绿色(见图11a),紫外光下荧光强度均降低明显,有的甚至彻底无荧光(见图11b),空白对照组无变化。这表明指示标签对乙胺、二乙胺、三乙胺、正丙胺、异丙胺这5种挥发性胺具有良好的比色和荧光双重响应,说明指示标签具备检测鱼类新鲜度的潜力。
[0074]
八、指示标签标准比色卡的制备
[0075]
为了制备标准比色卡,我们需要监测鱼肉从新鲜到腐败过程中,指示标签的自然光颜色和荧光灯照射下颜色的变化。我们选用大菱鲆鱼肉为实验对象,取背部肉做去皮处理,将鱼肉分割成多份5~6g的小块鱼肉,分别放置在一次性圆形透明塑料培养皿中,在培养皿盖子顶空处放入指示标签,扣紧盖子,放置于4℃冰箱贮藏,每间隔24小时检测1次大菱
鲆鱼肉的tvb-n含量,并采集指示标签自然光照片和荧光照片。获得的数据如图12所示。新鲜的大菱鲆鱼肉tvb-n含量从起始的2.8
±
0.06mg/100g整体呈上升趋势,tvb-n含量在第5天达到13.1
±
1.2mg/100g,之后开始迅速增加,到第9天达到了30.6
±
0.06mg/100g,而tvb-n可接受的极限为30mg/100g。因此,大菱鲆鱼肉为在4℃贮藏第9天可视为贮藏变质的临界值。在自然光下,指示标签由最初的蓝绿色,变成黄绿色,最终变成浅褐色;在365nm紫外光下,指示标签由最初的荧光亮粉色,变成荧光暗粉色,最终变成无荧光。
[0076]
根据中华人民共和国国家标准gb/t 18108-2019(鲜海水鱼通则)中规定,海水鱼中tvb-n含量最高限量为30mg/100g。tvb-n值≤15mg/100g时样品为优级;当15mg/100g《tvb-n值≤30mg/100g时样品为合格;当tvb-n值》30mg/100g时,此时样品为不合格。
[0077]
根据实测的tvb-n值及对应的指示标签自然光颜色和紫外光颜色照片,我们选取tvb-n值为2.8mg/100g、5.6mg/100g和11.4mg/100g对应的指示标签在自然光下分别呈现为深蓝绿色、蓝绿色和浅蓝绿色,紫外光照射下均呈现强烈的粉红色荧光,作为标准比色卡中新鲜部分的参照标准,当指示标签显示上述颜色状态之一时,可判断此样品为新鲜产品(见图13中新鲜区)。选取tvb-n值为15.1mg/100g、16.8mg/100g和22.4mg/100g对应的指示标签在自然光下分别呈现为浅黄绿色、黄绿色和深黄绿色,在紫外光照射下呈现中等强度的暗粉色荧光,作为标准比色卡中合格部分的参照标准,当指示标签显示上述颜色状态之一时,可判断此样品为合格产品(见图13中合格区)。选取tvb-n值为30.2mg/100g、44.8mg/100g和53.2mg/100g对应的指示标签在自然光下分别呈现为浅褐色、黄褐色和红褐色,在紫外光照射下呈现微弱或无荧光,作为标准比色卡中不合格部分的参照标准,当指示标签显示上述颜色状态之一时,可判断此样品为不合格产品(见图13中腐败区)。
[0078]
由此可以得到,新鲜产品自然光比色卡对应的色相为蓝绿色,新鲜产品紫外光比色卡荧光为亮粉色;合格产品自然光比色卡为黄绿色,合格产品紫外光比色卡荧光为暗粉色;不合格产品自然光比色卡为浅褐色,不合格产品紫外光比色卡为黑色。
[0079]
九、指示标签的实际应用
[0080]
使用指示标签对三文鱼新鲜度进行了实际监测应用,三文鱼样品处理和测试方法与大菱鲆相同。图14中显示了室温下三文鱼随贮藏时间的增加指示标签的颜色变化。新购买的三文鱼中指示标签在自然光下呈现蓝绿色,紫外光下发出强烈的粉红色荧光,与标准比色卡中新鲜部分相对应;当贮藏时间为10h时,指示标签自然光颜色为黄绿色,紫外光下为中等强度的暗粉色荧光时,表明此时仍为合格产品。进一步增加贮藏时间的,在16h时指示标签自然光颜色为浅褐色,紫外光下为微弱或无荧光时表明此时三文鱼已经腐败,不合格产品不可食用。
[0081]
为了更好的提高使用标签的便捷性,我们将指示标签与标准比色卡进行了集成,制作了可商品化使用的指示标签。指示卡由面积相同的三个正方形比色卡和一个正方形指示标签拼接而成的正方形,三个正方形比色卡分别为新鲜比色卡、合格比色卡和腐败比色卡,比色卡分为自然光比色区域和紫外光比色区域,在指示卡靠近中心区域分别为新鲜、合格和腐败自然光比色区,在指示卡远离中心区域分别为新鲜、合格和腐败紫外光比色区;如图15所示,三角形图片为标准比色卡的颜色,靠近中心区域的三角形是自然光照射下的临界点颜色,从右到左颜色依次为蓝绿色代表新鲜,黄绿色代表合格,浅褐色代表腐败(即不合格),远离中心区域的三角形为紫外光照射下的临界点颜色,从右到左颜色依次为强烈粉
红色荧光代表新鲜,中强度暗粉色荧光代表合格,黑色代表腐败(即不合格)。方形图片即为放指示标签的位置,随着贮藏时间的延长,观察此处指示标签的颜色变化即可判定鱼肉的新鲜程度。
[0082]
以三文鱼为例,利用指示标签监测三文鱼的新鲜度。将超市购买的三文鱼放入餐盒内,将餐盒上盖打一个圆孔,将指示标签的位置对准圆孔贴在餐盒盖上,记录室温下标签颜色随贮藏时间的变化。从图16中可看出,刚开始三文鱼指示标签与比色卡中新鲜区颜色是对应的,测试tvb-n值是7.28,证明鱼肉确实在新鲜范围内。当室温放置10h后,指示标签的颜色与比色卡中合格区颜色是对应的,此时测试tvb-n值是15.4,证明鱼肉在合格范围内。当室温放置16h后,指示标签的颜色与比色卡中腐败区颜色是对应的,此时测试tvb-n值是32.2,说明此时的三文鱼鱼肉已经超出了国家规定的标准,属于不合格产品,不能在食用。
[0083]
综上所述,无论在模拟环境和真实鱼肉的应用中,本发明的指示标签制备过程简单,可以实现比色和荧光双重通道检测鱼肉新鲜度,定性分析更准确可靠。该指示标签可非接触、无损化对海水鱼鱼肉新鲜度进行快速实时监测,能为生产商、零售商、消费者提供及时有效的新鲜度信息,具有较好的实际应用价值。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1