miR-663a或其靶基因CKDN2A在薄型子宫内膜中的应用
mir-663a或其靶基因ckdn2a在薄型子宫内膜中的应用
技术领域
1.本发明涉及生物医药技术领域,具体涉及mir-663a或其靶基因ckdn2a在薄型子宫内膜中的应用。
背景技术:
2.薄型子宫内膜指排卵前子宫内膜厚度≤7mm,病理特征显示为腺上皮生长缓慢,子宫动脉血流阻力高,血管生成不良和血管内皮生长因子低表达。研究显示,薄型子宫内膜在种植窗期(月经第20-24d)容受性下降,血管内皮细胞生长因子vegf及整合素β3表达严重缺乏,影响胚胎植入和着床,是导致临床不孕不育的高发因素。临床上因薄型子宫内膜导致不孕症的发生率越来越高,有部分患者因内膜因素无法受孕,辅助生殖技术给不孕不育患者带来了希望,但仍无法解决薄型子宫内膜的问题,由于内膜问题导致的低妊娠率尤为突出。在胚胎质量既定的情况下,子宫内膜作为胚胎着床和发育的“土壤”,在妊娠中起着举足轻重的作用,因此改善子宫内膜容受性是治疗不孕的关键。子宫内膜损伤病因,目前研究认为是多因素诱发引起的女性子宫内膜损伤,包括感染(结核杆菌感染)、激素分泌失调、子宫内膜及卵巢血流动力学改变、刮宫术、医源性损伤及炎症因子刺激等引起的,包括薄型子宫内膜、子宫内膜异位、子宫内膜粘连、薄型子宫内膜伴宫腔粘连等病症。
3.在导致薄型子宫内膜发生的众多因素中,内膜内血管缺血或血流减慢导致子宫内膜细胞缺氧这一治病因素引起科研人员的广泛关注。但是,目前对于薄型子宫内膜的分子机理研究尚浅。已有研究证实薄型子宫内膜中vegf、lif和整合素β3等与细胞生长和血管生成相关的因子表达显著降低;使用干细胞外泌体治疗后,vegf、lif和整合素β3等分子的表达明显上升,与正常组织水平相当,但其内在分子机制尚不清晰。因此,需要进一步的深入探究干细胞外泌体修复薄型子宫内膜的潜在分子机理。
4.而干细胞分泌的外泌体内含有大量mirna,对多种疾病具有治疗作用,因此本发明深入探究了外泌体mirna对薄型子宫内膜的修复作用及其潜在的分子机制。
技术实现要素:
5.为了寻找与薄型子宫内膜发生、发展有关的mirna,本发明一个目的在于提供mir-663a及其靶基因ckdn2a在制备诊断、预防和/或治疗薄型子宫内膜产品中的应用。
6.为实现上述目的,本发明具体技术方案如下:
7.本发明第一方面提供了检测mir-663a或其靶基因ckdn2a表达水平的试剂在制备检测薄型子宫内膜的产品中的应用。
8.所述mir-663a选自以下组中的至少一种:mir-663a初始mirna、mir-663a前体mirna、成熟mir-663a;所述mir-663a初始mirna能在人细胞内被剪切并表达成成熟mir-663a;所述mir-663a前体mirna能在人细胞内被剪切并表达成成熟mir-663a。
9.虽然在某些具体实施方式中所使用的是成熟mir-663a,但是本领域技术人员可以预期,初始mirna(pi-mir-663a)、前体mirna(pre-mir-663a)将可以获得与成熟mir-663a同
样的技术效果,因为细胞有能力进一步将初始mirna(pi-mir-663a)、前体mirna(pre-mir-663a)加工为成熟mir-663a。
10.优选地,所述mir-663a在缺氧损伤eec中下调;所述ckdn2a在缺氧损伤eec中上调。
11.优选地,所述检测mir-663a表达水平的试剂包括检测mir-663a的特异性引物;所述检测ckdn2a表达水平的试剂包括检测ckdn2a的特异性引物或抗体。
12.优选地,所述检测mir-663a的特异性引物的核苷酸序列如seq id no:1-3所示;所述检测ckdn2a的特异性引物的核苷酸序列如seq id no:4-5所示。
13.本发明第二方面提供了一种缓解或修复缺氧损伤eec的生物制剂,所述生物制剂中包含过表达mir-663a物质和/或下调其靶基因ckdn2a表达的物质。
14.优选地,所述过表达mir-663a物质包括mir-663a的寡核苷酸及其模拟物;所述下调其靶基因ckdn2a的物质包括其反义核苷酸序列或mir-663a。
15.优选地,所述生物制剂还包括人脐带间充质干细胞分泌的外泌体。
16.本发明第三方面提供了所述的生物制剂在预防或治疗薄型子宫内膜产品中的应用。
17.优选地,所述薄型子宫内膜的类型为由缺氧引起的薄型子宫内膜。
18.优选地,所述mir-663a抑制cdkn2a的表达并且能够修复eec缺氧损伤。
19.本发明第四方面提供了预防和/或治疗缺氧引起的薄型子宫内膜的药物组合物,所述药物组合物中包含过表达mir-663a物质和/或抑制cdkn2a的表达的物质。
20.优选地,所述药物组合物还包括治疗薄型子宫内膜的其他药物。
21.优选地,所述药物包括人脐带间充质干细胞分泌的外泌体。
22.基于上述技术方案,本发明具有以下有益效果:
23.本发明通过转录组测序技术(rna-sequence)筛选出mir-663,细胞功能实验和western blot实验显示,mir-663可显著抑制eec缺氧损伤发生,并且这种抑制能够通过靶基因cdkn2a实现,为薄型子宫内膜的治疗提供了新的思路。
附图说明
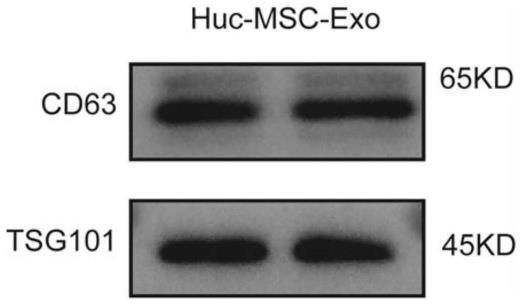
24.图1western blot实验鉴定hucmsc-ex。
25.图2exosome电镜和nta鉴定hucmsc-ex。
26.图3western blot鉴定eec缺氧损伤。
27.图4激光扫描共聚焦显微镜检测细胞对标记外泌体的摄取。
28.图5细胞增殖检测;图a为非低氧处理的eec(eec-normal)组、缺氧损伤4h的eec(eec-hypoxia injury)组、共培养hucmsc-ex的非低氧处理的eec组和共培养hucmsc-ex的缺氧损伤4h的eec组之间细胞活性比较;图b为非低氧处理的eec组、缺氧损伤4h的eec组和共培养hucmsc-ex的缺氧损伤4h的eec组中细胞培养不同时间的细胞活性比较。
29.图6细胞凋亡检测。
30.图7western blot检测非低氧处理的eec组、缺氧损伤4h的eec组、共培养hucmsc-ex的非低氧处理的eec组、共培养hucmsc-ex的缺氧损伤4h的eec组中上皮-间质转化(emt)和凋亡相关蛋白表达(a)及灰度分析(b)。
31.图8细胞迁移检测。图a镜下图,图b伤口愈合距离的统计图。
32.图9热图heatmap分析mirna差异基因表达谱。
33.图10qpcr验证mir-663a差异基因表达。
34.图11mir-663a靶基因预测。
35.图12qpcr验证mir-663a靶基因。
36.图13过表达has-mir-663a的缺氧损伤模型检测。
37.图14western blot实验检测转染了mir-663a mimic的缺氧损伤eec中cdkn2a、e-cadherin和bcl-2蛋白表达。
具体实施方式
38.以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
39.下述实施例所使用的实验方法如无特殊说明,均为常规方法。
40.下述实施例中所有的材料、试剂等,如无特殊说明,均可从商业途径获得。
41.在本发明中,术语“mir-663a”是指包含seq id no.6所示序列或其同源序列的mirna,例如本领域中已知各种来源如人、鼠、兔等的mir-663a。
42.aggcggggcgccgcgggaccgc,seq id no.6。
43.本发明的“mir-663a”还包含上述天然存在的mir-663a序列经取代、缺失或添加一个或几个核苷酸,或经过生物学化学修饰后仍具有mir-663a生物活性的mir-663a衍生物。
44.本发明的“mir-663a”还包含人工合成的以及可以通过购买市售商品方式获得的具有mir-663a生物学活性的mir-663a模拟物(mir-663a mimic)。
45.此外,本发明所述的mir-663a也可以为前体形式,mir-663a前体是指在被施用对象的细胞内或体内可以被加工成为mir-663a的前体。获得天然存在的mir-663a前体的方法为本领域技术人员所公知。
46.本领域技术人员公知,mir-663a的初始转录产物经过一系列的加工后,形成成熟的mir-663a。mir-663a前体只有在加工为成熟的mir-663a后才具有相应的生物学功能。
47.本发明实施例中所用的实验材料来自以下途径:
48.vegf(abcam ab214424);avβ3(abcam ab179473);cadherin(abcam ab40772);annexin v-fitc)/pi apoptosis detection kit:(beyotime biotechnology c1062);cd63 antibody(abcam ab134045);tsg101 antibody(abcam ab125011);vegf antibody(abcam ab214424);avβ3antibody(abcam ab179473);cdkn2a antibody(abcam ab108349);anti-bax antibody(abcam ab182734);cleaved-caspase3 antibody(abcam ab32042);p53 antibody(abcam ab26);bcl-2antibody(abcam ab182858);e-cadherin antibody(abcam ab40772);n-cadherin antibody(abcam ab76011);β-actin antibody(cwbio cw0096)。
49.实施例1 hucmsc-ex的提取与鉴定
50.人脐带间充质干细胞外泌体(hucmsc-ex)提取:超净台操作,取细胞培养液,分装灭菌后的离心瓶或离心管,低温离心机4℃,1000x g离心10min,去除培养液中的细胞培养上清、碎片和死细胞;
51.然后,超净台操作,上清通过0.2mm滤器过滤,分装灭菌后的离心瓶;将上清培养液
在超高速离心机,4℃,100,000x g,离心3h;弃掉上清,加入10ml pbs,超高速离心机,4℃,100,000x g洗涤90min;弃掉pbs,管底含外泌体的颗粒用50μl pbs重悬,转移至灭菌进口1.5ml ep管,封口膜封口,转移至-80℃保存。
52.hucmsc-ex鉴定:通过western blot实验、exosome(外泌体)电镜和nta鉴定hucmsc-ex。
53.western blot结果如图1,结果显示外泌体表达cd63和tsg101 marker,表明成功提取hucmsc外泌体;exosome鉴定结果如图2,结果显示:1、电镜发现外泌体囊泡结构,明显的膜结构和环状结构;2、nta显示峰值在100-150nm之间,与外泌体的理论直径大小相符。
54.实施例2 eec缺氧模型的构建
55.(1)人子宫内膜腺上皮细胞(eec)在常氧条件下培养,细胞生长到大约60-70%密度/容片率。
56.(2)缺氧处理时,细胞在加湿的缺氧空气(1%o2,94%n2,5%co2)下,置于恒温箱(thermo),37℃条件下培养1h、4h、8h、16h和24h;以常氧条件下培养的eecs为对照组。
57.(3)western blot检测vegf(abcam ab214424)、avβ3(abcam ab179473)和e-cadherin(abcam ab40772)的表达,以鉴定缺氧损伤。
58.结果如图3所示,western blot结果显示,缺氧4h后,与缺氧相关的指标vegf、avβ3明显上调,上皮细胞标志分子e-cadherin表达也明显下调;综合分析,选择缺氧4h的eec与干细胞外泌体做共培养实验。
59.实施例3缺氧eec对hucmsc外泌体摄取实验
60.hucmsc-ex分别与缺氧损伤4h的eec和与非低氧处理的eec共培养,随后将两组细胞进行rkh67荧光染色,并在400倍镜头下观察。
61.具体步骤如下,exosome外泌体用pkh67(公司:sigma-aldrich,货号:mini67-1kt)标记。pkh67标记的外泌体与hucmsc共培养孵育24小时;用多聚甲醛(4%)固定细胞,常温15min;用0.5%triton x-100的tbst给细胞打孔,常温,15min;用dapi染色标记细胞核(4
′
,6-diamidino-2-phenylindole(dapi)solution(selleck s9980));使用激光扫描共聚焦显微镜(olympus fluoview fv3000)检测细胞对标记外泌体的摄取。
62.结果如图4所示,结果显示与非低氧处理的eec相比,低氧处理4h后的eec组,细胞摄取外泌体的能力明显增强。
63.实施例4 cck8增值实验
64.对非低氧处理的eec、缺氧损伤4h的eec、共培养hucmsc-ex的非低氧处理的eec、共培养hucmsc-ex的缺氧损伤4h的eec进行cck8实验,实验步骤如下:
65.一.细胞准备
66.将细胞培养液收集在无菌15ml离心管中,用3ml nacl清洗1遍,清洗后每瓶t25加入1ml胰酶,消化至细胞呈流沙状滑落,随即加入旧培养液终止消化。用1ml移液枪,吹吸混匀,转移至15ml离心管中,1000rpm离心5分钟。
67.二.铺板
68.将离心完的细胞,倒去上清,并加1-3ml新鲜培养基重悬细胞,胎盘蓝1:1计数,按2000cell/well将其铺至96孔板中,每孔200μl,37℃培养箱培养,每种细胞4复孔。
69.三.cck8增殖检测
70.对非低氧处理的eec、缺氧损伤4h的eec、共培养hucmsc-ex的缺氧损伤4h的eec进行细胞增殖检测,实验步骤如下:
71.细胞贴壁后计算为细胞增值0d开始加入cck8试剂(索莱宝,货号ca1210-500),如下:
72.①
配制cck8使用液(10μl cck8原液+100μl无血清培养基);
73.②
吸去96孔板中的旧培养基,换上新配制的
①
,每孔加液110μl;
74.③
将加完
①
的96孔板和剩余的
①
37℃培养箱孵育1.5h;
75.④
将孵育完的cck8吸出95μl至新的96孔板中,加上孵育的
①
做空白;
76.⑤
将新的96孔板用酶标仪450nm读取吸光值。
77.cck8结果如图5显示,eec缺氧后细胞活性显著下降(图5a);与缺氧组细胞相比,加入hucmsc-ex刺激12h-36h,细胞活性有一定程度恢复(图5b)。
78.实施例5细胞凋亡实验
79.对非低氧处理的eec、缺氧损伤4h的eec、共培养hucmsc-ex的缺氧损伤4h的eec进行细胞凋亡实验,实验步骤如下:
80.a.把细胞培养液吸出至一合适离心管内,pbs洗涤贴壁细胞一次,加入适量胰酶细胞消化液(可含有edta)消化细胞。室温孵育至轻轻吹打可以使贴壁细胞吹打下来时,吸除胰酶细胞消化液。需避免胰酶的过度消化。
81.b.加入步骤a中收集的细胞培养液,把细胞轻轻吹打下来,转移到离心管内,1000g离心5分钟,弃上清,收集细胞,用pbs轻轻重悬细胞并计数。
82.c.取5-10万重悬的细胞,1000g离心5分钟,弃上清,加入195μl annexin v-fitc结合液轻轻重悬细胞。
83.d.加入5μl annexin v-fitc,轻轻混匀。
84.e.加入10μl碘化丙啶染色液,轻轻混匀。
85.f.室温避光孵育10-20分钟,随后置于冰浴中。可以使用铝箔进行避光。孵育过程中可以重悬细胞2-3次以改善染色效果。
86.g.流式细胞仪检测,可立即上机检测,annexin v-fitc为绿色荧光,碘化丙啶(pi)为红色荧光。
87.细胞凋亡实验结果如图6所示,结果显示,eec缺氧促进细胞凋亡,hucmsc外泌体可以缓解缺氧损伤eec凋亡水平。
88.实施例6 western blot实验
89.western blot(wb)实验对非低氧处理的eec、缺氧损伤4h的eec、共培养hucmsc-ex的非低氧处理的eec、共培养hucmsc-ex的缺氧损伤4h的eec进行上皮-间质转化(emt)相关蛋白e-cadherin、n-cadherin和凋亡相关蛋白bax、cleaved-caspase3、p53和bcl2检测。
90.实验步骤如下:
91.一.提取蛋白及蛋白定量
92.接种细胞铺至6孔板内,待细胞长至95%以上,收样。
93.收取上清,放入1.5ml进口ep管,冻存于-80℃冰箱。用预冷的氯化钠1ml/次,清洗两次。加入wb裂解液150μl/每孔(wb裂解液=m2 ripa裂解液+蛋白酶抑制剂+磷酸酶抑制剂=100:1:1)冰浴,摇床混匀25min,吸出放至1.5ml进口ep管,冻存于-80℃冰箱。
94.将裂解完的蛋白冰上解冻,4℃,12000rpm离心15分钟,将上清移至新管,从新管中取出2μl bca蛋白定量(以赛默飞试剂盒bca,货号23227)。
95.二.制备sds-page
96.1.胶板制备
97.制备分离胶和浓缩胶。
98.2.蛋白样品变性
99.确定实验蛋白浓度,上样质量为20ug/well,将计算好的蛋白与加完β-巯基乙醇的2x loading buffer混匀,沸水煮10min,瞬时离心冷却至室温进行实验。
100.3.电泳
101.80v,跑至marker全出现转120v跑浓缩胶。电泳跑上浓缩胶时,将转膜液放至4℃冰箱预冷,转膜液=1x转膜液+20%甲醇,跑至marker条带明显拉开,开始转印。
102.三.转印
103.转印前的pvdf膜事先用甲醇浸泡,pvdf膜裁剪大小为8.5cm*5.5cm,用镊子拿取,起胶后,marker位置在右。如有气泡,用海绵蘸水滴在胶上,同时用塑料铲,轻轻赶走气泡。夹板放入电泳槽前核对电极和颜色,同时在电泳槽中加入伯乐自带的冰袋。将电泳槽包裹在冰水混合物的泡沫箱中,60v转印3h,也可在电泳槽和泡沫箱的间隙中加入-20℃的冰袋。
104.四.孵育一抗和二抗
105.1.转印结束后,将转印成功的pvdf膜放在1x tbst中洗去剩余的甲醇,清洗三次,每次5-10分钟。然后转至用1x tbst配制的5%的牛奶摇床孵育1h,用3%bsa配制一抗。
106.2.将剪好的膜从牛奶中取出放入1x tbst中清洗,用镊子夹出膜并沥干水分,放至剪好的杂交袋中,使用封膜机进行封口,在封膜机上压实封膜处,每侧封两道,将配制好的一抗加至杂交袋中,轻轻弹出杂交袋中的气泡,用移液枪吸去多余的一抗并回收,封口在杂交袋上标明加入的一抗名称。将封好的一抗一起放入大小适应的自封袋中,绑在摇床上,4℃混匀过夜。
107.3.次日从杂交袋中取出孵育完一抗的pvdf膜,将pvdf膜放至1x tbst中,摇床清洗10分钟,三次。
108.4.将清洗完的pvdf膜,放至5%牛奶配制的二抗中,摇床孵育1h,孵育结束后,将pvdf膜放至1xtbst中,摇床清洗10分钟,三次。
109.5.显影和结果分析。
110.结果如图7a-b显示:1.eec-normal与hucmsc-ex-eec-normal两组间在上皮-间质转化(emt)和凋亡相关蛋白表达上均无显著差异;2.eec-hypocia injury与hucmsc-ex-eec-hypocia injury两组相比,emt蛋白和凋亡蛋白表达差异明显:eec缺氧后上皮细胞标志e-cadherin表达下调,间质细胞标志n-cadherin表达上调,说明上皮细胞在形态学发生向间质细胞表型的转变并获得迁移的能力;加入hucmsc-ex后,e-cadherin表达上调,n-cadherin表达下调,说明加入hucmsc-ex后抑制eec迁移;3.eec缺氧后,促凋亡蛋白bax、cleaved-caspase3和p53表达上调,抑制凋亡蛋白bcl2表达下调,加入hucmsc-ex后,促凋亡蛋白表达下调,抑制凋亡蛋白上调。
111.实施例7细胞划痕实验
112.对非低氧处理的eec、缺氧损伤4h的eec、共培养hucmsc-ex的非低氧处理的eec、共
培养hucmsc-ex的缺氧损伤4h的eec进行细胞划痕实验,实验步骤如下:
113.一.细胞准备
114.1.将细胞培养液收集在无菌15ml离心管中,用3ml nac清洗1遍,清洗后每瓶t25加入1ml胰酶,消化至细胞呈流沙状滑落,随即加入旧培养液终止消化。用1ml移液枪,吹吸混匀,转移至15ml离心管中,1000rpm离心5分钟。
115.2.将离心完的细胞,倒去上清,并加1-3ml新鲜培养基重悬细胞,胎盘蓝1:1计数,按3e5/well将其铺至6孔板中,每孔2ml,37℃培养箱培养。
116.二.划痕&拍照
117.1.次日用1ml移液枪吸去旧培养基,用200μl黄枪尖(尖头)在孔中间至上而下划一条直线,沿孔板壁缓慢加入2ml培养基,随即显微镜拍照(5x物镜),记录为迁移0h。
118.2.重复3换液步骤,显微镜拍照,记录为迁移24h。
119.3.重复4换液步骤,显微镜拍照,记录为迁移48h。
120.结果如图8a-b显示:eec-normal与hucmsc-ex-eec-normal两组细胞迁移有差异;eec缺氧后细胞迁移能力明显增强,再加入hucmsc-ex,细胞迁移能力减弱。与western blot emt细胞上皮-间质转化结果一致,说明eec缺氧损伤后细胞迁移转化能力增强,脐带间充质干细胞外泌体与缺氧损伤eec共培养后,eec的迁移转化能力减弱,干细胞外泌体修复了eec的缺氧损伤。
121.实施例8 rna-seq
122.由于干细胞分泌的外泌体内含有大量mirnas,对多种疾病具有治疗作用,而实施例1-7已经证实hucmsc-ex能够修复eec的缺氧损伤,因此对非低氧处理的eec、缺氧损伤4h的eec、共培养hucmsc-ex的缺氧损伤4h的eec进行rna的提取,并通过rna测序分析mirnas表达谱,结果如图9所示,根据rna-seq测序结果热图heatmap分析比较,与非低氧处理的eec相比,mir-663a在缺氧eec中显著下调,加入hucmsc-ex共培养后mir-663a表达又回升,猜测hucmsc-ex内携带mir-663a对缺氧eec有治疗作用。
123.所述mir-663a的特异性引物:
124.hsa-mir-663a-f:ctcaactggtgtcgtgga,seq id no:1;
125.hsa-mir-663a-r:gccgagaggcggggcgccgcgg,seq id no:2;
126.hsa-mir-663a-rt:ctcaactggtgtcgtggagcggtc,seq id no:3;
127.实施例9 mir-663a qpcr表达验证
128.rna-seq测序得到mirna差异基因表达谱,发现缺氧eec中mir-663a表达下调,外泌体共培养eec-hpoxia后,mir-663a表达上调,将mir-663a作为研究靶点;随后将测序返样返样进行了qpcr验证,验证结果如图10所示,qpcr结果与测序结果一致果,说明mir-663a可能在eec缺氧损伤中发挥关键调控作用。
129.实施例10 mirna靶基因预测
130.mirna靶基因预测发现ckdn2a作为mir-663a靶基因(图11)。并对其进行qpcr验证,结果如图12所示ckdn2a在缺氧损伤eec中的表达显著高于正常状态和外泌体共培养eec-hpoxia后的eec,其qpcr结果与mir-663相反,验证了mirna靶基因预测ckdn2a作为mir-663a靶基因的结果。
131.所述ckdn2a的特异性引物:
132.cdkn2a-f:ccacggcgcggagcccaa,seq id no:4;
133.cdkn2a-r:gcagcaccaccagcgtgtcca,seq id no:5。
134.实施例11过表达has-mir-663a的缺氧损伤模型
135.合成mir-663a mimic瞬时转染缺氧损伤模型细胞,转染结果如图13所示,结果显示转染成功,随后对缺氧损伤eec、没有转染mir-663a mimic的缺氧损伤eec以及转染了mir-663a mimic的缺氧损伤eec进行western blot实验,结果如图14所示,相较于缺氧损伤eec和没有转染mir-663a mimic的缺氧损伤eec,转染了mir-663a mimic的缺氧损伤eec中cdkn2a的表达明显下调,上皮细胞标志分子e-cadherin和抑制凋亡关键因子bcl-2的表达均明显上调,揭示了mir-663a抑制cdkn2a的表达并且能够修复eec缺氧损伤。
136.虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1