一种巴斯德毕赤酵母不同生长阶段的内参基因及其引物和应用
1.本发明属于分子生物学领域,具体涉及到一种巴斯德毕赤酵母不同生长阶段的内参基因及其引物和应用。
背景技术:
2.巴斯德毕赤酵母是一种单细胞真核微生物,同时也是一种甲醇酵母,被广泛用于生产重组蛋白的宿主,近年来作为生产化学品的细胞工厂备受关注,具有严格调控的表达系统,与酿酒酵母相比糖基化更少,在基础培养基中也可以实现高密度发酵,生长速度快,具有真核的翻译后修饰机制,可以正确的表达、分泌外源蛋白。在重组巴斯德毕赤酵母的构建过程中经常需要检测基因的表达水平。
3.目前,实时荧光定量(reverse transcription quantitative polymerase chain reα-tubion,rt-qpcr)是最常用于检测基因转录水平的方法,但它依赖于合适的内参基因对功能基因的相对表达定量进行数据标准化。内参基因必须在特定的实验条件下满足稳定表达的要求。以往的研究表明,没有一种单一的内参基因可以用于归一化所有的实验条件或者物种。迄今为止,act1基因是仅有的在巴斯德毕赤酵母中广泛应用于实时荧光定量的内参基因。在海滨雀稗中对mt2a,pip1,vp1,和cor413等基因的表达模式用实时荧光定量进行检测。结果表明,使用稳定的和不稳定的内参基因进行归一化会导致目的基因的表达水平存在显著差异,这会引起实验结果的误解。
4.巴斯德毕赤酵母用于构建细胞工厂时,需要检测不同生长阶段目的基因的转录情况,目前,还没有巴斯德毕赤酵母在不同生长阶段表达量稳定的内参基因的研究报道,这不利于使用实时荧光定量方法研究重组巴斯德毕赤酵母中功能基因的表达情况。
技术实现要素:
5.本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本技术的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
6.鉴于上述和/或现有技术中存在的问题,提出了本发明。
7.本发明的其中一个目的是提供一种内参基因在巴斯德毕赤酵母不同生长阶段的实时荧光定量中的应用,所述内参基因在巴斯德毕赤酵母不同生长阶段稳定表达,为蛋白生产过程中相关功能基因的表达定量提供可靠的分析依据。
8.为解决上述技术问题,本发明提供了如下技术方案:巴斯德毕赤酵母内参基因,所述内参基因为tif1基因和/或rpl19a基因。
9.作为本发明巴斯德毕赤酵母内参基因的一种优选方案,其中:所述tif1基因的核苷酸序列如seq id no.1所示。
10.作为本发明巴斯德毕赤酵母内参基因的一种优选方案,其中:所述rpl19a基因的
核苷酸序列如seq id no.2所示。
11.本发明的另一个目的是提供用于扩增所述巴斯德毕赤酵母内参基因的引物,包括扩增tif1基因用引物和/或扩增rpl19a基因用引物。
12.用于扩增tif1基因的引物包括核苷酸序列如seq id no.3所示的正向引物和核苷酸序列如seq id no.4所示的反向引物。
13.用于扩增rpl19a基因的引物包括核苷酸序列如seq id no.5所示的正向引物和核苷酸序列如seq id no.6所示的反向引物。
14.本发明的另一个目的是提供利用所述引物扩增巴斯德毕赤酵母内参基因的扩增方法,包括,
15.提取总rna并反转录为cdna作为扩增模板;
16.利用引物进行pcr扩增。
17.本发明的另一个目的是提供所述巴斯德毕赤酵母内参基因在巴斯德毕赤酵母不同生长阶段的实时荧光定量检测中的应用。
18.本发明的另一个目的是提供所述tif1基因的引物序列在巴斯德毕赤酵母不同生长阶段的实时荧光定量检测中的应用。
19.本发明的另一个目的是提供所述rpl19a基因的引物序列在巴斯德毕赤酵母不同生长阶段的实时荧光定量检测中的应用。
20.与现有技术相比,本发明具有如下有益效果:
21.本发明提供的内参基因在巴斯德毕赤酵母不同生长阶段稳定表达,为蛋白生产过程中相关功能基因的表达定量提供可靠的分析依据;弥补了巴斯德毕赤酵母实时荧光定量内参基因的缺失,有利于菌株构建工程和重组蛋白生产,为今后开展基因表达研究提供了可靠依据。
附图说明
22.为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
23.图1为本发明实时荧光定量pcr引物扩增基因的特异性图;
24.图2为本发明不同生长阶段的内参基因的ct值图;
25.图3为本发明genorm分析获得稳定性排序结果;
26.图4为本发明genorm算法中的成对变异值vn/vn+1图;
27.图5为本发明normfinder分析获得稳定性排序结果;
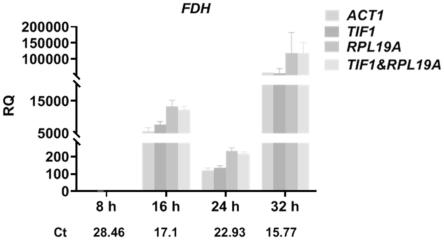
28.图6为本发明采用目的基因fdh验证不同生长阶段巴斯德毕赤酵母内参基因tif1和/或rpl19a表达稳定性结果图;
29.图7为本发明采用目的基因afdh验证不同生长阶段巴斯德毕赤酵母内参基因tif1和/或rpl19a表达稳定性结果图。
具体实施方式
30.为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合说明书实施例对本发明的具体实施方式做详细的说明。
31.在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
32.其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
33.实施例1
34.(1)巴斯德毕赤酵母不同生长阶段总rna提取及cdna的合成
35.收集ypd培养基中不同生长阶段(8h、16h、24h和32h)的巴斯德毕赤酵母,每种处理均有三个生物学重复,并分别用液氮冷冻处理,处理后分别采用康为世纪生物科技股份有限公司的超纯rna提取试剂盒提取纯净的总rna。使用quawell nanodrop紫外可见分光光度计(quawell,美国)检测总rna的浓度和质量。利用2.0%琼脂糖凝胶电泳检测总rna的完整性,然后进行基因组dna去除和反转录。首先加入4
×
gdna wiper mix 4μl,加入800ng rna模板,加入rnase-free ddh2o至16μl,42℃持续两分钟,加入4μl hiscript iii rt supermix,50℃持续15分钟,85℃失活5秒钟,cdna产物稀释到100ng/μl保存在-20℃。
36.(2)内参基因的选择及其引物的设计
37.通过分析了实验室前期两组rna-seq数据用于筛选出稳定表达的梯度强度的基因作为候选内参基因,最终得到了16个基因分别为rps8b、rpl35a、rpl10、eif5a、rpl19a(seq id no.2)、por1、rpl23b、0887、tif1(seq id no.1)、ole1、rpl14b、gs、sun、sdh2、trx1和ccp1。
38.在已知的巴斯德毕赤酵母基因组注释数据库中寻找并鉴定各候选内参基因的开放阅读框(orfs),根据已鉴定正确的orfs,利用ncbi网站设计引物。引物(表1)均在苏州金唯智生物科技有限公司合成,利用普通pcr检测引物特异性,利用琼脂糖胶与凝胶成像系统观察pcr产物的条带。进一步通过rt-qpcr检测引物的特异性与扩增效率,选择单一峰,扩增效率高且阴性对照无峰的引物作为最终引物。
39.(3)内参基因引物标准曲线的建立
40.对内参基因的每一对引物制作各自的标准曲线,并计算各自引物的扩增效率。将反转录的cdna混合后,以10为倍数稀释成5个浓度梯度(100μg/μl、10μg/μl、1μg/μl、0.1μg/μl和0.01μg/μl),作为标准曲线的建立模板。同时,以ddh2o作为阴性对照,以检测试剂或人为污染。所有样品均设置3次重复。用applied biosystem stepone plus system(appliedbiosystems,美国)进行实时荧光定量pcr,对获得的数据计算斜率与扩增效率,实时荧光定量pcr引物的扩增效率合格区间为90~110%之间。
41.表1 内参基因、目的基因及实时荧光定量引物
42.[0043][0044]
实施例2:实时荧光定量
[0045]
利用chamq universal sybr qpcr master mix(诺唯赞,中国)进行实时荧光定量,反应体系总体积为10.0μl,其中5.0μchamq universal sybr qpcr master mix,正反向引物(10mm)各0.2μl,2.0μcdna(100ng/μl),2.6μl rnase-free ddh2o。反应程序为:95℃预变性持续30秒,然后95℃持续10秒,60℃持续30秒,72℃持续20秒循环40次。加入熔解步骤循环(72℃持续2分钟,95℃持续15s,60℃持续30s,然后每10s 0.3℃升至95℃),验证每个反应产物是否存在单个峰。
[0046]
(1)总rna提取质量及引物特异性检测
[0047]
各样品的od
260/280
与od
260/230
比值均符合要求。总rna完整,无降解现象。对内参基因的引物在实时荧光定量中的熔解曲线均显示单一峰(图1),扩增效率(表1)较高,说明所有
引物不存在引物二聚体,可进行特异性扩增,实时荧光定量结果准确可信。
[0048]
(2)内参基因ct值分析
[0049]
ct值与基因的相对表达量呈反比,ct值越小说明基因的相对表达量越高,反之ct值越大说明基因的相对表达量越低。16个内参基因cq值的平均值在15.15~22.11之间(图2)。
[0050]
(3)稳定性评估
[0051]
利用qbase软件的genorm程序来分析实时荧光定量pcr的数据从而评估候选基因的稳定性。genorm分析所得到的m值可以用于表征基因的稳定性,m值最高的基因稳定性最低。genorm获得稳定性排序结果见图3。此外在实时荧光定量pcr实验中应用不止一个内参基因进行归一化可以使结果更可信。genorm的成对变异分析vn/n+1显示了精确归一化所需的最小内参基因数。当vn/n+1的结果小于0.15时,n就是可靠归一化所需的最少的内参基因数。本实施例的成对变异值v2/3=0.042<0.15,表明不同生长阶段巴斯德毕赤酵母仅需要选择2个内参基因进行基因的相对表达量分析(图4)。
[0052]
normfinder可以进一步验证genorm结果的可靠性。normfinder的结果表示为稳定性值;分析中最稳定的基因将呈现最低的稳定性值。它还有一个额外的优势,即较少受到候选基因相关表达的影响。normfinder获得稳定性排序结果见图5。综合ct值与genorm和normfinder等算法的评估结果,表明tif1&rpl19a基因是适用于巴斯德毕赤酵母不同生长阶段的荧光定量内参基因。
[0053]
实施例3:内参基因稳定性验证
[0054]
选用巴斯德毕赤酵母甲酸脱氢酶编码基因fdh和乙醇脱氢酶甲醛脱氢酶双功能酶的编码基因afdh当作目的基因,验证已筛选的稳定内参基因并与最常用的内参基因act1进行比较,实时荧光定量pcr程序同实施例2。表达稳定性结果如图6、图7所示。
[0055]
试验发现用不同的内参基因对fdh基因在不同生长阶段的相对表达量进行校正时,act1、tif1、rpl19a和tif1&rpl19a存在相似的变化趋势,但是内参基因tif1&rpl19a比act1倍数变化差异较大,说明本发明所述内参基因tif1&rpl19a对于目的基因的变化的表征更加明显(图6)。
[0056]
用不同的内参基因对afdh基因在不同生长阶段的相对表达量进行校正时,afdh在响应时间上略有差异,在用act1进行归一化时,afdh的表达量在24h达到了最高点,但是利用tif1、rpl19a以及tif1&rpl19a进行归一化时,该基因的表达量在16h达到最高,且本发明所述内参基因tif1&rpl19a对于目的基因的变化的表征同样比act1更加明显(图7)。
[0057]
以上结果说明选择不同的内参基因进行归一化会影响实时荧光定量pcr结果分析的准确性,更进一步说明本实施例的结果可靠,所筛选获得的内参基因tif1&rpl19a可适用于巴斯德毕赤酵母不同生长阶段功能基因的实时荧光定量分析。
[0058]
本发明通过巴斯德毕赤酵母的转录组测序数据库,参考选择了较为稳定的16个候选内参基因,鉴定了16个内参基因的基因序列和ct值(循环阈值),通过qbase软件中的genorm程序评估候选内参基因的稳定性和精准实时荧光定量所需的最佳内参基因数量,获得了适用于巴斯德毕赤酵母不同生长阶段的实时荧光定量内参基因,并设计了候选内参基因的实时荧光定量引物,该引物特异性强,扩增效率高,填补了巴斯德毕赤酵母不同生长阶段没有针对性的内参基因的现状,为巴斯德毕赤酵母不同生长阶段的相关功能基因的表达
定量提供可靠的分析依据,为功能基因的挖掘奠定必要的前期基础,同时可提高功能基因研究的重复性、稳定性和可靠性。
[0059]
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1