一种联苯-2-腈类化合物及其制备方法
1.本说明书一个或多个实施例涉及有机合成技术领域,尤其涉及一种联苯-2-腈类化合物及其制备方法。
背景技术:
2.芳香腈作为一种重要的单元结构,其在天然产物、药物、农用化学品、染料和其他功能性分子中广泛存在。在有机合成中,氰基也是转化各种有用官能团的重要前体,如亚胺、酮、酰胺、酯、醇、胺类以及其他含氮杂环。此外,作为有机骨架的核心部分,联芳基化合物存在于许多天然产物中,并广泛应用于大量有用的合成化合物中。考虑到这两个单元的重要性,因此开发一种合成联苯-2-腈的有效方法是吸引了大量科学家的关注。
3.目前,已经报道的合成联苯-2-腈的技术大部分是芳香腈与卤代苯在有机试剂中通过过渡金属催化交叉偶联反应完成的(org.lett.2011,13,1286-1289;acs catal.2017,7,3336-3343)这些方法已经取得了显著的成就。但是以芳基硅试剂为芳基源在水相中构建联苯-2-腈类化合物的方法目前还没有被报道过,因此这种通过过渡金属催化下芳基亚胺酸乙酯和芳基三乙氧基硅烷的邻位芳基化合成联苯-2-腈类化合物的方法将极具创新性和实用性,综上所述,本技术现提出一种联苯-2-腈类化合物及其制备方法来解决上述出现的问题。
技术实现要素:
4.有鉴于此,本说明书一个或多个实施例的目的在于提出一种联苯-2-腈类化合物及其制备方法,以解决背景技术中提出的问题。
5.基于上述目的,本说明书一个或多个实施例提供了一种联苯-2-腈类化合物,其结构式为式i所示:
[0006][0007]
其中,r1,r2为氢、卤素、苯基、烷基、烷氧基、三氟甲基、酰基和酯基。
[0008]
优选的,所述联苯-2-腈类化合物为:
[0009]
。
[0010]
一种联苯-2-腈类化合物的制备方法,包括以下步骤:将芳基亚胺酯、芳基硅试剂、金属催化剂、氧化剂、含氟活化剂、质子酸、添加剂和溶剂混合,在加热条件下进行c-h芳基化和脱醇反应,得到联苯-2-腈类化合物;
[0011]
其中,所述芳基亚胺酯为式ii所示结构:
[0012][0013]
其中,r1为氢、卤素、苯基、烷基、烷氧基、三氟甲基、酰基和酯基;r3为烷基;
[0014]
所述芳基硅试剂为式iii所示结构:
[0015][0016]
其中,r2为氢、卤素、苯基、烷基、烷氧基、三氟甲基、酰基和酯基;r4为烷基。
[0017]
更为优选的,所述催化反应在油浴的条件下进行,所述油浴的温度为60℃-140℃,所述催化反应的时间为2h-24h。
[0018]
更为优选的,所述溶剂为dmf(n,n-二甲基甲酰胺)、甲苯、氯苯、thf(四氢呋喃)、二氯甲烷、二氯乙烷、1,4-二氧六环、乙醇、异丙醇和水中的一种或几种混合。
[0019]
更为优选的,所述催化剂为rhcl3、[cp*rhcl2]
2和
[{ircp*cl2}2]中的一种或几种混
合。
[0020]
更为优选的,所述氧化剂为醋酸铜、氟化铜、氧化银、氟化银、二氟化银和碳酸银中的一种或几种混合。
[0021]
更为优选的,所述含氟活化剂为tbaf(四丁基氟化铵)、氟化铜、氟化银、氟化钾和氟化钠中的一种或几种混合。
[0022]
更为优选的,所述质子酸为hoac(醋酸)、pivoh(特戊酸)、ada(金刚烷甲酸)和2,4,6-tmba(2,4,6-三甲基苯甲酸)中的一种或几种混合。
[0023]
更为优选的,所述添加剂为agsbf6和agbf4中的一种或两种混合。
[0024]
更为优选的,所述芳基亚胺酯、芳基硅试剂、催化剂、氧化剂、含氟活化剂、质子酸和添加剂的摩尔比为(1.5-3.0):1.0:(0.01-0.1):(1.5-3.0):(1.5-3.0):(0.0-2.0):(0.0-2.0)。
[0025]
从上面所述可以看出,本发明的有益效果:本发明提供了一种铑催化下以绿色环保的芳基硅试剂为芳基源对具有操作简单对芳基亚胺酯直接c-h邻位芳基化反应和脱醇反应来合成联苯-2-腈类化合物的方法,该方法具有原子经济性高,底物范围广,官能团耐受性好等优点,对活性药物分子和功能材料的研发具有重要价值。
附图说明
[0026]
为了更清楚地说明本说明书一个或多个实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本说明书一个或多个实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
[0027]
图1-图2为本发明中实施例一制备的产物的核磁氢谱和碳镨图;
[0028]
图3-图4为本发明中实施例二制备的产物的核磁氢谱和碳镨图;
[0029]
图5-图6为本发明中实施例三制备的产物的核磁氢谱和碳谱图;
[0030]
图7-图8为本发明中实施例四制备的产物的核磁氢谱和碳镨图;
[0031]
图9-图10为本发明中实施例五制备的产物的核磁氢谱和碳镨图;
[0032]
图11-图12为本发明中实施例六制备的产物的核磁氢谱和碳谱图;
[0033]
图13-图14为本发明中实施例七制备的产物的核磁氢谱和碳镨图;
[0034]
图15-图16为本发明中实施例八制备的产物的核磁氢谱和碳镨图;
[0035]
图17-图18为本发明中实施例九制备的产物的核磁氢谱和碳谱图;
[0036]
图19-图20为本发明中实施例十制备的产物的核磁氢谱和碳镨图;
[0037]
图21-图22为本发明中实施例十一制备的产物的核磁氢谱和碳镨图;
[0038]
图23-图24为本发明中实施例十二制备的产物的核磁氢谱和碳谱图;
[0039]
图25-图26为本发明中实施例十三制备的产物的核磁氢谱和碳镨图;
[0040]
图27-图28为本发明中实施例十四制备的产物的核磁氢谱和碳谱图;
[0041]
图29-图30为本发明中实施例十五制备的产物的核磁氢谱和碳镨图;
[0042]
图31-图32为本发明中实施例十六制备的产物的核磁氢谱和碳镨图。
具体实施方式
[0043]
为使本公开的目的、技术方案和优点更加清楚明白,以下结合具体实施例,对本公开进一步详细说明。
[0044]
需要说明的是,除非另外定义,本说明书一个或多个实施例使用的技术术语或者科学术语应当为本公开所属领域内具有一般技能的人士所理解的通常意义。本说明书一个或多个实施例中使用的“第一”、“第二”以及类似的词语并不表示任何顺序、数量或者重要性,而只是用来区分不同的组成部分。“包括”或者“包含”等类似的词语意指出现该词前面的元件或者物件涵盖出现在该词后面列举的元件或者物件及其等同,而不排除其他元件或者物件。“连接”或者“相连”等类似的词语并非限定于物理的或者机械的连接,而是可以包括电性的连接,不管是直接的还是间接的。“上”、“下”、“左”、“右”等仅用于表示相对位置关系,当被描述对象的绝对位置改变后,则该相对位置关系也可能相应地改变。
[0045]
实施例
[0046]
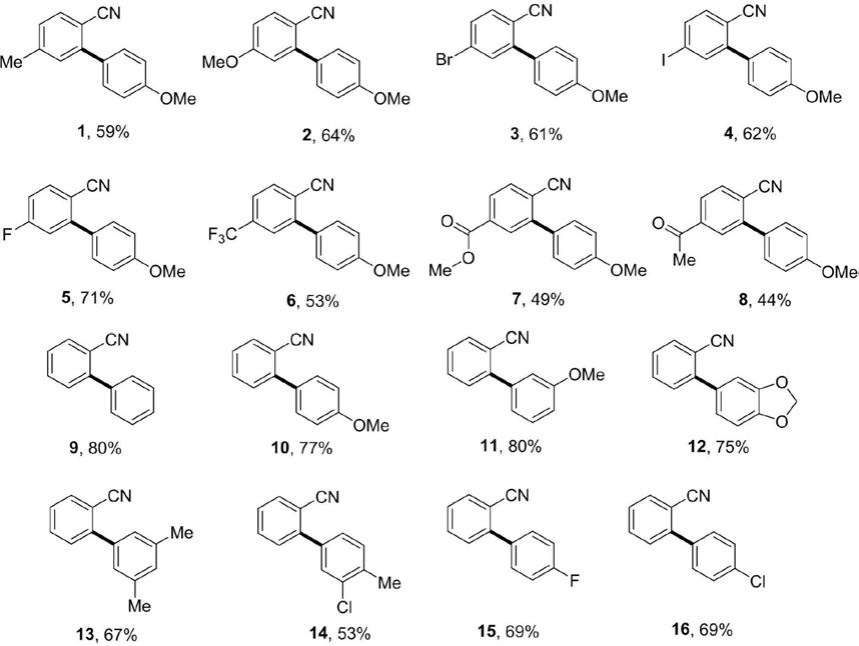
请参阅图1-图32,一种联苯-2-腈类化合物,其结构式为式i所示:
[0047][0048]
其中,r1,r2为氢、卤素、苯基、烷基、烷氧基、三氟甲基、酰基和酯基。
[0049]
作为上述方案的改进方案,所述联苯-2-腈类化合物为:
[0050]
。
[0051]
一种联苯-2-腈类化合物的制备方法,包括以下步骤:将芳基亚胺酯、芳基硅试剂、
金属催化剂、氧化剂、含氟活化剂、质子酸、添加剂和溶剂混合,在加热条件下进行c-h芳基化和脱醇反应,得到联苯-2-腈类化合物;
[0052]
其中,所述芳基亚胺酯为式ii所示结构:
[0053][0054]
其中,r1为氢、卤素、苯基、烷基、烷氧基、三氟甲基、酰基和酯基;r3为烷基;
[0055]
所述芳基硅试剂为式iii所示结构:
[0056][0057]
其中,r2为氢、卤素、苯基、烷基、烷氧基、三氟甲基、酰基和酯基;r4为烷基。
[0058]
作为上述方案的改进方案,所述催化反应在油浴的条件下进行,所述油浴的温度为60℃-140℃,所述催化反应的时间为2h-24h。
[0059]
作为上述方案的改进方案,所述溶剂为dmf(n,n-二甲基甲酰胺)、甲苯、氯苯、thf(四氢呋喃)、二氯甲烷、二氯乙烷、1,4-二氧六环、乙醇、异丙醇和水中的一种或几种混合。
[0060]
作为上述方案的改进方案,所述催化剂为rhcl3、[cp*rhcl2]
2和
[{ircp*cl2}2]中的一种或几种混合。
[0061]
作为上述方案的改进方案,所述氧化剂为醋酸铜、氟化铜、氧化银、氟化银、二氟化银和碳酸银中的一种或几种混合。
[0062]
作为上述方案的改进方案,所述含氟活化剂为tbaf(四丁基氟化铵)、氟化铜、氟化银、氟化钾和氟化钠中的一种或几种混合。
[0063]
作为上述方案的改进方案,所述质子酸为hoac(醋酸)、pivoh(特戊酸)、ada(金刚烷甲酸)和2,4,6-tmba(2,4,6-三甲基苯甲酸)中的一种或几种混合。
[0064]
作为上述方案的改进方案,所述添加剂为agsbf6和agbf4中的一种或两种混合。
[0065]
作为上述方案的改进方案,所述芳基亚胺酯、芳基硅试剂、催化剂、氧化剂、含氟活化剂、质子酸和添加剂的摩尔比为(1.5-3.0):1.0:(0.01-0.1):(1.5-3.0):(1.5-3.0):(0.0-2.0):(0.0-2.0)。
[0066]
工作流程:将芳基亚胺酯和芳基硅试剂为反应底物,与溶剂混合后在催化剂、氧化剂、含氟活化剂、质子酸和添加剂作用下生成联苯-2-腈类化合物。
[0067]
在本发明中,所述联苯-2-腈类化合物的制备过程如下所示:
[0068]
。
[0069]
本发明对所述联苯-2-腈类化合物制备过程的条件没有特殊的限定,在本发明的实施例中,具体是将芳基亚胺酯、芳基硅试剂溶于h2o溶剂中,于室温下加入促进剂、氧化剂、含氟活化剂、质子酸和添加剂进行反应,反应完后萃取,浓缩,分离,得到联苯-2-腈类产物。本发明通过tlc(薄层色谱)检测反应完毕,反应完后萃取,浓缩,分离,得到联苯-2-腈类化合物。
[0070]
实施例一
[0071]
4'-甲氧基-5-甲基-[1,1'-联苯]-2-甲腈的制备:
[0072][0073]
称取4-甲基苯甲亚胺酸乙酯(97.9mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物4'-甲氧基-5-甲基-[1,1'-联苯]-2-甲腈39.4mg,白色固体,产率为59%。
[0074]
对实施例一制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图1-2,具体数据为:
[0075]1h nmr(400mhz,cdcl3)δ7.6(d,j=7.9hz,1h),7.5
–
7.5(m,2h),7.3
–
7.3(m,1h),7.2(ddd,j=7.9,1.7,0.8hz,1h),7.1
–
7.0(m,2h),3.9(s,3h),2.4(s,3h).
13
c nmr(101mhz,cdcl3)δ159.9,145.0,143.6,133.6,130.6,130.6,129.9,127.8,119.3,114.0,107.9,55.3,21.8.
[0076]
实施例二
[0077]
4',5-二甲氧基-[1,1'-联苯]-2-甲腈的制备:
[0078][0079]
称取4-甲氧基苯甲亚胺酸乙酯(107.5mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物4',5-二甲氧基-[1,1'-联苯]-2-甲腈46.0mg,白色固体,产率为64%。
[0080]
对实施例二制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图3-4,具体数据为:
[0081]1h nmr(400mhz,cdcl3)δ7.5(dd,j=1.7,0.9hz,1h),7.5
–
7.5(m,2h),7.4
–
7.3(m,2h),7.0
–
7.0(m,2h),3.9(s,3h),2.4(s,3h).
13
c nmr(101mhz,cdcl3)δ159.7,142.2,137.0,133.8,133.7,130.3,129.8,129.6,119.1,114.0,110.5,55.2,20.6.
[0082]
实施例三
[0083]
5-溴-4'-甲氧基-[1,1'-联苯]-2-甲腈的制备:
[0084][0085]
称取4-溴苯甲亚胺酸乙酯(136.2mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物5-溴-4'-甲氧基-[1,1'-联苯]-2-甲腈52.7mg,白色固体,产率为61%。
[0086]
对实施例三制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图5-6,具体数据为:
[0087]1h nmr(400mhz,cdcl3)δ7.7(d,j=1.8hz,1h),7.6(d,j=8.3hz,1h),7.5
–
7.5(m,3h),7.1
–
7.0(m,2h),3.9(s,3h).
13
c nmr(101mhz,cdcl3)δ160.4,146.7,134.7,132.9,130.2,129.9,129.0,127.7,118.3,114.2,109.7,55.3.
[0088]
实施例四
[0089]
5-碘-4'-甲氧基-[1,1'-联苯]-2-甲腈的制备:
[0090][0091]
称取4-碘苯甲亚胺酸乙酯(165.0mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物5-碘-4'-甲氧基-[1,1'-联苯]-2-甲腈62.4mg,白色固体,产率为62%。
[0092]
对实施例四制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图7-8,具体数
据为:
[0093]1h nmr(400mhz,cdcl3)δ7.9(d,j=1.7hz,1h),7.7(dd,j=8.2,1.7hz,1h),7.5
–
7.4(m,2h),7.4(d,j=8.1hz,1h),7.1
–
7.0(m,2h),3.9(s,3h).
13
c nmr(101mhz,cdcl3)δ160.3,146.3,138.8,136.1,134.4,129.9,128.8,118.4,114.2,110.3,100.3,55.3.
[0094]
实施例五
[0095]
5-氟-4'-甲氧基-[1,1'-联苯]-2-甲腈的制备:
[0096][0097]
称取4-氟苯甲亚胺酸乙酯(100.2mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物5-氟-4'-甲氧基-[1,1'-联苯]-2-甲腈48.2mg,白色固体,产率为71%。
[0098]
对实施例五制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图9-10,具体数据为:
[0099]1h nmr(400mhz,cdcl3)δ7.7(dd,j=8.6,5.6hz,1h),7.6
–
7.5(m,2h),7.2(dd,j=9.4,2.5hz,1h),7.1(ddd,j=8.6,7.8,2.5hz,1h),7.1
–
7.0(m,2h),3.9(s,3h).
13
c nmr(101mhz,cdcl3)δ166.1,163.5,160.4,148.3,148.2,136.1,136.0,129.9,129.3,129.3,118.3,117.2,116.9,114.8,114.5,114.3,107.1,107.0,55.3.
[0100]
实施例六
[0101]
4'-甲氧基-5-(三氟甲基)-[1,1'-联苯]-2-甲腈的制备:
[0102][0103]
称取4-三氟甲基苯甲亚胺酸乙酯(130.2mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物4'-甲氧基-5-(三氟甲基)-[1,1'-联苯]-2-甲腈44.2mg,白色固体,产率为53%。
[0104]
对实施例六制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图11-12,具体
数据为:
[0105]1h nmr(400mhz,cdcl3)δ7.9(dt,j=8.0,0.8hz,1h),7.8(dt,j=1.6,0.7hz,1h),7.7(ddd,j=8.1,1.8,0.8hz,1h),7.6
–
7.5(m,2h),7.1
–
7.0(m,2h),3.9(s,3h).
13
c nmr(101mhz,cdcl3)δ160.6,146.0,134.6,134.3,134.3,130.0,129.0,126.7,126.7,126.6,126.6,124.4,123.7,123.7,123.6,123.6,121.7,117.7,114.4,114.3,55.4.
[0106]
实施例七
[0107]
6-氰基-4'-甲氧基-[1,1'-联苯]-3-羧酸甲酯的制备:
[0108][0109]
称取4-(乙氧基(亚氨基)甲基)苯甲酸甲酯(124.3mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物6-氰基-4'-甲氧基-[1,1'-联苯]-3-羧酸甲酯39.9mg,白色固体,产率为49%。
[0110]
对实施例七制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图13-14,具体数据为:
[0111]1hnmr(400mhz,cdcl3)δ8.1(d,j=1.7hz,1h),8.0(dd,j=8.0,1.6hz,1h),7.8(d,j=8.1hz,1h),7.6
–
7.4(m,2h),7.1
–
6.9(m,2h),4.0(s,3h),3.9(s,3h).
13
c nmr(101mhz,cdcl3)δ165.5,160.3,145.4,133.9,133.8,130.7,130.0,129.5,127.6,118.2,114.7,114.3,55.3,52.7.
[0112]
实施例八
[0113]
5-乙酰基-4'-甲氧基-[1,1'-联苯]-2-甲腈的制备:
[0114][0115]
称取4-乙酰基苯甲亚胺酸乙酯(114.7mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物5-乙酰基-4'-甲氧基-[1,1'-联苯]-2-甲腈26.5mg,白色固体,产率为35%。
[0116]
对实施例八制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图15-16,具体数据为:
[0117]1hnmr(400mhz,cdcl3)δ8.0(d,j=1.8hz,1h),7.9(dd,j=8.1,1.7hz,1h),7.8(d,j=8.1hz,1h),7.5
–
7.5(m,2h),7.1
–
7.0(m,2h),3.9(s,3h),2.7(s,3h).
13
c nmr(101mhz,cdcl3)δ196.7,160.4,145.7,139.9,134.1,130.0,129.6,129.3,126.3,118.1,114.8,114.3,55.4,26.8.
[0118]
实施例九
[0119]
[1,1'-联苯]-2-腈的制备:
[0120][0121]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、苯基三乙氧基硅烷(72.1mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物[1,1'-联苯]-2-腈43.0mg,无色油状液体,产率为80%。
[0122]
对实施例九制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图17-18,具体数据为:
[0123]1h nmr(400mhz,cdcl3)δ7.77(dd,j=7.8,1.4hz,1h),7.65(td,j=7.7,1.4hz,1h),7.60
–
7.55(m,2h),7.54
–
7.41(m,5h).
13
cnmr(101mhz,cdcl3)δ145.4,138.1,133.7,132.8,130.0,128.7,128.7,127.5,118.7.
[0124]
实施例十
[0125]
4'-甲氧基-[1,1'-联苯]-2-甲腈的制备:
[0126][0127]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、三乙氧基(4-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物4'-甲氧基-[1,1'-联苯]-2-甲腈34.4mg,白色固体,产率为77%。
[0128]
对实施例十制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图19-20,具体数据为:
[0129]1h nmr(400mhz,cdcl3)δ7.7(dd,j=7.8,1.4hz,1h),7.6(td,j=7.7,1.4hz,1h),
7.6
–
7.5(m,3h),7.4(td,j=7.6,1.3hz,1h),7.1
–
7.0(m,2h),3.9(s,3h).
13
c nmr(101mhz,cdcl3)δ160.0,145.1,133.7,132.7,130.5,129.9,129.8,127.0,118.9,114.1,111.0,55.3.
[0130]
实施例十一
[0131]
3'-甲氧基-[1,1'-联苯]-2-甲腈的制备:
[0132][0133]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、三乙氧基(3-甲氧基苯基)硅烷(81.0mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物3'-甲氧基-[1,1'-联苯]-2-甲腈50.1mg,黄色固体,产率为80%。
[0134]
对实施例十一制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图21-22,具体数据为:
[0135]1h nmr(400mhz,cdcl3)δ7.76(ddd,j=7.8,1.4,0.6hz,1h),7.64(td,j=7.7,1.4hz,1h),7.52(ddd,j=7.9,1.3,0.6hz,1h),7.47
–
7.35(m,2h),7.14(ddd,j=7.6,1.7,1.0hz,1h),7.10(dd,j=2.5,1.6hz,1h),6.99(ddd,j=8.3,2.6,1.0hz,1h),3.87(s,3h).
13
c nmr(101mhz,cdcl3)δ159.6,145.2,139.3,133.7,132.7,129.9,129.7,127.6,121.1,118.6,114.4,114.2,111.2,55.3.
[0136]
实施例十二
[0137]
2-(苯并[d][1,3]二氧戊环-5-基)苄腈的制备:
[0138][0139]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、苯并[d][1,3]二氧戊环-5-基三乙氧基硅烷(85.2mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物2-(苯并[d][1,3]二氧戊环-5-基)苄腈50.4mg,白色固体,产率为75%。
[0140]
对实施例十二制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图23-24,具体数据为:
[0141]1h nmr(400mhz,cdcl3)δ7.73(ddd,j=7.7,1.4,0.5hz,1h),7.61(td,j=7.7,
1.4hz,1h),7.50
–
7.34(m,2h),7.07
–
6.98(m,2h),6.91(dd,j=7.8,0.7hz,1h),6.02(s,2h).
13
c nmr(101mhz,cdcl3)δ148.1,147.9,145.1,133.7,132.7,132.0,129.9,127.2,122.7,118.7,111.1,109.1,108.5,101.4.
[0142]
实施例十三
[0143]
3',5'-二甲基-[1,1'-联苯]-2-甲腈的制备:
[0144][0145]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、(3,5-二甲基苯基)三乙氧基硅烷(80.4mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物3',5'-二甲基-[1,1'-联苯]-2-甲腈41.6mg,黄色油状液体,产率为67%。
[0146]
对实施例十三制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图25-26,具体数据为:
[0147]1h nmr(400mhz,cdcl3)δ7.75(dd,j=7.7,1.4hz,1h),7.62(td,j=7.7,1.4hz,1h),7.50(dd,j=7.9,1.3hz,1h),7.42(td,j=7.6,1.3hz,1h),7.18(dt,j=1.5,0.8hz,2h),7.10(dt,j=1.6,0.8hz,1h),2.41(s,6h).
13
c nmr(101mhz,cdcl3)δ145.7,138.2,138.0,133.6,132.6,130.2,129.9,127.2,126.5,118.7,111.1,21.2.
[0148]
实施例十四
[0149]
3'-氯-4'-甲基-[1,1'-联苯]-2-甲腈的制备:
[0150][0151]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、(3-氯-4-甲基苯基)三乙氧基硅烷(86.4mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物3'-氯-4'-甲基-[1,1'-联苯]-2-甲腈36.1mg,白色固体,产率为53%。
[0152]
对实施例十四制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图27-28,具
体数据为:
[0153]1h nmr(400mhz,cdcl3)δ7.8(dd,j=7.8,1.4hz,1h),7.6(td,j=7.7,1.4hz,1h),7.5
–
7.4(m,3h),7.4
–
7.3(m,2h),2.4(s,3h).
13
cnmr(101mhz,cdcl3)δ143.9,137.1,136.6,134.7,133.7,132.9,131.1,129.8,129.1,127.8,126.9,118.4,111.1,19.9.
[0154]
实施例十五
[0155]
4'-氟-[1,1'-联苯]-2-腈的制备:
[0156][0157]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、三乙氧基(4-氟苯基)硅烷(77.4mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物4'-氟-[1,1'-联苯]-2-腈40.7mg,白色固体,产率为69%。
[0158]
对实施例十五制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图29-30,具体数据为:
[0159]1h nmr(400mhz,cdcl3)δ7.76(ddd,j=7.8,1.4,0.6hz,1h),7.65(td,j=7.7,1.4hz,1h),7.58
–
7.39(m,4h),7.18(t,j=8.7hz,2h).
13
c nmr(101mhz,cdcl3)δ164.3,161.8,144.4,134.2,134.1,133.7,132.9,130.6,130.5,130.0,127.7,118.5,115.9,115.7,111.3.
[0160]
实施例十六
[0161]
4'-氯-[1,1'-联苯]-2-腈的制备:
[0162][0163]
称取苯甲亚胺酸乙酯(89.4mg,0.6mmol)、三乙氧基(4-氯苯基)硅烷(82.2mg,0.3mmol)、催化剂[cp*rhcl2]2(4.6mg,0.0075mmol),氧化剂ag2o(139.0mg,0.6mmol),含氟活化剂tbaf(156.9mg,0.6mmol),添加剂agsbf6(10.3mg,0.03mmol)、质子酸pivoh(15.3mg,0.15mmol)和再加入h2o(1ml),于100℃的油浴锅中反应5小时,反应完成后,用20.0ml
×
3的乙酸乙酯萃取,合并有机相,无水硫酸钠干燥,柱层析(淋洗液:石油醚/乙酸乙酯=50:1)分离,得到目标产物4'-氯-[1,1'-联苯]-2-腈44.1mg,白色固体,产率为69%。
[0164]
对实施例十六制备的产物进行核磁氢谱、核磁碳谱表征,具体谱图见图31-32,具体数据为:
[0165]1h nmr(400mhz,cdcl3)δ7.77(dd,j=7.7,1.4hz,1h),7.65(td,j=7.7,1.4hz,1h),7.55
–
7.41(m,6h).
13
c nmr(101mhz,cdcl3)δ144.1,136.5,135.0,133.7,132.9,130.0,129.9,128.9,127.9,118.4,111.1.
[0166]
本说明书一个或多个实施例旨在涵盖落入所附权利要求的宽泛范围之内的所有这样的替换、修改和变型。因此,凡在本说明书一个或多个实施例的精神和原则之内,所做的任何省略、修改、等同替换、改进等,均应包含在本公开的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1