乙酰木聚糖酯酶突变体及其应用
1.本发明涉及乙酰木聚糖酯酶突变体及其应用,具体涉及的是一个乙酰木聚糖酯酶的突变体在降解造纸胶黏物中的应用,属于酶学工程技术领域。
背景技术:
2.随着废纸利用率的逐年提高,废纸已经成为造纸产业的重要原材料之一。然而废纸中存在天然木质抽出物以及涂布粘合剂、热熔胶、压敏胶等人工合成聚合物,在回收利用过程中会不断絮聚为高黏性的胶黏物,滞留于纸张表面以及烘缸、成形网等设备表面,导致纸张质量差,发生断纸同时降低纸机设备的利用率。因此如何控制废纸回收过程中积累的胶黏物是当前亟待解决的问题之一。目前生物酶法以其环境友好、高效专一的独特优势引起人们的重视,其主要通过酶作用于胶黏物的化学键进而降低胶黏物的黏性,减缓胶黏物的沉积现象,已经成为一种重要的胶黏物控制手段。
3.按照按胶黏物产生原因分类可将胶黏物分为原生胶黏物和次生胶黏物两种。原生胶黏物是指随着废纸回收循环系统的运行,本身就留存于纸浆中的胶黏物,它们是随着废纸浆料而引入流水线,经过碎浆、抄造等回收过程后,逐渐从其中分散并释放出来的物质聚集而成。通常情况下,以固体存在形式为主,不溶于水,特点是尺寸较大,通过过滤装置可除去绝大部分。次生胶黏物属于物理化学作用后发生环境体系中的温度或者ph的高低突发变化而衍生出的胶黏物。在碎浆的过程中,众多杂质会溶解于浆水中,然而胶黏物稳定性极差,在外界的温度、ph值、表面电荷等条件变换后就会发生剧烈的失稳现象,使其极易絮聚形成黏性较大的胶黏物。因其不可控性,所以工业上对于次生胶黏物的控制比原生胶黏物难。当前,工业上常常采用沉淀、微浮选或者超滤法去除次生胶黏物。
4.目前,国内造纸工业中的胶黏物的处理还是以传统的化学法为主,虽然可以在造纸过程中起到良好的作用,但仍存在着化学品带来的二次污染等问题。随着全球污染的进一步加剧和环境保护意识的提高,生物酶法因为条件温和、绿色环保、底物专一性强等优势受到各个工业领域的关注,因此在近些年来也逐渐被应用在废纸回收过程中的胶黏物控制领域,从而不仅减少耗能,也能减小化学物对于环境的污染,同时达到胶黏物去除的目的。胶黏物中存在大量极性基团,分子链的柔顺性普遍偏低,致使聚合物分子内和分子间的吸引力增强,黏性增大。生物酶法的作用机理主要是通过酶对于胶黏物中化学键的水解,破坏胶黏物的主要结构组分,进而使粒子黏性降低,相互作用减弱,有效地削弱胶黏物的絮聚现象。
5.酯酶通过水解酯键降解胶黏物,是最主要的胶黏物控制用酶。胶黏物中可被这两类酶水解的是油脂和人工合成聚酯。胶黏物中的人工合成聚酯主要分为聚丙烯酸酯(pa)和聚醋酸乙烯酯(pvac)两类。两种聚酯主链均为碳碳链,而酯键位于侧链。胶黏物聚酯所带的负电荷值较低,主体呈疏水性,胶黏物聚酯的碳碳主链赋予了聚酯的弹性,侧链酯赋予聚酯的黏性,因此胶黏物聚酯易聚集形成有黏性的胶黏物颗粒。
6.乙酰木聚糖酯酶是一种可水解多聚糖侧链酯键的聚酯酶,对胶黏物聚合物侧链酯
的水解效果可能优于一般的酯酶,因此可以作为胶黏物控制用酶。
技术实现要素:
7.在前期的研究中,发明人已经筛选出一种乙酰木聚糖酯酶bpaxe,经过试验已经证实对pea和pvac具有一定降解效果,对于实际造纸工业中的胶黏物控制可能有所帮助,但是其仍然有很大的提升空间。首先,由于含有少量游离羧酸或羟基基团,胶黏物本身除具有疏水性特征外还带有弱电负性,其次pea和pvac为人工合成的聚酯,自然界中并未进化出相关的酶或微生物能高效降解pea和pvac。因此,本发明对已经筛选出的乙酰木聚糖酯酶bpaxe,从酶和底物结合角度进行分子改造,通过理性分析增强酶的催化凹槽的正电性,提升bpaxe对底物的结合效率,提升bpaxe降解pea和pvac的效率。
8.酯酶或脱乙酰酶能处理的胶黏物成分为酯或聚合物酯,在酶处理之前有少量未参与形成酯键的羧基、羟基,因此胶黏物本身除具有典型的疏水性特征外还具有电负性,随着酶解反应的进行以及游离羧基、羟基的产生,胶黏物的电负性增加。针对这种特征,发明人通过以乙酰木聚糖酯酶bpaxe的氨基酸序列为出发序列,分别构建bpaxe突变体k12a、k17a、d101n、n104k、l135k,并将这些bpaxe突变体应用于pea及pvac的降解。
9.本发明提供了乙酰木聚糖酯酶突变体,所述突变体以氨基酸序列突seq id no.1所示的乙酰木聚糖酯酶为亲本酶,将其第12位、17位、101位、104位和135位的一个或多个位点进行取代得到突变体。
10.在一种实施方式中,所述突变体为(a)~(e)所述任一:
11.(a)将第12位的赖氨酸取代为丙氨酸;
12.(b)将第17位的赖氨酸取代为丙氨酸;
13.(c)将第101位的天冬氨酸取代为天冬酰胺;
14.(d)将第104位的天冬酰胺取代为赖氨酸;
15.(e)将第135位的亮氨酸取代为赖氨酸。
16.在一种实施方式中,编码所述乙酰木聚糖酯酶的核苷酸序列如seq id no.2所示。
17.本发明提供了编码所述乙酰木聚糖酶突变体的基因。
18.本发明提供了携带所述编码所述乙酰木聚糖酶突变体的基因的重组质粒。
19.在一种实施方式中,所述重组质粒的表达载体包括但不限于pet系列、duet系列、pgex系列、phy300、phy300plk、ppic3k或ppic9k系列载体。
20.优选地,以pet24a(+)为表达载体。
21.本发明提供了表达所述乙酰木聚糖酶突变,或含有所述基因的微生物细胞。
22.在一种实施方式中,所述微生物细胞为原核细胞或真核细胞。
23.本发明提供了一种水解胶黏物的方法,所述方法是将所述突变体加入含有胶黏物的反应体系中水解胶黏物。
24.在一种实施方式中,所述突变体按照不少于800u/g底物的量添加至反应体系中。
25.在一种实施方式中,所述胶黏物包括pea和pvac。
26.在一种实施方式中,在ph7.0
±
0.5、45~55℃的环境中反应不少于4h。
27.本发明提供了所述乙酰木聚糖酯酶突变体,或编码所述乙酰木聚糖酶突变体的基因,或所述方法在降解造纸胶黏物中的应用。
28.在一种实施方式中,所述造纸胶黏物包括但不限于pea或pvac。
29.本发明的有益效果:
30.本发明对来源于短小芽孢杆菌的乙酰木聚糖酯酶基因bpaxe进行分子改造,构建得到了5种突变体,将这5种突变体应用于pvac的降解中,能够提升对pvac的降解效果、减少pvac浊液的粒径并保持较好的稳定性;将这5种突变体应用于pea的降解中,也能取得良好的降解效果,pea浊液的粒径显著减少并且能使pea浊液保持良好的稳定性。
附图说明
31.图1为bpaxe及其突变体的sds-page凝胶电泳分析图;
32.图2为bpaxe突变体降解pvac浊液的浊度变化图;
33.图3为bpaxe突变体降解pvac浊液的粒径变化图;
34.图4为bpaxe突变体降解pvac浊液的电位变化图;
35.图5为bpaxe突变体降解pea浊液的浊度变化图;
36.图6为bpaxe突变体降解pea浊液的粒径变化图;
37.图7为bpaxe突变体降解pea浊液的电位变化图。
具体实施方式
38.下面结合具体实施例,对本发明进行进一步的阐述。
39.1、下述实施例中涉及的大肠杆菌escherichia coli jm109、大肠杆菌escherichia coli bl21(de3)购自生工生物工程(上海)股份有限公司,pet-24a(+)质粒购自novagen公司,pvac和pea购自上海sigma公司,商品酶cwb-3560购于changzyme公司。
40.2、蛋白质质量采用天根bca蛋白质定量试剂盒(pa115)测定。
41.3、下述实施例中涉及的培养基如下:
42.lb培养基:胰蛋白胨10g/l,酵母粉5g/l,氯化钠10g/l;
43.tb培养基:胰蛋白胨12g/l,酵母粉24g/l,甘油5g/l,kh2po
4 2.31g/l,k2hpo4·
3h2o16.43g/l。
44.实施例1:突变体的构建
45.对乙酰木聚糖酯酶bpaxe基因(见seq id no.2)分别进行定点突变,所用引物如下表1所示。
46.表1:bpaxe定点突变引物序列
[0047][0048]
具体步骤为将核苷酸序列如seq id no.2所示的序列连接至pet24a(+)载体的多克隆酶切位点处,以连接在pet24a(+)载体上的bpaxe基因为模板,使用定点突变引物利用pcr反应对突变后序列进行扩增,反应条件为:98℃预变性3min,98℃变性30s,55℃退火20s和72℃延伸6.5min,共30个循环。将pcr产物用dpn i消化后,转入大肠杆菌jm109中,待长出单克隆后挑取相应转化子进行测序验证,获得验证正确的阳性转化子。
[0049]
实施例2:乙酰木聚糖酯酶突变体的发酵表达、酶活测定及蛋白纯化
[0050]
(1)乙酰木聚糖酯酶突变体的发酵表达
[0051]
将实施例1中验证正确的转化子使用质粒提取试剂盒提取突变后的质粒,将提取的质粒转入e.coli bl21(de3)中,构建得到重组菌株e.coli bl21(de3)/pet24a(+)-axe。将e.coli bl21(de3)/pet24a(+)-axe接种于液体lb培养基(含30μg/ml卡那霉素)生长8~10h,按5%(v/v)的接种量将种子接入tb液体发酵培养基(含30μg/ml卡那霉素);将摇瓶置于37℃,200r
·
min-1
的培养条件下恒温培养2h,加入终浓度为0.2mm的iptg于25℃进行诱导表达24h。将得到的菌液8000r
·
min-1
离心20min,弃上清,收集菌体,并使用缓冲液复溶菌体,使用高压匀浆机进行破壁,再次离心后收集破壁上清即为粗酶液。
[0052]
(2)sds-page蛋白电泳检测
[0053]
将上清的粗酶液进行sds-page蛋白电泳检测(图1),sds-page结果表明,重组bpaxe及其突变体在大肠杆菌中得到了表达,突变体蛋白大小约为36.07kda,与野生型条带基本相吻合。
[0054]
(3)粗酶液酶活测定
[0055]
乙酰木聚糖酯酶的酶活测定方法:在50℃下,采用连续分光光度法测定酶活力。反应总体积为1.5ml,包括30μl发酵粗酶液、30μl浓度为50mmol/l的对硝基苯酚乙酸酯(pnpa)和1.44ml tris-hcl缓冲液(ph 7.0),在波长405nm处,记录对硝基酚(pnp)的生成速率。
[0056]
酶活的定义为:在50℃,每分钟将对pnpa催化水解生成1μmol pnp所需要的酶量即为一个酶活力单位(u)。
[0057]
如下表2所示为在50℃条件下bpaxe突变体及其野生型的酶活,结果表明突变体与
野生型酶活相比,bpaxe的突变体n104k、k17a、l135k的酶活有所提高,其中k17a提高最明显,增加了52.0%;k12a和d101n有所下降,其中k12a减少最明显,减少了83.2%。
[0058]
表2:bpaxe突变体及其野生型在50℃下的酶活
[0059][0060]
(4)蛋白纯化
[0061]
采用镍柱亲和层析的方法纯化目的蛋白。把粗酶液加入镍柱进行上样,按照不同比例把结合缓冲液(a液)和洗脱缓冲液(b液)混合后泵入进行梯度洗脱,收集流出液后进行sds-page凝胶电泳。根据sds-page分析选取最佳浓度,取该浓度的流出液继续超滤后得到纯化后的蛋白质。
[0062]
涉及的缓冲液如下:
[0063]
结合缓冲液(a液):tris-hcl缓冲液25mmol/l,nacl 500mmol/l,使用hcl调至ph8.0;
[0064]
洗脱缓冲液(b液):tris-hcl缓冲液25mmol/l,nacl 500mmol/l,咪唑300mmol/l使用hcl调至ph 8.0。
[0065]
实施例3:乙酰木聚糖酯酶突变体对pvac的降解效果
[0066]
1%(w/v)pvac溶液的配制:取1g pvac,溶解于甲醇并定容至100ml。
[0067]
取0.5ml浓度为1%的pvac溶液于15ml玻璃瓶中,蛋白纯化后用tris-hcl缓冲液(50mm,ph 7.0)稀释酶蛋白浓度到0.1g/l后,取0.5ml加入到玻璃瓶中,加入9ml缓冲液使终体积为10ml,野生型及k12a、d101n、n104k、k17a、l135k突变体在体系中的酶活分别为8.73u、16.38u、13.09u、11.08u、19.41u、23.55u(即分别为873u/g底物、1638u/g底物、1309u/g底物、1108u/g底物、1941u/g底物、2355u/g底物),酶活测定方法同实施例2步骤3。置于50℃摇床中,200rpm,反应4h,利用分光光度计、纳米粒度及zeta电位分析仪测定反应体系的浊度变化、粒径变化、zeta电位变化。
[0068]
商品酶组:取0.5ml浓度为1%的pvac溶液于15ml玻璃瓶中,商品酶的酶活为2500u/ml(酶活测定方法同实施例2中步骤3,区别在于底物为pnpb),比活为833.33u/mg,稀释蛋白浓度到0.1g/l后,取0.5ml加入到玻璃瓶中,加入9ml缓冲液使终体积为10ml,体系中的酶活为41.67u。置于50℃摇床中,200rpm,反应4h,利用分光光度计、纳米粒度及zeta电位分析仪测定反应体系的浊度变化、粒径变化、zeta电位变化。
[0069]
缓冲液代替酶液作为空白对照,每个实验组做三个平行对照。
[0070]
(1)酶水解pvac浊液的浊度变化
[0071]
溶解pvac的溶剂常见的为甲醇。当其溶于酶反应的缓冲液时,甲醇会首先溶解于
水中,导致pvac不能继续溶解在甲醇中,会在酶反应体系中形成大量微粒并进一步絮聚为大颗粒,黏附在反应容器内壁,因此浊度较低。当酶作用于pvac侧链乙酰基释放出乙酸时,pvac的亲水性增加,从反应容器内壁脱落并由大颗粒分散成稳定的小颗粒,以悬浊液的形式存在。因此,可以采用测定浊度变化的方法,表征乙酰木聚糖酯酶对于pvac的降解效果。
[0072]
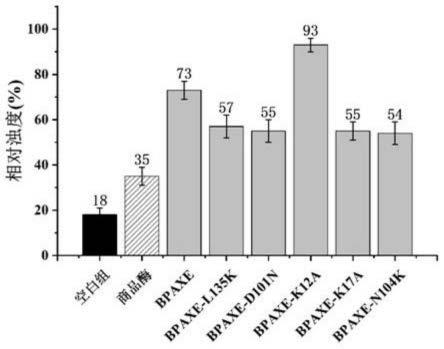
浊度上升说明pvac被降解后,黏结在一起的大颗粒被分散,进一步减缓pvac絮聚的趋势。如图2所示,以初始浊度为100%,在反应4h后空白组的浊度下降趋势明显。bpaxe野生型组和突变体组的浊度下降趋势基本一致,浊度都高于商品酶组,k12a组的浊度为75%,是野生型组的1.34倍,说明bpaxe的突变体k12a对底物pvac有最好的降解效果。
[0073]
(2)酶水解pvac浊液的粒径变化
[0074]
粒径检测是分析微细颗粒凝聚状态的重要手段之一,而粒径的变化常用来表征体系中模式底物的降解效果。将酶反应后的pvac浊液通过高速离心去除大颗粒物后,分析pvac浊液的粒径。
[0075]
如图3所示,空白组粒径较大,bpaxe及其突变体和商品酶处理后pvac浊液的粒径均有不同程度的减小。bpaxe野生型组的粒径较空白组减小了63.98%,商品酶组的粒径仅减小了23.55%,突变体k12a组减少了77.07%,说明bpaxe的突变体k12a对底物pvac有最好的降解效果。
[0076]
(3)酶水解pvac浊液的zeta电位变化
[0077]
zeta电位主要是通过测定微细颗粒的带电情况,表征反应后酶水解体系中颗粒的稳定性。zeta电位可以反映出反应过程中蛋白质与电解质的相互聚集和分散作用,而zeta电位的绝对值越高代表着所测体系在自然状态下越稳定,称之为胶体系统的电荷稳定。
[0078]
如图4所示,经过反应后bpaxe和其突变体组电位绝对值与空白组及商品酶组相比有一个明显的上升,bpaxe野生型组电位绝对值较空白组提高了8.1,突变体组较空白组提高了6.0~8.6,其中k12a组的电位绝对值最高,较空白组的15.8提升了54.43%,说明bpaxe的突变体k12a作用后形成的酶反应体系最稳定,不容易被破坏其电荷平衡、出现反复絮聚的情况。
[0079]
实施例4:乙酰木聚糖酯酶突变体对pea的降解效果
[0080]
1%(w/v)pea溶液:准确称取1g pea,溶解于甲醇并定容至100ml。
[0081]
乙酰木聚糖酯酶及其突变体组:取1ml浓度为1%的pea溶液于15ml玻璃瓶中,蛋白纯化后用tris-hcl缓冲液(50mm,ph 7.0)稀释酶蛋白浓度到0.1g/l后,取0.5ml加入到玻璃瓶中,加入8.5ml缓冲液使终体积为10ml,野生型及k12a、d101n、n104k、k17a、l135k突变体体系的酶活分别为8.73u、16.38u、13.09u、11.08u、19.41u、23.55u(即分别为873u/g底物、1638u/g底物、1309u/g底物、1108u/g底物、1941u/g底物、2355u/g底物),酶活测定方法同实施例2步骤3。置于50℃摇床中,200rpm,反应4h,利用分光光度计、纳米粒度及zeta电位分析仪测定反应体系的浊度变化、粒径变化、zeta电位变化。
[0082]
商品酶组:取1ml浓度为1%的pea溶液于15ml玻璃瓶中,商品酶的酶活为2500u/ml(酶活测定方法同实施例2中步骤3,区别在于底物为pnpb),比活为833.33u/mg,稀释蛋白浓度到0.1g/l后,取0.5ml加入到玻璃瓶中,加入8.5ml缓冲液使终体积为10ml,体系酶活为41.67u。置于50℃摇床中,200rpm,反应4h,利用分光光度计、纳米粒度及zeta电位分析仪测定反应体系的浊度变化、粒径变化、zeta电位变化。
[0083]
缓冲液代替酶液作为空白对照,每个实验组做三个平行对照。
[0084]
(1)酶水解pea浊液的浊度变化
[0085]
pea本身可溶于丙酮等有机溶剂中,在水相体系中形成悬浊液。在体系中加入酶液后,随着反应的不断进行,pea侧链的酯键会被降解,导致其亲水性增强,从而使pea的聚集趋势得到抑制,浊度有一定幅度的降低,因此可以通过测定浊度的减少量来表征乙酰木聚糖酯酶对pea的降解效果。
[0086]
如图5所示,以初始浊度为100%,经过酶处理后,商品酶组和bpaxe野生型及其突变体组的浊度都呈现下降趋势,bpaxe野生型的浊度相比空白组降低30.3%,突变体组的浊度相比空白组降低了22.5~47.2%,其中k12a组降低了47.2%,说明bpaxe的突变体k12a对底物pea有最好的降解效果。
[0087]
(2)酶水解pea浊液的粒径变化
[0088]
对pea粒径的检测同实施例3。如图6所示,经过酶处理后,商品酶组和bpaxe野生型及其突变体组的浊度都呈现下降趋势,商品酶组较空白组的粒径减少了178nm,bpaxe野生型组相比空白组减少了208nm,bpaxe突变体组相比空白组减少了150~335nm不等,其中突变体k12a组减少量最多为335nm,说明bpaxe的突变体k12a对底物pea有较好的降解效果。
[0089]
(3)酶水解pea浊液的zeta电位变化
[0090]
对pea的zeta电位的检测同实施例3。如图7所示,经过bpaxe突变体反应后,电位绝对值与空白组相比有明显的上升,全部突变体组高于商品酶组,且k12a、k17a、n104k组高于野生型组。野生型的电位绝对值相比空白组提高了21.6%,突变体的电位绝对值相比空白组提高了19.7~34.1%,说明bpaxe的突变体k12a、k17a、n104k作用后形成的酶反应体系最稳定。
[0091]
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1