于污染条件下分离肠道上皮细胞的方法
1.本技术涉及肠道上皮细胞分离技术领域,尤其涉及一种于污染条件下分离肠道上皮细胞的方法,适用于不同年龄阶段和生理状态的不同种属动物(新生和已采食动物均可)现场有菌条件下获取肠道上皮细胞。
背景技术:
2.肠道上皮细胞是肠道主要功能性细胞,在肠道营养物质消化吸收、构成肠道免疫屏障抵御细菌等病原体的入侵以及应急反应中均发挥着重要的作用。由于肠道经常经受食物和药物等等异物的刺激,其微环境中存在着强大的抗感染生物因素。由于受这种特殊的生长条件限制,肠道上皮细胞原代培养较难。
3.现有技术对于肠道上皮细胞的分离纯化方法主要有酶消化法和组织块,这些方法虽然能提成和分离得到上皮细胞,但是这些操作过程较为繁琐,耗时较长,获取细胞纯度和活细胞数量较低,并且对于一些有污染的肠道或者已经产生肿瘤的肠道,其提取和分离得到的上皮细胞纯度不够,无法满足对于其继续传代培养的要求。
技术实现要素:
4.有鉴于此,本技术的目的在于建立一种快速、简便、高效,且适用于污染条件下的肠道上皮细胞的分离纯化,在医学、动物学、营养学等领域的研究以及试剂盒的研发等具有重要的指导意义。
5.本发明的发明人深入研究比较了国内外不同种属动物肠道上皮细胞分离、纯化、以及原代培养等多种方法,通过大量的实验摸索,发明了适用于不同种属动物(不同年龄,不同生理阶段)肠道上皮细胞的分离纯化方法,适合现场有菌条件下提取,更能反映出肠道上皮细胞机能的实际情况,为动物肠道上皮细胞的结构、发育以及物种进化等研究奠定基础。此方法可应用于大鼠、猪、鸡、鸭、鹅、狗、骆驼、牛、马、羊、兔、猴、虎、猫、熊猫、人等肠道上皮的提取、分离及纯化。
6.为了达到上述目的,本发明具体通过以下技术方案实现:
7.本技术实施例公开了一种于污染条件下分离肠道上皮细胞的方法,所述污染条件包括肠道以活菌计数计包含细菌数不低于105cfu/m3、以及所述方法实施环境中采用gb/t16293-2010《医药工业洁净室(区)浮游菌的测试方法》检测浮游微生物不低于104cfu/l,所述方法包括以下步骤:
8.得到去除组织周围的结缔组织和脂肪的肠道组织块;
9.将所述肠道组织块用0.05~0.25%胰酶消化处理,并用完全培养液终止消化,以得到组织消化液;
10.将所述组织消化液依次通过100μm细胞滤器和70μm细胞过滤器,离心,得到第一细胞沉淀;
11.将所述第一细胞沉淀用样本稀释液重悬至浓度为2
×
108~1
×
109个/ml,进行密度
梯度离心,即可得到第二细胞沉淀。
12.在本技术实施例中,在对所述肠道组织块进行消化的处理条件为温度-4~40℃,消化0-3h;在对所述组织消化液过滤后的离心条件为400~500g离心10~15min。
13.在本技术实施例中,所述样本稀释液包含8.0g/l氯化钠、0.2g/l氯化钾、41.44g/l磷酸氢二钠和0.24g/l磷酸二氢钾,所述样本稀释液的ph 7.2~7.5;所述完全培养基为包含10%胎牛血清、1%双抗的dmem/f12培养基。
14.在本技术实施例中,所述方法还包括对第二细胞沉淀进行鉴定的步骤。
15.在本技术实施例中,对第二细胞沉淀进行鉴定的步骤具体包括:
16.将所述第二细胞沉淀用样本稀释液重悬后,400~500g离心10~15min,弃上清;
17.加入0.5~1.0ml 4℃预冷的固定剂,室温或37℃孵育5~30min;
18.400~500g离心10~15min,弃上清;
19.加入预冷pbs洗涤;
20.加入1.0~3.0ml破膜剂室温或37℃孵育5~15min,400~500g离心10~15min,弃上清;
21.加入0.1~1.0ml重悬液后,完成细胞计数;
22.加1~10μl浓缩型血清,37℃孵育5~30min,洗涤;
23.加入krt8抗体室温或37℃孵育30~120min,400~500g离心10~15min,弃上清,加1ml pbs重悬清洗2次;
24.加入荧光二抗,37℃避光孵育30~60min,400~500g离心10~15min,弃上清,加1ml pbs清洗2次,弃上清,加0.1ml pbs,混匀,最后上机检测。
25.在本技术实施例中,所述方法还包括对所述肠道组织块进行冻存与复苏的步骤。
26.在本技术实施例中,对所述肠道组织块进行冻存的步骤具体包括:
27.将所述肠道组织块装入冻存管中,加入冻存液,封口,置于4℃冰箱30min,随后放入-20℃冰箱1.5h,最后放入-80冰箱保存;
28.对所述肠道组织块进行复苏的步骤具体包括:将细胞冻存管从-80℃冰箱取出后迅速至于37℃水浴锅中,并摇动冻存管,使之迅速融化,取出组织块,用pbs缓冲液清洗干净,用于后续上皮细胞的分离、纯化及鉴定。
29.其中,所述pbs缓冲溶液包含8.0g/l氯化钠、0.2g/l氯化钾、41.44g/l磷酸氢二钠和0.24g/l磷酸二氢钾,所述pbs缓冲液的ph为7.2~7.5。
30.其中,所述细胞冻存液为无血清细胞冻存液或含有10%二甲基亚砜、90%胎牛血清的混合溶液。
31.与现有技术相比,本技术至少具有以下有益效果:
32.本技术实施例公开的方法可对污染条件的肠道上皮细胞进行有效的分离,得到的上皮细胞纯度高;并且本技术实施例提供的方法无需控制无菌提取条件和使用细胞传代纯化技术,操作方法快速、简便、高效,所用仪器设备为实验常规仪器设备,成本低廉。
附图说明
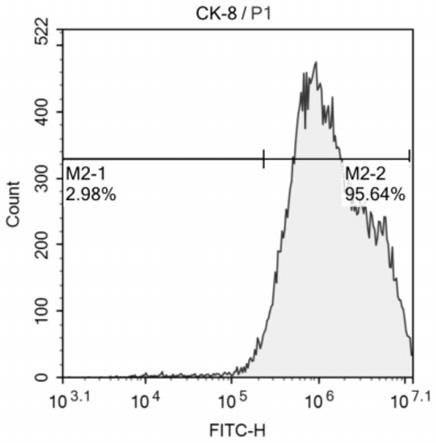
33.图1为本技术实施例提供的大鼠空肠上皮细胞鉴定图。
34.图2为本技术实施例提供的猪空肠上皮细胞鉴定图。
35.图3为本技术实施例提供的羊十二指空肠上皮细胞鉴定图。
36.图4为本技术实施例提供的兔回肠上皮细胞鉴定图。
具体实施方式
37.为了使本技术的目的、技术方案及优点更加清楚明白,以下结合实施例对本技术进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本技术,并不用于限定本技术。本技术中未详细单独说明的试剂均为常规试剂,均可从商业途径获得;未详细特别说明的方法均为常规实验方法,可从现有技术中获知。
38.实施例1大鼠肠道上皮细胞的提取与分离
39.1、材料
40.8周龄sd大鼠6只,购自南方医科大学实验动物中心。选取sd大鼠6只,短颈处死取出小肠肠段,采用活菌计数法检测其肠道肠段所含污染的微生物含量不低于105cfu/m3。
41.实施环境条件:采用gb/t16293-2010《医药工业洁净室(区)浮游菌的测试方法》检测浮游微生物不低于104cfu/l。
42.2、方法
43.(1)提取细胞
44.取sd大鼠肠道段,去除组织周围的结缔组织和脂肪,用预冷的pbs冲洗干净,纵向剖开肠段后,用预冷的pbs冲洗干净。将约0.6g肠道组织块剪碎并转入六孔板中,加入1.0ml 0.25%胰酶,将六孔板用封口膜封好并转移到水浴锅里,温度37℃,消化30min,用完全培养液终止消化。将消化后的细胞先后通过100μm细胞滤器和70μm细胞过滤器,过滤去除粘液和粘膜下层。500g离心10min,弃上清。
45.其中,所用pbs缓冲溶液中各组分及含量如下:配方按1l配制,氯化钠8.0g,氯化钾0.2g,磷酸氢二钠41.44g,磷酸二氢钾0.24g,ph7.2~7.5。
46.所用的完全培养基终止液配方为dmem/f12培养基(gibco)、10%胎牛血清,1%双抗(gibco)。
47.(2)细胞分离
48.用样本稀释液重悬组织细胞,将细胞悬液细胞浓度调整为2
×
108~1
×
109个/ml,大约1.8g分离的细胞,样本稀释液可以加到2ml。试剂和实验环境均需在20℃左右环境的条件下进行。采用细胞密度梯度离心的原理对上皮细胞进行纯化,具体操作详见试剂说明书,所得沉淀即为肠道上皮细胞。
49.其中,所用到的纯化试剂盒为大鼠组织上皮细胞分离液试剂盒(ep2012ratk,天津灏洋)。
50.(3)纯化细胞的鉴定
51.通过(1)和(2)获取的纯化上皮细胞,500g离心10min,弃上清。加入0.5ml 4℃预冷的固定剂,室温孵育10min。500g离心10min,弃上清。加入预冷pbs洗涤。加入1.5ml破膜剂室温孵育10min,500g离心10min,弃上清。加入0.1ml重悬液后,完成细胞计数。
52.加5μl浓缩型血清,37℃孵育10min。洗涤。加入krt8抗体37℃孵育45min。500g离心10min,弃上清。加1ml pbs重悬清洗2次。荧光二抗,37℃避光孵育40min。500g离心10min,弃上清。加1ml pbs清洗2次,弃上清。加0.1ml pbs,混匀。最后上机检测。
53.其中,所用到的固定剂(上海懋康,mx1502),破膜剂为(上海懋康,mx1503),浓缩型正常山羊血清(ar1009上海懋康生物技术),一抗为anti-krt8 antibody(onoclonal,3g9)(mo1421-3博士德生物工程有限公司)稀释比例为1~3μg/1
×
106个细胞,荧光二抗为goat anti-mouse igg(h+l)highly cross-adsorbed secondary antibo(a-11029invitrogen赛默飞)稀释比例10μg/ml。
54.3、结果
55.如图1所示,通过检测结果发现所得上皮细胞纯度可达到95.64%。
56.实施例2猪肠道上皮细胞的分离
57.1、材料
58.13月龄长白猪6头,购自某屠宰场,屠宰后取出小肠肠段,采用活菌计数法检测其肠道肠段所含污染的微生物含量不低于105cfu/m3。
59.实施环境条件:采用gb/t16293-2010《医药工业洁净室(区)浮游菌的测试方法》检测浮游微生物不低于104cfu/l。
60.2、方法
61.(1)细胞分离
62.取长白猪小肠肠段,去除组织周围的结缔组织和脂肪,用预冷的pbs冲洗干净,纵向剖开肠段后,用预冷的pbs冲洗干净。将约0.6g肠道组织块剪碎并转入六孔板中,加入1.0ml 0.25%胰酶,将六孔板用封口膜封好并转移到水浴锅里,温度37℃,消化30min,用完全培养液终止消化。将消化后的细胞先后通过100μm细胞滤器和70μm细胞过滤器,过滤去除粘液和粘膜下层。500g离心10min,弃上清。
63.其中,所用pbs缓冲溶液中各组分及含量如下:配方按1l配制,氯化钠8.0g,氯化钾0.2g,磷酸氢二钠41.44g,磷酸二氢钾0.24g,ph7.2~7.5。
64.所用的完全培养基终止液配方为dmem/f12培养基(gibco)、10%胎牛血清,1%双抗(gibco)。
65.(2)细胞纯化
66.用样本稀释液重悬组织细胞,将细胞悬液细胞浓度调整为2
×
108~1
×
109个/ml,大约1.8g分离的细胞,样本稀释液可以加到2ml。试剂和实验环境均需在20℃左右环境的条件下进行。采用细胞密度梯度离心的原理对上皮细胞进行纯化,具体操作详见试剂说明书,最终所得沉淀即为肠道上皮细胞。
67.其中,所用到的纯化试剂盒为猪组织上皮细胞分离液试剂盒(ephy2012pk,天津灏洋)。
68.(3)纯化细胞的鉴定
69.通过(1)和(2)获取的纯化上皮细胞,500g离心10min,弃上清。加入0.5ml 4℃预冷的固定剂,室温孵育10min。500g离心10min,弃上清。加入预冷pbs洗涤。加入1.5ml破膜剂室温孵育10min,500g离心10min,弃上清。加入0.1ml重悬液后,完成细胞计数。
70.加5μl浓缩型血清,37℃孵育10min。洗涤。加入krt8抗体37℃孵育45min。500g离心10min,弃上清。加1ml pbs重悬清洗2次。荧光二抗,37℃避光孵育40min。500g离心10min,弃上清。加1ml pbs清洗2次,弃上清。加0.1ml pbs,混匀。最后上机检测。
71.其中,所用到的固定剂(上海懋康,mx1502),破膜剂为(上海懋康,mx1503),浓缩型
正常山羊血清(ar1009上海懋康生物技术),一抗为cytokeratin8抗体[c-43](fitc)(gtx22530-06,genetex),荧光二抗为goat anti-mouse igg(h+l)highly cross-adsorbed secondary antibo(a-11029invitrogen赛默飞)稀释比例10μg/ml。
[0072]
如图2所示,通过检测结果发现所得上皮细胞纯度为96.16%。实施例3羊肠道上皮细胞的分离
[0073]
1、材料
[0074]
13月龄长白猪6头,购自某屠宰场,屠宰后取出小肠肠段,采用活菌计数法检测其肠道肠段所含污染的微生物含量不低于105cfu/m3。
[0075]
实施环境条件:采用gb/t16293-2010《医药工业洁净室(区)浮游菌的测试方法》检测浮游微生物不低于104cfu/l。
[0076]
2、方法
[0077]
(1)细胞分离
[0078]
取羊小肠肠段,去除组织周围的结缔组织和脂肪,用预冷的pbs冲洗干净,纵向剖开肠段后,用预冷的pbs冲洗干净。将约0.6g肠道组织块剪碎并转入六孔板中,加入1.0ml 0.25%胰酶,将六孔板用封口膜封好并转移到水浴锅里,温度37℃,消化30min,用完全培养液终止消化。将消化后的细胞先后通过100μm细胞滤器和70μm细胞过滤器,过滤去除粘液和粘膜下层。500g离心10min,弃上清。
[0079]
其中,所用pbs缓冲溶液中各组分及含量如下:配方按1l配制,氯化钠8.0g,氯化钾0.2g,磷酸氢二钠41.44g,磷酸二氢钾0.24g,ph7.2~7.5。所用的完全培养基终止液配方为dmem/f12培养基(gibco)、10%胎牛血清,1%双抗(gibco)。
[0080]
(2)细胞纯化
[0081]
用样本稀释液重悬组织细胞,将细胞悬液细胞浓度调整为2
×
108~1
×
109个/ml,大约1.8g分离的细胞,样本稀释液可以加到2ml。试剂和实验环境均需在20℃左右环境的条件下进行。采用细胞密度梯度离心的原理对上皮细胞进行纯化,具体操作详见试剂说明书,最终所得沉淀即为肠道上皮细胞。
[0082]
其中,所用到的纯化试剂盒为羊组织上皮细胞分离液试剂盒(ep2012gox,天津灏洋)。
[0083]
(3)纯化细胞的鉴定
[0084]
通过(1)和(2)获取的纯化上皮细胞,500g离心10min,弃上清。加入0.5ml 4℃预冷的固定剂,室温孵育10min。500g离心10min,弃上清。加入预冷pbs洗涤。加入1.5ml破膜剂室温孵育10min,500g离心10min,弃上清。加入0.1ml重悬液后,完成细胞计数。
[0085]
加5μl浓缩型血清,37℃孵育10min。洗涤。加入krt8抗体37℃孵育45min。500g离心10min,弃上清。加1ml pbs重悬清洗2次。荧光二抗,37℃避光孵育40min。500g离心10min,弃上清。加1ml pbs清洗2次,弃上清。加0.1ml pbs,混匀。最后上机检测。
[0086]
其中,所用到的固定剂(上海懋康,mx1502),破膜剂为(上海懋康,mx1503),浓缩型正常山羊血清(ar1009上海懋康生物技术),一抗为cytokeratin8抗体[c-43](fitc)(gtx22530-06,genetex),荧光二抗为goat anti-mouse igg(h+l)highly cross-adsorbed secondary antibo(a-11029invitrogen赛默飞)稀释比例10μg/ml。
[0087]
如图3所示,通过检测结果发现所得上皮细胞纯度为91.11%。实施例4兔肠道上皮
细胞的分离
[0088]
1、材料
[0089]
13月龄长白猪6头,购自某屠宰场,屠宰后取出小肠肠段,采用活菌计数法检测其肠道肠段所含污染的微生物含量不低于105cfu/m3。
[0090]
实施环境条件:采用gb/t16293-2010《医药工业洁净室(区)浮游菌的测试方法》检测浮游微生物不低于104cfu/l。
[0091]
2、方法
[0092]
(1)细胞分离
[0093]
取兔小肠肠段,去除组织周围的结缔组织和脂肪,用预冷的pbs冲洗干净,纵向剖开肠段后,用预冷的pbs冲洗干净。将约0.6g肠道组织块剪碎并转入六孔板中,加入1.0ml 0.25%胰酶,将六孔板用封口膜封好并转移到水浴锅里,温度37℃,消化30min,用完全培养液终止消化。将消化后的细胞先后通过100μm细胞滤器和70μm细胞过滤器,过滤去除粘液和粘膜下层。500g离心10min,弃上清。
[0094]
其中,所用pbs缓冲溶液中各组分及含量如下:配方按1l配制,氯化钠8.0g,氯化钾0.2g,磷酸氢二钠41.44g,磷酸二氢钾0.24g,ph7.2~7.5。所用的完全培养基终止液配方为dmem/f12培养基(gibco)、10%胎牛血清,1%双抗(gibco)。
[0095]
(2)细胞纯化
[0096]
用样本稀释液重悬组织细胞,将细胞悬液细胞浓度调整为2
×
108~1
×
109个/ml,大约1.8g分离的细胞,样本稀释液可以加到2ml。试剂和实验环境均需在20℃左右环境的条件下进行。采用细胞密度梯度离心的原理对上皮细胞进行纯化,具体操作详见试剂说明书,最终所得沉淀即为肠道上皮细胞。
[0097]
其中,所用到的纯化试剂盒为兔组织上皮细胞分离液试剂盒(eph2012pk,天津灏洋)。
[0098]
(3)纯化细胞的鉴定
[0099]
通过(1)和(2)获取的纯化上皮细胞,500g离心10min,弃上清。加入0.5ml 4℃预冷的固定剂,室温孵育10min。500g离心10min,弃上清。加入预冷pbs洗涤。加入1.5ml破膜剂室温孵育10min,500g离心10min,弃上清。加入0.1ml重悬液后,完成细胞计数。
[0100]
加5μl浓缩型血清,37℃孵育10min。洗涤。加入krt8抗体37℃孵育45min。500g离心10min,弃上清。加1ml pbs重悬清洗2次。荧光二抗,37℃避光孵育40min。500g离心10min,弃上清。加1ml pbs清洗2次,弃上清。加0.1ml pbs,混匀。最后上机检测。
[0101]
其中,所用到的固定剂(上海懋康,mx1502),破膜剂为(上海懋康,mx1503),浓缩型正常山羊血清(ar1009上海懋康生物技术),一抗为cytokeratin8抗体[c-43](fitc)(gtx22530-06,genetex),荧光二抗为goat anti-mouse igg(h+l)highly cross-adsorbed secondary antibo(a-11029invitrogen赛默飞)稀释比例10μg/ml。
[0102]
如图4所示,通过检测结果发现所得上皮细胞纯度为91.49%。
[0103]
以上所述,仅为本技术较佳的具体实施方式,但本技术的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本技术揭露的技术范围内,可轻易想到的变化或替换,都应涵盖在本技术的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1