Dicer1基因及其dsRNA在害虫防治中的应用
dicer1基因及其dsrna在害虫防治中的应用
技术领域
1.本发明涉及一种dicer1基因及其dsrna在害虫防治中的应用,属于昆虫基因工程技术领域。
背景技术:
2.白背飞虱sogatalla furcifera(horv
á
th)属半翅目hemiptera飞虱科delphacidae,是水稻上一种典型的r对策型害虫。主要以若虫和成虫刺吸水稻汁液为害;此外,还传播南方水稻黑条矮缩病毒(southern rice black-streaked dwarf virus,srbsdv)等病毒,给水稻生产带来了严重的经济损失。应用杀虫剂仍然是控制白背飞虱最有效的方法之一,然而,杀虫剂的长期使用已导致白背飞虱对多种杀虫剂产生抗性。抗药性的产生给白背飞虱的有效防治带来极大挑战,因此,研究并开发环境友好型的新型杀虫剂迫在眉睫。
3.rna干扰(rna interference,rnai)能够实现基因沉默,在转录水平调控基因的表达。该技术已经成为研究昆虫功能基因的重要手段,并加快了rnai介导的害虫防治候选基因的筛选。因此,rnai技术的发展拓宽了昆虫基因功能分析和害虫防治治理等领域的研究。
4.核糖核酸内切酶(dicer)作为rnai通路核心元件,在rnai形成过程中有重要作用。dicer切割rna前体产生小干扰rna(small interfering rna,sirna)和非编码小rna(microrna,mirna),通过与argonaut(ago)家族蛋白结合形成rna诱导沉默复合体(rna-induced silencingcomplex,risc)从而保证了在转录水平对靶基因的沉默,调控基因表达。大部分昆虫中含有两个dicer:dicer1、dicer2,其中dicer1参与切割pre-mirna形成mirna,而dicer2切割dsrna产生sirna。由于dicer1在昆虫mirna合成过程中起着关键的剪切作用,所以dicer1的缺失可能影响到昆虫正常的生长发育。哺乳动物中只有1个dicer基因,在sirna和mirna的形成中起双重作用,因此,以mirna合成过程中的关键酶作为害虫防治的靶标相对安全,但是目前针对白背飞虱dicer酶1的研究未见相关报道,也未见针对白背飞虱dicer酶1基因的dsrna的报道。
5.所以,提供一种能够影响mirna通路的dicer酶1(sfdicer1)基因及其dsrna在白背飞虱防治中的应用是本领域技术人员亟需解决的问题。
技术实现要素:
6.本发明的目的是:提供一种白背飞虱dicer酶1(sfdicer1)基因片段,其核苷酸序列如序列表seq id no 3所示。
7.本发明的另一目的是:提供一种采用上述白背飞虱dicer酶1(sfdicer1)基因片段合成dsrna的方法,基于所述核苷酸序列seq id no 3通过primer premier 6.0软件设计dsrna上游引物和下游引物,且上游引物和下游引物均携带t7启动子序列,其序列分别为seq id no 1和seq id no 2;以上游引物seq id no 1和下游引物seq id no 2进行pcr进行扩增,将扩增产物纯化后,再克隆转化至大肠杆菌中,然后进行测序,将测序结果进行比
对,并获得一段长度为413bp的dna片段,该片段的核苷酸序列如seq id no 4;将测序正确的菌液进行扩大培养,并提取质粒;以提取的质粒为模板,将带有t7启动子的上、下游引物引物进行pcr扩增,pcr产物胶回收与纯化后,以该胶回收的产物为模板,按照transcript aid t7 high yield transcription(thermo)试剂盒说明书在体外转录合成dsrna。
8.本发明的另一目的是:提供一种白背飞虱dicer酶1(sfdicer1)基因片段合成的dsrna在白背飞虱防治中的应用。
9.与现有技术相比,本发明的优点在于:本发明能够显著影响白背飞虱mirna的转录水平,同时虫体有明显的蜕皮困难、翅畸形等表型,干扰8d后存活率46%,其中存活白背飞虱的翅畸形率高达62%。本发明可用于以白背飞虱rna干扰介导的害虫防治,同时也可用于新型杀虫剂靶标基因的研发。
附图说明:
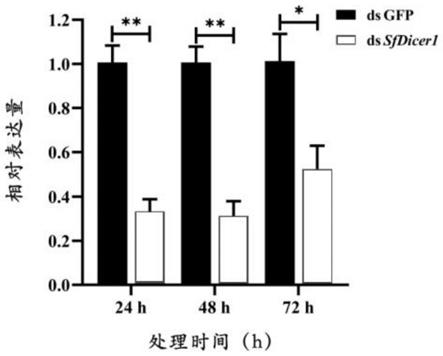
10.图1为白背飞虱4龄若虫体内注射sfdicer1基因的dsrna 24、48和72h后的sfdicer1基因相对表达量(以核糖体蛋白9(rpl9)为内参基因,sfdicer1为实验组,dsgfp为对照组);
11.图2a为白背飞虱4龄若虫注射sfdicer1基因的dsrna 24、48和72h后的mir-2a-3p_6四个mirna的相对表达量(均以u6为内参基因,sfdicer1为实验组,dsgfp为对照组);
12.图2b为白背飞虱4龄若虫注射sfdicer1基因的dsrna 24、48和72h后的let-7-1四个mirna的相对表达量(均以u6为内参基因,sfdicer1为实验组,dsgfp为对照组);
13.图2c为白背飞虱4龄若虫注射sfdicer1基因的dsrna 24、48和72h后的mir-14四个mirna的相对表达量(均以u6为内参基因,sfdicer1为实验组,dsgfp为对照组);
14.图2d为白背飞虱4龄若虫注射sfdicer1基因的dsrna 24、48和72h后的mir-34_5四个mirna的相对表达量(均以u6为内参基因,sfdicer1为实验组,dsgfp为对照组);
15.图3为白背飞虱4龄若虫注射sfdicer1基因的dsrna 1-8d后的绘制白背飞虱若虫存活率曲线图,其中dsgfp为对照组,sfdicer1为实验组。
16.图4a为4龄白背飞虱若虫注射sfdicer1基因的dsrna后的致死表型;
17.图4b为4龄白背飞虱若虫注射sfdicer1基因的dsrna后的翅畸形表型。
具体实施方式
18.为了使本发明目的、技术方案和优点更加清楚,下面结合实施例及附图对本发明作进一步的详细说明。
19.实施例1:白背飞虱dicer酶1(sfdicer1)基因片段获取及其dsrna合成
20.1.白背飞虱dicer酶1(sfdicer1)基因片段的获取
21.基于白背飞虱基因组和转录组数据库,通过geneious r9软件对白背飞虱dicer酶1基因进行搜索,通过ncbi数据库blast进行序列比对分析后,获得白背飞虱dicer酶1(sfdicer1)序列:seq id no 3。
22.2.白背飞虱dicer酶1(sfdicer1)基因的dsrna合成
23.(1)基于所获得的sfdicer1基因片段seq id no 3,利用primer premier 6.0软件设计带有t7启动子的上游引物seq id no 1和下游引物seq id no 2,所用引物均由北京擎
科生物科技有限公司合成。具体序列如下:
24.t7-dsdicer1-f:taatacgactcactataggggttgctggaagacggaat seq id no 1
25.t7-dsdicer1-r:taatacgactcactatagggaatagactcgcctcaatgaa seq id no 2
26.(2)选取白背飞虱5龄若虫10头、成虫5头,置于1.5ml无rna酶的离心管中,用hp total rna kit(美国omega公司)提取总rna,具体操作方法参照试剂说明书进行。然后按照primescript rt reagent kit and gdna eraser试剂盒(takara公司)从总rna中合成第一条链cdna,根据用户说明书进行。
27.(3)以上述合成的cdna为模板,利用上游引物seq id no 1和下游引物seq id no 2进行pcr扩增。pcr反应体系总体积为25l,包括:上下游引物(10μmol/l)各1μl,pcr mix 12.5μl,cdna模板3μl,ddh2o 7.5μl。pcr扩增条件:95℃预变性3min;5℃变性30s,65℃退火30s,72℃延伸30s,30个循环;最后72℃延伸5min。
28.(4)pcr产物在1.2%琼脂糖凝胶中跑电泳,于凝胶成像仪检测目的条带长度并初步判断是否为预期的目的条带。若出现预期目的条带,将pcr产物体系扩增至300μl,将目的条带切胶。通过e.z.n.a.gel extraction kit(美国omega公司)对pcr产物进行回收与纯化,具体操作步骤参见试剂盒说明书。将胶回收产物连接到pmd18-t载体上(体系为回收产物2l、solationⅰ2.5l和pmd18-t载体0.5l,16℃过夜孵育),再转化到大肠杆菌dh5感受态细胞中,在摇床中培养3~4h。然后吸取50μl菌液加入到含有氨苄青霉素(amp+)的lb固体培养基中,用玻璃棒涂抹均匀,然后倒置于37℃恒温箱过夜培养。取1μl菌液进行菌液pcr检验,吸取检验正确的菌液500ml送北京擎科生物科技有限公司测序。
29.(5)将测序结果通过seqman软件进行比对,获取核苷酸序列如seq id no 4所示,经测序验证无误后,把测序正确的预留菌液加入到5ml含有氨苄青霉素的lb液体培养基中,置于摇床37℃、180rpm震荡培养过夜。利用e.z.n.a.plasmid midi kit(美国omega公司)进行质粒提取,具体步骤参照说明书完成。
30.(6)以提取的质粒为模板,将携带t7启动子的上下游引物进行pcr扩增,反应体系及条件同上述(3)。pcr产物经1.2%琼脂糖凝胶电泳检验扩增片段的正确性,之后采用e.z.n.a.
tm gel&pcr clean up kit(美国omega公司)进行pcr产物回收与纯化,并nanodrop 2000spectrophotometer(thermo fisher)检测纯化产物的浓度,确保dsdna浓度≥300ng/l。
31.(7)以回收得到的高浓度dsdna为模板,采用transcriptaid t7 high yield transcription kit(thermo)试剂盒体外合成dsrna。合成之前,需将5x transcriptaid reaction buffer在室温下进行解冻,其它试剂均需在冰上进行解冻。待所有试剂解冻后,轻柔混匀后进行短暂离心。具体反应体系如下:atp 2μl,gtp 2μl,utp 2μl,ctp 2μl,5x transcriptaid reaction buffer 4μl dsdna模板1g,t7 enzyme mix 2μl,nuclease-free water补足至20μl。依次加入上述溶液在1.5ml的离心管内,轻柔混匀,短暂离心,随后将其置于pcr仪上37℃孵育8h。待反应结束后,在上述反应体系中加入2l dnase i,混匀后进行短暂离心,将其置于pcr仪上37℃孵育10min。接着在反应体系中加入2l edta,轻柔混匀,简易离心,随后将其置于pcr仪上65℃孵育10min,终止其反应。
32.(8)采用thermo公司的genejet rna purification kit试剂盒对dsrna进行纯化,并得到白背飞虱sfdicer1基因片段的dsrna。以绿色荧光蛋白基因gfp为对照。
33.(9)取上述纯化的dsrna产物进行1.2%琼脂糖凝胶电泳检测其单一性,并用nanodrop 2000核酸浓度分析仪检测其浓度。保存至-80℃冰箱备用。
34.实施例2:白背飞虱dicer酶1(sfdicer1)基因片段的dsrna注射干扰实验
35.1.白背飞虱dicer酶1(sfdicer1)基因片段的dsrna注射
36.选取4龄1d大小一致且健康的若虫用于注射上述合成的dsrna。首先准备2%的琼脂糖平板,将供试白背飞虱用co2麻醉后腹部向上固定在琼脂糖平板上,利用im-31微型注射器进行注射,注射时要轻微操作,前胸和中胸相接的位置作为注射点。dsrna注射剂量约为100ng/头,并以注射dsgfp作为阴性对照组,每组注射61头,设置4个生物学重复。注射后,将试虫放入装有新鲜稻苗的试管中,将试管放置于人工气候箱中,并设置条件为,温度25
±
1℃,相对湿度70%
±
10%,光周期l:d=16:8。
37.2.白背飞虱dicer酶1(sfdicer1)基因的沉默效率检测
38.基于上述注射试验,在注射dssfdicer1或dsgfp 24、48和72h后,每个处理收集存活的试虫各10头,设置4个生物重复。提取总rna,随后反转录为cdna,采用qpcr检测rnai后的目的基因转录水平。结果表明,在24、48和72h后,与注射dsgfp的对照组相比,注射dssfdicer1的实验组的相对表达量显著降低,分别下调66%、69%和48%,结果如图1所示。
39.qpcr引物如下:
40.y-dicer1-f:gtggcgacctgtgatggaatgc seq id no 5
41.y-dicer1-r:gaacgtgtggatgctgctggtt seq id no 6
42.3.敲除dicer酶1(sfdicer1)基因后对mirna的mrna水平的影响
43.基于上述注射后3个时间点的样品,通过qpcr检测mirna的表达水平。我们基于白背飞虱mirna数据库筛选出高峰tpm值的4个mirna,分别为let-7-1、mir-2a-3p_6、mir-14和mir-34_5。结果表明,与dsgfp的对照组相比,白背飞虱在注射dssfdicer124、48和72h时,4个mirna的表达水平均显著下调,这说明特异性沉默目的基因后能够明显抑制mirna的合成,结果如图2a、图2b、图2c以及图2d所示。
44.mirna实时荧光定量引物如下:
45.y-let-7-1:cgcgtgaggtagtaggttgtatagtaa seq id no 7
46.y-mir-2a-3p_6:gcgtatcacagccagctttgatgagc seq id no 8
47.y-mir-34_5:gctggcagtgtggttagctggttgaa seq id no 9
48.y-mir-14:cgcgctcagtctttttctctctccta seq id no 10
49.y-u6:cgatacagagaagattagcatgg seq id no 11
50.3.注射dsrna后白背飞虱死亡情况的观察
51.4龄1d若虫注射dsrna或dsgfp后,观察和记录实验组与对照组的白背飞虱存活率。结果表明,注射8d后,注射dsrna的实验组白背飞虱存活率为46%,这与注射dsgfp的对照组(存活率为90%)相比,致死效果明显,结果如图3所示。
52.4.注射dsrna后白背飞虱表型的观察
53.注射dsrna的实验组白背飞虱共246头,白背飞虱死亡率为54%,其中表皮未裂开、虫体变得细长蜕皮失败而死亡占36%,翅畸形致死率为11%,如图4a所示;8d后能够成功羽化且存活个体仅占46%,存活个体中翅畸形率高达62%,该基因干扰后对白背飞虱的正常生长发育有显著影响,表型如图4b所示。以上所述实施方式及应用领域仅为本发明的优选
实施例,而并非本发明可行实施的穷举。对于本领域一般技术人员而言,在不背离本发明原理和精神的前提下对其所做出的任何显而易见的改动及应用领域的托广,都应当被认为包含在本发明的权利要求保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1