新型冠状病毒核衣壳蛋白(N蛋白)的制备和定值方法与流程
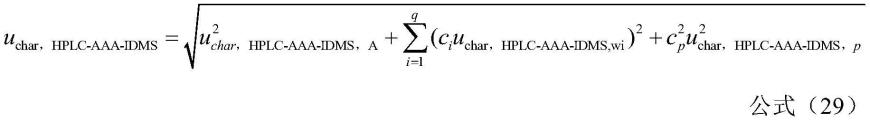
新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法
技术领域
1.本发明涉及计量化学分析检测技术领域,特别是涉及一种新型冠状病毒核衣壳蛋白(n 蛋白)标准物质制备及定值技术。
背景技术:
2.新冠患者的确诊依赖临床检验的结果,临床检验结果的准确与否直接关系到抗击疫情的成败。从临床检验上看,新冠患者的临床检验主要依靠分子生物学和免疫学的方法。新冠病毒的n蛋白是2019-ncov的重要结构蛋白,在病毒的包装、复制和蛋白质翻译等过程中起关键作用。n蛋白是一种核衣壳碱性磷酸化蛋白,在其n 末端存在有一高度保守的基因序列fyylgtgp。n蛋白首先是与基因组rna在胞浆中结合形成螺旋卷曲的核衣壳,并与m、e蛋白相互作用后包裹进入病毒衣壳内,s蛋白在病毒膜出芽成熟时插入,并与m蛋白相用后形成病毒体从囊泡中释放。n蛋白与病毒基因组rna 间存在两种互相识别作用,一是n蛋白只能和完整的病毒基因组rna结合,这与病毒基因组rna中包装信号序列有关;二是m蛋白与n蛋白与病毒rna的结合物发生相互作用,这种识别与某些辅助因子有关。在患者被感染后1-2天即可检出病毒n蛋白,因此能够有效实现“早发现、早隔离、早治疗”的目的,对于疫情的防控具有积极的意义。
3.计量是实现单位统一、量值准确可靠的活动,测量结果准确可比是依靠标准物质通过量值溯源传递实现的。作为量值源头的n蛋白纯物质量值准确与否直接决定了检测结果是否可靠,要保证n蛋白检测结果的准确可比,就必须研制新型冠状病毒核衣壳蛋白(n蛋白)的标准物质,将其作为量值传递载体,在n蛋白测定时作为校准标准或者用于方法的确认与验证。
技术实现要素:
4.本技术的发明目的是提供了一种新型冠状病毒核衣壳蛋白(n蛋白)标准物质制备及定值方法,旨在填补相关技术的空白,保证新型冠状病毒n蛋白检测结果的准确有效。
5.为了完成本技术的发明目的,本技术采用以下技术方案:
6.本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:包括步骤以下:
7.(一)、新型冠状病毒核衣壳蛋白(n蛋白)原料的纯化与稀释
8.(a)、新型冠状病毒核衣壳蛋白(n蛋白)原料的纯化
9.所述新型冠状病毒核衣壳蛋白(n蛋白)是具有seqidno:1的n蛋白序列,或在seqidno: 1的n蛋白序列一端或两端连接有(3~10)个组氨酸或赖氨酸的蛋白质序列,以下为seqidno: 1的n蛋白序列:
10.11.原料来自于市售新型冠状病毒核衣壳蛋白(n蛋白)生化试剂,该生化试剂的纯度在 90%~95%之间,为了得到高纯度的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物,采用等电聚焦法和/或分子筛法对上述生化试剂进行纯化,得到纯度为98.5%以上的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物;
12.(b)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物浓度的初步测定
13.取上述纯化好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物(1~100)μl,加入浓度在(0.001~1)mg/ml的
13
c或
15
n或d同位素标记的脯氨酸和/或缬氨酸和/或亮氨酸和/或异亮氨酸和/或苯丙氨酸后,进行离心浓缩或者氮气吹干,然后在其中加入浓度为 (6~8)mol/l的(100~1000)μl的浓盐酸,再通入氮气保护进行封口,在110℃~150℃的烘箱中水解24hr~72hr得到水解液,水解后以脯氨酸和/或缬氨酸和/或亮氨酸和/或异亮氨酸和/或苯丙氨酸国家标准物质为标准,采用高效液相色谱-同位素稀释质谱法,来测定上述水解液中氨基酸的含量,并且根据seqidno:1的n蛋白序列计算出新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物的初始浓度;
14.(c)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物的稀释
15.将初步测定浓度的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物用pbs作为溶剂,稀释到浓度(0.05~0.2)mg/g的范围内,得到稀释好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液;
16.(二)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液的均匀性初检与分装
17.(d)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液的均匀性初检
18.从步骤(c)的稀释好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液的上、中和下三个部分分别各采集取3个子样品,共得到9个抽取检测样品,对上述9个抽取检测样品依次进行编号和顺序排列,用同位素稀释质谱法、氨基酸分析法或免疫分析法对每个抽取检测样品中的新型冠状病毒核衣壳蛋白(n蛋白)含量进行第一次检验,然后打乱上述顺序,再重复对上述每个抽取检测样品中的新型冠状病毒核衣壳蛋白(n蛋白)含量进行第二次检验,重复上述操作,直到对每个抽取检测样品中进行了3次检验,从而得到27次检验结果,按照下面公式计算并统计出:抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白) 含量的均匀性;
19.当抽取了m=9个样品,按照上述检验方法在重复性n=3次条件下,得到9组精密度测量数据如下:
20.编号1:x
11
,x
12
……………
x
1n
,平均值
21.编号2:x
21
,x
22
……………
x
2n
,平均值
22.……………
23.编号m:x
m1
,,x
m2
……………
x
mn
,平均值
24.平均值
25.统计量n
26.n=m
·
n公式(2)
27.组间差平方和:
[0028][0029]
组内差平方和:
[0030][0031]
组间自由度:v1=m-1;组内自由度:v2=n-m
[0032][0033][0034]
统计量f:
[0035][0036]
其中s
12
为组间方差,s
22
为组内方差,根据自由度(v1,v2)及给定的显著性水平α=0.05,由表查得f
α
的临界值值,由公式(7)计算出的f值与f
α
进行比较,若f《f
α
,则认为组内与组间无明显差异,抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白)是均匀的;否则,抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白)含量是不均匀的,如果抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白)含量是不均匀,重复步骤(a)至(c),直到抽取检测样品中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液通过均匀性初检为止;
[0037]
(e)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液的分装
[0038]
对通过步骤(d)均匀性初检合格的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的候选物溶液进行分装,用容积为(500μl~2ml)的硅烷化冻存管对上述候选物溶液进行分装,每个硅烷化冻存管分装(10μl~500μl)的上述候选物溶液,分装好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液贴上标签并按照分装顺序对其进行连续编号,分装单元的总数为p,然后将上述分装单元储存于-80℃的冰箱中;
[0039]
(三)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液理化性质的表征
[0040]
(f)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质纯度测定
[0041]
采用通用蛋白质纯度分析方法,对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质纯度进行表征;
[0042]
(g)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质分子量的表征
[0043]
采用凝胶电泳法、和/或凝胶排阻高效液相色谱法、和/或质谱法,对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质分子量进行测定,测定结果平均值应当与seqidno: 1的n蛋白序列的理论分子量吻合;
[0044]
(h)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的蛋白质鉴定
[0045]
采用胰蛋白酶、和/或v8蛋白酶对新型冠状病毒核衣壳蛋白(n蛋白)进行酶切,酶切后的肽段采用肽质量指纹图谱法或串联质谱法对蛋白质酶切产生的肽段进行鉴定,然后通过sqeuest或mascot搜索swissprot数据库得到目标蛋白质,结果应当与seqidno: 1的n蛋白序列对应的蛋白质一致;
[0046]
(i)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的从头测序
[0047]
采用胰蛋白酶、和/或v8蛋白酶对新型冠状病毒核衣壳蛋白(n蛋白)进行酶切,酶切后的肽段采用高效液相色谱-串联质谱进行从头测序,根据每一条肽段产生的b,y离子系列来确定肽段的氨基酸序列;根据所有得到肽段的氨基酸序列进行手工或者随机配套软件或第三方软件进行序列拼接,得到新型冠状病毒核衣壳蛋白(n蛋白)的全长序列,结果应当与seqidno:1的n蛋白序列对应的蛋白质序列一致;
[0048]
或者采用胰蛋白酶、和/或v8蛋白酶对新型冠状病毒核衣壳蛋白(n蛋白)进行酶切,酶切后的肽段采用反相高效液相色谱法进行分离,逐一收集分离度好和出峰信号相应较高的所有肽段,分别将上述肽段冷冻干燥后,再用含有0.1%甲酸的水进行复溶,然后点于pvdf 膜上,用基于edman原理的蛋白质序列分析仪对收集得到的每条肽段进行从头测序,将所有肽段的序列进行拼接,得到新型冠状病毒核衣壳蛋白(n蛋白)的全长序列,结果应当与 seqidno:1的n蛋白序列对应的蛋白质序列一致;
[0049]
(j)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质中杂质蛋白的鉴定与定量
[0050]
在步骤(f)的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的纯度检验中,若单一杂质的含量超过1%时,把含有该杂质的馏分液收集出来,按照步骤(f)至步骤(h),对杂质蛋白进行鉴定,鉴定出来后,购置或重组表达的该杂质,来制成该杂质的标准品,然后绘制标准曲线,横轴为标准品的浓度,纵轴为相应信号;否则,不需要对杂质进行鉴定和定量;
[0051]
(四)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的均匀性和稳定性检验
[0052]
(k)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的均匀性检验
[0053]
用excel中的randbetween函数对连续编号的分装单元进行随机抽取检验,当p≤200时,抽取分装单元数量m不少于11个;当200《p≤500时,抽取分装单元数量m不少于15个;当500《p≤1000时,抽取分装单元数量m不少于25个;当分装单元p》1000时,抽取分装单元数量m不少于30个,按照抽取的先后次序,对m个抽取分装单元进行依次重新编号和顺序排列,用同位素稀释质谱法、或氨基酸分析法、或免疫分析法对上述抽取分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行均匀性检测,在检测时,首先按照上述顺序对每个抽取分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n 蛋白进行第一次检测,然后打乱上述顺序,再重复对上述每个抽取分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行第二次检测,重复上述操作,直到对每个抽取分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白进行第n次检测,n为大于等于3的整数,从而得到n次检测结果,按照下面公式计算并统计出:分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白均匀性;
[0054]
当抽取了m个样品,按照上述检验方法在重复性n次条件下,得到m组精密度测量数
据如下:
[0055]
编号1:x
11
,x
12
……………
x
1n
,平均值
[0056]
编号2:x
21
,x
22
……………
x
2n
,平均值
[0057]
……………
[0058]
编号m:x
m1
,,x
m2
……………
x
mn
,平均值
[0059]
平均值
[0060]
统计量n
[0061]
n=m
·nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(9)
[0062]
组间差平方和:
[0063][0064]
组内差平方和:
[0065][0066]
组间自由度:v1=m-1;组内自由度:v2=n-m
[0067][0068][0069]
统计量f:
[0070][0071]
其中s
12
为组间方差,s
22
为组内方差,根据自由度(v1,v2)及给定的显著性水平α=0.05,由表查得f
α
的临界值值,由公式(14)计算出的f值与f
α
进行比较,若f《f
α
,则认为组内与组间无明显差异,分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的 n蛋白是均匀的,否则,分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n 蛋白是不均匀的;
[0072]
(l)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的长期稳定性进行检验
[0073]
在不少于6个月的持续时间段内进行长期稳定性检验,按照前密后疏的原则,选择不少于5个时间点k,在每个时间点上,抽取步骤(e)的至少2个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质,用同位素稀释质谱法、和/或氨基酸分析法、和/或免疫分析法对每个分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行3 次重复检验,然后计算出在每个时间点的测量结果的算术平均值yi,将上述测量结果的算术平
均值yi与对应测量时间xi,按照下面的线性模型进行拟合:
[0074]
yi=b0+bxi公式(15)
[0075]
在公式(15)中:
[0076]
b0—截距,b—回归系数(斜率);xi—检验时间,单位为月;yi—在每个时间点的新型冠状病毒核衣壳蛋白(n蛋白)标准物质中n蛋白含量的测定结果的算术平均值;
[0077]
根据公式(16)和公式(17)计算出回归系数(斜率)和截距:
[0078][0079][0080]
在公式(16)和公式(17)中:
[0081]
xi—第i个时间点的检测时间,单位为月;
[0082]
yi—在第i个时间点上,上述分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白测定结果的算术平均值;
[0083]
—所有时间点的检测时间的平均值,单位为月;
[0084]
—所有时间点上,上述分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的 n蛋白测定结果的算术平均值;
[0085]
k—时间点的数量;
[0086]
根据公式(18)计算s值:
[0087][0088]
公式(18)中的各个符号的含义与公式(15)、公式(16)和公式(17)中的符号含义相同,
[0089]
根据公式(19)计算s(b)的值:
[0090][0091]
查t分布表,得到t
0.95,k-2
的值;
[0092]
若|b|<t
0.95,k-2
·
s(b),则表明斜率不显著,说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是长期稳定的;否则说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是不稳定的;
[0093]
(m)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量的短期稳定性进行检验
[0094]
在不少于7天的持续时间段内进行短期稳定性检验,按照前密后疏的原则,选择不少于5个时间点k,在每个时间点上,抽取步骤(e)的至少2个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质,将它们分别置于-20℃到40℃的温度范围下进行考察,用同位
素稀释质谱法、和/或氨基酸分析法、和/或免疫分析法对每个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行3次重复检验,然后计算出在每个时间点的测量结果的算术平均值yi,将上述测量结果的算术平均值yi与对应测量时间xi,按照下面的线性模型进行拟合:
[0095]
yi=b0+bxiꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(20)
[0096]
在公式(20)中:
[0097]
b0—截距,b—回归系数(斜率);xi—第i个时间点的检测时间,单位为天;yi—在第 i个时间点上,新型冠状病毒核衣壳蛋白(n蛋白)标准物质中n蛋白含量的测定结果的算术平均值;
[0098]
根据公式(21)和公式(22)计算出回归系数(斜率)和截距:
[0099][0100][0101]
在公式(21)和公式(22)中:
[0102]
xi—第i个时间点的检测时间,单位为天;
[0103]
yi—在第i个时间点上,上述分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量测定结果的算术平均值;
[0104]
—所有时间点的检测时间的平均值,单位为天;
[0105]
—所有时间点上,上述分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n 蛋白含量测定结果的算术平均值;
[0106]
k—时间点的数量;
[0107]
根据公式(23)计算s值:
[0108][0109]
公式(23)中的各个符号的含义与公式(20)、公式(21)和公式(22)中的符号含义相同,
[0110]
根据公式(23)计算s(b)的值:
[0111][0112]
查t分布表,得到t
0.95,k-2
的值,
[0113]
若|b|<t
0.95,k-2
·
s(b),则表明斜率不显著,说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是短期稳定的;否则说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是短期不稳定的; (五)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质中n蛋白含量标准值的测定
[0114]
(n)、用基于氨基酸分析的高效液相色谱-同位素稀释质谱仪测定新型冠状病毒核
衣壳蛋白(n蛋白)标准物质中n蛋白含量
[0115]
首先,任取步骤(e)中的至少5个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白) 标准物质作为样本,按照步骤(b)的方法,对上述分装单元中的每个分装单元重复测定3 次n蛋白含量,共得到至少15个测量结果,按照k-s单样本正态性检验,并采用格拉布斯法和/或dixon法进行异常值检验,通过上述统计检验后,取所有结果的算术平均值作为高效液相色谱-同位素稀释质谱法测定结果的标准值;未通过统计k-s单样本正态性检验、格拉布斯法和/或dixon法进行异常值检验的样本,增加样本数量,重复步骤(n),直到通过为止;
[0116]
(o)、用基于肽段分析的高效液相色谱-同位素稀释质谱法测定新型冠状病毒核衣壳蛋白(n蛋白)标准物质中的n蛋白含量,合成如下一条或多条标准肽段,以及对应标准肽段的同位素标记肽段,标准物质候选物中也含有以下肽段:
[0117]
msdngpqnqr、itfggpsdstgsnqnger、pqglpnntaswftaltqhgk、 gqgvpintnsspddqigyyr、wyfyylgtgpeaglpygank、dgiiwvategalntpk、npannaaivlqlpqgttlpk、gfyaegsr、ggsqassr、nstpgssr、 magnggdaalalllldr、lnqlesk、gqqqqgqtvtk、saaeask、aynvtqafgr、 gpeqtqgnfgdqelir、qgtdyk、hwpqiaqfapsasaffgmsr、 igmevtpsgtwltytgaik、dqvillnk、hidayk、tfpptepk、adetqalpqr、 qqtvtllpaadlddfsk、qlqqsmssadstqa
[0118]
按照步骤(f)的方法对上述合成标准肽段的纯度进行检测,选出纯度不低于99%的标准肽段,同时合成上述对应的标准肽段的同位素标记肽段,采用
13
c、
15
n或d作为标记,当用同位素标记的标准肽段分子量在1000以下时,标记原子数不少于3个;当用同位素标记的标准肽段分子量在1000以上时,标记原子数不少于6个;
[0119]
将上述选出的标准肽段用含有0.1%三氟乙酸的水进行溶解,配制成含有0.1mg/g标准肽段溶液,取上述各条标准肽段溶液各100μl,加入浓度含有(0.001~1)mg/ml
13
c或/和
15
n或/和d同位素标记的氨基酸,使得同位素标记的氨基酸含量与标准肽段溶液完全水解以后理论氨基酸含量相同,同位素标记原子个数不少于3个,离心浓缩或者氮气吹干后,在其中加入浓度(6~8)mol/l(100~1000)μl的浓盐酸,再通入氮气保护进行封口,在 110℃~150℃的烘箱中水解24hr~72hr,水解后,以上述氨基酸混合溶液的国家标准物质为标准,采用高效液相色谱-同位素稀释质谱法来测定水解液中上述氨基酸的含量,并且根据标准肽段序列计算出上述标准肽段的纯度;
[0120]
选取步骤(e)中的至少5个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质作为样本,每个样本中取出100μl,根据步骤(b)测定上述样本的n蛋白浓度,然后加入与上述n蛋白摩尔数相同的同位素标记肽段后,再加入5μg~100μg胰蛋白酶,该胰蛋白酶是溶于浓度0.1~0.2mol/l的200μl碳酸氢铵,其ph为8.0,内含10%~20%的乙腈,加入上述胰蛋白酶后在37℃温度下酶解24~72小时,得到酶解样品;配制与酶解样品中酶切肽段浓度相同的标准肽段与同位素标记肽段的混合物作为标准溶液,采用下面的方法检测上述酶解样品中的酶切肽段浓度;
[0121]
将上述酶解样品和标准溶液用高效液相色谱-串联质谱分别对进行分析,用含有0.1%甲酸的水溶液作为流动相a,含有0.1%甲酸的乙腈溶液作为流动相b;进样量为(3~20)μl,采用2.1mm
×
150mm的c18反相色谱柱进行分离,流速为0.2ml/min,在120min内,流动相梯度由100%流动相a线性变化到100%流动相b,实现上述酶切肽段的分离,用质谱三重
串联四级杆仪进行检测,分别采集各个标准肽段和对应的同位素标记肽段的质谱信号,每个酶解样品和标准溶液重复分析3次,根据标准溶液中标准肽段与同位素标记肽段的浓度及其分别加入的质量、以及酶解样品提取色谱图中标准肽段的峰面积与同位素标记肽段的峰面积、标准溶液提取色谱图中的标准肽段的峰面积与同位素标记肽段的峰面积,样品质量以及样品中加入的同位素标记肽段的浓度及其质量,计算出酶解样品中各个标准肽段的浓度,并根据标准肽段和n蛋白分子量,计算出样品中n蛋白的浓度,计算公式如下:
[0122][0123][0124][0125]
式中,r
std
为标准溶液中标准肽段质量与同位素标记肽段质量之比,c
pep
为标准肽段浓度,m
pep
为加入的标准肽段质量,c’pep
为同位素标记肽段浓度,m’pep
为加入的同位素标记肽段质量,cs为酶切样品中标准肽段的浓度,as为样品中标准肽段与同位素标记肽段的峰面积比,c’s
为样品中加入的同位素标记肽段的浓度,m’s
为样品中加入的同位素标记肽段的质量,a
std
为标准溶液中标准肽段与同位素标记肽段的峰面积比,ms为样品的质量,cn为样品中n蛋白的浓度,mws为标准肽段的分子量,mwn为n蛋白的分子量。
[0126]
得到的测量结果按照k-s单样本正态性检验,并采用格拉布斯法和/或dixon法进行异常值检验,通过上述统计检验后,取所有结果的算术平均值作为基于肽段分析的高效液相色谱-同位素稀释质谱法测定结果的标准值;未通过统计k-s单样本正态性检验、格拉布斯法和/或dixon法进行异常值检验的样本,增加上述样本数量,重复步骤(o),直到通过为止;
[0127]
(六)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质标准值的确定和统计检验
[0128]
对步骤(n)基于氨基酸分析高效液相色谱-同位素稀释质谱法测定得到的至少15个n 蛋白含量数据和步骤(o)基于肽段分析的高效液相色谱-同位素稀释质谱法测定得到的至少 15个n蛋白含量数据进行独立样本t检验,若由公式(24)算出的|t|值小于其中通过查gb/t 4086.3-1983《统计分布数值表t分布》得到,则认为t检验结果通过,说明两种方法定值结果之间没有系统性偏倚,取两种方法的算术平均值作为认定值x,当t 检验结果未通过时,重复步骤(五);
[0129][0130]
在公式(24)中:
[0131]
—第一个样本的平均数,即基于氨基酸分析高效液相色谱-同位素稀释质谱法测定结果的标准值;
[0132]
—第二个样本的平均数,即基于肽段分析的高效液相色谱-同位素稀释质谱法
测定结果的标准值;
[0133]s12
—第一个样本的方差,
[0134]s22
—第二个样本的方差,
[0135]
n1—第一个样本的容量,即基于氨基酸分析高效液相色谱-同位素稀释质谱法测定的数量;
[0136]
n2—第二个样本的容量,即基于肽段分析的高效液相色谱-同位素稀释质谱法测定的数量;
[0137]
(七)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质标准值定值结果的不确定度评定
[0138]
新型冠状病毒核衣壳蛋白(n蛋白)标准物定值结果的不确定度u来源于定值过程中引入的不确定度u
char
、标准物质均匀性引入的不确定度u
bb
、短期稳定性引入的不确定度u
sts
和长期稳定性引入的不确定度u
lts
,按照公式(25)进行合成
[0139][0140]
式中,k'为包含因子,通常取k'=2;
[0141]
其中u
char
包括了来自基于氨基酸分析高效液相色谱-同位素稀释质谱法的不确定度 u
char,hplc-aaa-idms
和来自基于肽段分析的高效液相色谱-同位素稀释质谱法的不确定度u
char, hplc-pep-idms;
[0142]uchar,hplc-aaa-idms
则包括了来自基于氨基酸分析高效液相色谱-同位素稀释质谱测量结果重复性引入的不确定度分量u
char,hplc-aaa-idms,a
(公式26)、以及由多次天平称量引入的不确定度分量u
char,hplc-aaa-idms,wi
(公式27)和氨基酸标准物质引入的不确定度分量u
char,hplc-aaa-idms,p
(公式28),各个不确定度分量按照公式(29)进行合成,
[0143][0144]
在公式(26)中,s为标准偏差,即s为标准偏差,即为某一数据与样本平均值之间的偏差,n为测量次数;
[0145][0146]
在公式(27)中,mpe为天平检定证书的最大允许误差
[0147][0148]
在公式(28)中,u为国家氨基酸标准物质证书中的不确定度,k'为包含因子,通常取 k'=2;
[0149][0150]
在公式(29)中,q为天平称量的次数,ci为第i次称量时的灵敏系数,c
p
为标准物质纯度的灵敏系数,它依据jjf1059.1-2012《测量不确定度评定与表示》进行计算;
[0151]uchar,hplc-pep-idms
则包括了来自基于肽段分析的高效液相色谱-同位素稀释质谱测量结果重复性引入的不确定度分量u
char,hplc-pep-idms,a
(公式30)、以及由多次天平称量引入的不确定度分量u
char,hplc-pep-idms,wi
(公式31)和肽段标准物质引入的不确定度分量u
char,hplc-pep-idms,p (公式32),各个不确定度分量按照公式(33)进行合成;
[0152][0153]
在公式(30)中,s为标准偏差,即s为标准偏差,即为某一数据与样本平均值之间的偏差,n为测量次数;
[0154][0155]
在公式(31)中,mpe为天平检定证书的最大允许误差
[0156][0157][0158]
在公式(33)中,q为天平称量的次数,ci为第i次称量时的灵敏系数,c
p
为标准物质纯度的灵敏系数;
[0159]
根据公式(34)计算u
char
:
[0160][0161]
当组间均方大于等于组内均方时,根据公式(35)计算均匀性引入的不确定度;
[0162][0163]
当组间均方小于组内均方时,根据公式(36)进行计算均匀性引入的不确定度;
[0164][0165]
标准物质短期稳定性引入的不确定度和长期稳定性引入的不确定度,根据公式(37)和公式(38)进行计算:
[0166]usts
=s
k,sts
·
t
sts
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(37)
[0167]ults
=s
k,lts
·
t
lts
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(38)
[0168]
式中,
[0169]
上述s
k,sts
为由公式(19)得到的短期稳定性检验时的s(b),t
ts
为短期稳定性检验的持续时间,t
ts
单位为天;
[0170]
上述s
k,lts
为由公式(23)得到的长期稳定性检验时的s(b),t
lts
为长期稳定性检验的持续时间,t
lts
单位为月;
[0171]
将以上结果按照公式(25)进行合成,得到标准物质认定值的扩展不确定度u,因此新型冠状病毒核衣壳蛋白(n蛋白)标准物质的定值结果可以表示为:
[0172]
x
±u[0173]
式中,x是认定值,u为认定值的扩展不确定度;
[0174]
最终得到:制备的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的均匀性、稳定性和n 蛋白含量的定值结果。
[0175]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤(a) 中,用等电聚焦电泳仪对上述生化试剂进行纯化,等电聚焦电泳仪两端电泳液分别采用 (0.01~1)mol/l的磷酸和(0.01~1)mol/l的氢氧化钠,当等电聚焦完成后,收集等电点在10.5附近的馏分,然后用分子筛柱对上述生化试剂进行纯化,在280nm吸光度下监测出峰时间,收集出峰时间段内的馏分液,将收集得到的馏分液再重复进行分子筛柱的纯化,重复3次分子筛柱纯化后,收集得到最后一次出峰时的馏分液,完成新型冠状病毒核衣壳蛋白(n蛋白)的纯化。
[0176]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤(a) 中,用分子筛柱对上述生化试剂进行纯化,在280nm吸光度下监测出峰时间,收集出峰时间段内的馏分液,将收集得到的馏分液再重复进行分子筛柱的纯化,重复3次分子筛柱后,收集得到最后一次出峰时的馏分液,完成新型冠状病毒核衣壳蛋白(n蛋白)的纯化。
[0177]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤(b) 中,所述同位素标记的原子个数不少于3个。
[0178]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤(f) 中,所述通用蛋白质纯度分析为包括:反相高效液相色谱法、和/或离子交换层析高效液相色谱法、和/或凝胶排阻高效液相色谱法、和/或疏水相互作用高效液相色谱法、和/或免疫亲和高效液相色谱法,然后配合紫外、和/或荧光、和/或示差折光、和/或蒸发光散射、和/或荧光电雾检测法、和/或圆二色光谱检测器,对标准物质纯度进行表征。
[0179]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤(f) 中,所述通用蛋白质纯度分析还包括:sds-page凝胶电泳法、和/或毛细管电泳法、和/或芯片电泳法、和/或双向电泳法,然后配合紫外、和/或荧光,对标准物质纯度进行表征。
[0180]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤(f) 中,所述通用蛋白质纯度分析还包括:高效液相色谱-质谱联用法、和/或基质辅助激光诱导解吸飞行时间质谱法,对标准物质纯度进行表征。
[0181]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤(f) 中,所述通用蛋白质纯度分析还包括:包括电化学法或核磁共振波谱法,对标准物质纯度进行表征。
[0182]
本发明的一种新型冠状病毒核衣壳蛋白(n蛋白)的制备和定值方法,其中:在步骤
(o)中,所述的质谱三重串联四级杆仪的检测中,采用正离子模式和选择性离子扫描(sim)或多反应监测(mrm)扫描模式。
具体实施方式
[0183]
为进一步说明本发明,结合以下实施例具体说明:
[0184]
本发明的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的制备和定值方法包括以下步骤:
[0185]
(一)、新型冠状病毒核衣壳蛋白(n蛋白)原料的纯化与稀释
[0186]
(a)、新型冠状病毒核衣壳蛋白(n蛋白)原料的纯化
[0187]
所述新型冠状病毒核衣壳蛋白(n蛋白)是具有seqidno:1的n蛋白序列,或在seqidno:1的n蛋白序列一端或两端连接有(3~10)个组氨酸或赖氨酸的蛋白质序列,以下为seqidno:1的n蛋白序列:
[0188][0189]
从生物技术服务公司购买新型冠状病毒核衣壳蛋白(n蛋白)原料,该原料经高效液相色谱-凝胶排阻液相色谱法对纯度进行检验,纯度约为95%,为了得到高纯度的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物,采用分子筛法或等电聚焦法对上述生化试剂进行纯化,得到纯度为98.5%以上的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物;为了得到具有活性的高纯度新型冠状病毒核衣壳蛋白(n蛋白),采用以下条件进行纯化:
[0190]
首先采用geaktaexplorer蛋白纯化工作站,将购置的n市售n蛋白原料过sephadexg75凝胶柱,采用pbs进行洗脱,uv280nm监测流出信号,收集主峰;以牛血清白蛋白作为定量标准,采用考马斯亮蓝法测定收集液中的浓度,共收集得到5ml收集液,n蛋白浓度大约2mg/ml,然后将收集液用水稀释至10ml,使得其中的n蛋白浓度约为1mg/ml。然后每次取1ml溶液,上样至自制的等电聚焦纯化装置中,电极两端分别采用0.1mol/l的磷酸和0.1mol/l的naoh作为电极液。在电压3000v下进行等电聚焦,温度10℃,同时通过实时ccd成像信号检测泳道内蛋白质的等电聚焦情况,当等电聚焦完成后,收集等电点在10.5
±
0.2的馏分。将收集得到的新型冠状病毒核衣壳蛋白(n蛋白)馏分用pbs作为流动相,采用sephadexg75分子筛柱进一步纯化,以280nm下吸光度监测出峰时间,收集出峰时间段内的馏分,重复3次分子筛柱的纯化过程,收集得到最后一次出峰时的馏分,得到新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物。以牛血清白蛋白作为标准,采用考马斯亮蓝法对收集得到的馏分中的n蛋白进行定量,得到纯度98.5%以上的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物,并将其浓度用水稀释至大约0.1mg/ml;
[0191]
(b)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物浓度的初步测定
[0192]
取上述纯化好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物50μl,加入浓度为0.01mg/ml的
13
c标记的缬氨酸和苯丙氨酸(同位素标记的原子个数分别为5个和8个)后,进行离心浓缩或者氮气吹干,然后在其中加入浓度为6mol/l的(500)μl的浓盐酸,再通入氮气保护进行封口,在110℃的烘箱中水解36hr得到水解液,水解后以缬氨酸和苯丙氨酸国家标准物质为标准,采用高效液相色谱-同位素稀释质谱法,来测定上述水解液中氨基酸
的含量,并且根据seqidno:1的n蛋白序列,计算出新型冠状病毒核衣壳蛋白(n 蛋白)标准物质候选物的初始浓度;结果为0.142mg/g;
[0193]
(c)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物的稀释
[0194]
将初步测定浓度的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物用pbs作为溶剂,稀释到浓度(0.1)mg/g的范围内,得到稀释好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液;
[0195]
(二)、新型冠状病毒核衣壳蛋白(n蛋白)的均匀性初检与分装
[0196]
(d)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液的均匀性初检
[0197]
从步骤(c)的稀释好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液的上、中和下三个部分分别各采集取3个子样品,共得到9个抽取检测样品,对上述9个抽取检测样品依次进行编号和顺序排列,用同位素稀释质谱法、氨基酸分析法或免疫分析法对每个抽取检测样品中的新型冠状病毒核衣壳蛋白(n蛋白)含量进行第一次检验,然后打乱上述顺序,再重复对上述每个抽取检测样品中的新型冠状病毒核衣壳蛋白(n蛋白)含量进行第二次检验,重复上述操作,直到对每个抽取检测样品中进行了3次检验,从而得到27次检验结果,按照下面公式计算并统计出:抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白) 含量的均匀性;
[0198]
当抽取了m=9个样品,按照上述检验方法在重复性n=3次条件下,得到9组精密度测量数据如下:
[0199]
编号1:x
11
,x
12
……………
x
1n
,平均值
[0200]
编号2:x
21
,x
22
……………
x
2n
,平均值
[0201]
……………
[0202]
编号m:x
m1
,,x
m2
……………
x
mn
,平均值
[0203]
平均值
[0204]
统计量n
[0205]
n=m
·
n公式(2)
[0206]
组间差平方和:
[0207][0208]
组内差平方和:
[0209][0210]
组间自由度:v1=m-1;组内自由度:v2=n-m
[0211]
[0212][0213]
统计量f:
[0214][0215]
其中s
12
为组间方差,s
22
为组内方差,根据自由度(v1,v2)及给定的显著性水平α=0.05,由表查得f
α
的临界值值,由公式(7)计算出的f值与f
α
进行比较,若f《f
α
,则认为组内与组间无明显差异,抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白)是均匀的;否则,抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白)含量是不均匀的,如果抽取检测样品中新型冠状病毒核衣壳蛋白(n蛋白)含量是不均匀,重复步骤(a)至(c),直到抽取检测样品中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液通过均匀性初检为止;对采集的9个样品按照上述的方法进行均匀性检验,检验结果如下:
[0216]
表1新型冠状病毒核衣壳蛋白(n蛋白)标准物质均匀性预检结果(mg/g)
[0217] 123平均样品10.1010.1030.1050.103样品20.1010.1040.1000.103样品30.1050.1020.1030.104q14.66667e-06q22.13333e-05 f0.66f
crit
5.14 [0218] 从均匀性检验结果看出,f计算值小于临界值,因此新型冠状病毒核衣壳蛋白标准物质的均匀性预检结果是均匀的,可以进行分装。
[0219]
(e)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液的分装
[0220]
对通过步骤(d)均匀性初检合格的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的候选物溶液进行分装,用容积为500μl的硅烷化冻存管对上述候选物溶液进行分装,每个硅烷化冻存管分装10μl的上述候选物溶液,分装好的新型冠状病毒核衣壳蛋白(n蛋白)标准物质候选物溶液贴上标签并按照分装顺序对其进行连续编号,分装单元的总数为p,然后将上述分装单元储存于-80℃的冰箱中;
[0221]
(三)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质理化性质的表征
[0222]
(f)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质纯度测定
[0223]
采用sds-page凝胶电泳法和高效液相色谱凝胶排阻色谱法对新型冠状病毒核衣壳蛋白(n蛋白)标准物质的纯度进行分析;
[0224]
sds-page凝胶电泳法的实验步骤如下:从分装的标准物质单元中取出20μl n蛋白与等体积的1x电泳上样缓冲液混合,在沸水浴中煮沸5min,每个泳道上样10μl n蛋白。采用伯乐公司mini-protean预制胶进行分离,电泳电压120v,电泳时间45min。电泳完成后用考马斯亮蓝进行染色,染色完毕后用甲醇-乙酸溶液进行脱色并成像。采用 bio-rad的凝胶成像系统进行并进行纯度分析,n蛋白泳道未见其它明显蛋白条带,纯度》99%。
[0225]
高效液相色谱-凝胶排阻色谱的实验步骤如下:
[0226]
样品:n蛋白标准物质原料溶液0.1mg/ml
[0227]
进样量:10μl
[0228]
色谱柱:tskgel 2000swxl凝胶排阻色谱柱,7.8mm
×
300mm
[0229]
流动相:水:乙腈:三氟乙酸(70:30:0.1,v:v:v)
[0230]
检测波长:215nm
[0231]
流速:0.5ml/min
[0232]
根据采集的色谱图,采用面积归一化方法对n蛋白纯度进行分析,纯度为99.2%,不存在含量大于0.1%的单一杂质。
[0233]
(g)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质分子量的表征
[0234]
采用sds-page凝胶电泳法和基质辅助激光诱导解吸飞行时间质谱法,对新型冠状病毒核衣壳蛋白(n蛋白)标准物质分子量进行测定。
[0235]
sds-page凝胶电泳法的实验条件如下:从分装的标准物质单元中取出20μl n蛋白与等体积的1x电泳上样缓冲液混合,在沸水浴中煮沸5min,每个泳道上样10μl n蛋白,并在其中一个用到上样蛋白质中分子量marker。采用伯乐公司mini-protean预制胶进行分离,电泳电压120v,电泳时间45min。电泳完成后用考马斯亮蓝进行染色,染色完毕后用甲醇-乙酸溶液进行脱色并成像。根据marker的分子量计算n蛋白的分子量。由电泳图得到n蛋白的分子量为45kd,与根据其理论序列计算得到的45625da的平均分子量符合。
[0236]
基质辅助激光诱导解吸飞行时间质谱分子量的实验条件如下:首先,将10μl浓度0.1 mg/ml的n蛋白原料与羟基肉桂酸(sinapinic acid,sa)基质溶液按1:1(v/v)充分混合,取2μl混合液点靶。样品结晶后,基质辅助激光解吸附-串联飞行时间质谱仪(线性模式) 用于表征n蛋白分子量。加速电压20kv;质荷比(m/z)扫描范围为15000-100000。实验所得原始数据均通过flex analysis软件进行分析(信噪比为3:1)。从质谱图上得到n蛋白分子量为45kd,与理论分子量45625da一致。
[0237]
(h)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的蛋白质鉴定
[0238]
新型冠状病毒核衣壳蛋白(n蛋白)标准物质的蛋白质鉴定实验条件如下:取大约2μg 蛋白在含有0.1%(w/v)rapigest sf的50μl 50mm碳酸氢铵中溶解,将浓度为0.1mol/l 的4μl二流苏糖醇(dtt)加入样品,样品在50℃加热30min,加入8μl 0.1mol/l碘代乙酰胺,在样品冷却至室温后样品在黑暗中静至40min。样品中加入16μg胰蛋白酶(胰蛋白酶浓度=20μg/100μl),样品在37℃孵育过夜。酶切后的样品用纯水稀释10倍进行 maldi-tof质谱分析,通过mascot进行搜索在swissprot数据库得到目标蛋白质,结果为新型冠状病毒核衣壳蛋白;
[0239]
(i)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的从头测序
[0240]
取大约200μg蛋白在含有0.1%(w/v)rapigest sf的500μl 50mm碳酸氢铵中溶解。样品中加入160μg胰蛋白酶(胰蛋白酶浓度=20μg/100μl),样品在37℃孵育过夜。酶切后的样品采用反相高效液相色谱法进行分离,逐一收集分离度高,出峰信号相应较高的所有肽段,分别冷冻干燥后用含有0.1%甲酸的水复溶,点于pvdf膜上,用基于edman 原理的蛋白质序列分析仪对收集得到的每条肽段进行从头测序,将所有肽段的序列进行拼接,得到新型冠状病毒核衣壳蛋白(n蛋白)的全长序列,对序列进行拼接,结果与seqidno: 1序列对应的蛋白质一致。
[0241]
(j)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质中杂质蛋白的鉴
定与定量
[0242]
当新型冠状病毒核衣壳蛋白(n蛋白)标准物质纯度检验中,有超过1%含量的单一杂质时,需要对杂质进行鉴定和定量;当纯度检验时没有超过1%含量的单一杂质时,不需要对杂质进行鉴定和定量。本实施例中,杂质蛋白的含量小于1%,因此不需要做杂质蛋白的鉴定与定量。
[0243]
(四)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的均匀性和稳定性检验
[0244]
(k)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的均匀性检验
[0245]
用excel中的randbetween函数对连续编号的分装单元进行随机抽取检验,当p≤200时,抽取分装单元数量m不少于11个;当200《p≤500时,抽取分装单元数量m不少于15个;当500《p≤1000时,抽取分装单元数量m不少于25个;当分装单元p》1000时,抽取分装单元数量m不少于30个,按照抽取的先后次序,对m个抽取分装单元进行依次重新编号和顺序排列,用同位素稀释质谱法、或氨基酸分析法、或免疫分析法对上述抽取分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行均匀性检测,在检测时,首先按照上述顺序对每个抽取分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n 蛋白进行第一次检测,然后打乱上述顺序,再重复对上述每个抽取分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行第二次检测,重复上述操作,直到对每个抽取分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白进行第n次检测,n为大于等于3的整数,从而得到n次检测结果,按照下面公式计算并统计出:分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白均匀性;
[0246]
当抽取了m个样品,按照上述检验方法在重复性n次条件下,得到m组精密度测量数据如下:
[0247]
编号1:x
11
,x
12
……………
x
1n
,平均值
[0248]
编号2:x
21
,x
22
……………
x
2n
,平均值
[0249]
……………
[0250]
编号m:x
m1
,,x
m2
……………
x
mn
,平均值
[0251]
平均值
[0252]
统计量n
[0253]
n=m
·nꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(9)
[0254]
组间差平方和:
[0255][0256]
组内差平方和:
[0257]
[0258]
组间自由度:v1=m-1;组内自由度:v2=n-m
[0259][0260][0261]
统计量f:
[0262][0263]
其中s
12
为组间方差,s
22
为组内方差,根据自由度(v1,v2)及给定的显著性水平α=0.05,由表查得f
α
的临界值值,由公式(14)计算出的f值与f
α
进行比较,若f《f
α
,则认为组内与组间无明显差异,分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的 n蛋白是均匀的,否则,分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n 蛋白是不均匀的;
[0264]
本次共制备300个单元的新型冠状病毒核衣壳蛋白(n蛋白)标准物质,采用步骤(b) 中的同位素稀释质谱法对随机抽取的15个n蛋白样品进行分析,每个样品重复分析3次,结果如下表所示:
[0265]
表2新型冠状病毒核衣壳蛋白(n蛋白)标准物质的均匀性检验
[0266][0267]
[0268]
从均匀性检验结果来看,新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量均匀性检验的f计算值小于临界值,说明标准物质是均匀的。
[0269]
(l)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的长期稳定性进行检验
[0270]
在不少于6个月的持续时间段内进行长期稳定性检验,按照前密后疏的原则,选择不少于5个时间点k,在每个时间点上,抽取步骤(e)的至少2个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质,用同位素稀释质谱法、和/或氨基酸分析法、和/或免疫分析法对每个分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行3 次重复检验,然后计算出在每个时间点的测量结果的算术平均值yi,将上述测量结果的算术平均值yi与对应测量时间xi,按照下面的线性模型进行拟合:
[0271]
yi=b0+bxiꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(15)
[0272]
在公式(15)中:
[0273]
b0—截距,b—回归系数(斜率);xi—检验时间,单位为月;yi—在每个时间点的新型冠状病毒核衣壳蛋白(n蛋白)标准物质中n蛋白含量的测定结果的算术平均值;
[0274]
根据公式(16)和公式(17)计算出回归系数(斜率)和截距:
[0275][0276][0277]
在公式(16)和公式(17)中:
[0278]
xi—第i个时间点的检测时间,单位为月;
[0279]
yi—在第i个时间点上,上述分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白测定结果的算术平均值;
[0280]
—所有时间点的检测时间的平均值,单位为月;
[0281]
—所有时间点上,上述分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的 n蛋白测定结果的算术平均值;
[0282]
k—时间点的数量;
[0283]
根据公式(18)计算s值:
[0284][0285]
公式(18)中的各个符号的含义与公式(15)、公式(16)和公式(17)中的符号含义相同,
[0286]
根据公式(19)计算s(b)的值:
[0287]
[0288]
查t分布表,得到t
0.95,k-2
的值;
[0289]
若|b|<t
0.95,k-2
·
s(b),则表明斜率不显著,说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是长期稳定的;否则说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是不稳定的;
[0290]
对新型冠状病毒核衣壳蛋白(n蛋白)标准物质进行了为期6个月的长期稳定性检验,稳定性检验的结果如表3所示。
[0291]
表3新型冠状病毒核衣壳蛋白(n蛋白)标准物质长期稳定性检验结果
[0292]
时间/月123平均00.1040.1080.0990.103710.0950.1030.1000.099320.1020.1080.1080.106040.0980.1010.1040.101060.1070.0970.0950.0997
[0293]
以时间作为x轴,含量作为y轴,则得到斜率k=-0.000505172,截距b=0.103253448。
[0294]
标准偏差
[0295]
则s=0.002973852,
[0296]
斜率的不确定度
[0297]
自由度为4和p=0.95的t分布因子为2.78,由于
[0298]
|k|<t
0.95.n-2
·
s(k)
[0299]
故斜率是不显著的,因而未观察到不稳定性。根据稳定性检验结果,在-80℃下新型冠状病毒核衣壳蛋白(n蛋白)标准物质的量值至少在6个月内保持稳定。
[0300]
(m)、对分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量的短期稳定性进行检验
[0301]
在不少于7天的持续时间段内进行短期稳定性检验,按照前密后疏的原则,选择不少于5个时间点k,在每个时间点上,抽取步骤(e)的至少2个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质,将它们分别置于-20℃到40℃的温度范围下进行考察,用同位素稀释质谱法、和/或氨基酸分析法、和/或免疫分析法对每个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量进行3次重复检验,然后计算出在每个时间点的测量结果的算术平均值yi,将上述测量结果的算术平均值yi与对应测量时间xi,按照下面的线性模型进行拟合:
[0302]
yi=b0+bxiꢀꢀꢀꢀꢀ
公式(20)
[0303]
在公式(20)中:
[0304]
b0—截距,b—回归系数(斜率);xi—第i个时间点的检测时间,单位为天;yi—在第 i个时间点上,新型冠状病毒核衣壳蛋白(n蛋白)标准物质中n蛋白含量的测定结果的算术
平均值;
[0305]
根据公式(21)和公式(22)计算出回归系数(斜率)和截距:
[0306][0307][0308]
在公式(21)和公式(22)中:
[0309]
xi—第i个时间点的检测时间,单位为天;
[0310]
yi—在第i个时间点上,上述分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n蛋白含量测定结果的算术平均值;
[0311]
—所有时间点的检测时间的平均值,单位为天;
[0312]
—所有时间点上,上述分装单元中新型冠状病毒核衣壳蛋白(n蛋白)标准物质的n 蛋白含量测定结果的算术平均值;
[0313]
k—时间点的数量;
[0314]
根据公式(23)计算s值:
[0315][0316]
公式(23)中的各个符号的含义与公式(20)、公式(21)和公式(22)中的符号含义相同,
[0317]
根据公式(23)计算s(b)的值:
[0318][0319]
查t分布表,得到t
0.95,k-2
的值,
[0320]
若|b|<t
0.95,k-2
·
s(b),则表明斜率不显著,说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是短期稳定的;否则说明新型冠状病毒核衣壳蛋白(n蛋白)标准物质是短期不稳定的;在4℃下新型冠状病毒核衣壳蛋白(n蛋白)标准物质的短期稳定性检验结果如下:
[0321]
表4 4℃下新型冠状病毒核衣壳蛋白(n蛋白)标准物质的短期稳定性检验结果mg/g
[0322]
时间/月123平均00.0960.0970.1090.100710.0960.1030.0990.099330.1000.1020.1070.103050.1080.1010.1010.103370.1010.1090.1070.1057
[0323]
以时间作为x轴,含量作为y轴,则得到斜率k=0.000801829,截距b=
0.099834146。
[0324]
标准偏差
[0325]
则s=0.001075777,
[0326]
斜率的不确定度
[0327]
自由度为4和p=0.95的t分布因子为2.78,由于
[0328]
|k|<t
0.95,n-2
·
s(k)
[0329]
故斜率是不显著的,因而未观察到不稳定性。根据稳定性检验结果,在4℃下新型冠状病毒核衣壳蛋白(n蛋白)标准物质的量值至少在7天内保持稳定。
[0330]
(五)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质中n蛋白含量标准值的测定
[0331]
(n)、用基于氨基酸分析的高效液相色谱-同位素稀释质谱仪测定新型冠状病毒核衣壳蛋白(n蛋白)标准物质中n蛋白含量
[0332]
首先,任取步骤(e)中的至少5个分装单元中的新型冠状病毒核衣壳蛋白(n蛋白) 标准物质作为样本,按照步骤(b)的方法,对上述分装单元中的每个分装单元重复测定3 次n蛋白含量,共得到至少15个测量结果,如下表所示:
[0333]
表5基于氨基酸分析的高效液相色谱-同位素稀释质谱n蛋白含量测定结果mg/g
[0334][0335]
按照k-s单样本正态性检验,并采用格拉布斯法和/或dixon法进行异常值检验,均通过上述统计检验,因此取所有结果的算术平均值0.1018mg/g作为高效液相色谱-同位素稀释质谱方法测定结果的标准值。
[0336]
(o)、用基于肽段分析的高效液相色谱-同位素稀释质谱法测定新型冠状病毒核衣壳蛋白(n蛋白)标准物质中的n蛋白含量
[0337]
合成标准肽段itfggpsdstgsnqnger以及对应的同位素标记肽段 itf*ggpsdstgsnqnger,其中f*为
13
c8标记的苯丙氨酸。合成的标准肽段通过反相高效液相色谱方法进行纯度检验,结果为99.2%。将上述合成的标准肽段用含有0.1%三氟乙酸的水溶解,配制成0.1mg/g的溶液,取标准肽段溶液100ml,加入浓度在0.01mg/ml的
13
c 同位素标记的苯丙氨酸和脯氨酸,离心浓缩或者氮气吹干,在其中加入浓度为6mol/l的 500μl的浓盐酸,通氮气保护并封口,在110℃的烘箱中水解60hr。水解后以氨基酸混合溶液的国家标准
物质为标准,采用同位素稀释质谱法对测定水解液中上述氨基酸的含量,并且根据标准肽段序列计算标准肽段的纯度,结果为0.843g/g。
[0338]
随机抽取5个新型冠状病毒核衣壳蛋白(n蛋白)标准物质,每个样本中取出100μl,按照0.1mg/g计算,加入与其摩尔数相同的同位素标记肽段。加入100μg胰蛋白酶(该胰蛋白酶溶于浓度为0.1mol/l的200μl碳酸氢铵,ph=8.0,内含10%的乙腈),于37℃酶解36小时,得到酶解样品,根据样品中酶切肽段的浓度,配制与其浓度接近的标准肽段与同位素标记肽段的混合物作为标准溶液。
[0339]
酶切完成后,酶解样品和标准溶液都采用高效液相色谱-串联质谱对酶解液进行分析,采用的流动相a为含有0.1%甲酸的水溶液,流动相b为含有0.1%甲酸的乙腈溶液。进样量为(3~20)μl,采用2.1mm
×
150mm的c18反相色谱柱进行分离,流速为0.2ml/min,在120min内,流动相梯度由100%流动相a线性变化到100%流动相b,实现酶切肽段的分离。质谱采用三重串联四级杆进行检测,采用正离子模式和多反应监测(mrm)扫描模式,分别采集itfggpsdstgsnqnger标准肽段和对应的同位素标记肽段的质谱信号,每个样品重复分析3次。根据标准溶液中标准肽段与同位素标记肽段的浓度及其分别加入的质量、以及酶解样品提取色谱图中标准肽段的峰面积与同位素标记肽段的峰面积、标准溶液提取色谱图中的标准肽段的峰面积与同位素标记肽段的峰面积,样品质量以及样品中加入的同位素标记肽段的浓度及其质量,计算出酶解样品中各个标准肽段的浓度,并根据标准肽段和n蛋白分子量,计算出样品中n蛋白的浓度,计算公式如下:
[0340][0341][0342][0343]
式中,r
std
为标准溶液中标准肽段质量与同位素标记肽段质量之比,c
pep
为标准肽段浓度,m
pep
为加入的标准肽段质量,c’pep
为同位素标记肽段浓度,m’pep
为加入的同位素标记肽段质量,cs为酶切样品中标准肽段的浓度,as为样品中标准肽段与同位素标记肽段的峰面积比,c’s
为样品中加入的同位素标记肽段的浓度,m’s
为样品中加入的同位素标记肽段的质量,a
std
为标准溶液中标准肽段与同位素标记肽段的峰面积比,ms为样品的质量,cn为样品中n蛋白的浓度,mws为标准肽段的分子量,mwn为n蛋白的分子量。
[0344]
结果如表6所示。
[0345]
表6基于肽段分析的高效液相色谱-同位素稀释质谱n蛋白含量测定结果mg/g
[0346][0347]
得到的测量结果按照k-s单样本正态性检验,并采用格拉布斯法和/或dixon法进行异常值检验,均通过上述统计检验,因此取所有结果的算术平均值0.1027mg/g作为基于肽段分析的高效液相色谱-同位素稀释质谱法测定结果的标准值。
[0348]
(六)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质标准值的确定和统计检验
[0349]
对步骤(n)基于氨基酸分析高效液相色谱-同位素稀释质谱法测定得到的至少15个n 蛋白含量数据和步骤(o)基于肽段分析的高效液相色谱-同位素稀释质谱法测定得到的至少 15个n蛋白含量数据进行独立样本t检验,若由公式(24)算出的|t|值小于其中通过查gb/t 4086.3-1983《统计分布数值表t分布》得到,则认为t检验结果通过,说明两种方法定值结果之间没有系统性偏倚,取两种方法的算术平均值作为认定值x,当t 检验结果未通过时,重复步骤(五);
[0350][0351]
在公式(24)中:
[0352]
—第一个样本的平均数,即基于氨基酸分析高效液相色谱-同位素稀释质谱法测定结果的标准值;
[0353]
—第二个样本的平均数,即基于肽段分析的高效液相色谱-同位素稀释质谱法测定结果的标准值;
[0354]s12
—第一个样本的方差,
[0355]s22
—第二个样本的方差,
[0356]
n1—第一个样本的容量,即基于氨基酸分析高效液相色谱-同位素稀释质谱法测定的数量;
[0357]
n2—第二个样本的容量,即基于肽段分析的高效液相色谱-同位素稀释质谱法测定的数量;
[0358]
对表5和表6中的数据进行平均值一致性检验,算出的|t|=0.0106值小于
因此,两种方法定值结果之间没有系统误差,取两种方法定值结果的平均值 0.102mg/g作为定值结果。
[0359]
(七)、新型冠状病毒核衣壳蛋白(n蛋白)标准物质标准值定值结果的不确定度评定
[0360]
新型冠状病毒核衣壳蛋白(n蛋白)标准物定值结果的不确定度u来源于定值过程中引入的不确定度u
char
、标准物质均匀性引入的不确定度u
bb
、短期稳定性引入的不确定度u
sts
和长期稳定性引入的不确定度u
lts
,按照公式(25)进行合成
[0361][0362]
式中,k'为包含因子,通常取k'=2;
[0363]
其中u
char
包括了来自基于氨基酸分析高效液相色谱-同位素稀释质谱法的不确定度 u
char,hplc-aaa-idms
和来自基于肽段分析的高效液相色谱-同位素稀释质谱法的不确定度u
char,hplc-pep-idms
;
[0364]uchar,hplc-aaa-idms
则包括了来自高效液相色谱-同位素稀释质谱测量结果重复性引入的不确定度分量u
char,hplc-aaa-idms,a
(公式26)、以及由多次天平称量引入的不确定度分量 u
char,hplc-aaa-idms,wi
(公式27)和氨基酸标准物质引入的不确定度分量u
char,hplc-aaa-idms,p
(公
[0365]
式28),各个不确定度分量按照公式(29)进行合成,
[0366][0367]
在公式(62)中,s为标准偏差,即s为标准偏差,即为某一数据与样本平均值之间的偏差,n为测量次数;
[0368][0369]
在公式(63)中,mpe为天平检定证书的最大允许误差
[0370][0371]
在公式(28)中,u为国家氨基酸标准物质证书中的不确定度,k'为包含因子,通常取 k'=2;
[0372][0373]
在公式(29)中,q为天平称量的次数,ci为第i次称量时的灵敏系数,c
p
为标准物质纯度的灵敏系数,它依据jjf1059.1-2012《测量不确定度评定与表示》进行计算;
[0374]
基于肽段分析的高效液相色谱-同位素稀释质谱法测定结果的u
char,hplc-pep-idms
根
据公式 (33)进行计算:
[0375][0376]
在公式(33)中,q为天平称量的次数,ci为第i次称量时的灵敏系数,c
p
为标准物质纯度的灵敏系数,u
char,hplc-pep-idms,a
、u
char,hplc-pep-idms,wi
和u
char,hplc-pep-idms,p
的计算公式与高效液相色谱-同位素稀释质谱中的相同;
[0377]
根据公式(34)计算u
char
:
[0378][0379]
在均匀性检验中当组间均方小于组内均方时,根据下面公式进行计算均匀性引入的不确定度;
[0380][0381]
标准物质短期稳定性引入的不确定度和长期稳定性引入的不确定度,根据下面公式进行计算:
[0382]usts
=s
k,sts
·
t
sts
=0.00370mg/g
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(37)
[0383]ults
=s
k,lts
·
t
lts
=0.00131mg/g
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
公式(38)
[0384]
上述s
k,sts
为由公式(19)得到的短期稳定性检验时的s(b),t
ts
为短期稳定性检验的持续时间,t
ts
单位为天;
[0385]
上述s
k,lts
为由公式(23)得到的长期稳定性检验时的s(b),t
lts
为长期稳定性检验的持续时间,t
lts
单位为月;
[0386]
将以上结果按照公式(25)进行合成,得到标准物质认定值的扩展不确定度u,因此新型冠状病毒核衣壳蛋白(n蛋白)标准物质的定值结果可以表示为:
[0387]
x
±u[0388]
式中,x是认定值,u为认定值的扩展不确定度;得到标准物质认定值的扩展不确定度 u=0.011mg/g,因此新型冠状病毒核衣壳蛋白(n蛋白)标准物质的定值结果可以表示为: (0.102
±
0.011)mg/g,最终得到:制备的新型冠状病毒核衣壳蛋白(n蛋白)标准物质的均匀性、稳定性和n蛋白含量的定值结果。
[0389]
以上描述是对本发明的解释,不是对发明的限定,本发明所限定的范围参见权利要求,在不违背本发明的精神的情况下,本发明可以作任何形式的修改。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1