一种YH66_09125基因突变的重组菌及其在制备精氨酸中的应用的制作方法
一种yh66_09125基因突变的重组菌及其在制备精氨酸中的应用
技术领域
1.本发明属于生物技术领域,具体涉及一种yh66_09125基因突变的重组菌及其在制备精氨酸中的应用。
背景技术:
2.精氨酸是人体必需的一种氨基酸,存在于多种动物类食物中。精氨酸在医药、营养保健、食品等领域应用广泛,需求量大,被称之为氨基酸中最重要的品种之一。l-精氨酸是生物体尿素循环的重要中间代谢产物,所有的机体组织都利用l-精氨酸合成细胞浆蛋白和核蛋白。在生理活性方面,除了与生长激素、胰岛素、胰高血糖素等激素诱导有关外,近年来,又作为血管舒张因子而引起关注,有望成为营养疗法的新材料。
3.目前已被报道的精氨酸生产菌株主要有钝齿棒状杆菌、谷氨酸棒状杆菌、大肠杆菌、酿酒酵母、黄色短杆菌等。虽然已被报道的部分精氨酸生产菌株已经具备了较为优良的发酵性能,但是,鉴于精氨酸重要的应用价值和巨大的市场需求,寻求发酵性能更为优良的精氨酸生产菌株仍然是所有研究开发工作的基础,更是各精氨酸生产厂家增加自身市场竞争力的重中之重。
技术实现要素:
4.第一方面,本发明保护一种yh66_09125突变体。
5.本发明保护的yh66_09125突变体是将yh66_09125蛋白质第176位氨基酸残基由甘氨酸突变为其他氨基酸残基得到的蛋白质;
6.所述yh66_09125蛋白质为如下a1)-a3)中的任一种:
7.a1)seq id no.2所示的氨基酸序列组成的蛋白质;
8.a2)将a1)所示的氨基酸序列经过除第176位氨基酸残基以外的一个或几个氨基酸残基的取代和/或缺失和/或添加得到的与细菌产精氨酸相关的蛋白质;
9.a3)来源于细菌且与a1)或a2)具有95%以上同一性且与细菌产精氨酸相关的蛋白质。
10.上述a2)所述的蛋白质中,所述一个或几个氨基酸残基的取代和/或缺失和/或添加为不超过10个氨基酸残基的取代和/或缺失和/或添加。
11.上述a3)所述的蛋白质中,这里使用的术语“同一性”指与天然氨基酸序列的序列相似性。“同一性”包括与本发明的seq id no.2所示的氨基酸序列具有95%或更高,或96%或更高,或 97%或更高,或98%或更高,或99%或更高同一性的氨基酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
12.上述a1)或a2)或a3)所述的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。
13.进一步的,所述yh66_09125突变体是将yh66_09125蛋白质第176位氨基酸残基由甘氨酸突变为谷氨酸得到的蛋白质(对应本发明实施例中的yh66_09125
g527a
蛋白质)。
14.更进一步的,所述yh66_09125突变体(yh66_09125
g527a
蛋白质)是seq id no.4所示的氨基酸序列组成的蛋白质。
15.第二方面,本发明保护与yh66_09125突变体相关的生物材料。
16.本发明保护的与yh66_09125突变体相关的生物材料为如下b1)至b3)中的任一种:
17.b1)编码上述yh66_09125突变体的核酸分子;
18.b2)含有b1)所述核酸分子的表达盒;
19.b3)含有b1)所述核酸分子的重组载体、或含有b2)所述表达盒的重组载体;
20.b4)含有b1)所述核酸分子的重组微生物、或含有b2)所述表达盒的重组微生物、或含有b3)所述重组载体的重组微生物。
21.第三方面,本发明保护上述yh66_09125蛋白质或与上述yh66_09125蛋白质相关的生物材料或上述yh66_09125突变体或与上述yh66_09125突变体相关的生物材料的新用途。
22.本发明保护上述yh66_09125蛋白质或与上述yh66_09125蛋白质相关的生物材料或上述yh66_09125突变体或与上述yh66_09125突变体相关的生物材料在如下x1)至x3)中任一种中的应用:
23.x1)调控细菌精氨酸产量;
24.x2)构建产精氨酸工程菌;
25.x3)制备精氨酸;
26.与yh66_09125蛋白质相关的生物材料为如下d1)至d4)中的任一种:
27.d1)编码所述yh66_09125蛋白质的核酸分子;
28.d2)含有d1)所述核酸分子的表达盒;
29.d3)含有d1)所述核酸分子的重组载体、或含有d2)所述表达盒的重组载体;
30.d4)含有d1)所述核酸分子的重组微生物、或含有d2)所述表达盒的重组微生物、或含有d3)所述重组载体的重组微生物。
31.上述生物材料或应用中,b1)所述编码yh66_09125突变体的核酸分子为如下c1)或 c2)中的任一种:
32.c1)核苷酸序列为seq id no.3的dna分子;
33.c2)将seq id no.3所示的核苷酸序列经过修饰和/或一个或几个核苷酸的取代和/或缺失和/或添加得到的与c1)所示的dna分子具有90%以上的同一性,且具有相同功能的dna 分子。
34.d1)所述编码yh66_09125蛋白质的核酸分子为如下e1)或e2)中的任一种:
35.e1)核苷酸序列为seq id no.1的dna分子;
36.e2)将seq id no.1所示的核苷酸序列经过修饰和/或一个或几个核苷酸的取代和/或缺失和/或添加得到的与e1)所示的dna分子具有90%以上的同一性,且具有相同功能的dna分子。
37.其中,seq id no.1所示的dna分子为谷氨酸棒杆菌(corynebacterium glutamicum) cgmcc no.20516中的yh66_09125基因,其编码的yh66_09125蛋白质的氨基酸序列如seqid no.2所示。在本发明中通过引入点突变,得到seq id no.3所示的yh66_
09125
g527a
基因,其编码的yh66_09125
g527a
蛋白质的氨基酸序列如seq id no.4所示。
38.本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码yh66_09125蛋白质或yh66_09125突变体的核苷酸序列进行突变。那些经过人工修饰的,具有编码yh66_09125蛋白质或yh66_09125突变体的核苷酸序列90%或者更高同一性的核苷酸,只要编码yh66_09125蛋白质或yh66_09125突变体且具有相同功能,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
39.这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的编码seq id no.2或seq id no.4所示的氨基酸序列组成的蛋白质的核苷酸序列具有90%或更高,或91%或更高,或92%或更高,或93%或更高,或94%或更高,或95%或更高,或96%或更高,或97%或更高,或98%或更高,或99%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比 (%)表示,其可以用来评价相关序列之间的同一性。
40.所述严格条件是在2
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次5min;或,0.5
×
ssc,0.1%sds的溶液中,在68℃下杂交并洗膜2次,每次15min;或,0.1
×
sspe (或0.1
×
ssc)、0.1%sds的溶液中,65℃条件下杂交并洗膜。
41.上述生物材料或应用中,b2)所述含有编码yh66_09125突变体的核酸分子的表达盒是指能够在宿主细胞中表达yh66_09125突变体的dna,该dna不但可包括启动yh66_09125 突变体基因转录的启动子,还可包括终止yh66_09125突变体基因转录的终止子。进一步,所述表达盒还可包括增强子序列。d2)所述含有编码yh66_09125蛋白质的核酸分子的表达盒是指能够在宿主细胞中表达yh66_09125蛋白质的dna,该dna不但可包括启动 yh66_09125基因转录的启动子,还可包括终止yh66_09125基因转录的终止子。进一步,所述表达盒还可包括增强子序列。
42.上述生物材料或应用中,b3)或d3)所述载体可为质粒、黏粒、噬菌体或病毒载体。所述质粒具体可为pk18mobsacb质粒或pxmj19质粒。
43.在本发明的一个具体实施例中,所述重组载体为重组载体pk18-yh66_09125
g527a
。
44.在本发明的另一个具体实施例中,所述重组载体为重组载体pk18-yh66_09125oe或重组载体pk18-yh66_09125
g517a
oe。
45.在本发明的又一个具体实施例中,所述重组载体为重组载体pxmj19-yh66_09125或重组载体pxmj19-yh66_09125
g527a
。
46.上述生物材料中,b4)或d4)所述微生物可为酵母、细菌、藻或真菌。
47.进一步的,细菌可为任一具有产精氨酸能力的细菌,如来自短杆菌属(brevibacterium)、棒杆菌属(corynebacterium)、埃希氏菌属(escherichia)、气杆菌属(aerobacter)、微球菌属(micrococcus)、黄杆菌属(flavobacterium)或芽胞杆菌属(bacillus)的细菌等。
48.更进一步的,所述细菌包括但不限于谷氨酸棒杆菌(corynebacterium glutamicum)、黄色短杆菌(brevibacterium flavum)、乳酸发酵短杆菌(brevibacterium lactofermentum)、产谷氨酸微球菌(micrococcus glutamicus)、产氨短杆菌(brevibacterum ammoniagenes)、大肠杆菌 (escherichia coli)、产气气杆菌(aerobacter aerogenes)。
49.在本发明的一个具体实施例中,所述微生物为谷氨酸棒杆菌(corynebacteriumglutamicum)cgmccno.20516,该菌株名称为yparg01,已于2020年8月10日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址为:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所),保藏登记号为cgmccno.20516。
50.上述应用中,调控为正调控。具体体现为当细菌中yh66_09125蛋白质或yh66_09125突变体含量或活性提高时,所述细菌精氨酸产量提高;当细菌中yh66_09125蛋白质含量或活性降低时,所述细菌精氨酸产量降低。
51.第四方面,本发明保护提高yh66_09125蛋白质或yh66_09125突变体含量和/或活性的物质或提高yh66_09125基因或yh66_09125突变体基因表达量的物质的新用途。
52.本发明保护提高yh66_09125蛋白质或yh66_09125突变体含量和/或活性的物质或提高yh66_09125基因或yh66_09125突变体基因表达量的物质在如下y1)至y3)中任一种中的应用:
53.y1)提高细菌精氨酸产量;
54.y2)构建产精氨酸工程菌;
55.y3)制备精氨酸。
56.进一步的,所述提高yh66_09125基因表达量的物质可为yh66_09125基因或含有所述yh66_09125基因的重组载体。
57.所述提高yh66_09125突变体基因表达量的物质可为yh66_09125突变体基因或含有所述yh66_09125突变体基因的重组载体。
58.更进一步的,含有所述yh66_09125基因的重组载体具体可为重组载体pk18-yh66_09125oe或重组载体pxmj19-yh66_09125。
59.含有所述yh66_09125突变体基因的重组载体具体可为重组载体pk18-yh66_09125
g527a
oe或重组载体pxmj19-yh66_09125
g527a
。
60.第五方面,本发明保护一种提高细菌精氨酸产量的方法。
61.本发明保护的提高细菌精氨酸产量的方法为如下m1)或m2):
62.所述m1)包括如下步骤:将细菌基因组中的yh66_09125基因替换为yh66_09125突变体基因,实现细菌精氨酸产量的提高;
63.所述m2)包括如下步骤:提高细菌中yh66_09125蛋白质或yh66_09125突变体含量和/或活性,或提高细菌中yh66_09125基因或yh66_09125突变体基因表达量,实现细菌精氨酸产量的提高。
64.第六方面,本发明保护一种产精氨酸工程菌的构建方法。
65.本发明保护的产精氨酸工程菌的构建方法为如下n1)或n2):
66.所述n1)包括如下步骤:将细菌基因组中的yh66_09125基因替换为yh66_09125突变体基因,得到所述产精氨酸工程菌;
67.所述n2)包括如下步骤:提高细菌中yh66_09125蛋白质或yh66_09125突变体含量和/或活性,或提高细菌中yh66_09125基因或yh66_09125突变体基因表达量,得到所述产精氨酸工程菌;
68.上述任一所述应用或方法中,所述yh66_09125突变体具体为yh66_09125
g527a
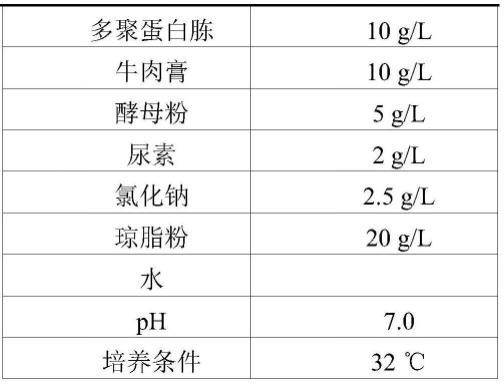
蛋白质,具体为seqidno.4所示的氨基酸序列组成的蛋白质。
69.所述yh66_09125突变体基因具体为yh66_09125
g527a
基因,具体为seq id no.3所示的 dna分子。
70.按照上述产精氨酸工程菌的构建方法构建得到的产精氨酸工程菌在制备精氨酸中的应用也属于本发明的保护范围。
71.第七方面,本发明保护一种制备精氨酸的方法。
72.本发明保护的制备精氨酸的方法包括如下步骤:发酵培养按照上述产精氨酸工程菌的构建方法构建得到的产精氨酸工程菌,得到所述精氨酸。
73.所述发酵培养方法可按照现有技术中的常规试验方法进行。也可采用优化和改进后的常规试验方法进行。
74.所述发酵培养采用的培养基如实施例中的表3所示。
75.所述发酵培养条件如实施例中的表4所示。
76.上述任一所述应用或方法中,所述精氨酸具体为l-精氨酸。
77.本发明首先通过对yh66_09125基因进行单点突变得到yh66_09125
g527a
基因,然后通过对构建的yh66_09125或突变基因的过表达重组菌以及yh66_09125敲除重组菌进行发酵培养发现,yh66_09125基因或其突变基因可以调控细菌l-精氨酸产量。本发明首次发现 yh66_09125基因参与精氨酸的生物合成,对于培育符合工业化生产的高产、高质量菌种,以及精氨酸工业化生产具有重大的应用价值。
具体实施方式
78.下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。以下提供的实施例可作为本技术领域普通技术人员进行进一步改进的指南,并不以任何方式构成对本发明的限制。
79.下述实施例中的实验方法,如无特殊说明,均为常规方法,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
80.实施例1、构建包含点突变的yh66_09125基因编码区的重组载体
81.依据ncbi公布的黄色短杆菌(brevibacterium flavum)atcc15168基因组序列,设计并合成两对扩增yh66_09125基因编码区的引物,以等位基因置换的方式在谷氨酸棒杆菌 (corynebacterium glutamicum)cgmcc 20516(经测序确认该菌株染色体上保留有野生型的 yh66_09125基因)的yh66_09125基因编码区(seq id no.1)中引入点突变,所述点突变为将yh66_09125基因的核苷酸序列(seq id no.1)中的第527位鸟嘌呤(g)突变为腺嘌呤(a),得到seq id no.3所示的dna分子(突变的yh66_09125基因,名称为 yh66_09125
g527a
)。
82.其中,seq id no.1所示的dna分子编码氨基酸序列为seq id no.2的蛋白质(所述蛋白质名称为蛋白质yh66_09125)。seq id no.3所示的dna分子编码氨基酸序列为seq idno.4的突变蛋白质(所述突变蛋白质名称为yh66_09125
g527a
)。所述突变蛋白质 yh66_09125
g527a
氨基酸序列(seq id no.4)中的第176位谷氨酸(e)由甘氨酸(g)突变而来。
83.采用nebuilder重组技术进行基因定点突变,引物设计如下(上海invitrogen公司合成),加红色粗字体的碱基为突变位置:
84.p1:5'-cagtgccaagcttgcatgcctgcaggtcgactctag ctcaccgaga acctcggtga-3';
85.p2:5'-gaggcttcgccaacttcaatgacagaggcgatgg-3';
86.p3:5'-ccatcgcctctgtcattgaagttggcgaagcctc-3';
87.p4:5'-cagctatgaccatgattacgaattcgagctcggtaccccagaaccgtt gtacatggtc-3'。
88.构建方法:以黄色短杆菌atcc15168为模板,分别采用引物p1/p2和p3/p4进行pcr 扩增,获得两条分别带有突变碱基,大小分别为780bp和688bp的yh66_09125基因编码区的dna片段(yh66_09125up和yh66_09125down)。
89.pcr扩增体系为:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2+
(25mm) 4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。
90.pcr扩增反应程序为:94℃预变性5min,(94℃变性30s;52℃退火30s;72℃延伸 40s;30个循环),72℃过度延伸10min。
91.将上述两条dna片段(yh66_09125up和yh66_09125down)经琼脂糖凝胶电泳分离纯化后,与经过酶切(xbal i/bamh i)后纯化的pk18mobsacb质粒(购自addgene公司,用 xbal i/bamh i酶切)用nebuilder酶(购自neb公司)50℃连接30min,连接产物转化后长出的单克隆经pcr鉴定获得阳性重组载体pk18-yh66_09125
g527a
,该重组载体上含有卡那霉素抗性标记。将酶切正确的重组载体pk18-yh66_09125
g527a
送测序公司测序鉴定,并将含有正确点突变(g-a)的重组载体pk18-yh66_09125
g527a
保存备用。
92.重组载体pk18-yh66_09125
g527a
中yh66_09125
g527a up-down dna片段(yh66_09125 up-down,seq id no.5)大小为1434bp,由于含有突变位点,导致菌株谷氨酸棒杆菌cgmcc 20516中yh66_09125基因编码区的第527位鸟嘌呤(g)变为腺嘌呤(a),最终导致编码蛋白的第176位甘氨酸(g)突变为谷氨酸(e)。
93.重组载体pk18-yh66_09125
g527a
是将pk18mobsacb载体的xbal i和/bamh i识别位点间的片段(小片段)替换为序列表中seq id no.5第37-1396位所示的dna片段,且保持 pk18mobsacb载体的其他序列不变得到的重组载体。
94.重组载体pk18-yh66_09125
g527a
含有seq id no.3所示的突变基因yh66_09125
g527a
的第1-687位所示的dna分子。
95.实施例2、构建包含基因yh66_09125
g527a
的工程菌株
96.构建方法:将实施例1中的等位替换质粒(pk18-yh66_09125
g527a
)通过电击转化入谷氨酸棒杆菌(corynebacterium glutamicum)cgmcc 20516中后,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落分别通过实施例1中的引物p1和通用引物 m13r进行鉴定,能扩增出大小为1441bp条带的菌株为阳性菌株。将阳性菌株在含15%蔗糖的培养基上培养,对培养产生的单菌落分别在含有卡那霉素和不含卡那霉素的培养基上培养,选择在不含卡那霉素的培养基上生长,而在含卡那霉素的培养基上不生长的菌株进一步采用如下引物(上海invitrogen公司合成)进行pcr鉴定:
97.p5:5'-ttccattatt ttcccgcagg-3';
98.p6:5'-aaggcccatg ggcagggtca-3'。
99.将得到的pcr扩增产物(217bp)通过95℃高温变性10min、冰浴5min后进行sscp (single-strand conformation polymorphis)电泳(以质粒pk18-yh66_09125
g527a
扩增片段为阳性对照,黄色短杆菌atcc15168扩增片段为阴性对照,水作为空白对照),sscp电泳的 page的制备及电泳条件参见表2,由于片段结构不同,电泳位置不同,因此片段电泳位置与
阴性对照片段位置不一致且与阳性对照片段位置一致的菌株为等位替换成功的菌株。再次通过引物p5/p6 pcr扩增阳性菌株yh66_09125基因片段,并连接到pmd19-t载体进行测序,通过序列比对,碱基序列发生突变(g-a)的菌株为等位替换成功的阳性菌株,并被命名为 ypr-037。
100.重组菌ypr-037含有seq id no.3所示的突变的基因yh66_09125
g527a
。
101.表1、培养基的组成和培养条件
[0102][0103][0104]
表2、sscp电泳的page的制备及电泳条件
[0105][0106]
实施例3、构建基因组上过表达yh66_09125基因或yh66_09125
g527a
基因的工程菌株
[0107]
依据ncbi公布的黄色短杆菌atcc15168基因组序列,设计并合成三对扩增上下游同源臂片段及yh66_09125或yh66_09125
g527a
基因编码区及启动子区的引物,以同源重组的方式在谷氨酸棒杆菌cgmcc 20516中引入yh66_09125或yh66_09125
g527a
基因。
[0108]
引物设计如下(上海invitrogen公司合成):
[0109]
p7: 5'-cagtgccaagcttgcatgcctgcaggtcgactctagcatgacggctgactggactc-3' ;
[0110]
p8:5'-ggcttttaaa agccgtcacaaatcggactccttaaatggg-3';
[0111]
p9:5'-cccatttaag gagtccgatttgtgacggcttttaaaagcc-3';
[0112]
p10:5'-ctatgtgagt agtcgatttattacttcttcaccgccaaac-3';
[0113]
p11:5'-gtttggcggt gaagaagtaataaatcgactactcacatag-3';
[0114]
p12:5'-cagctatgaccatgattacgaattcgagctcggtaccctgcataagaa acaaccactt-3'。
[0115]
构建方法:分别以黄色短杆菌atcc15168或ypr-037为模板,分别采用引物p7/p8、 p9/p10和p11/p12进行pcr扩增,获得上游同源臂片段806bp(对应于谷氨酸棒杆菌cgmcc 20516yh66_03350基因及其启动子区或者是与上一个基因的间隔区,序列如seq id no.6所示),yh66_09125基因及其启动子片段848bp(序列如seq id no.7所示)或yh66_09125
g527a
基因及其启动子片段848bp(序列如seq id no.8所示)及下游同源臂片段783bp(对应于谷氨酸棒杆菌cgmcc 20516yh66_03355基因及其与yh66_03350基因的部分间隔区,序列如seq id no.9所示)。pcr反应结束后,对每个模板扩增得到的3个片段采用柱式dna凝胶回收试剂盒分别进行电泳回收。回收后的3个片段与经过xbal i/bamh i酶切后纯化的 pk18mobsacb质粒(购自addgene公司)用nebuilder酶(购自neb公司)50℃连接30min,连接产物转化后长出的单克隆用m13引物经pcr鉴定获得阳性整合质粒(重组载体),分别为pk18-yh66_09125oe、pk18-yh66_09125
g527a
oe,该阳性整合质粒上含有卡那霉素抗性标记,可以通过卡那霉素筛选获得质粒整合到基因组上的重组子。
[0116]
pcr反应体系为:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2+
(25mm) 4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。
[0117]
pcr反应程序为:94℃预变性5min,94℃变性30s;52℃退火30s;72℃延伸60s (30个循环),72℃过度延伸10min。
[0118]
将测序正确的整合质粒(pk18-yh66_09125oe、pk18-yh66_09125
g527a
oe)分别电转化入谷氨酸棒杆菌cgmcc 20516,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落通过p13/p14引物进行pcr鉴定,pcr扩增出含有大小为1555bp条带的菌株为阳性菌株,扩增不到条带的菌株为原菌。将阳性菌株在含15%蔗糖的培养基上培养,对培养产生的单菌落进一步采用p15/p16引物进行pcr鉴定,扩增出大小为1369bp片段的菌株为yh66_09125或yh66_09125
g527a
基因整合到谷氨酸棒杆菌cgmcc 20516基因组上同源臂yh66_03350和下同源臂yh66_03355的间隔区上的阳性菌株,分别命名为ypr-038(不含突变点)和ypr-039(含突变点)。
[0119]
重组菌ypr-038含有双拷贝的seq id no.1所示的yh66_09125基因;具体地,重组菌 ypr-038是将谷氨酸棒杆菌cgmcc 20516的基因组中上同源臂yh66_03350和下同源臂yh66_03355的间隔区替换为yh66_09125基因,且保持谷氨酸棒杆菌cgmcc 20516的基因组中的其它核苷酸不变得到的重组菌。含有双拷贝yh66_09125基因的重组菌可以显著和稳定地提高yh66_09125基因的表达量。
[0120]
重组菌ypr-039含有seq id no.3所示的突变的yh66_09125
g527a
基因;具体地,重组菌ypr-039是将谷氨酸棒杆菌cgmcc 20516的基因组中上同源臂yh66_03350和下同源臂 yh66_03355的间隔区替换为yh66_09125
g527a
基因,且保持谷氨酸棒杆菌cgmcc 20516的基因组中的其它核苷酸不变得到的重组菌。
[0121]
pcr鉴定引物如下所示:
[0122]
p13:5'-gtccgctctg ttggtgttca-3'(对应上同源臂yh66_03350的外侧);
[0123]
p14:5'-agatcgcgaa cacgacaaat-3'(对应yh66_09125基因内部);
[0124]
p15:5'-ctcaccgcaa tgagggtctc-3'(对应yh66_09125基因内部);
[0125]
p16:5'-tggaggaata ttcggcccag-3'(对应下同源臂yh66_03355的外侧)。
[0126]
实施例4、构建质粒上过表达yh66_09125基因或yh66_09125
g527a
基因的工程菌株
[0127]
依据ncbi公布的黄色短杆菌atcc15168基因组序列,设计并合成一对扩增yh66_09125 或yh66_09125
g527a
基因编码区及启动子区的引物,引物设计如下(上海invitrogen公司合成):
[0128]
p17: 5'-gcttgcatgcctgcaggtcgactctagaggatcccctgtgacggcttttaaaagcc-3' (带下划线的核苷酸序列为pxmj19上的序列);
[0129]
p18: 5'-atcaggctgaaaatcttctctcatccgccaaaacttacttcttcaccgccaaac-3'(带下划线的核苷酸序列为pxmj19上的序列)。
[0130]
构建方法:分别以黄色短杆菌atcc15168或ypr-037为模板,以引物p17/p18进行pcr 扩增,获得yh66_09125基因及其启动子片段(序列如seq id no.12所示)和yh66_09125
g527a
基因及其启动子片段878bp(序列如seq id no.13所示),对扩增产物进行电泳并采用柱式 dna凝胶回收试剂盒进行纯化回收,回收的dna片段与经ecor i酶切回收的穿梭质粒 pxmj19用nebuilder酶(购自neb公司)50℃连接30min,连接产物转化后长出的单克隆用m13引物经pcr鉴定获得阳性过表达质粒pxmj19-yh66_09125(含有yh66_09125基因) 和pxmj19-yh66_09125
g527a
(含有yh66_09125
g527a
基因),将该质粒送测序。因质粒上含有氯霉素抗性标记,可以通过氯霉素来筛选质粒是否转化到菌株中。
[0131]
pcr反应体系为:10
×
ex taq buffer 5μl,dntp mixture(各2.5mm)4μl,mg
2+
(25mm) 4μl,引物(10pm)各2μl,ex taq(5u/μl)0.25μl,总体积50μl。
[0132]
pcr反应程序为:94℃预变性5min,94℃变性30s;52℃退火30s;72℃延伸120s (30个循环),72℃过度延伸10min。
[0133]
将测序正确的pxmj19-yh66_09125和pxmj19-yh66_09125
g527a
质粒分别电转化入谷氨酸棒杆菌cgmcc 20516中,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落通过引物m13r(-48)/p18进行pcr鉴定,pcr扩增出含有大小为917bp片段的菌株为阳性菌株,其被命名为ypr-040(不含突变点)和ypr-041(含突变点)。
[0134]
重组菌ypr-040含有seq id no.1所示的yh66_09125基因;重组菌ypr-041含有seqid no.3所示的突变的yh66_09125
g527a
基因。
[0135]
实施例5、构建基因组上缺失yh66_09125基因的工程菌株
[0136]
根据ncbi公布的黄色短杆菌atcc15168的基因组序列,合成两对扩增yh66_09125基因编码区两端片段的引物,作为上下游同源臂片段。引物设计如下(上海invitrogen公司合成):
[0137]
p19: 5'-cagtgccaagcttgcatgcctgcaggtcgactctaggtgaggtagacatgatcgca-3' ;
[0138]
p20:5'-tgcgcgaact gtattagccagtggtggtgc tccttgttaa-3';
[0139]
p21:5'-ttaacaagga gcaccaccactggctaatac agttcgcgca-3';
[0140]
p22: 5'-cagctatgaccatgattacgaattcgagctcggtaccccttcagtgcaataaccatct-3 '。
[0141]
构建方法:以黄色短杆菌atcc15168为模板,分别以引物p19/p20和p21/p22进行pcr扩增,获得大小为743bp的yh66_09125的上游同源臂片段及大小为699bp的yh66_09125的下游同源臂片段。对扩增的产物进行电泳并采用柱式dna凝胶回收试剂盒进行纯化,回收的dna片段与经过xbali/bamhi酶切后纯化的pk18mobsacb质粒(购自addgene公司)用nebuilder酶(购自neb公司)50℃连接30min,连接产物转化后长出的单克隆用m13引物经pcr鉴定获得阳性敲除载体pk18-δyh66_09125,该质粒含有整个敲除yh66_09125同源臂片段1402bp(序列如seqidno.14所示)和卡那霉素抗性作为筛选标记,将该质粒送测序。
[0142]
pcr扩增反应体系为:10
×
extaqbuffer5μl,dntpmixture(各2.5mm)4μl,mg
2+
(25mm)4μl,引物(10pm)各2μl,extaq(5u/μl)0.25μl,总体积50μl。
[0143]
pcr扩增反应程序为:94℃预变性5min,94℃变性30s;52℃退火30s;72℃延伸90s(30个循环),72℃过度延伸10min。
[0144]
将测序正确的敲除质粒pk18-δyh66_09125电转化入谷氨酸棒杆菌cgmcc20516,在培养基中进行培养,培养基成分和培养条件参见表1,对培养产生的单菌落通过如下引物(上海invitrogen公司合成)进行pcr鉴定:
[0145]
p23:5'-gtgaggtagacatgatcgca-3'(对应于谷氨酸棒杆菌cgmcc20516yh66_09120基因编码区);
[0146]
p24:5'-cttcagtgcaataaccatct-3'(对应于谷氨酸棒杆菌cgmcc20516yh66_09130基因编码区)。
[0147]
上述pcr同时扩增出大小为1328bp及2015bp条带的菌株为阳性菌株,只扩增出大小为2015bp条带的菌株为原菌。阳性菌株在15%蔗糖培养基上筛选后分别在含有卡那霉素和不含卡那霉素的培养基上培养,选择在不含卡那霉素的培养基上生长,而在含卡那霉素的培养基上不生长的菌株进一步采用p23/p24引物进行pcr鉴定,扩增出大小为1328bp条带的菌株为yh66_09125基因编码区被敲除的阳性菌株。再次通过p23/p24引物pcr扩增阳性菌株yh66_09125片段,并连接到pmd19-t载体进行测序,将测序正确的菌株命名为ypr-042。
[0148]
重组菌ypr-042为将谷氨酸棒杆菌cgmcc20516基因组上的yh66_09125基因敲除后得到的重组菌。
[0149]
实施例6、l-精氨酸发酵实验
[0150]
将上述实施例构建的菌株和原始菌株谷氨酸棒杆菌cgmcc20516在blbio-5gc-4-h型号的发酵罐(购自上海百仑生物科技有限公司)中以表3所示的培养基和表4所示的控制工艺进行发酵实验。每个菌株重复三次,结果如表5所示。
[0151]
结果如表5所示,在谷氨酸棒杆菌中对yh66_09125基因编码区进行点突变yh66_09125
g527a
及过表达,有助于l-精氨酸产量及转化率的提高,而对基因进行敲除或弱化,不利于l-精氨酸的积累。
[0152]
表3、发酵培养基配方(其余为水)
[0153]
成分配方硫酸铵14g/l磷酸二氢钾1g/l磷酸氢二钾1g/l
硫酸镁0.5g/l酵母粉2g/l硫酸亚铁18mg/l硫酸锰4.2mg/l生物素0.02mg/l维生素b12mg/lantifoam(cb-442)消泡0.5ml/l70%葡萄糖(底糖)40g/l
[0154]
表4、发酵控制工艺
[0155][0156]
表5、l-精氨酸发酵实验结果
[0157]
菌株od
610nm
l-精氨酸产量(g/l)谷氨酸棒杆菌cgmcc 2051675.387.9ypr-03777.588.8ypr-03877.689.1ypr-03977.889.5ypr-04078.988.7ypr-04178.488.9ypr-04273.286.6
[0158]
以上对本发明进行了详述。对于本领域技术人员来说,在不脱离本发明的宗旨和范围,以及无需进行不必要的实验情况下,可在等同参数、浓度和条件下,在较宽范围内实
施本发明。虽然本发明给出了特殊的实施例,应该理解为,可以对本发明作进一步的改进。总之,按本发明的原理,本技术欲包括任何变更、用途或对本发明的改进,包括脱离了本技术中已公开范围,而用本领域已知的常规技术进行的改变。按以下附带的权利要求的范围,可以进行一些基本特征的应用。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1