一种近红外荧光探针及其制备方法和应用
1.本发明属于有机化合物及其制备的技术领域,具体为一种近红外荧光探针及其制备方法和应用。
背景技术:
2.1,4-二氢烟酰胺腺嘌呤二核苷酸(nadh)以及它的磷酸酯(nadph)是维持细胞内氧化还原稳态所必需的辅酶。它们作为一种电子载体,与氧化还原酶紧密相关,并参与糖酵解、柠檬酸循环、β-氧化等代谢途径中重要的氧化还原反应。nad(p)h是能量代谢的重要产物,与癌症的发生密切相关。因此,寻找一种合适的方法实现对nad(p)h水平的检测至关重要。
3.目前,已经开发了很多用于体外检测nad(p)h的方法,如电泳、酶法和荧光成像方法,如基因编码蛋白、纳米颗粒、小分子探针等。其中,小分子荧光探针因具备很多优点而受到广泛关注,如制备简单、使用方便、细胞渗透性好、毒性低、适合体内实验等。但是,大多数探针为关闭型荧光探针,且无法应用于活细胞成像,甚至是活体成像。因此,开发一种打开型、可用于活细胞成像以及活体成像的荧光探针具有重要意义。
技术实现要素:
4.针对现有检测nad(p)h的小分子荧光探针存在的缺陷,本发明提供了一种近红外荧光探针及其制备方法和应用。该荧光探针是本技术发明人在前期研究中,发现基于苯并吡喃嗡盐骨架的小分子探针可以对nad(p)h有所响应。因此,通过一系列有机合成反应完成了该化合物荧光探针的设计与合成,并对其进行了紫外吸收和荧光测试,随后,还在细胞共聚焦以及活体实验中发现可以检测到nad(p)h。
5.为了达到上述目的,本发明采用了下列技术方案:
6.本发明提供一种近红外荧光探针,所述探针为3-(9-(2-((乙酰氧基甲氧基)羰基)苯基)-6-(二乙氨基)-2,3-二羟基亚甲基-4(1h)-亚甲基)-1-甲基喹啉-1-高氯酸盐三氟甲磺酸酯,其结构式为:
[0007][0008]
本发明还提供一种上述近红外荧光探针的制备方法,包括以下步骤:
[0009]
步骤1,将4-二乙氨基酮酸与环己酮、浓硫酸、高氯酸反应生成9-(2-羧基苯基)-6-(二乙氨基)-1,2,3,4-四羟基高氯酸盐;
[0010]
步骤2,将步骤1生成的9-(2-羧基苯基)-6-(二乙氨基)-1,2,3,4-四羟基高氯酸盐与3-喹啉甲醛反应生成9-(2-羧基苯基)-6-(二乙氨基)-4-(喹啉-3-亚甲基)-1,2,3,4-四羟基高氯酸盐;
[0011]
步骤3,将步骤2生成的9-(2-羧基苯基)-6-(二乙氨基)-4-(喹啉-3-亚甲基)-1,2,3,4-四羟基高氯酸盐与三氟甲烷磺酸甲酯反应生成3-(9-(2-羧基苯基)-6-(二乙氨基)-2,3-二羟基甲基-4(1h)-亚甲基)-1-甲基喹啉-1-过氯酸盐三氟甲磺酸酯;
[0012]
步骤4,将步骤3生成的3-(9-(2-羧基苯基)-6-(二乙氨基)-2,3-二羟基甲基-4(1h)-亚甲基)-1-甲基喹啉-1-过氯酸盐三氟甲磺酸酯与溴乙酸甲酯反应生成3-(9-(2-((乙酰氧基甲氧基)羰基)苯基)-6-(二乙氨基)-2,3-二羟基亚甲基-4(1h)-亚甲基)-1-甲基喹啉-1-高氯酸盐三氟甲磺酸酯,即得到所述近红外荧光探针。
[0013]
进一步,所述制备方法具体为:
[0014]
步骤1,在0℃下将环己酮逐滴加入到质量分数为98%浓硫酸中并进行搅拌,然后分批加入4-二乙氨基酮酸,在90℃~120℃条件下继续搅拌,待反应进行3~5h后停止反应,将最终反应混合物倒入0℃水中,加入质量分数为70%高氯酸,将析出的沉淀物进行抽滤,并用0℃水洗涤后得到橙红色固体化合物,即9-(2-羧基苯基)-6-(二乙氨基)-1,2,3,4-四羟基高氯酸盐;
[0015]
步骤2,向反应容器中依次加入9-(2-羧基苯基)-6-(二乙氨基)-1,2,3,4-四羟基高氯酸盐、3-喹啉甲醛和哌啶,再加入无水乙醇溶解,将溶解后的混合物加热到80℃进行回流,反应过夜,待反应结束,温度恢复到室温后,将其冷却至0℃放置2~4h,析出紫色固体,随后用叔丁基甲基醚洗涤固体,待固体干燥后得到化合物:9-(2-羧基苯基)-6-(二乙氨基)-4-(喹啉-3-亚甲基)-1,2,3,4-四羟基高氯酸盐;
[0016]
步骤3,在二氯甲烷中先加入三氟甲烷磺酸甲酯,再加入9-(2-羧基苯基)-6-(二乙氨基)-4-(喹啉-3-亚甲基)-1,2,3,4-四羟基高氯酸盐,室温搅拌3h,停止反应,冷却析出紫色固体,进行抽滤后,用二氯甲烷洗涤,干燥后得到化合物:3-(9-(2-羧基苯基)-6-(二乙氨基)-2,3-二羟基甲基-4(1h)-亚甲基)-1-甲基喹啉-1-过氯酸盐三氟甲磺酸酯;
[0017]
步骤4,将3-(9-(2-羧基苯基)-6-(二乙氨基)-2,3-二羟基甲基-4(1h)-亚甲基)-1-甲基喹啉-1-过氯酸盐三氟甲磺酸酯和n,n-二异丙基乙胺加入到反应容器中,再加入乙腈混合均匀,随后向混合溶液加入溴乙酸甲酯,在氩气保护下搅拌48h,经柱色谱分离得到化合物:3-(9-(2-((乙酰氧基甲氧基)羰基)苯基)-6-(二乙氨基)-2,3-二羟基亚甲基-4(1h)-亚甲基)-1-甲基喹啉-1-高氯酸盐三氟甲磺酸酯,即得到所述近红外荧光探针。
[0018]
更进一步,所述步骤1中环己酮、质量分数为98%浓硫酸、4-二乙氨基酮酸、质量分数为70%高氯酸用量的体积:体积:质量:体积=6.6ml:72ml:9.82g:7.9ml;将最终反应混合物倒入200ml的0℃水中。
[0019]
所述步骤2中9-(2-羧基苯基)-6-(二乙氨基)-1,2,3,4-四羟基高氯酸盐、3-喹啉甲醛、哌啶、无水乙醇的质量:质量:体积:体积=2g:1g:0.04ml:35ml。
[0020]
所述步骤3中二氯甲烷、三氟甲烷磺酸甲酯、9-(2-羧基苯基)-6-(二乙氨基)-4-(喹啉-3-亚甲基)-1,2,3,4-四羟基高氯酸盐用量的体积:体积:质量=108ml:1.2ml:1.53g。
[0021]
所述步骤4中3-(9-(2-羧基苯基)-6-(二乙氨基)-2,3-二羟基甲基-4(1h)-亚甲
基)-1-甲基喹啉-1-过氯酸盐三氟甲磺酸酯、n,n-二异丙基乙胺、乙腈、溴乙酸甲酯用量的质量:体积:体积:体积=60mg:0.124ml:2ml:0.1ml。
[0022]
进一步,所述步骤1和步骤3中的抽滤用减压真空泵,所述步骤4中柱色谱的流动相为体积比为二氯甲烷:甲醇=8:1。
[0023]
本发明还提供一种上述近红外荧光探针的应用,用于制备检测1,4-二氢烟酰胺腺嘌呤二核苷酸以及其磷酸酯的试剂。
[0024]
与现有技术相比本发明具有以下优点:
[0025]
1、本发明提供了一种打开型荧光探针,具有较高的信噪比。
[0026]
2、本发明提供了一种基于苯并吡喃嗡盐骨架的小分子探针,该探针合成路线简单,原料易得,成本较低。
[0027]
3、本发明小分子探针可以与nad(p)h响应,对nad(p)h具有很高的选择性,发射波长可达745nm左右,可为后续分子探针的结构优化奠定基础。
[0028]
4、本发明提供了小分子探针的生物应用,由于其较长的发射波长,使其在细胞和小鼠实验中均得以利用,有助于癌症的后续研究。
附图说明
[0029]
图1是本发明探针的核磁共振的氢谱图;
[0030]
图2是本发明探针的核磁共振的碳谱图;
[0031]
图3是本发明探针的高分辨质谱;
[0032]
图4是本发明探针的光谱测试图;
[0033]
图5是本发明探针在不同活细胞中检测nad(p)h的细胞成像图;
[0034]
图6是本发明探针在不同葡萄糖浓度下hela细胞的细胞成像图;
[0035]
图7是本发明探针的小鼠活体成像图。
具体实施方式
[0036]
下面结合本发明实施例和附图,对本发明的技术方案进行具体、详细的说明。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干变型和改进,这些也应视为属于本发明的保护范围。
[0037]
实施例1
[0038]
一种近红外荧光探针的制备:
[0039]
1)化合物2的制备
[0040]
向200ml烧瓶中加入质量分数为98%浓硫酸(72ml),接着在0℃下将环己酮(6.6ml,64mmol)逐滴加入到98%浓硫酸(72ml)中并进行搅拌,然后分批次加入4-二乙氨基酮酸(9.82g,32mmol),将混合物在90℃条件下搅拌。待反应进行3小时后停止反应。将最终反应混合物倒入0℃水(200ml)中,加入质量分数为70%高氯酸(7.9ml),将析出的沉淀物通过减压真空泵进行抽滤,并用0℃水洗涤三次,得到橙红色固体化合物2(15g),即9-(2-羧基苯基)-6-(二乙氨基)-1,2,3,4-四羟基高氯酸盐,产率为98%。
[0041][0042]
2)化合物3的制备
[0043]
向50ml烧瓶中依次加入化合物2(2g,4.2mol),3-喹啉甲醛(1g,6.3mol)和哌啶(40μl),再加入一定量的溶剂无水乙醇(35ml)使化合物溶解,最终混合物加热至80℃进行回流,反应过夜,待反应结束,温度恢复到室温后,将其冷却至0℃放置2小时,析出紫色固体,随后用叔丁基甲基醚洗固体3次,待固体干燥后得到化合物3(1.5513g),即9-(2-羧基苯基)-6-(二乙氨基)-4-(喹啉-3-亚甲基)-1,2,3,4-四羟基高氯酸盐,产率为61%。
[0044][0045]
3)化合物4的制备
[0046]
在二氯甲烷(108ml)中加入三氟甲烷磺酸甲酯(1200μl,10.2mol),再加入化合物3(1.53g,2.5mol),室温搅拌3小时,停止反应,冷却析出紫色固体,用减压真空泵进行抽滤,用二氯甲烷洗三次,干燥后得到化合物4(0.9133g),即3-(9-(2-羧基苯基)-6-(二乙氨基)-2,3-二羟基甲基-4(1h)-亚甲基)-1-甲基喹啉-1-过氯酸盐三氟甲磺酸酯,产率为58%。
[0047][0048]
4)化合物1(探针)的制备
[0049]
将化合物4(60mg,0.097mmol)和n,n-二异丙基乙胺(124μl,0.75mmol)加入到10ml圆底烧瓶中,再加入乙腈(2ml)混合均匀,随后,向混合溶液加入溴乙酸甲酯(100μl,1.02mmol),在氩气保护下搅拌48小时,经柱色谱(二氯甲烷:甲醇=8:1,体积比)分离得到化合物1,即3-(9-(2-((乙酰氧基甲氧基)羰基)苯基)-6-(二乙氨基)-2,3-二羟基亚甲基-4(1h)-亚甲基)-1-甲基喹啉-1-高氯酸盐三氟甲磺酸酯(近红外荧光探针),产率为22%。
[0050][0051]
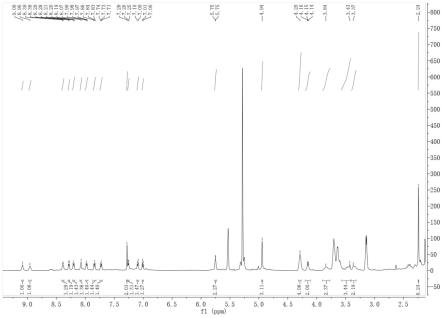
图1为本实施例探针的核磁共振的氢谱图,从图1可得:
[0052]1h nmr(600mhz,cdcl3)δ9.09(s,1h),8.96(s,1h),8.39(d,j=6.7hz,1h),8.28(d,j=7.8hz,1h),8.20(t,j=7.0hz,1h),8.07(s,1h),7.98(t,j=7.1hz,1h),7.84(t,j=7.8hz,1h),7.73(t,j=7.6hz,1h),7.28(s,2h),7.26(d,j=7.4hz,1h),7.10(d,j=9.7hz,1h),7.01(d,j=9.6hz,1h),5.77
–
5.73(m,2h),4.94(s,3h),4.29(s,4h),4.20
–
4.11(m,2h),3.84(s,2h),3.43(s,3h),3.37(s,2h),2.24(s,6h).
[0053]
图2为本实施例探针的核磁共振的碳谱图,从图2可得:
[0054]
13c nmr(151mhz,cdcl3)δ169.3,167.9,163.6,161.6,158.8,156.4,152.3,137.2,136.5,134.5,134.1,133.8,132.7,131.8,130.6,130.6,130.3,129.8,129.7,129.7,129.1,129.0,127.8,123.7,118.8,118.7,118.0,98.2,86.7,80.0,62.5,54.2,53.4,42.4,29.6,14.0,12.1,10.5.
[0055]
图3为本实施例探针的高分辨质谱图,从图3可得:
[0056]
hrms(esi)[m]
2+
calculated for c
38h38
n2o5:301.1390,found:301.1387。
[0057]
实施例2
[0058]
对实施例1制得的荧光探针进行光谱测试:
[0059]
该测试是在体系pbs:ch3ch2oh=3:2(体积比)进行的,探针配制的母液浓度为2mm,nadh和nadph的母液浓度均为20mm。(所有测试均控制温度在37℃进行)
[0060]
测试结果如图4所示。图4中(a)为化合物1(10μm,pbs:ch3ch2oh,体积比3:2)加入100μm nadh后随时间的推移紫外吸收的变化;(b)为化合物1(10μm,pbs:ch3ch2oh,体积比3:2)的荧光强度随nadh浓度(0-100μm)的变化;(λex=680nm,狭缝:10nm/10nm);(c)为化合物1(10μm,pbs:ch3ch2oh,体积比3:2)加入100μm nadh后随时间的增加,荧光光谱的变化;(d)为化合物1(10μm)在pbs和ch3ch2oh(体积比3:2)混合溶剂中加入100μm nadh的动力学曲线;(λex=680nm,狭缝:10nm/10nm);(e)为化合物1(10μm)在不同浓度nadh存在下的工作曲线;(f)为化合物1(10μm,pbs:ch3ch2oh,体积比3:2)与各种离子、氨基酸以及酶在37℃水浴中反应2.5小时后在745nm的荧光强度;横坐标a至w分别代表200μm k
+
,na
+
,ca
2+
,mg
2+
,f-,br-,no
2-,oh-,hso
3-,so
32-,scn-,h2o2,vc,cys,hcy,gsh,lys,asn,脂肪酶,胃蛋白酶,胰蛋白酶,nadph,nadh。
[0061]
从图4中可以看出,探针的紫外吸收峰在556nm处,加入nadh后,在723nm出现一个新的吸收峰,并且随着时间的增加,在556nm处的紫外吸收逐渐下降,在723nm的紫外吸收逐渐升高(a),说明该探针能对nadh响应。随后,用680nm作为探针的激发波长,当加入不同浓度的nadh(0-100μm),发现745nm处的荧光强度逐渐增强(b),说明该探针对nadh的响应呈浓度依耐性,加入100μm nadh后,随着时间的推移,荧光强度也逐渐增强(c和d),说明该探针对一定浓度nadh的相应呈时间依耐性。图(e)中曲线的r2=0.99,表明该探针用于检测nadh
具有很好的线性关系。从图(f)可以看出:同样条件下检测nadph和nadh的荧光强度远高于其它物质,表明本发明荧光探针对nadph和nadh具有很好的选择性。同时,图4的结果也表明本发明荧光探针属于打开型荧光探针,具有较高的信噪比。
[0062]
实施例3
[0063]
细胞实验:对实施例1制得的荧光探针进行细胞实验
[0064]
(1)不同活细胞中nad(p)h的共聚焦荧光检测
[0065]
图5为在不同活细胞中检测nad(p)h的细胞成像图。其中:(a)为用10μm的化合物1分别孵育正常细胞(7702)、人宫颈癌细胞(hela)、人肝癌细胞(hepg2)1小时后的成像结果。(b)为正常细胞(7702)、人宫颈癌细胞(hela)、人肝癌细胞(hepg2)三种类型细胞的平均荧光强度;正常细胞(7702)作为对照组定义为1.0,数据表示为平均值
±
sd(n=3)。
[0066]
在细胞实验中发现(图5),当将探针加入正常细胞(7702)、人宫颈癌细胞(hela)、人肝癌细胞(hepg2)中,都会有红色荧光产生,但hela和hepg2细胞中的荧光强度要相对高于正常细胞(7702)。说明化合物1(本发明荧光探针)可以检测到不同细胞中nad(p)h的水平,并且发现癌细胞中nad(p)h的水平要高于正常细胞。
[0067]
(2)不同葡萄糖浓度下hela细胞中nad(p)h的共聚焦荧光检测
[0068]
图6为不同葡萄糖浓度下hela细胞的细胞成像图。(a)为分别用5、10、20mm的葡萄糖预孵hela细胞15分钟后,再用10μm的化合物1孵育15分钟后进行的成像;(b)为hela细胞在不同浓度葡萄糖的条件下显示的平均荧光强度;将细胞预孵5mm的葡萄糖的荧光强度作为对照组定义为1.0,数据表示为平均值
±
sd(n=3)。
[0069]
从图6可以看到:在向平均荧光强度最高的hela细胞中加入不同浓度的葡萄糖时,随着葡萄糖浓度的增加,hela细胞中的荧光强度也逐渐增强。说明在细胞发生糖酵解的过程中会有nad(p)h的产生。
[0070]
通过上述结果可以得出:本发明荧光探针可用于癌症的后续研究。
[0071]
实施例4
[0072]
小鼠活体实验:将母液浓度为2mm的探针稀释到500μm,吸取10μl经尾静脉注射至小鼠体内。分别在0、20、30和50分钟后,进行小鼠体内荧光成像。
[0073]
图7为小鼠的体内荧光成像图。从图中可以看到:小鼠体内的荧光强度随着时间的增加,由弱到强再渐渐变弱,说明本发明探针可以在小鼠体内检测nad(p)h,可以用于活体成像。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1