一种耐热耐碱木聚糖酶及应用
1.本发明涉及一种耐热耐碱木聚糖酶及应用,属于生物工程领域。
背景技术:
2.木聚糖(xylan)是自然界中广泛存在的一种五碳糖,而木聚糖酶(xylanase)是一类能将木聚糖水解成单糖和寡糖的酶,由于木聚糖的组成成分复杂,其水解需要多种酶协同作用,所以广义上的木聚糖酶是指能够将木聚糖水解成寡糖或单糖的一系列酶的总称,包括内切β-1,4-d-木聚糖酶、β-d-木糖苷酶、α-l-阿拉伯糖苷酶、α-d-葡糖苷酸酶、乙酰基木聚糖酶、酚酸酯酶等。狭义上单指内切β-1,4-d-木聚糖酶。其来源非常广泛,可以由不同种类的微生物产生。根据其对酸碱环境的耐受度,木聚糖酶分为碱性、中性和酸性。
3.木聚糖酶分子中含有不同的功能区域,包括催化区(catalyitc domain,cd)、纤维素结合区(cellulose—binding domain,cbd)、木聚糖结合区(xylan binding domain,xbd)、连接序列、重复序列、热稳定区、cellulosome—docking区及其它未知功能的非催化区,每个区域有不同的功能,来源不同的木聚糖酶分子的功能区域之间同源性大小不同。随着计算机技术与基因工程手段的发展,对于蛋白质结构的分析也越来越精确与直观,利用基因工程改造木聚糖酶的方法也越来越成熟。如中国发明专利cn 113528491 a(申请号:202110952905.9)具体公开了一种n-糖基化修饰提高黑曲霉木聚糖酶热稳定性的方法。研究发现通过对木聚糖酶基因序列的编辑,如取代、缺失或添加一个或几个氨基酸,可以改变使木聚糖酶的热稳定性,也可在基因工程和基因功能研究中用于提高目标基因的性能,但这种方法一般针对某一特定序列,在不同序列之间无法通用。因此利用序列编辑的方法提高某一特定序列的性能仍十分必要。此外,目前多数研究针对酶的单方面性能(如耐热或耐碱),兼顾耐热与耐碱特性酶的构建仍较少。
4.中国专利文献cn105505806a(申请号:201610046663.6)公开了一种木聚糖酶杂合酶工程菌株的构建方法。通过n-端替换将xynzf-2的n-端48个氨基酸替换成木聚糖酶evxyn11n-端的34个氨基酸,并引入芳香族氨基酸p9y和h14f,进而在xynzf-2酶c端继续引入二硫键cys38-cys191、α-螺旋及cord区域分别引入疏水性氨基酸k164m、g166a、n160i以及v111a、g109a,最后引入糖基化修饰位点e42n和f17s,构建多位点突变杂合酶xynzl,期望杂合酶xynzl的热稳定性有所改善;该文献中记载的构建木聚糖杂合酶工程菌的方法复杂,并且仅涉及耐热单方面性能的改善。
技术实现要素:
5.针对现有技术的不足,本发明提供了一种耐热耐碱木聚糖酶及应用。
6.发明人发现将木聚糖酶基因cfxyl3的n端编码前48个氨基酸的144个碱基进行替换,进行替换的153个碱基来自于syxyn11p的n端前51个氨基酸。本发明改造后的木聚糖酶基因cfxyl3耐热能力显著提高,其最适ph值由7.0提高到了8.0。
7.本发明技术方案如下:
8.一种木聚糖酶cfxyl3-syxyn11p编码基因的核苷酸序列如seq id no.1所示。
9.一种木聚糖酶cfxyl3-syxyn11p的氨基酸序列如seq id no.2所示。
10.一种重组载体,包含上述木聚糖酶cfxyl3-syxyn11p编码基因的核苷酸序列,如seq id no.1所示。
11.一种重组菌,包含上述木聚糖酶cfxyl3-syxyn11p编码基因的核苷酸序列,如seq id no.1所示。
12.根据本发明优选的,一种大肠杆菌工程菌,包含上述木聚糖酶cfxyl3-syxyn11p编码基因的核苷酸序列,如seq id no.1所示。
13.一种含木聚糖酶cfxyl3-syxyn11p编码基因的大肠杆菌工程菌的构建方法,包括如下步骤:
14.(1)通过反向pcr扩增cfxyl3基因片段,其核苷酸序列如seq id no.3所示;
15.(2)通过反向pcr扩增syxyn11p基因片段,其核苷酸序列如seq id no.4所示;
16.(3)将步骤(1)中制得的cfxyl3基因片段与步骤(2)制得的syxyn11p基因片段进行无缝克隆连接,制得融合片段cfxyl3-syxyn11p,再将融合片段cfxyl3-syxyn11p插入pet-28a(+)载体,得到重组质粒pet-28a(+)-cfxyl3-syxyn11p;
17.(4)制备大肠杆菌bl21(de3)感受态细胞,将步骤(3)制得的重组质粒pet-28a(+)-cfxyl3-syxyn11p转化大肠杆菌bl21(de3)感受态细胞,获得转化子,筛选阳性克隆,即得含木聚糖酶cfxyl3-syxyn11p编码基因的大肠杆菌工程菌。
18.根据本发明优选的,所述步骤(1)中,反向pcr扩增以cfxyl3基因片段为模板,扩增引物的核苷酸序列如下:
19.f1:ggtaagggttggagcacgg seq id no.5;
20.r1:catggtatatctccttcttaaagttaaaca seq id no.6。
21.进一步优选的,所述步骤(1)中,pcr扩增的反应体系如下,总体系为50μl:
[0022][0023]
pcr扩增程序如下:
[0024]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸30sec,30个循环;72℃延伸10min,4℃保存。
[0025]
根据本发明优选的,所述步骤(2)中,反向pcr扩增模板为syxyn11p基因片段;扩增引物的核苷酸序列如下:
[0026]
f2:taagaaggagatataccatgaatgctcagacatgtctaacttcacc seq id no.7;
[0027]
r2:cccgtgctccaacccttaccaccaacccagttgttgatgcc seq id no.8。
[0028]
进一步优选的,所述步骤(2)中,pcr扩增的反应体系如下,总体系为50μl:
[0029][0030]
所述的pcr扩增程序如下:
[0031]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸3min,30个循环;72℃延伸10min,4℃保存。
[0032]
根据本发明优选的,所述步骤(3)中,无缝克隆pcr扩增体系如下,总体系为20μl:
[0033][0034]
所述的无缝克隆程序如下:
[0035]
37℃反应30min,4℃保存。
[0036]
根据本发明优选的,所述步骤(4)中,筛选阳性克隆的方法为,将转化子37℃,200r/min培养1h,随后将转化细胞涂布在含有50μg/ml卡那霉素的lb平板上,37℃恒温过夜培养,挑取单菌落接种至含有50μg/ml卡那霉素的lb液体培养基中,待菌液浑浊后通过菌落pcr验证,得到目的基因条带的阳性克隆子,然后测序,保留测序结果正确的菌株作为目的表达菌株。
[0037]
上述大肠杆菌工程菌或上述方法构建得的大肠杆菌工程菌在生产木聚糖酶中的应用。
[0038]
有益效果
[0039]
本发明提供一种木聚糖酶cfxyl3-syxyn11p编码基因的核苷酸序列如seq id no.1所示,氨基酸序列如seq id no.2所示;本发明提供的木聚糖酶cfxyl3-syxyn11p与原始酶cfxyl3相比,最适温度由50℃提高至85℃,耐热能力显著提高,最适ph值由7.0提高到了8.0,其耐碱能力有一定提高。本发明提供的木聚糖酶cfxyl3-syxyn11p拓宽了木聚糖酶cfxyl3的应用范围,在制浆、造纸、纺织、饲料等领域具有广泛的应用前景。
附图说明
[0040]
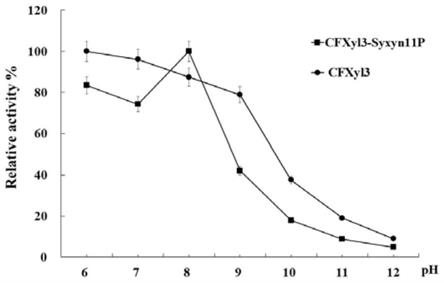
图1为实施例4中不同ph值条件下酶活检测结果图。
[0041]
图2为实施例4中不同温度条件下酶活检测结果图。
[0042]
图3为对比例1中不同ph值条件下酶活检测结果图。
[0043]
图4为对比例1中不同温度条件下酶活检测结果图。
[0044]
图5为对比例2中不同ph值条件下酶活检测结果图。
[0045]
图6为对比例2中不同温度条件下酶活检测结果图。
具体实施方式
[0046]
下面结合实施例对本发明的技术方案做进一步阐述,但本发明所保护范围不限于此。
[0047]
实施例中未详加说明的均按本领域现有技术。
[0048]
实施例1
[0049]
木聚糖酶cfxyl3-syxyn11p基因构建
[0050]
(i)以pet-28a(+)-cfxyl3的dna为模板,进行pcr扩增,得到替换基因模板;
[0051]
所述的pcr引物序列如下:
[0052]
f1:ggtaagggttggagcacgg seq id no.5;
[0053]
r1:catggtatatctccttcttaaagttaaaca seq id no.6;
[0054]
所述的pcr扩增体系见表1:
[0055]
表1
[0056][0057]
所述的pcr扩增程序如下:
[0058]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸30sec,30个循环;72℃延伸10min,4℃保存;
[0059]
琼脂糖凝胶电泳检验pcr产物,长度为约6000bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0060]
(ii)以pet-28a(+)-syxyn11p的dna为模板,进行pcr扩增,得到替换基因片段;
[0061]
所述的pcr引物序列如下:
[0062]
f2:taagaaggagatataccatgaatgctcagacatgtctaacttcacc seq id no.7;
[0063]
r2:cccgtgctccaacccttaccaccaacccagttgttgatgcc seq id no.8;
[0064]
所述的pcr扩增体系见表2:
[0065]
表2
[0066]
[0067]
所述的pcr扩增程序如下:
[0068]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸30sec,30个循环;72℃延伸10min,4℃保存;
[0069]
琼脂糖凝胶电泳检验pcr产物,长度为约150bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0070]
(iii)将步骤(i)制得的cfxyl3片段与步骤(ii)制得的syxyn11p片段进行无缝克隆,制得cfxyl3-syxyn11p基因序列如seq id no.1所示,其氨基酸序列如seq id no.2所示;
[0071]
所述的无缝克隆的扩增体系见表3:
[0072]
表3
[0073][0074]
所述的无缝克隆程序如下:
[0075]
37℃反应30min,4℃保存;
[0076]
琼脂糖凝胶电泳检验pcr产物,长度为6154bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用。
[0077]
实施例2
[0078]
制备大肠杆菌感受态
[0079]
(i)挑取大肠杆菌(escherichia coli)bl21(de3)单菌落接种至lb培养基中,200r/min、37℃培养过夜;
[0080]
(ii)吸取0.1ml菌液至10ml的lb培养基中,300r/min、37℃培养至od
600
达0.6~0.8;
[0081]
(iii)吸取1mlod
600
达0.6~0.8的菌液至1.5ml无菌离心管中,12000r/min离心2min,彻底去除上清;
[0082]
(iv)加入100μl冰预冷的sscs(一步法快速制备感受态细胞试剂盒,上海生工生物工程公司产品),轻悬菌体即制成感受态细胞。
[0083]
(v)将制备好的感受态细胞分装100μl每管,-80℃保存,备用。
[0084]
实施例3
[0085]
cfxyl3-syxyn11p基因化学转化大肠杆菌(escherichia coli)bl21(de3)
[0086]
首先利用核酸超微量分光光度计测定cfxyl3-syxyn11p片段浓度,达到300μg/ml浓度后,进行化学转化,得到的细胞使用复苏培养基37℃复苏培养1h后,取100μl涂布在含50μg/ml卡纳霉素的lb固体培养基上,在37℃过夜培养,筛选具有卡纳霉素抗性的阳性重组菌落。
[0087]
液体复苏培养基,每升组分如下:
[0088]
蛋白胨10g、酵母粉5g、氯化钠10g、山梨醇91g、甘露醇69.4g,余量水。
[0089]
阳性重组菌的培养及鉴定
[0090]
挑取上述阳性重组菌落,接种到含50μg/ml卡纳霉素抗性的液体lb培养基中37℃培养过夜,培养完成后,使用上海生物工程有限公司提供的试剂盒提取重组菌dna,并以获得的基因组为模板,f1和r2为引物进行pcr扩增,扩增产物利用琼脂糖凝胶电泳进行验证;
[0091]
所述的pcr引物序列如下:
[0092]
f1:ggtaagggttggagcacgg seq id no.5;
[0093]
r2:cccgtgctccaacccttaccaccaacccagttgttgatgcc seq id no.8;
[0094]
所述的pcr扩增体系为20μl,见表4:
[0095]
表4
[0096][0097]
所述的pcr扩增程序如下:
[0098]
95℃预变性5min;94℃变性30sec,57℃退火30sec,72℃延伸4min,30个循环;72℃延伸10min,4℃保存;
[0099]
琼脂糖凝胶电泳检验pcr产物,结果显示,使用引物f1和r2能够扩增出一条特异性基因条带,约为6100bp,与理论值6154bp接近,表明包含目的基因的载体已成功转入到大肠杆菌细胞内,制得木聚糖酶cfxyl3-syxyn11p基因的大肠杆菌工程菌。
[0100]
实施例4
[0101]
实施例3制备的大肠杆菌工程菌发酵测试
[0102]
将制备的含有木聚糖酶cfxyl3-syxyn11p基因的大肠杆菌工程菌接种至100ml lb培养基(蛋白胨10g/l,酵母膏5g/l,nacl 10g/l,余量水)中200rpm 37℃下培养至发酵液od
600
在0.7,再加入iptg诱导22h,取样。参考qb/t4483-2013碱性木聚糖酶酶活测定方法,样品处理后通过3,5-二硝基水杨酸(dns)法检测发酵液中木聚糖酶最适酸碱度,在55℃,ph6.0-12.0的条件下分别与底物木聚糖反应30min后,沸水浴5min停止反应,紫外分光光度计562nm处测定吸光度值,检测结果见图1。通过3,5-二硝基水杨酸(dns)法检测发酵液中木聚糖酶的最适温度,在ph9.0,温度55℃-90℃(梯度为5℃)的条件下分别与底物木聚糖反应30min后,沸水浴5min停止反应,紫外分光光度计562nm处测定吸光度值,检测结果见图2。
[0103]
与原始酶cfxyl3(最适温度为50℃,最适ph为7.0,在ph6.0~9.0下较稳定)相比,重组后的cfxyl3-syxyn11p基因大肠杆菌工程菌发酵液中木聚糖酶的最适温度可以达到85℃,与原始酶cfxyl3相比提高了35℃,在ph6.0~9.0下较稳定,最适ph值由7.0提高至8.0;在55℃,ph=9时,与底物木聚糖反应30min,木聚糖酶cfxyl3-syxyn11p的比活力为80.90u/
mg,原始酶cfxyl3的比活力为79.36u/mg。
[0104]
对比例1
[0105]
木聚糖酶cfxyl3-syxyn11p-1基因的构建及发酵测试
[0106]
(i)提取大肠杆菌(escherichia coli)bl21(de3)的pet-28a(+)-cfxyl3质粒dna,以该基因组dna为模板,进行pcr扩增,得到替换基因模板;
[0107]
所述的pcr引物序列如下:
[0108]
f1-1:tggcgtaatacgggcaactt seq id no.9;
[0109]
r1-1:catggtatatctccttcttaaagttaaaca seq id no.10;
[0110]
所述的pcr扩增体系,见表5:
[0111]
表5
[0112][0113][0114]
所述的pcr扩增程序如下:
[0115]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸30sec,30个循环;72℃延伸10min,4℃保存;
[0116]
琼脂糖凝胶电泳检验pcr产物,长度为约6000bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0117]
(ii)提取大肠杆菌(escherichia coli)bl21(de3)的pet-28a(+)-syxyn11p质粒dna,以该基因组dna为模板,进行pcr扩增,得到替换基因片段;
[0118]
所述的pcr引物序列如下:
[0119]
f2-1:taagaaggagatataccatgaatgctcagacatgtctaacttcacc seq id no.11;
[0120]
r2-1:aagttgcccgtattacgccaattgctggtataacggccacc seq id no.12;
[0121]
所述的pcr扩增体系,见表6:
[0122]
表6
[0123][0124]
所述的pcr扩增程序如下:
[0125]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸30sec,30个循环;72℃延伸10min,4℃保存;
[0126]
琼脂糖凝胶电泳检验pcr产物,长度为约150bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0127]
(iii)将步骤(i)制得的cfxyl3片段与步骤(ii)制得的syxyn11p片段进行无缝克隆,制得cfxyl3-syxyn11p-1基因序列seq id no.13,其氨基酸序列如seq id no.14所示;
[0128]
所述的无缝克隆的扩增体系,见表7:
[0129]
表7
[0130][0131][0132]
所述的无缝克隆程序如下:
[0133]
37℃反应30min,4℃保存;
[0134]
琼脂糖凝胶电泳检验pcr产物,长度为6154bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0135]
参照实施例3的方法,制备含有耐热耐碱木聚糖酶cfxyl3-syxyn11p-1基因的大肠杆菌工程菌,将制备的含有耐热耐碱木聚糖酶cfxyl3-syxyn11p-1基因的大肠杆菌工程菌接种至100ml lb培养基(蛋白胨10g/l,酵母膏5g/l,nacl 10g/l,余量水)中200rpm、37℃下培养至发酵液od
600
=0.7时,再加入iptg诱导22h,取样。参考qb/t4483-2013碱性木聚糖酶酶活测定方法,样品处理后通过3,5-二硝基水杨酸(dns)法检测发酵液中木聚糖酶最适酸碱度,在55℃,ph6.0-12.0的条件下分别与底物木聚糖反应30min后,沸水浴5min停止反应,紫外分光光度计562nm处测定吸光度值,检测结果见图3。通过3,5-二硝基水杨酸(dns)法检测发酵液中木聚糖酶的最适温度,在ph9.0,温度55℃-90℃(梯度为5℃)的条件下分别与底物木聚糖反应30min后,沸水浴5min停止反应,紫外分光光度计562nm处测定吸光度值,检测结果见图4。
[0136]
与原始酶cfxyl3(最适温度为50℃,最适ph为7.0,在ph6.0~9.0下较稳定)相比,重组后的cfxyl3-syxyn11p-1基因大肠杆菌工程菌发酵液中木聚糖酶的最适温度可以达到60℃,与原始酶cfxyl3相比提高了10℃,最适ph为8.0,在ph6.0~9.0下较稳定。在55℃,ph=9,与底物木聚糖反应30min,木聚糖酶cfxyl3-syxyn11p-1的比活力为14.44u/mg,原始酶cfxyl3的比活力为79.36u/mg。
[0137]
对比例2
[0138]
木聚糖酶cfxyl3-syxyn11p-2基因的构建及发酵测试
[0139]
(i)提取大肠杆菌(escherichia coli)bl21(de3)的pet-28a(+)-cfxyl3质粒dna,以该基因组dna为模板,进行pcr扩增,得到替换基因模板;
[0140]
所述的pcr引物序列如下:
[0141]
f1-2:aactttgttattggtaagggttgga seq id no.15;
[0142]
r1-2:catggtatatctccttcttaaagttaaaca seq id no.16;
[0143]
所述的pcr扩增体系,见表8:
[0144]
表8
[0145][0146][0147]
所述的pcr扩增程序如下:
[0148]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸30sec,30个循环;72℃延伸10min,4℃保存;
[0149]
琼脂糖凝胶电泳检验pcr产物,长度为约6000bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0150]
(ii)提取大肠杆菌(escherichia coli)bl21(de3)的pet-28a(+)-syxyn11p质粒dna,以该基因组dna为模板,进行pcr扩增,得到替换基因片段;
[0151]
所述的pcr引物序列如下:
[0152]
f2-2:taagaaggagatataccatgaatgctcagacatgtctaacttcacc seq id no.17;
[0153]
r2-2:cccttaccaataacaaagttgttgatgccgctccaattgc seq id no.18;
[0154]
所述的pcr扩增体系,见表9:
[0155]
表9
[0156][0157]
所述的pcr扩增程序如下:
[0158]
95℃预变性5min;94℃变性30sec,55℃退火30sec,72℃延伸30sec,30个循环;72℃延伸10min,4℃保存;
[0159]
琼脂糖凝胶电泳检验pcr产物,长度为约150bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0160]
(iii)将步骤(i)制得的cfxyl3片段与步骤(ii)制得的syxyn11p片段进行无缝克
隆,制得cfxyl3-syxyn11p-2基因序列seq id no.19,其氨基酸序列如seq id no.20所示;
[0161]
所述的无缝克隆的扩增体系,见表10:
[0162]
表10
[0163][0164][0165]
所述的无缝克隆程序如下:
[0166]
37℃反应30min,4℃保存;
[0167]
琼脂糖凝胶电泳检验pcr产物,长度为6154bp,使用sanprep柱式dna胶回收试剂盒(上海生工)进行胶回收,回收产物-20℃保存,备用;
[0168]
参照实施例3的方法,制备含有耐热耐碱木聚糖酶cfxyl3-syxyn11p-2基因的大肠杆菌工程菌,将制备的含有耐热耐碱木聚糖酶cfxyl3-syxyn11p-2基因的大肠杆菌工程菌接种至100ml lb培养基(蛋白胨10g/l,酵母膏5g/l,nacl 10g/l)中200rpm 37℃下培养至发酵液od
600
=0.7时,再加入iptg诱导22h,取样,参考qb/t4483-2013碱性木聚糖酶酶活测定方法,样品处理后通过3,5-二硝基水杨酸(dns)法检测发酵液中木聚糖酶最适酸碱度,在55℃,ph6.0-12.0的条件下分别与底物木聚糖反应30min后,沸水浴5min停止反应,紫外分光光度计562nm处测定吸光度值,检测结果见图5。通过3,5-二硝基水杨酸(dns)法检测发酵液中木聚糖酶的最适温度,在ph9.0,温度55℃-90℃(梯度为5℃)的条件下分别与底物木聚糖反应30min后,沸水浴5min停止反应,紫外分光光度计562nm处测定吸光度值,检测结果见图6。
[0169]
与原始酶cfxyl3(最适温度为50℃,最适ph为7.0,在ph6.0~9.0下较稳定)相比,重组后的cfxyl3-syxyn11p-2基因大肠杆菌工程菌发酵液中木聚糖酶的最适温度可以达到65℃,与原始酶cfxyl3相比提高了15℃,最适ph为8.0,在ph6.0~9.0下较稳定。在55℃,ph=9,与底物木聚糖反应30min,木聚糖酶cfxyl3-syxyn11p-2的比活力为29.09u/mg,原始酶cfxyl3的比活力为79.36u/mg。
[0170]
综上,对比例1中木聚糖酶cfxyl3-syxyn11p-1与对比例2中木聚糖酶cfxyl3-syxyn11p-2是分别选取了耐热木聚糖酶syxyn11p的n端前42个氨基酸和前47个氨基酸来替换木聚糖酶cfxyl3的前39个氨基酸和前44个氨基酸,本发明所保护的重组基因序列cfxyl3-syxyn11p是采用耐热木聚糖酶syxyn11p的n端前51个氨基酸来替换木聚糖酶cfxyl3的前48个氨基酸。
[0171]
对比例1中木聚糖酶cfxyl3-syxyn11p-1与原始酶cfxyl3相比,最适ph值由7.0提高至8.0,最适温度由50℃提高至60℃;木聚糖酶cfxyl3-syxyn11p-1的比活力显著低于原始酶cfxyl3的比活力,见表11。
[0172]
对比例2中木聚糖酶cfxyl3-syxyn11p-2与原始酶cfxyl3相比,最适ph值由7.0提
高至8.0,最适温度由50℃提高至65℃;木聚糖酶cfxyl3-syxyn11p-1的比活力显著低于原始酶cfxyl3的比活力,见表11。
[0173]
本发明所保护的木聚糖酶cfxyl3-syxyn11p与原始酶cfxyl3相比,最适ph值由7.0提高至8.0,最适温度由50℃提高至85℃;木聚糖酶cfxyl3-syxyn11p的比活力与原始酶cfxyl3的比活力几乎相同,见表11。
[0174]
表11
[0175]
木聚糖酶名称最适温度(℃)最适ph比活力(u/mg)n端替换氨基酸数量cfxyl350℃7.079.36-cfxyl3-syxyn11p85℃8.080.9051cfxyl3-syxyn11p-160℃8.014.4442cfxyl3-syxyn11p-265℃8.029.0947
[0176]
由表11可以看出,重组木聚糖酶的比活力、耐热性、耐碱性的变化与n端替换氨基酸片段的长度没有直接关系,即重组木聚糖酶的特性与n端替换氨基酸的数量二者之间的变化没有规律性。
[0177]
本发明提供的重组木聚糖酶cfxyl3-syxyn11p与原始酶cfxyl3相比,木聚糖酶cfxyl3-syxyn11p的比活力与原始酶cfxyl3的比活力几乎相同,最适ph由7.0提高到8.0,最适温度由50℃提高至85℃,耐碱性提高,耐热性提升明显;而对比例1、对比例2涉及的重组木聚糖酶热性的提升不明显,比活力明显低于原始酶cfxyl3。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1