嘧啶杂环化合物及其制备方法和应用与流程
1.本发明涉及某些卤代杂环化合物或其药学上可接受的盐、前药或溶剂化物,其可用于治疗或预防由某些变异形态的表皮生长因子受体(例如l858r激活突变体、exon19缺失激活突变体、和t790m抗性突变体、1个或多个外显子20突变的egfr)所介导疾病或病况。具体而言,所述化合物或其药学上可接受的盐、前药或溶剂化物可用于治疗或预防多种不同的相关的癌症。本发明还涉及包含所述化合物或其药学上可接受的盐、前药或溶剂化物的药物组合物、制备所述化合物的的中间体,以及使用所述化合物或其药学上可接受的盐、前药或溶剂化物治疗各种不同形式的egfr介导的疾病的方法。
背景技术:
2.egfr是erbb受体家族的跨膜蛋白酪氨酸激酶成员。当与生长因子配体(例如表皮生长因子(egf))结合时,受体可以与其他的egfr分子发生同源二聚,或者与另一家族成员(例如erbb2(her2)、erbb3(her3)、或者erbb4(her4))发生异源二聚。
3.erbb受体的同源二聚和/或异源二聚导致胞内域中关键酪氨酸残基的磷酸化,并且导致对参与细胞增殖和生存的许多细胞内信号传导通路的刺激。erbb家族信号传导的失调促进增殖、侵入、转移、血管生成和肿瘤细胞生存,并且已在许多人类癌症(包括肺癌、头颈部癌和乳腺癌)中得到描述。
4.因此,erbb家族代表了抗癌药物开发的合理靶点。目前,临床上存在多种靶向egfr或erbb2的药物,包括吉非替尼(iressa
tm
)、厄洛替尼(tarceva
tm
)、拉帕替尼(tykerb
tm
,tyverb
tm
)。new england journal of medicine(2008)第358期,1160-74和biochemical and biophysical research communication(2004)vol.319,1-11详细论述了对erbb受体信号传导及其在肿瘤发生中的参与。
5.science[2004]第304期,1497-500和new england journal of medicine[2004]第350期,2129-39报道了,在非小细胞肺癌(nsclc)中egfr的激活突变与对吉非替尼治疗的反应有关。与野生型(wt)egfr相比,最普遍的egfr激活突变(l858r和dele746_a750)导致对小分子酪氨酸激酶抑制剂(如吉非替尼和厄洛替尼)的亲和力增加,以及对上磷酸腺苷(atp)亲和力下降。最终,产生了对吉非替尼或厄洛替尼治疗的获得性抗性,例如据报道在50%的临床耐药性患者中检测到看门基因残基t790m的突变,该突变被认为不在空间上阻碍吉非替尼或厄洛替尼与egfr的结合,仅将对atp的亲和力改变到相当于wt egfr的水平。
[0006]
鉴于这种突变在靶向egfr的现有疗法的抗性中的重要性,我们认为可以抑制包含看门基因突变的egfr的药物在癌症的治疗中特别有用。
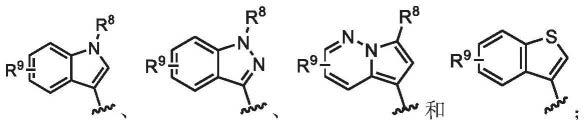
[0007]
相对于激活突变体形式的egfr(例如l858r egfr突变体、或者dele746_a750突变体或exon19缺失egfr突变体)和/或抗性突变体形式的egfr(例如t790m egfr突变体),对于可表现出对wt egfr的有利效能特性和/或相对其它酶受体的选择性化合物仍然存在着需求,所述选择性使得这些化合物特别有希望被开发成治疗剂。因此,需要对于对某些激活或抗性突变体形式的egfr显示较高的抑制同时对wt egfr显示相对较低的抑制的化合物。已
经知道,对野生型egfr抑制,造成了严重的皮疹和/或腹泻等病理学特征。为了减少与野生型egfr抑制相关的毒理学特征,预期这种具有所述选择性的化合物可以更适于用作治疗剂,特别是用于癌症治疗。
[0008]
本发明的发明人发现,一种或多种卤代杂环化合物对若干egfr突变体形式具有高效能,同时显示对wtegfr相对较低的抑制。与其它已知的egfr/egfr突变体抑制剂相比,本发明的化合物对某些egfr突变体呈现出选择性并且也显示有利的物理性质(例如,较高的水溶解度、渗透性和/或较低的血浆蛋白结合)和/或有利的毒性特征(例如降低的herg阻断倾向)和/或有利的代谢特征。因此,本发明的化合物尤其而可用于预防或治疗例如癌症治疗中牵连有egfr和/或egfr的激活突变和/或egfr的抗性突变的疾病状况。
技术实现要素:
[0009]
一方面,本发明提供式(i)的化合物或其药学上可接受的盐、前药或溶剂化物,
[0010][0011]
其中
[0012]
r1选自:氢、氘、卤素、未取代的或取代的c
1-6
烷基、-nr6r7、硝基、氰基、-or6、-c(o)or6、-c(o)r6、-c(o)nr6r7、-s(o)
t-r6和-s(o)
2-nr6r7,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0013]
r2选自:卤素、c
1-6
烷基、卤素取代的c
1-6
烷基、-s(o)
t-r6和-or
13
;
[0014]
r3选自:未取代的或取代的c
1-6
烷基、未取代的或取代的芳基、未取代的或取代的杂芳基、未取代的或取代的杂环基、-or6、-nr6r7、-c(o)nr6r7、-c(o)r6和-s(o)
t-r6,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0015]
r4和r5独立地选自:氢、未取代的或取代的c
1-6
烷基、-c(o)r6和-s(o)
t-r6,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0016]r13
选自卤素取代或未取代的c
1-6
烷基;
[0017]
g选自以下基团:
[0018]
其中r8选自:氢、氘、取代或未取代的c
1-6
烷基、取代或未取代的c
3-6
环烷基、-c(o)r6和-s(o)
t-r6;以及r9选自:氢、卤素、取代或未取代的烷基、-or6和-s(o)
t-r6,其中所述取代
基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0019]
t为0、1或2;
[0020]
或者,r4和r9一起形成二价基团,所述二价基团与所连接的氮原子和苯环一起形成大环基团,其中所述二价基团选自取代的或未取代的二价烷基、取代的或未取代的二价烯基、取代的或未取代的二价炔基和取代的或未取代的二价环烷基,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0021]
r6和r7独立地选自:氢、取代的或未取代的c
1-6
烷基、取代的或未取代的c
3-6
环烷基、取代的或未取代的c
2-6
烯基、取代的或未取代的芳基、取代的或未取代的杂芳基、取代的或未取代的杂环基、取代的或未取代的烷氧基、取代的或未取代的芳氧基、取代或未取代的氨基和卤素,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0022]
条件是:当g为且r4与r9没有形成二价基团时,r2不是-or
13
,其中r
13
选自卤素取代或未取代的c
1-6
烷基。
[0023]
在一些实施方案中,本发明提供式(i)化合物,其中g为以及r2选自:卤素、卤素取代的c
1-6
烷基和-s(o)
t-r6,其余变量如对式(i)所定义。在该实施方案中,所述式(i)化合物对应为式(i-1)化合物:
[0024][0025]
其中,
[0026]
r1选自:氢、氘、卤素、未取代的或取代的c
1-6
烷基、-nr6r7、硝基、氰基、-or6、-c(o)or6、-c(o)r6、-c(o)nr6r7、-s(o)
t-r6和-s(o)
2-nr6r7,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0027]
r2选自:卤素、c
1-6
烷基、卤素取代的c
1-6
烷基和-s(o)
t-r6;
[0028]
r3选自:未取代的或取代的c
1-6
烷基、未取代的或取代的芳基、未取代的或取代的杂芳基、未取代的或取代的杂环基、-or6、-nr6r7、-c(o)nr6r7、c(o)r6和-s(o)
t-r6,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0029]
r4和r5独立地选自:氢、未取代的或取代的c
1-6
烷基、-c(o)r6和-s(o)
t-r6,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0030]r13
选自卤素取代或未取代的c
1-6
烷基;
[0031]
r8选自:氢、氘、取代或未取代的c
1-6
烷基、取代或未取代的c
3-6
环烷基、-c(o)r6和-s(o)
t-r6;以及r9选自:氢、卤素、取代或未取代的烷基、-or6和-s(o)
t-r6;
[0032]
t为0、1或2;
[0033]
r6和r7独立地选自:氢、取代的或未取代的c
1-6
烷基、取代的或未取代的c
3-6
环烷基、取代的或未取代的c
2-6
烯基、取代的或未取代的芳基、取代的或未取代的杂芳基、取代的或未取代的杂环基、取代的或未取代的烷氧基、取代的或未取代的芳氧基、取代或未取代的氨基和卤素,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基。
[0034]
在优选实施方案中,r2选自:氯、溴、三氟甲基、甲硫基和-s(o)ch3。
[0035]
在优选的实施方案中,r8选自:氢、氘、取代或未取代的c
1-3
的烷基、取代或未取代的c
3-5
的环烷基和-s(o)
2-r6,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基;
[0036]
其中r6选自:取代或未取代的c
1-6
的烷基、取代或未取代的c
3-6
的环烷基,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基。
[0037]
在进一步优选的实施方案中,r8选自:氢、卤素取代或未取代的c
1-3
烷基(例如,甲基、乙基、异丙基或正丙基)、取代或未取代的c
3-5
的环烷基和-s(o)
2-r6,其中r6选自:取代或未取代的c
1-3
的烷基和取代或未取代的环丙基。
[0038]
在更进一步优选的实施方案中,r8选自:-ch3、-ch2cf3、环丙基、异丙基和甲磺酰基;
[0039]
在优选的实施方案中,r9选自:氢、卤素、取代或未取代的c
1-6
的烷基、-or6和-s(o)
2-r6,其中r6为取代或未取代的c
1-6
的烷基,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基。
[0040]
在进一步优选的实施方案中,r9选自:氢、卤素和卤素取代或未取代的c
1-3
烷基(例如,甲基、乙基、异丙基、正丙基)。
[0041]
在进一步优选的实施方案中,r9选自:氢、氟、-ch3、-cf3和-ch2cf3。
[0042]
在一些实施方案中,本发明提供式(i)化合物,其中g为其中r8选自:氢、氘、取代或未取代的c
1-6
烷基、取代或未取代的c
3-6
环烷基、-c(o)r6和-s(o)
t-r6,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基。
[0043]
在优选的实施方案中,r8选自:-ch3、-ch2cf3、环丙基、异丙基和甲磺酰基。
[0044]
在进一步优选的实施方案中,r8选自:-ch3、-ch2cf3和环丙基。
[0045]
在一些实施方案中,本发明提供式(i)化合物,其中r3选自:-nr6r7、-or6、-c(o)nr6r7、-c(o)r6和-s(o)
t-r6,其中r6和r7如式(i)所定义。在优选的实施方案中,r6选自:取代的或未取代的c
1-3
烷基、取代或未取代的氨基和卤素,其中所述取代基选自卤素、-ora和-nrara,其中所述ra和rb各自独立选自氢和c
1-3
烷基;r7独立选自:h、c
1-3
的烷基和卤素取代的c
1-3
的烷基。在优选的实施方案中,r3选自:-nr6r7和-or6,其中r6为取代的或未取代的c
1-3
烷基,其中所述取代基选自卤素、-ora和-nrara,其中所述ra和rb各自独立选自氢和c
1-3
烷基;r7独立选自:h、c
1-3
的烷基和卤素取代的c
1-3
的烷基。在进一步优选的实施方案中,r3选自-nh(ch3)ch2ch2n(ch3)2和-och2ch2n(ch3)2。在优选的实施方案中,r3选自:-nr6r7和-or6,r7独立选自:h、c
1-3
的烷基和卤素取代的c
1-3
的烷基;以及r2选自:卤素、卤素取代的c
1-6
烷基和-s(o)
t-r6,其中r6为取代的或未取代的c
1-3
烷基,其中所述取代基选自卤素、-ora和-nrara,其中所述ra和rb各自独立选自氢和c
1-3
烷基。
[0046]
在一些实施方案中,本发明提供式(i)化合物,其中r1选自:氢、氘、卤素、氟取代或未取代的c
1-3
烷基、硝基、氰基和-c(o)or6。在优选的实施方案中,r1选自:氢、氘、卤素、氰基、-c(o)or6、甲基和三氟甲基。在进一步优选的实施方案中,r1选自:氢、氯、氰基、-c(o)or6和三氟甲基,其中r6选自:甲基、乙基、异丙基、氟取代的异丙基、c
3-6
环烷基。在更进一步优选的实施方案中,r1选自:氢、氟、
[0047]
在一些实施方案中,本发明提供式(i)化合物,其中r4和r5独立地选自:氢、未取代的或取代的c
1-3
烷基、-c(o)r6和-s(o)
2-r6,其中r6选自:氢、取代的或未取代的c
1-3
烷基、取代的或未取代的c
3-6
环烷基和取代的或未取代的c
2-3
烯基。在优选的实施方案中,r4和r5独立地选自:氢、甲基、-c(o)r6和-s(o)
2-r6,其中r6选自:c
2-4
烯基和c
3-6
环烷基,优选为乙烯基、氟乙烯基、甲基乙烯基、2-(二甲氨基)乙基、2-(二乙氨基)乙基和环丙基。在优选的实施方案中,r4为氢,r5为-c(o)r6,其中r6选自:c
2-4
烯基和c
3-6
环烷基,优选为乙烯基、氟乙烯基、甲基乙烯基、2-(二甲氨基)乙基、2-(二乙氨基)乙基和环丙基。在进一步优选的实施方案中,r4为氢,以及r5选自:丙烯酰基、2-氟丙烯酰基、3-(二甲基氨基)丙酰基和环丙烷甲酰基。
[0048]
在一些实施方案中,本发明提供式(i)化合物,其中r4和r9一起形成二价基团,所述二价基团与所连接的氮原子和苯环一起形成大环基团,其中所述二价基团选自取代的或未取代的二价烷基、取代的或未取代的二价烯基、取代的或未取代的二价炔基和取代的或未取代的二价环烷基,其中所述取代基选自卤素、硝基、氰基、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基、杂环基、-ora、-c(o)ora、-c(o)ra、-c(o)nrarb和-nrara,其中所述ra和rb各自独立选自氢、c
1-6
烷基、c
2-6
烯基、c
2-6
炔基、c
3-6
环烷基、芳基、杂芳基和杂环基。在优选的实施方案中,r4和r9一起形成二价基团,所述二价基团与所连接的氮原子和苯环一起形成大环基团,其中所述二价基团选自取代的或未取代的二价烷基。在进一步优选的实施方案中,r4和r9一起形成二价基团,所述二价基团与所连接的氮原子和苯环一起形成大环基团,其中所述二价基团选自未取代的二价c
3-4
烷基。在该实施方案中,所述化合物对应于式(ii-1)化合物,
[0049][0050]
n为1或2;
[0051]
r3选自:-or6、-nr6r7、-c(o)nr6r7、-sor6和-so2r6,其余变量如对式(i)所定义。
[0052]
在一些实施方案中,本发明提供以下化合物或其药学上可接受的盐、前药或溶剂化物,其中所述化合物选自:
[0053]
[0054][0055]
另一方面,本发明提供了式(i)化合物的制备方法,例如:
丁基、3-甲基-2-丁基、3-甲基-1-丁基、2-甲基-1-丁基、1-己基、2-己基、3-己基、2-甲基-2-戊基、3-甲基-2-戊基、4-甲基-2-戊基、3-甲基-3-戊基、2-甲基-3-戊基、2,3-二甲基-2-丁基和3,3-二甲基-2-丁基。所述烷基基团可以任选地富含氘,如-cd3、-cd2cd3等。
[0068]
术语“卤素”是指氟f、氯cl、溴br和碘i。
[0069]
术语“卤代烷基”是指其中一个或多个氢被一个或多个卤素原子(如氟、氯、溴和碘)取代的烷基。卤代烷基的例子包括卤代c
1-8
烷基、卤代c
1-6
烷基或卤代c
1-4
烷基,但不限于-cf3、-ch2cl、-ch2cf3、-ccl2、cf3等。
[0070]
术语“烯基”是指选自直链的和支链的烃基的烃基,其包含至少一个c=c双键和2至8个(如2至6个,进一步如2至4个)碳原子。烯基(例如,c
2-6
烯基)的例子包括但不限于次乙基或乙烯基、丙-1-烯基、丙-2-烯基、2-甲基丙-1-烯基、丁-1-烯基、丁-2-烯基、丁-3-烯基、丁-1,3-二烯基、2-甲基丁-1,3-二烯基、己-1-烯基、己-2-烯基、己-3-烯基、己-4-烯基和己-1,3-二烯基。
[0071]
术语“炔基”是指选自直链的和支链的烃基的烃基,其包含至少一个c≡c三键和2至8个(如2至6个,进一步如2至4个)碳原子。炔基(例如,c
2-6
炔基)的例子包括但不限于乙炔基、1-丙炔基、2-丙炔基(亦即炔丙基)、1-丁炔基、2-丁炔基和3-丁炔基。
[0072]
术语“烷基氧基”或“烷氧基”是指通过氧原子附接至母体分子部分的如上定义的烷基。烷氧基的例子例如c
1-6
烷氧基或c
1-4
烷氧基包括但不限于甲氧基、乙氧基、异丙氧基、丙氧基、正丁氧基、叔丁氧基、戊氧基和己氧基等。
[0073]
术语“环烷基”是指如下烃基,所述烃基选自饱和的环状烃基,包括单环的和多环的(例如双环的和三环的)基团,包括稠合环烷基、桥接环烷基或螺环烷基。
[0074]
例如,环烷基可以包含3至12个(如3至10个,进一步如3至8个,进一步如3至6个、3至5个或3至4个)碳原子。甚至进一步例如,环烷基可以选自包含3至12个(如3至10个,进一步如3至8个、3至6个)碳原子的单环基团。所述单环环烷基的例子包括环丙基、环丁基、环戊基、1-环戊-1-烯基、环己基、环庚基、环辛基、环壬基、环癸基、环十一烷基和环十二烷基。具体地,饱和的单环的环烷基(例如,c
3-8
环烷基)的例子包括但不限于环丙基、环丁基、环戊基、环己基、环庚基和环辛基。在优选的实施方案中,环烷基是含有3至6个碳原子的单环(缩写为c
3-6
环烷基),其包括但不限于环丙基、环丁基、环戊基和环己基。双环的环烷基的例子包括具有7至12个环原子的那些,其排列为选自[4,4]、[4,5]、[5,5]、[5,6]和[6,6]环系的稠合双环,或选自双环[2.2.1]庚烷、双环[2.2.2]辛烷和双环[3.2.2]壬烷的桥连双环。双环的环烷基的其他例子包括排列为选自[5,6]和[6,6]环系的双环(如环的环烷基的其他例子包括排列为选自[5,6]和[6,6]环系的双环(如)的那些,其中波浪线指示附接点。环可以是饱和的或者具有至少一个双键(即部分不饱和的),但不是完全共轭的,并且不是芳香族的,因为芳香族在本技术中进行了定义。
[0075]
单独使用或与其他术语组合使用的术语“芳基”是指选自以下的基团:
[0076]
a)5和6元碳环芳香族环,例如苯基;
[0077]
b)双环环系,如7至12元双环环系,其中至少一个环是碳环和芳香族的,例如萘基
基)、蝶啶基、嘌呤基、1-氧杂-2,3-二唑基、1-氧杂-2,4-二唑基、1-氧杂-2,5-二唑基、1-氧杂-3,4-二唑基、1-硫杂-2,3-二唑基、1-硫杂-2,4-二唑基、1-硫杂-2,5-二唑基、1-硫杂-3,4-二唑基、呋咱基(如呋咱-2-基、呋咱-3-基)、苯并呋咱基、苯并噻吩基、苯并噻唑基、苯并噁唑基、喹唑啉基、喹喔啉基、萘啶基、呋喃并吡啶基、苯并噻唑基(如苯并[d]噻唑-6-基)、吲唑基(如1h-吲唑-5-基)以及5,6,7,8-四氢异喹啉。
[0087]“杂环基”、“杂环”、或“杂环的”是可互换的,并且是指包含一个或多个选自nh、o、s、so或so2杂原子的杂原子作为环成员且其余环成员是碳的非芳香族杂环基,包括单环、稠合环、桥接环和螺环,即包括单环杂环基、桥接杂环基、螺杂环基和稠合杂环基。
[0088]
术语“单环杂环基”是指单环基团,其中至少一个环成员是选自nh、o、s、so、或so2的杂原子。杂环可以是饱和的或部分饱和的。
[0089]
示例性的单环4至9元杂环基包括但不限于(如从指定优先级1的连接位置编号)吡咯烷-1-基、吡咯烷-2-基、吡咯烷-3-基、咪唑烷-2-基、咪唑烷-4-基、吡唑烷-2-基、吡唑烷-3-基、哌啶-1-基、哌啶-2-基、哌啶-3-基、哌啶-4-基、2,5-哌嗪基、吡喃基、吗啉基、吗啉代、吗啉-2-基、吗啉-3-基、环氧乙烷基、氮丙啶-1-基、氮丙啶-2-基、氮杂环辛烷-1-基、氮杂环辛烷-2-基、氮杂环辛烷-3-基、氮杂环辛烷-4-基、氮杂环辛烷-5-基、环硫乙烷基、氮杂环丁烷-1-基、氮杂环丁烷-2-基、氮杂环丁烷-3-基、氧杂环丁烷基、硫杂环丁烷基、1,2-二硫杂环丁烷基、1,3-二硫杂环丁烷基、二氢吡啶、四氢吡啶、硫代吗啉基、噻噁烷基、哌嗪基、高哌嗪基、高哌啶基、氮杂环庚烷-1-基、氮杂环庚烷-2-基、氮杂环庚烷-3-基、氮杂环庚烷-4-基、氧杂环庚烷基、硫杂环庚烷基、1,4-氧杂硫杂环己烷基、1,4-二氧杂环庚烷基、1,4-氧杂硫杂环庚烷基、1,4-氧杂氮杂环庚烷基、1,4-二硫杂环庚烷基、1,4-硫杂氮杂环庚烷基和1,4-二氮杂环庚烷基、1,4-二硫杂环己烷基、1,4-氮杂硫杂环己烷基、氧杂氮杂卓基、二氮杂卓基、硫杂氮杂卓基、二氢噻吩基、二氢吡喃基、二氢呋喃基、四氢呋喃基、四氢噻吩基、四氢吡喃基、四氢噻喃基、1-吡咯啉基、2-吡咯啉基、3-吡咯啉基、二氢吲哚基、2h-吡喃基、4h-吡喃基、1,4-二噁烷基、1,3-二氧戊环基、吡唑啉基、吡唑烷基、二硫杂环己烷基、二硫戊环基、吡唑烷基、咪唑啉基、嘧啶酮基、或1,1-二氧代-硫代吗啉基。
[0090]
术语“二价基团”是指能与两个其他部分形成共价键的连接基团,例如二价烷基、二价烯基、二价炔基和二价环烷基。例如,二价烷基的具体例子包括亚甲基、亚乙基、亚丙基、亚丁基等,具体可以表示为-(ch2)
n-,其中n为1-8的整数。
[0091]
术语“前药”是指可在生物体内转化为相应的活性药物化合物的任何衍生物。
[0092]
术语“药学上可接受的盐”是指在合理的医学判断范围内适合于与人和低等动物的组织接触使用而没有过度毒性、刺激、过敏反应等并与合理的利益/风险比相称的那些盐。药学上可接受的盐可以在本技术公开的化合物的最终分离和纯化期间原位制备,或者通过使游离碱官能团与合适的有机酸反应或通过使酸性基团与合适的碱反应而单独制备。
[0093]
术语“溶剂化物”是指在溶液中,溶质分子或离子通过库伦力、范德瓦尔斯力、电荷传递力、氢键等分子间力吸引相邻的溶剂分子形成的复合分子化合物。在一个实施方案中,溶剂为水,即本发明化合物形成水合物。
[0094]
依据取代基的不同,式(i)化合物可以旋光异构体或不同组成的异构体混合物形式存在,所述混合物如果合适可通过常规方式分离。本发明提供了纯异构体和异构体混合物,及其制备方法和用途,以及包括它们的组合物。为简便起见,下文中将其称为式(i)化合
物,其既指纯的旋光异构体,如果合适也指不同比例的异构体混合物。
[0095]
合成
[0096]
有机反应中常用的合适溶剂均可在以下本发明制备方法的各步反应中使用,例如,但不限于:脂肪族和芳香族的、任选烃或者卤化的烃(例如戊烷、己烷、庚烷、环己烷、石油醚、汽油、挥发油、苯、甲苯、二甲苯、二氯甲烷、二氯乙烷、氯仿、四氯化碳、氯苯和邻二氯苯),脂肪族和芳香族的、任选的醇类(例如甲醇、乙醇、丙醇、异丙醇、叔丁醇、乙二醇等)、醚(例如乙醚和二丁醚,乙二醇二甲醚和二甘醇二甲醚、四氢呋喃和二噁烷等)、酯(例如乙酸甲酯或乙酸乙酯等)、腈(例如乙腈或丙腈等)、酮(例如丙酮、丁酮等)、酰胺(例如二甲基甲酰胺、二甲基乙酰胺和n-甲基吡咯烷酮等),以及二甲基亚砜、四亚甲基砜和六甲基磷酰三胺和n,n-二甲基丙撑脲(dmpu)等。
[0097]
合成实施例:
[0098]
实施例1:n-(4-氯-2-((2-(二甲基氨基)乙基)(甲基)氨基)-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺的合成:
[0099][0100]
步骤1:2-氯-4-氟-5-硝基苯胺的合成:
[0101]
将浓硫酸(20ml)加入反应瓶中,在冰浴条件下将化合物2-氯-4-氟苯胺(5.0g,34.35mmol)加入反应液中,完全溶解后分批加入硝酸钾(3.33g,34.35mmol),在冰水浴下反应30分钟后,将反应液慢慢倒入冰水中,用乙酸乙酯萃取,有机相依次用饱和碳酸氢钠溶液洗,饱和食盐水洗,无水硫酸钠干燥,浓缩,柱层析分离得到黄色固体。(2.0g,收率:30.5%)1h nmr(400mhz,cdcl3)δ7.45-7.44(d,j=4.0hz,1h),7.26-7.23(d,12hz),4.21(s,2h).
[0102]
步骤2:n-(2-氯-4-氟-5-硝基苯基)-4-(1-甲基-1h-吲哚-3-基)嘧啶-2-胺的合成:
[0103]
2-氯-4-氟-5-硝基苯胺(312mg,1.64mmol)和3-(2-氯嘧啶-4-基)-1-甲基吲哚(400mg,1.64mmol)加入反应瓶中,然后加入1,4-二氧六环(10ml),在搅拌下加入对甲基苯磺酸(455mg,2.642mmol),加热至85℃反应10个小时,反应完毕后,冷却至室温,析出固体,过滤,滤饼用乙腈洗涤,干燥得到黄色固体(205mg,收率:31.5%)。1h nmr(400mhz,cdcl3)δ9.92(d,j=7.8hz,1h),8.44(d,j=5.4hz,1h),8.19(s,1h),8.17(d,j=7.2hz,1h),7.60(s,1h),7.40(dd,j=15.0,8.7hz,2h),7.36
–
7.28(m,3h),3.94(s,1h).
[0104]
步骤3:2-氯-n
4-(2-(二甲基氨基)乙基)-n
4-甲基-n
1-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-5-硝基苯-1,4-二胺的合成:
[0105]
将化合物n-(2-氯-4-氟-5-硝基苯基)-4-(1-甲基-1h-吲哚-3-基)嘧啶-2-胺(200mg,0.502mmol)加入反应瓶中,然后加入dmf(5ml),在搅拌下加入n1,n1,n
2-三甲基乙烷-1,2-二胺(57mg,0.553mmol)和dipea(78mg,0.603mmol),加热至75℃反应2个小时,反应
完毕后,将反应液倒入水中,用乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩。柱层析分离得到红色固体。(190mg,收率:81.5%)1h nmr(400mhz,cdcl3)δ9.44(s,1h),8.41(d,j=5.3hz,1h),8.19(d,j=6.8hz,1h),8.14(s,1h),7.47(s,1h),7.41(d,j=7.3hz,1h),7.37
–
7.27(m,3h),7.23(d,j=5.4hz,1h),3.94(s,3h),3.28
–
3.17(m,2h),2.87(s,3h),2.62-2.52(m,2h),2.29(s,6h).
[0106]
步骤4:5-氯-n
1-(2-(二甲基氨基)乙基)-n
1-甲基-n
4-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)苯-1,2,4-三胺的合成:
[0107]
将化合物2-氯-n
4-(2-(二甲基氨基)乙基)-n
4-甲基-n
1-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-5-硝基苯-1,4-二胺(60mg,0.13mmol),铁粉(40mg,0.71mmol)和氯化铵(55mg,1.03mmol)加入反应瓶中,然后加入etoh/h2o=4/1(8ml)溶液,回流反应2个小时,冷却,用硅藻土过滤,用二氯甲烷洗,用二氯甲烷萃取,无水硫酸钠干燥,浓缩得到目标化合物(50mg,收率:86%)。1h nmr(400mhz,cdcl3)δ8.48(d,j=7.8hz,1h),8.34(d,j=5.4hz,1h),8.10(s,1h),7.81(s,1h),7.39(d,j=7.6hz,2h),7.34
–
7.28(m,2h),7.07(d,j=5.3hz,1h),7.03(s,1h),3.89(s,3h),3.08-3.00(m,2h),2.69(s,3h),2.64-2.59(m,2h),2.44(s,6h).
[0108]
步骤5:n-(4-氯-2-((2-(二甲基氨基)乙基)(甲基)氨基)-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺的合成:
[0109]
将丙烯酰氯(10mg,0.11mmol)在二氯甲烷中的溶液逐滴滴加到在冰水浴中冷却的5-氯-n
1-(2-(二甲基氨基)乙基)-n
1-甲基-n
4-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)苯-1,2,4-三胺(50mg,0.11mmol)和dipea(17mg,0.13mmol)在二氯甲烷(5ml)中的经搅拌混合物中。反应30分钟后,用二氯甲烷稀释,用饱和碳酸氢钠洗涤,水相用二氯甲烷萃取两次,合并有机相,无水硫酸钠干燥,浓缩,柱层析分离得到目标化合物(27mg,收率:37.05%)。1h nmr(400mhz,cdcl3)δ10.28(s,1h),9.91(s,1h),8.94(s,1h),8.42(d,j=5.3hz,1h),8.08(d,j=7.0hz,1h),7.56(s,1h),7.39(d,j=7.0hz,1h),7.31-7.24(m,4h),6.49(d,j=17.2hz,1h),6.44
–
6.34(m,1h),5.75(d,j=11.7hz,1h),3.96(s,3h),2.87(s,2h),2.70(s,3h),2.28(s,8h).ms(esi)m/z:505.03[m+h].
[0110]
实施例2:n-(2-((2-(二甲基氨基)乙基)(甲基)氨基)-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)(甲硫基)苯基)丙烯酰胺的合成:
[0111][0112]
步骤1:n
1-(2-(二甲基氨基)乙基)-n
1-甲基-n
4-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-5-(甲硫基)-2-硝基苯-1,4-二胺的合成:
[0113]
2-氯-n
4-(2-(二甲基氨基)乙基)-n
4-甲基-n
1-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-5-硝基苯-1,4-二胺(130mg,0.27mmol)溶于dmf(5ml)中,然后加入甲硫醇钠(40%)
nmr(400mhz,meod)δ8.98(s,1h),8.35
–
8.29(m,2h),8.27(d,j=8.0hz,1h),7.59(s,1h),7.47(d,j=8.2hz,1h),7.32
–
7.23(m,2h),7.18(t,j=7.5hz,1h),6.60(dd,j=17.0,10.1hz,1h),6.50
–
6.41(m,1h),5.87(dd,j=10.2,1.6hz,1h),3.93(s,3h),3.26(s,2h),2.90(s,2h),2.73(s,3h),2.62(s,6h).ms(esi)m/z:548.48[m+h].
[0133]
实施例5:n-(2-((2-(二甲基氨基)乙基)(甲基)氨基)-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)-4-(三氟甲基)苯基)丙烯酰胺的合成:
[0134][0135]
步骤1:n-(4-溴-2-硝基-5-(三氟甲基)苯基)-2,2,2-三氟乙酰胺的合成:
[0136]
将化合物4-溴-3-(三氟甲基)苯胺(4.8g,20.0mmol)加入用冰水浴冷却的三氟乙酸酐(50ml)中,然后分批加入硝酸钾(2.22g,22.0mmol),在冰水浴下搅拌反应1小时后升至室温反应过夜。反应完毕后将反应液倒入冰水中,析出固体,过滤,固体用水洗,干燥得到亮黄色固体。(7.0g,收率:91.87%)。1h nmr(600hz,cdcl3)δ11.22(s,1h),9.19(s,1h),8.64(s,1h).
[0137]
步骤2:4-溴-2-硝基-5-(三氟甲基)苯胺的合成:
[0138]
将化合物n-(4-溴-2-硝基-5-(三氟甲基)苯基)-2,2,2-三氟乙酰胺(7.0g,18.37mmol)溶于甲醇(30ml)中,然后加入饱和碳酸钾溶液(15ml),室温搅拌4个小时。反应完毕后用水稀释反应液,析出固体,过滤并用水洗,干燥得到黄色固体。(4.5g,收率:86.5%)。1h nmr(600hz,cdcl3)δ8.45(s,1h),7.21(s,1h),6.22(s,2h).
[0139]
步骤3:1-溴-4-氯-5-硝基-2-(三氟甲基)苯的合成:
[0140]
将化合物4-溴-2-硝基-5-(三氟甲基)苯胺(1.5g,5.26mmol)溶于浓盐酸(10ml)中,在冰水浴冷却下分批加入亚硝酸钠(400mg,5.79mmol),在冰水浴条件下搅拌反应1小时后,滴加氯化亚铜(781mg,7.89mmol)的浓盐酸溶液(2ml),在冰水浴条件下搅拌反应30分钟后,用饱和碳酸氢钠溶液调节ph至7,用乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩得到粗品。(1.15g,收率:71.8%)。
[0141]
步骤4:n
1-(4-溴-2-硝基-5-(三氟甲基)苯基)-n1,n2,n
2-三甲基乙烷-1,2-二胺的合成:
[0142]
将化合物1-溴-4-氯-5-硝基-2-(三氟甲基)苯(1.15g,3.78mmol)溶于dmf(5ml)中,加入n1,n1,n
2-三甲基乙烷-1,2-二胺(465mg,4.53mmol)和dipea(732mg,5.67mmol)。加热至75℃反应4个小时。反应完毕后,冷却至室温,用水稀释反应液,乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩,柱层析分离得到黄色固体。(300mg,收率:21.5%)。
[0143]
步骤5:n
1-(2-(二甲基氨基)乙基)-n
1-甲基-n 4-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-2-硝基-5-(三氟甲基)苯-1,4-二胺的合成:
[0144]
将化合物n
1-(4-溴-2-硝基-5-(三氟甲基)苯基)-n1,n2,n
2-三甲基乙烷-1,2-二胺(99mg,0.267mmol)和4-(1-甲基-1h-吲哚-3-基)嘧啶-2-胺(60mg,0.267mmol)溶于甲苯(5ml)中,然后加入碳酸铯(261mg,0.801mmol),xantphos(32mg,0.054mmol)和醋酸钯(7mg,0.027mmol),置换氮气三次,加热至110℃反应12个小时。反应完毕后,冷却至室温,用乙酸乙酯稀释反应液,然后用饱和食盐水洗,无水硫酸钠干燥,浓缩,tlc分离纯化得到类白色固体。(80mg,收率:58.4%)
[0145]
步骤6:n
1-(2-(二甲基氨基)乙基)-n
1-甲基-n
4-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-5-(三氟甲基)苯-1,2,4-三胺的合成:
[0146]
将化合物n
1-(2-(二甲基氨基)乙基)-n
1-甲基-n 4-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-2-硝基-5-(三氟甲基)苯-1,4-二胺(80mg,0.156mmol)溶于乙醇/水=4/1(5ml)中,加入铁粉(44mg,0.779mmol)和氯化铵(67mg,1.248mmol),加热至85℃反应2个小时。反应完毕后,冷却至室温,过滤除去不容物,并用二氯甲烷洗,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩,tlc分离纯化得到类白色固体。(25mg,收率:33.5%)
[0147]
步骤7:n-(2-((2-(二甲基氨基)乙基)(甲基)氨基)-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)-4-(三氟甲基)苯基)丙烯酰胺的合成:
[0148]
将化合物n
1-(2-(二甲基氨基)乙基)-n
1-甲基-n
4-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)-5-(三氟甲基)苯-1,2,4-三胺(25mg,0.052mmol)溶于二氯甲烷(5ml)中,冷却至0-5℃后,加入dipea(8mg,0.052mmol),然后滴加丙烯酰氯(8mg,0.062mmol)的二氯甲烷(1ml)溶液。反应完毕后,用饱和碳酸氢钠溶液淬灭反应,用二氯甲烷萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩,tlc分离纯化得到类白色固体。(10mg,收率:36%).1h nmr(400mhz,meod)δ8.94(s,1h),8.28
–
8.20(m,3h),7.60(s,1h),7.44(d,j=8.2hz,1h),7.24(dd,j=10.8,6.4hz,2h),7.15(d,j=7.4hz,1h),6.67(dd,j=17.0,10.3hz,1h),6.43(dd,j=17.0,1.4hz,1h),5.86(dd,j=10.3,1.4hz,1h),3.89(s,3h),3.30(s,2h),2.96(s,2h),2.76(s,3h),2.65(s,6h).ms(esi)m/z:538.6[m+h].
[0149]
实施例6:n-(5-((4-(苯并[b]噻吩-3-基)嘧啶-2-基)氨基)-2-((2-(二甲基氨基)乙基)(甲基)氨基)-4-甲氧基苯基)丙烯酰胺的合成:
[0150][0151]
步骤1:2-(苯并[b]噻吩-3-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷的合成:
[0152]
3-溴苯并[b]噻吩(5.0g,23.46mmol)和双联频哪醇硼酸酯(6.55g,25.81mmol)溶于1,4-二氧六环(50ml)中,然后加入醋酸钾(6.9g,70.38mmol)和pd(dppf)cl2(860mg,1.173mmol),在氮气氛围下加热到110℃搅拌反应8个小时。反应完毕后,冷却至室温,加入水稀释,用乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩,柱层析分离得到
淡黄色固体。(2.1g,收率:34.4%)。1h nmr(400mhz,cdcl3)δ8.37(d,j=8.1hz,1h),8.07(s,1h),7.89(d,j=7.9hz,1h),7.44
–
7.30(m,2h),1.39(s,12h).
[0153]
步骤2:4-(苯并[b]噻吩-3-基)-2-氯嘧啶的合成:
[0154]
2-(苯并[b]噻吩-3-基)-4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷(2.1g,8.07mmol)和2,4-二氯嘧啶(1.32g,8.88mmol)溶于1,4-二氧六环/水=2:1(15ml)中,加入碳酸钠(1.71g,16.14mmol)和pd(dppf)cl2(590mg,0.807mmol),置换氮气,在氮气氛围下加热至120℃反应4个小时。反应完毕后,冷却至室温,用乙酸乙酯稀释,过滤,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩,柱层析分离得到类白色固体。(800mg,收率:40.17%)。1h nmr(400mhz,cdcl3)δ8.67(dd,j=6.7,3.9hz,2h),8.19(s,1h),7.93(d,j=8.0hz,1h),7.65(d,j=5.3hz,1h),7.57
–
7.41(m,2h).
[0155]
步骤3:4-(苯并[b]噻吩-3-基)-n-(4-氟-2-甲氧基-5-硝基苯基)嘧啶-2-胺的合成:
[0156]
4-(苯并[b]噻吩-3-基)-2-氯嘧啶(50mg,0.203mmol)和4-氟-2-甲氧基-5-硝基苯胺(38mg,0.203mmol)溶于1,4-二氧六环(3ml)中,加入对甲苯磺酸(42mg,0.243mmol),加热至110℃搅拌过夜。冷却至室温,用食盐水稀释,乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,柱层析分离得到类白色固体。(50mg,收率:62%)。
[0157]
步骤4:n
1-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-n
4-(2-(二甲基氨基)乙基)-2-甲氧基-n
4-甲基-5-硝基苯-1,4-二胺的合成:
[0158]
4-(苯并[b]噻吩-3-基)-n-(4-氟-2-甲氧基-5-硝基苯基)嘧啶-2-胺(50mg,0.126mmol)溶于dmf(2ml)中,加入n1,n1,n
2-三甲基乙烷-1,2-二胺(16mg,0.151mmol)和dipea(25mg,0.189mmol)。在75℃下搅拌反应3个小时。反应完毕后,冷却至室温,用食盐水稀释,乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩得到黄红色固体。(50mg,收率:82.9%)1h nmr(600mhz,cdcl3)δ9.26(s,1h),8.54(s,1h),8.53(s,1h),8.13(s,1h),7.93(d,j=8.0hz,1h),7.67(s,1h),7.50(t,j=7.6hz,1h),7.43(t,j=7.2hz,1h),7.35(d,j=2.5hz,1h),7.18(d,j=5.1hz,1h),7.08(dd,j=8.5,2.5hz,1h),6.98(s,1h),6.75(s,1h),4.01(s,3h),3.35(m,2h),2.89(s,3h),2.72(m,2h),2.35(s,6h).
[0159]
步骤5:n
4-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-n
1-(2-(二甲基氨基)乙基)-5-甲氧基-n
1-甲基苯-1,2,4-三胺的合成:
[0160]n1-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-n
4-(2-(二甲基氨基)乙基)-2-甲氧基-n
4-甲基-5-硝基苯-1,4-二胺(50mg,0.104mmol)溶于乙醇/水=3:1(8ml)中,加入fe(31mg,0.52mmol)和氯化铵(45mg,0.832mmol),在85℃反应3个小时。反应完毕后冷却至室温,用硅藻土过滤,并用二氯甲烷洗,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩得到粗产物直接用于下一步。
[0161]
步骤6:n-(5-((4-(苯并[b]噻吩-3-基)嘧啶-2-基)氨基)-2-((2-(二甲基氨基)乙基)(甲基)氨基)-4-甲氧基苯基)丙烯酰胺的合成:
[0162]n4-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-n
1-(2-(二甲基氨基)乙基)-5-甲氧基-n
1-甲基苯-1,2,4-三胺粗品(50mg,0.104mmol)和dipea(mg,mmol)溶于二氯甲烷(5ml)中,在冰浴冷却下滴加丙烯酰氯(10mg,0.104mmol)的二氯甲烷溶液(2ml),在冰浴下搅拌反应5分钟,用饱和碳酸氢钠溶液淬灭反应,用二氯甲烷萃取,有机相用饱和食盐水洗,无水硫酸
钠干燥,浓缩,tlc分离纯化得到类白色固体。(35mg,收率:69.4%)。1h nmr(600mhz,dmso)δ9.70(s,1h),8.73
–
8.66(m,2h),8.53(s,1h),8.49(d,j=5.2hz,1h),8.39(s,1h),8.06(d,j=7.6hz,1h),7.40(dd,j=16.9,8.8hz,2h),7.34(d,j=5.2hz,1h),7.02(s,1h),6.26(dd,j=17.3,1.7hz,1h),6.09(dd,j=17.3,10.3hz,0.5h),5.88(dd,j=10.3,1.7hz,0.5h),5.76(s,1h),3.85(s,3h),3.28-3.27(m,2h),2.64(d,j=26.0hz,8h).ms(esi)m/z:503.6[m+h].
[0163]
实施例7:n-(5-((4-(苯并[b]噻吩-3-基)嘧啶-2-基)氨基)-4-溴-2-((2-(二甲基氨基)乙基)(甲基)氨基)苯基)丙烯酰胺
[0164][0165]
步骤1:4-(苯并[b]噻吩-3-基)-n-(2-溴-4-氟-5-硝基苯基)嘧啶-2-胺的合成:
[0166]
4-(苯并[b]噻吩-3-基)-2-氯嘧啶(50mg,0.203mmol)和4-氟-2-甲氧基-5-硝基苯胺(38mg,0.203mmol)溶于1,4-二氧六环(3ml)中,加入对甲苯磺酸(42mg,0.243mmol),加热至110℃搅拌过夜。冷却至室温,用食盐水稀释,乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,柱层析分离得到类白色固体。(30mg,收率:33%)。1h nmr(300mhz,cdcl3)δ9.62(d,j=7.6hz,1h),8.61(d,j=5.2hz,1h),8.50(dd,j=6.8,1.9hz,1h),8.17(s,1h),7.95(dd,j=6.3,1.5hz,1h),7.72(s,1h),7.59(d,j=9.6hz,1h),7.52
–
7.40(m,3h),7.33(d,j=5.2hz,1h).
[0167]
步骤2:n
1-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-2-溴-n
4-(2-(二甲基氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺的合成:
[0168]
4-(苯并[b]噻吩-3-基)-n-(2-溴-4-氟-5-硝基苯基)嘧啶-2-胺(30mg,0.067mmol)溶于dmf(2ml)中,加入dipea(13mg,0.10mmol)和化合物n1,n1,n2-三甲基乙烷-1,2-二胺(9mg,0.081mmol),在室温下搅拌反应2个小时。反应完毕后用饱和食盐水稀释,乙酸乙酯萃取,无水硫酸钠干燥,浓缩得到红黄色固体。(30mg,收率:84.4%)。1h nmr(300mhz,cdcl3)δ9.14(s,1h),8.60
–
8.51(m,2h),8.15(s,1h),7.96(d,j=7.3hz,1h),7.59(s,1h),7.54
–
7.45(m,3h),7.26(s,1h),3.29(m,2h),2.87(s,3h),2.36(s,6h),2.02(m,2h).
[0169]
步骤3:n
4-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-5-溴-n 1-(2-(二甲基氨基)乙基)-n
1-甲基苯-1,2,4-三胺的合成:
[0170]n1-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-2-溴-n
4-(2-(二甲基氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺(30mg,0.06mmol)溶于乙醇/水=3:1(8ml)中,加入fe(16mg,0.28mmol)和氯化铵(25mg,0.46mmol),在85℃反应3个小时。反应完毕后冷却至室温,用硅藻土过滤,并用二氯甲烷洗,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩得到粗产物直接用于下一步。(30mg,收率:100%)
[0171]
步骤4:n-(5-((4-(苯并[b]噻吩-3-基)嘧啶-2-基)氨基)-4-溴-2-((2-(二甲基氨
基)乙基)(甲基)氨基)苯基)丙烯酰胺的合成:
[0172]
在冰浴冷却下,将丙烯酰氯(6mg,0.06mmol)的二氯甲烷溶液(1ml)滴加到化合物n
4-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-5-溴-n 1-(2-(二甲基氨基)乙基)-n
1-甲基苯-1,2,4-三胺(30mg,0.06mmol)和dipea(9mg,0.07mmol)的二氯甲烷(3ml)溶液中,在冰水浴条件下搅拌反应30分钟。反应完毕后,用饱和碳酸氢钠溶液淬灭反应,用二氯甲烷萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩,tlc分离纯化得到浅黄色固体。(10mg,收率:30%).1h nmr(300mhz,cdcl3)δ10.30(s,1h),9.75(s,1h),8.58(d,j=5.2hz,1h),8.55(s,1h),8.42(d,j=7.2hz,1h),7.91(d,j=7.5hz,1h),7.48(s,1h),7.39(s,3h),7.21(d,j=5.2hz,1h),6.53
–
6.44(m,1h),6.34(d,j=10.5hz,1h),5.74(d,j=11.8hz,1h),2.84(s,2h),2.70(s,3h),2.31(s,2h),2.27(s,6h).ms(esi)m/z 551[m+h].
[0173]
实施例8:n-(4-溴-5-((4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)胺基)-2-((2-(二甲基胺基)乙基)胺基)苯基)丙烯酰胺的合成:
[0174][0175]
步骤1:1-环丙基-1h-吲哚的合成:
[0176]
将吲哚(0.351g,0.3mmol)、环丙基硼酸(0.516g,0.6mmol)、碳酸钠(0.636g,0.6mmol)、醋酸铜(0.545g,0.3mmol)、2,2'联吡啶(0.468g,0.3mmol)混于5ml二氯乙烷中,70℃反应4小时。之后冷却至室温,加入20ml 1n盐酸溶液,分液,水相使用二氯甲烷萃取,合并有机相,有机相使用饱和食盐水洗涤,干燥,过柱,得到目标化合物。(0.1g,收率:21%)。1h nmr(300mhz,cdcl3)δ7.62(ddd,j=8.9,7.8,1.0hz,2h),7.32
–
7.19(m,1h),7.21
–
7.09(m,2h),6.46(dd,j=3.1,1.1hz,1h),3.37(dq,j=6.9,3.5hz,1h),1.17
–
0.98(m,4h).
[0177]
步骤2:3-(2-氯嘧啶-4-基)-1-环丙基-1h-吲哚的合成:
[0178]
将1-环丙基-1h-吲哚(1.6g,10.2mmol)、2,4-二氯嘧啶(1.5g,10.2mmol)、三氯化铝(2.34g,15.3mmol)溶于53ml乙二醇二甲醚中,60℃反应3h;冷却后,倒入冰水中,甲基叔丁醚萃取,干燥,过柱,得到固体。(1.0g,收率:36%)。1h nmr(300mhz,cdcl3)δ8.48(d,j=5.4hz,1h),8.35
–
8.28(m,1h),8.04(s,1h),7.72
–
7.64(m,1h),7.53(d,j=5.4hz,1h),7.41
–
7.33(m,2h),3.53
–
3.42(m,1h),1.25
–
1.07(m,4h).
[0179]
步骤3:n-(2-溴-4-氟-5-硝基苯基)-4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-胺的合成:
[0180]
将3-(2-氯嘧啶-4-基)-1-环丙基-1h-吲哚(0.5g,1.86mmol)、2-溴-4-氟-5-硝基苯胺(0.52g,2.24mmol)、对甲苯磺酰氯(0.465g,2.4mmol)混于20ml的2-戊醇中,120℃反应16小时,冷却,浓缩,二氯甲烷溶解,饱和碳酸氢钠溶液洗涤,分液,有机相干燥,过柱,得到
目标化合物。(0.22g,收率:25%)。1h nmr(300mhz,cdcl3)δ9.84(d,j=7.7hz,1h),8.48(d,j=5.4hz,1h),8.22(s,1h),8.18(dd,j=6.5,2.3hz,1h),7.77
–
7.67(m,1h),7.49
–
7.41(m,1h),7.37
–
7.31(m,3h),7.02(s,1h),3.50(ddd,j=10.7,7.1,4.0hz,1h),1.19(d,j=2.2hz,2h).
[0181]
步骤4:2-溴-n
1-(4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲基胺基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺的合成:
[0182]
将n-(2-溴-4-氟-5-硝基苯基)-4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-胺(0.22g,0.47mmol)、三甲基乙二胺(0.096g,0.94mmol)、dipea(0.121g,0.94mmol)混于20ml的dmf中,70℃反应3小时,冷却后倒入水中,二氯甲烷萃取,有机相使用饱和食盐水洗涤,干燥,过柱,得到目标化合物。(0.23g,收率:89%)。1h nmr(300mhz,cdcl3)δ9.32(s,1h),8.42(d,j=5.3hz,1h),8.24
–
8.16(m,1h),8.15(s,1h),7.71
–
7.64(m,1h),7.48(s,1h),7.44(s,1h),7.39
–
7.31(m,2h),7.24(d,j=5.3hz,1h),3.48(tt,j=6.6,4.1hz,1h),3.27
–
3.18(m,2h),2.89(s,3h),2.60
–
2.50(m,2h),2.28(s,7h),1.20(ddq,j=7.8,3.8,2.3,1.7hz,4h).
[0183]
步骤5:5-溴-n
4-(4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)-n
1-(2-(二甲基胺基)乙基)-n
1-甲基苯-1,2,4-三胺的合成:
[0184]
将2-溴-n
1-(4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲基胺基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺(0.23g,0.42mmol)、铁粉(0.12g,2.1mmol)、氯化铵(0.18g,2.56mmol)混于乙醇/水(5/1,12ml)中,90℃反应1小时,冷却,过滤,加入二氯甲烷与饱和食盐水,分液,有机相干燥,旋干得到粗产物直接用于下一步。
[0185]
步骤6:n-(4-溴-5-((4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)胺基)-2-((2-(二甲基胺基)乙基)胺基)苯基)丙烯酰胺的合成:
[0186]
将上一步所得固体溶于5ml二氯甲烷中,加入dipea(65mg,0.50mmol),冰水浴下滴加丙烯酰氯(0.038g,0.42mmol)的二氯甲烷溶液(4ml),反应10min后,反应液水洗,分液,有机相干燥,过柱,得到目标化合物。(40mg,收率:16%)。1h nmr(300mhz,cdcl3)δ10.27(s,1h),9.84(s,1h),8.51(s,1h),8.45(d,j=5.3hz,1h),8.14(dd,j=6.5,2.4hz,1h),7.69
–
7.62(m,1h),7.46(s,1h),7.41(s,1h),7.35
–
7.29(m,2h),7.24(d,j=5.3hz,1h),6.51(d,j=16.0hz,1h),5.76(d,j=11.9hz,1h),3.45(tt,j=7.2,3.8hz,1h),2.90(s,2h),2.73(s,3h),2.36(d,j=26.1hz,8h),1.21
–
1.08(m,4h).ms(esi)m/z:575.6[m+h].
[0187]
实施例9:n-(4-溴-5-((4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)胺基)-2-((2-(二甲基胺基)乙基)(甲基)胺基)苯基)丙烯酰胺的合成:
[0188][0189]
步骤1:1-环丙基-5-氟-1h-吲哚的合成:
[0190]
将5-氟-吲哚(0.402g,0.3mmol)、环丙级硼酸(0.516g,0.6mmol)、碳酸钠(0.636g,0.6mmol)、醋酸铜(0.545g,0.3mmol)、2,2'联吡啶(0.468g,0.3mmol)混于5ml二氯乙烷中,70℃反应4小时;之后冷却至室温,加入20ml 1n盐酸溶液,分液,水相使用二氯甲烷萃取,合并有机相,有机相使用饱和食盐水洗涤,干燥,过柱,得到目标化合物。(0.17g,收率:32%)。
[0191]
步骤2:3-(2-氯嘧啶-4-基)-1-环丙基-5-氟-1h-吲哚的合成:
[0192]
将1-环丙基-5-氟-1h-吲哚(1.7g,10.0mmol)、2,4-二氯嘧啶(1.5g,10.2mmol)、三氯化铝(2.34g,15.3mmol)混于53ml乙二醇二甲醚中,60℃反应3h;冷却后,倒入冰水中,甲基叔丁醚萃取,干燥,过柱,得到目标化合物。(0.67g,收率:23%)。
[0193]
步骤3:n-(2-溴-4-氟-5-硝基苯基)-4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-胺的合成:
[0194]
将3-(2-氯嘧啶-4-基)-1-环丙基-5-氟-1h-吲哚(0.59g,2.1mmol)、2-溴-4-氟-5-硝基苯胺(0.59g,2.52mmol)、对甲苯磺酰氯(0.53g,2.73mmol)混于20ml的2-戊醇中,120℃反应16小时,冷却,浓缩,二氯甲烷溶解,饱和碳酸氢钠溶液洗涤,分液,有机相干燥,过柱,得到目标化合物。(98mg,收率:8.5%)。1h nmr(300mhz,cdcl3)δ9.78(d,j=7.7hz,1h),8.47(d,j=5.3hz,1h),8.19(s,1h),7.93
–
7.80(m,1h),7.67
–
7.56(m,3h),7.21(d,j=5.4hz,1h),7.12(dd,j=8.8,2.4hz,1h),3.48(ddd,j=10.7,7.0,3.9hz,1h),1.26
–
1.19(m,4h).
[0195]
步骤4:2-溴-n
1-(4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲基胺基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺的合成:
[0196]
将n-(2-溴-4-氟-5-硝基苯基)-4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-胺(0.098g,0.20mmol)、三甲基乙二胺(0.041g,0.40mmol)、dipea(0.051g,0.40mmol)混于10ml的dmf中,70℃反应3小时,冷却后倒入水中,二氯甲烷萃取,有机相使用饱和食盐水洗涤,干燥,过柱,得到目标化合物。(0.11g,收率:99%)。
[0197]
步骤5:5-溴-n
4-(4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)-n
1-(2-(二甲基胺基)乙基)-n
1-甲基苯-1,2,4-三胺的合成:
[0198]
将2-溴-n
1-(4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲基胺基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺(0.11g,0.21mmol)、铁粉(0.06g,1.05mmol)、氯化铵(0.09g,1.28mmol)混于乙醇/水(5/1,6ml)中,90℃反应1小时,冷却,过滤,加入二氯甲烷与饱和食盐水,分液,有机相干燥,浓缩得到粗产物直接用于下一步。
[0199]
步骤6:n-(4-溴-5-((4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)胺基)-2-((2-(二甲基胺基)乙基)(甲基)胺基)苯基)丙烯酰胺的合成:
[0200]
将上一步所得固体溶于5ml二氯甲烷中,滴加dipea(0.033g,0.25mmol),滴加丙烯酰氯(0.019g,0.21mmol)的二氯甲烷溶液(4ml),反应10min后,反应液水洗,分液,有机相干燥,过柱,得到目标化合物。(5mg,收率:4%)。1h nmr(300mhz,cdcl3)δ9.77(s,1h),8.48
–
8.32(m,2h),7.90
–
7.80(m,1h),7.54(dd,j=8.9,4.6hz,1h),7.40(d,j=6.9hz,2h),7.11(d,j=5.4hz,1h),7.03(td,j=9.0,2.5hz,2h),6.45(d,j=16.0hz,1h),5.75(d,j=11.9hz,1h),3.43(dp,j=7.2,4.0hz,1h),3.05(d,j=23.3hz,2h),2.74(s,3h),2.46(s,8h),1.14(d,j=10.9hz,4h).
[0201]
实施例10:n-(4-氯-5-((4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)胺基)-2-((2-(二甲基胺基)乙基)(甲基)胺基)苯基)丙烯酰胺的合成:
[0202][0203]
步骤1:n-(2-氯-4-氟-5-硝基苯基)-4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-胺的合成:
[0204]
将3-(2-氯嘧啶-4-基)-1-环丙基-1h-吲哚(1.15g,4.28mmol)、2-氯-4-氟-5-硝基苯胺(0.96g,5.136mmol)、对甲苯磺酸(0.96g,5.6mmol)混于40ml的2-戊醇中,120℃反应16小时,冷却,浓缩,二氯甲烷溶解,饱和碳酸氢钠溶液洗涤,分液,有机相干燥,过柱,得到目标化合物。(0.32g,收率:17%)。
[0205]
步骤2:2-氯-n
1-(4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲基胺基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺的合成:
[0206]
将n-(2-氯-4-氟-5-硝基苯基)-4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-胺(0.32g,0.76mmol)、三甲基乙二胺(0.15g,1.52mmol)、dipea(0.2g,1.52mmol)混于30ml的dmf中,70℃反应3小时,冷却后倒入水中,二氯甲烷萃取,有机相使用饱和食盐水洗涤,干燥,过柱,得到目标化合物。(0.41g,收率:106%)。
[0207]
步骤3:5-氯-n
4-(4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)-n
1-(2-(二甲基胺基)乙基)-n
1-甲基苯-1,2,4-三胺的合成:
[0208]
将2-氯-n
1-(4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲基胺基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺(0.41g,0.83mmol)、铁粉(0.23g,4.15mmol)、氯化铵(0.53g,6.64mmol)混于乙醇/水(5/1,24ml)中,90℃反应1小时,冷却,过滤,加入二氯甲烷与饱和食盐水,分液,有机相干燥,浓缩得到粗产物直接用于下一步。
[0209]
步骤4:n-(4-氯-5-((4-(1-环丙基-1h-吲哚-3-基)嘧啶-2-基)胺基)-2-((2-(二甲基胺基)乙基)(甲基)胺基)苯基)丙烯酰胺的合成:
[0210]
将上一步所得固体溶于12ml二氯甲烷中,滴加dipea(0.13g,0.99mmol),滴加丙烯酰氯(0.074g,0.83mmol)的二氯甲烷溶液(4ml),反应10min后,反应液水洗,分液,有机相干燥,过柱,得到目标化合物。(100mg,收率:23%)。1h nmr(300mhz,cdcl3)δ10.18(s,1h),9.87(s,1h),8.51(s,1h),8.45(d,j=5.3hz,1h),8.14(dd,j=6.4,2.3hz,1h),7.71
–
7.61(m,1h),7.50(s,1h),7.33
–
7.29(m,1h),7.28
–
7.21(m,3h),6.49(s,2h),5.81
–
5.69(m,1h),3.46(tt,j=7.2,3.8hz,1h),2.92(d,j=5.7hz,2h),2.72(s,3h),2,41(d,j=6.8hz,2h),2.35(s,6h),1.24
–
1.10(m,4h).ms(esi)m/z:531[m+h].
[0211]
实施例11:1-(4
4-((2-(二甲基胺基)乙基)(甲基)胺基)-4
6-甲氧基-1
1-甲基-11h-3,5-二氮杂-1(3,5)-吲哚-2(4,2)-嘧啶-4(1,3)-苯基环辛烷-5-基)丙-2-烯-1-酮的合成:
[0212][0213]
步骤1:(e)-3-(1-甲基-1h-吲哚-5-基)丙烯甲酯的合成:
[0214]
将n-甲基-5-溴吲哚(2.09g,10mmol)、丙烯酸甲酯(4.3g,50mmol)、醋酸钯(0.22g,1mmol)、三苯基膦(0.52g,2mmol)、碳酸钾(2.76g,20mmol)混于30ml的dmf中,110℃反应15小时,冷却后倒入水中,ea萃取,有机相干燥,过柱,得到目标化合物。(1.3g,收率:60%)。1h nmr(400mhz,cdcl3)δ7.87(d,j=15.9hz,1h),7.81(s,1h),7.48(dd,j=8.6,1.6hz,1h),7.34(d,j=8.6hz,1h),7.10(d,j=3.1hz,1h),6.55(d,j=3.1hz,1h),6.44(d,j=15.9hz,1h),3.84(s,6h).
[0215]
步骤2:3-(1-甲基-1h-吲哚-5-基)丙酸甲酯的合成:
[0216]
将(e)-3-(1-甲基-1h-吲哚-5-基)丙烯甲酯(1.3g,6mmol)溶于甲醇(20ml)中,加入催化量pd/c,h2氛围,反应15小时候,过滤,浓缩,得到目标化合物。(1.3g,收率:99%)。1h nmr(400mhz,cdcl3)δ7.48(s,1h),7.27(s,1h),7.10(dd,j=8.4,1.7hz,1h),7.06(d,j=3.1hz,1h),6.45(d,j=3.1hz,1h),3.80(s,3h),3.70(s,3h),3.09(t,j=7.9hz,2h),2.71(t,j=7.9hz,2h).
[0217]
步骤3:3-(3-(2-氯嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸甲酯的合成:
[0218]
将1-甲基-1h-吲哚-5-基)丙酸甲酯(1.8g,8.3mmol)、2,4-二氯嘧啶(1.23g,8.3mmol)、三氯化铝(2.2g,16.3mmol)混于40ml乙二醇二甲醚中,60℃反应3h;冷却后,倒入冰水中,甲基叔丁醚萃取,干燥,过柱,得到目标化合物。(1.0g,收率:38%)。
[0219]
步骤4:3-(3-(2-((4-氟-2-甲氧基-5-硝基苯基)胺基)嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸戊-2-基酯的合成:
[0220]
将3-(3-(2-氯嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸甲酯(1.0g,3.125mmol)、2-甲氧基-4-氟-5-硝基苯胺(0.70g,3.75mmol)、对甲苯磺酸(0.70g,4.1mmol)混于20ml的2-戊醇中,120℃反应16小时,冷却,浓缩,二氯甲烷溶解,饱和碳酸氢钠溶液洗涤,分液,有机相干燥,过柱,得到目标化合物。(1.2g,收率:80%)。
[0221]
步骤5:3-(3-(2-((4-((2-(二甲基胺基)乙基)(甲基)胺基)-2-甲氧基-5-硝基苯基)胺基)嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸戊-2-基酯的合成:
[0222]
将3-(3-(2-((4-氟-2-甲氧基-5-硝基苯基)胺基)嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸戊-2-基酯(1.2g,2.5mmol)、三甲基乙二胺(0.51g,5mmol)、dipea(0.645g,5mmol)混于90ml的dmf中,70℃反应3小时,冷却后倒入水中,二氯甲烷萃取,有机相使用饱和食盐水洗涤,干燥,过柱,得到目标化合物。(1.6g,收率:112%)。1h nmr(400mhz,cdcl3)δ
9.64(s,1h),8.43(d,j=5.3hz,1h),8.33(s,1h),7.95(s,1h),7.57(s,1h),7.35(d,j=8.4hz,1h),7.21(dd,j=12.3,6.9hz,2h),6.71(s,1h),4.96(q,j=6.3hz,1h),4.02(s,3h),3.96(s,3h),3.32(t,j=7.1hz,2h),3.15(t,j=7.8hz,2h),2.94(s,3h),2.73(q,j=7.7,7.1hz,2h),2.62(t,j=7.2hz,2h),2.31(s,6h),1.44(tt,j=13.4,6.0hz,2h),1.30(d,j=9.4hz,2h),1.20(d,j=6.2hz,3h),0.88(t,j=7.3hz,3h).
[0223]
步骤6:3-(3-(2-((5-胺基-4-((2-(二甲基胺基)乙基)(甲基)胺基)-2-甲氧基苯基)胺基)嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸戊-2-基酯的合成:
[0224]
将3-(3-(2-((4-((2-(二甲基胺基)乙基)(甲基)胺基)-2-甲氧基-5-硝基苯基)胺基)嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸戊-2-基酯(1.6g,2.58mmol)、铁粉(0.72g,10.29mmol)、氯化铵(1.09g,20.6mmol)混于乙醇/水(5/1,60ml)中,90℃反应1小时,冷却,过滤,加入二氯甲烷与饱和食盐水,分液,有机相干燥,过柱,得到gyz-001-044-01共0.6g(39%)。1h nmr(400mhz,cdcl3)δ8.37(d,j=5.3hz,1h),8.17(d,j=12.4hz,2h),7.83(s,1h),7.64(s,1h),7.32(d,j=8.4hz,2h),7.19(d,j=8.4hz,1h),7.06(d,j=5.3hz,1h),6.71(s,1h),4.93(h,j=6.4hz,1h),3.88(d,j=2.4hz,7h),3.24(t,j=6.4hz,2h),3.14(t,j=7.9hz,2h),2.94
–
2.83(m,2h),2.72(s,3h),2.70(m,2h),1.64
–
1.36(m,2h),1.27(ddt,j=15.8,13.4,6.8hz,2h),1.18(d,j=6.2hz,3h),0.86(t,j=7.3hz,3h).
[0225]
步骤7:3-(3-(2-((5-胺基-4-((2-(二甲基胺基)乙基)(甲基)胺基)-2-甲氧基苯基)胺基)嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸的合成:
[0226]
将3-(3-(2-((5-胺基-4-((2-(二甲基胺基)乙基)(甲基)胺基)-2-甲氧基苯基)胺基)嘧啶-4-基)-1-甲基-1h-吲哚-5-基)丙酸戊-2-基酯(0.1g,0.17mmol)、一水合氢氧化锂(0.09g,2.1mmol)溶于甲醇/水(5/1,10ml)中,60℃加热3小时,冷却,用1n盐酸溶液酸化至ph=7,之后将溶剂旋干得到粗产物直接用于下一步。
[0227]
步骤8:4
4-((2-(二甲基胺基)乙基)(甲基)胺基)-4
6-甲氧基-1
1-甲基-11h-3,5-二氮杂-1(3,5)-吲哚-2(4,2)-嘧啶-4(1,3)-苯基环庚烷-6-酮的合成:
[0228]
将上一步所得固体与hobt(46mg,0.34mmol)、dcc(58mg,0.34mmol)、三乙胺(68mg,0.34mmol)混于4ml dmf中,45℃反应18小时,冷却后,倒入水中,二氯甲烷萃取,有机相干燥,过柱,得到目标化合物。(35mg,收率:41%)。ms m/z:500.69[m+h]
[0229]
步骤9:n
1-(4
6-甲氧基-1
1-甲基-11h-3,5-二氮杂-1(3,5)-吲哚-2(4,2)-嘧啶-4(1,3)-苯基环庚烷-4
4-基)-n1,n2,n
2-三甲基乙烷-1,2-二胺的合成:
[0230]
将4
4-((2-(二甲基胺基)乙基)(甲基)胺基)-4
6-甲氧基-1
1-甲基-11h-3,5-二氮杂-1(3,5)-吲哚-2(4,2)-嘧啶-4(1,3)-苯基环庚烷-6-酮(100mg,0.2mmol)溶于thf(10ml)中,滴加bh3.sme2溶液(0.5ml,2m in thf),回流24小时,冷却后,滴加甲醇(2ml),待反应液没有气体放出后,旋干,过柱,得到目标化合物。(78mg,收率:80%)(部分产物在过柱后依旧与bh3复合)。ms m/z:486.79[m+h]
[0231]
步骤10:1-(4
4-((2-(二甲基胺基)乙基)(甲基)胺基)-4
6-甲氧基-1
1-甲基-11h-3,5-二氮杂-1(3,5)-吲哚-2(4,2)-嘧啶-4(1,3)-苯基环辛烷-5-基)丙-2-烯-1-酮的合成:
[0232]
将n
1-(4
6-甲氧基-1
1-甲基-11h-3,5-二氮杂-1(3,5)-吲哚-2(4,2)-嘧啶-4(1,3)-苯基环庚烷-4
4-基)-n1,n2,n
2-三甲基乙烷-1,2-二胺(78mg,0.16mmol)溶于12ml二氯甲烷中,滴加丙烯酰氯(0.015g,0.16mmol)的二氯甲烷溶液(4ml),反应10min后,反应液水洗,分
液,有机相干燥,浓缩,加入1n盐酸溶液10ml搅拌过夜,之后二氯甲烷萃取,有机相干燥,过柱,得到gyz-001-056-05共34mg(39%)。1h nmr(400mhz,cdcl3)δ8.67(s,1h),8.27(t,j=4.6hz,1h),8.10(s,1h),7.62(d,j=2.9hz,1h),7.37(s,1h),7.24(d,j=8.3hz,1h),7.16
–
7.10(m,1h),6.95(dd,j=5.3,2.6hz,1h),6.72(s,1h),6.27(dd,j=16.8,2.3hz,1h),6.12(dd,j=16.8,10.2hz,1h),5.42(dd,j=10.2,2.2hz,1h),3.93(d,j=2.4hz,3h),3.85(s,3h),3.06(s,2h),2.99(d,j=6.3hz,2h),2.72(s,3h),2.53(dd,j=17.1,9.4hz,2h),2.29(s,6h),2.12(dq,j=15.2,7.7hz,4h).ms m/z:540.86(m+h)
+
;
[0233]
实施例12:n-(4-氯-5-((4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)氨基)-2-((2-(二甲氨基)乙基)(甲基)氨基)苯基)丙烯酰胺
[0234][0235]
步骤1:5-氯-n
1-(2-(二甲氨基)乙基)-n
1-甲基-2-硝基苯-1,4-二胺的合成
[0236]
2-氯-4氟-5-硝基苯胺(2.7g,14.2mmol)溶于dmf(50ml)中,加入三甲基乙二胺(2.2g,21.2mmol),dipea(3.7g,28.3mmol),加热至70℃,反应过夜,tlc检测反应完全,倒入冰水中,乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,过柱纯化得3g棕色油状物,收率77.7%。
[0237]
步骤2:2-氯-n
1-(4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺的合成
[0238]
3-(2-氯嘧啶)-环丙基-5-氟吲哚(261mg,0.91mmol)与5-氯-n
1-(2-(二甲氨基)乙基)-n1-甲基-2-硝基苯-1,4-二胺(206mg,0.76mmol)溶于dmf(50ml)中,加入碳酸铯(738mg,2.26mmol),加热至115℃,反应过夜,tlc检测反应完全,倒入冰水中,乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,过柱纯化得170mg黄色固体,收率43%。1h nmr(300mhz,cdcl3)δ9.29(s,1h),8.41(d,j=5.4hz,1h),8.11(s,1h),7.87(dd,j=10.1,2.4hz,1h),7.58(dd,j=8.9,4.5hz,1h),7.48(s,1h),7.30(s,1h),7.09(ddd,j=11.4,8.8,3.9hz,2h),3.46(dd,j=7.1,3.3hz,1h),3.37
–
3.27(m,2h),2.89(s,3h),2.77
–
2.66(m,2h),2.42(s,6h),1.25
–
1.11(m,4h)。
[0239]
步骤3:5-氯-n
4-(4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)-n
1-(2-(二甲氨)乙基)-n
1-甲基苯基-1,2,4-三胺的合成:
[0240]
2-氯-n
1-(4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)-n
4-(2-(二甲氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺(170mg,0.32mmol)溶于甲醇(50ml)中,加入铁粉(109mg,1.95mmol)和乙酸(30mg),加热至70℃,反应2小时,tlc检测反应完全,过滤,滤液中加水,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩,制备板纯化得120mg淡黄色固体,收率75%。1h nmr(300mhz,cdcl3)δ8.35(d,j=5.4hz,1h),8.15(dd,j=10.2,2.5hz,1h),7.94(s,1h),7.87(s,1h),7.55(dd,j=8.9,4.5hz,1h),7.46(s,1h),7.05(ddd,j=12.1,8.9,4.0hz,
3h),3.53
–
3.43(m,1h),3.25(t,j=6.0hz,2h),2.97(t,j=5.9hz,2h),2.71(d,j=2.5hz,9h),1.24
–
1.05(m,4h)。
[0241]
步骤4:n-(4-氯-5-((4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)氨基)-2-((2-(二甲氨基)乙基)(甲基)氨基)苯基)丙烯酰胺的合成:
[0242]
5-氯-n
4-(4-(1-环丙基-5-氟-1h-吲哚-3-基)嘧啶-2-基)-n
1-(2-(二甲氨)乙基)-n
1-甲基苯基-1,2,4-三胺(120mg,0.24mmol)溶于二氯甲烷(20ml)中,加入dipea(120mg,0.24mmol),冰浴下滴加丙烯酰氯(37.6mg,0.29mmol),10分钟后,tlc检测反应完全,倒入冰水中,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩,制备板纯化得80mg灰白色固体,收率62.5%。1h nmr(400mhz,cdcl3)δ10.10(s,1h),9.79(s,1h),8.43(s,2h),7.83(s,1h),7.54(s,1h),7.47(s,1h),7.29(s,1h),7.25(s,1h),7.13(s,1h),7.02(s,1h),6.45(s,1h),5.76(s,1h),3.44(s,1h),2.97(s,2h),2.74(s,3h),2.31(s,8h),1.10(s,4h)。ms m/z:549[m+h]
+
.
[0243]
实施例13:n-(4-氯-5-((4-(1-环丙基-5-氟-1h-吲哚-3-基)-5-氟嘧啶-2-基)氨基)-2-((2-(二甲氨基)乙基)(甲基)氨基)苯基)丙烯酰胺的合成:
[0244][0245]
步骤1:3-(2-氯-5-氟嘧啶-4-基)-1-环丙基-5-氟-1h-吲哚的合成
[0246]
1-环丙基-5-氟吲哚(300mg,1.72mol)与2,4-二氯-5-氟嘧啶(288mg,1.72mmol)溶于二氯乙烷(50ml)中,加入三氯化铝(275mg,2.07mmol),加热至70℃,反应2小时,tlc检测反应完全,倒入冰水中,乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,过柱纯化得280mg淡黄色固体,收率53%。1h nmr(400mhz,cdcl3)δ8.28(dd,j=10.1,2.5hz,1h),8.24(d,j=3.4hz,1h),7.98(d,j=2.6hz,1h),7.51(dd,j=8.9,4.5hz,1h),7.06(td,j=8.9,2.5hz,1h),3.54
–
3.36(m,1h),1.24
–
1.02(m,4h)。
[0247]
步骤2:2-氯-n
1-(4-(1-环丙基-5-氟-1h-吲哚-3-基)-5-氟嘧啶-2-基)-n
4-(2-(二甲氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺的合成
[0248]
3-(2-氯-5-氟嘧啶-4-基)-1-环丙基-5-氟-1h-吲哚(170mg,0.56mmol)与5-氯-n
1-(2-(二甲氨基)乙基)-n
1-甲基-2-硝基苯-1,4-二胺(126mg,0.46mmol)溶于dmf(20ml)中,加入碳酸铯(450mg,1.38mmol),加热至115℃,反应过夜,tlc检测反应完全,倒入冰水中,乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,过柱纯化得100mg黄色固体,收率40%。1h nmr(400mhz,cdcl3)δ8.92(s,1h),8.27(d,j=3.4hz,1h),8.19(d,j=10.2hz,1h),8.07(s,1h),7.57(dd,j=8.8,4.5hz,1h),7.39(s,1h),7.31(s,1h),7.09(t,j=7.7hz,1h),3.48(d,j=3.7hz,1h),3.33(t,j=7.0hz,2h),2.89(s,3h),2.72(t,j=6.9hz,2h),2.42(s,6h),1.21(d,j=6.3hz,2h),1.12(s,2h)。
[0249]
步骤3:5-氯-n
4-(4-(1-环丙基-5-氟-1h-吲哚-3-基)-5-氟嘧啶-2-基)-n
1-(2-(二
(二甲氨基)乙基)-n
1-甲苯-1,2,4-三胺的合成
[0260]
2-溴-n
1-(4-(1-环丙基-5-氟-1h-吲哚-3-基)-5-氟嘧啶-2-基)-n
4-(2-(二甲氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺(45mg,0.08mmol)溶于甲醇(20ml)中,加入铁粉(26mg,0.46mmol)和乙酸(10mg),加热至70℃,反应2小时,tlc检测反应完全,过滤,滤液中加水,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩,制备板纯化得32mg淡黄色固体,收率74.4%。
[0261]
步骤4:n-(4-溴-5-((4-(1-环丙基-5-氟-1h-吲哚-3-基)-5-氟嘧啶-2-基)氨基)-2-((2-(二甲氨基)乙基)(甲基)氨基)苯基)丙烯酰胺的合成
[0262]
5-溴-n
4-(4-(1-环丙基-5-氟-1h-吲哚-3-基)-5-氟嘧啶-2-基)-n
1-(2-(二甲氨基)乙基)-n
1-甲苯-1,2,4-三胺(32mg,0.057mmol)溶于二氯甲烷(10ml)中,加入dipea(8.9mg,0.069mmol),冰浴下滴加丙烯酰氯(5.2mg,0.057mmol),10分钟后,tlc检测反应完全,倒入冰水中,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩,制备板纯化得15mg淡黄色固体,收率42.8%。1h nmr(400mhz,cdcl3)δ10.14(s,1h),9.49(s,1h),8.30(d,j=3.7hz,1h),8.19(dd,j=10.5,2.3hz,1h),8.10(d,j=2.1hz,1h),7.51(dd,j=8.8,4.5hz,1h),7.42(s,1h),7.27(s,1h),7.02(td,j=9.0,2.5hz,1h),6.35(d,j=15.6hz,2h),5.68(d,j=11.8hz,1h),3.48
–
3.40(m,1h),2.96(s,2h),2.74(s,3h),2.38(s,8h),1.19
–
1.06(m,4h)。
[0263]
实施例15:n-(5-((4-(苯并[b]噻吩-3-基)嘧啶-2-基)氨基)-4-氯-2-((2-(二甲氨基)乙基)(甲基)氨基)苯基)丙烯酰胺的合成:
[0264][0265]
步骤1:n
1-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-2-氯-n
4-(2-(二甲氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺的合成
[0266]
4-(苯并[b]噻吩-3-基)-2-氯嘧啶(83mg,0.34mmol)与5-氯-n
1-(2-(二甲氨基)乙基)-n
1-甲基-2-硝基苯-1,4-二胺(110mg,0.40mmol)溶于2-戊醇(10ml)中,加入对甲苯磺酸(75mg,0.44mmol),加热至120℃,反应过夜,tlc检测反应完全,倒入冰水中,乙酸乙酯萃取,无水硫酸钠干燥,减压浓缩,过柱纯化得50mg黄色固体,收率30.8%。
[0267]
步骤2:n
4-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-5-氯-n
1-(2-(二甲氨基)乙基)-n
1-甲基苯基-1,2,4-三胺的合成n
1-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-2-氯-n
4-(2-(二甲氨基)乙基)-n
4-甲基-5-硝基苯-1,4-二胺(100mg,0.21mmol)溶于甲醇(20ml)中,加入铁粉(70mg,1.24mmol)和乙酸(10mg),加热至70℃,反应2小时,tlc检测反应完全,过滤,滤液中加水,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩,制备板纯化得70mg淡黄色固体,收率74.7%。1h nmr(400mhz,cdcl3)δ8.68(d,j=8.2hz,1h),8.51(d,j=5.2hz,1h),8.09(s,1h),8.03(s,1h),7.97
–
7.90(m,1h),7.57(s,1h),7.53
–
7.40(m,2h),7.16(d,j=5.2hz,1h),6.98(d,j=4.8hz,1h),3.24(dd,j=14.1,8.4hz,2h),3.10(dd,j=11.1,6.4hz,2h),2.81(s,6h),2.70(s,3h)。
[0268]
步骤3:n-(5-((4-(苯并[b]噻吩-3-基)嘧啶-2-基)氨基)-4-氯-2-((2-(二甲氨基)乙基)(甲基)氨基)苯基)丙烯酰胺的合成
[0269]n4-(4-(苯并[b]噻吩-3-基)嘧啶-2-基)-5-氯-n
1-(2-(二甲氨基)乙基)-n
1-甲基苯基-1,2,4-三胺(70mg,0.15mmol)溶于二氯甲烷(20ml)中,加入dipea(24mg,0.18mmol),冰浴下滴加丙烯酰氯(14mg,0.15mmol),10分钟后,tlc检测反应完全,倒入冰水中,二氯甲烷萃取,无水硫酸钠干燥,减压浓缩,制备板纯化得30mg淡黄色固体,收率38.5%。1h nmr(600mhz,cdcl3)δ10.28(s,1h),9.80(s,1h),8.62
–
8.55(m,2h),8.44(d,j=8.1hz,1h),7.93(d,j=8.0hz,1h),7.54(s,1h),7.47(t,j=7.4hz,1h),7.41(t,j=7.4hz,1h),7.24(d,j=5.1hz,2h),6.51(d,j=16.8hz,1h),6.33(s,1h),5.77(d,j=9.8hz,1h),2.87(s,2h),2.73(s,3h),2.30(s,8h)。
[0270]
实施例16:n-(4-氯-2-(2-(二甲基氨基)乙氧基)-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺的合成
[0271][0272]
步骤1:n-(2-氯-4-(2-(二甲基氨基)乙氧基)-5-硝基苯基)-4-(1-甲基-1h-吲哚-3-基)嘧啶-2-胺的合成
[0273]
将化合物2-(二甲基氨基)乙烷-1-醇(88mg,0.98mmol)溶于无水二氧六环(5ml)中,在冰水浴冷却下加入60%nah(36mg,0.91mmol),冰水浴冷却下搅拌反应10分钟后,将化合物n-(2-氯-4-氟-5-硝基苯基)-4-(1-甲基-1h-吲哚-3-基)嘧啶-2-胺(300mg,0.75mmol)加入反应液中,室温下搅拌反应8个小时。反应完毕后,将反应液倒入水中,用乙酸乙酯萃取,有机相用饱和食盐水洗,无水硫酸钠干燥,浓缩。柱层析分离得到黄色色固体。(260mg,收率:73.8%)1h nmr(400mhz,cdcl3)δ9.44(s,1h),8.41(d,j=5.3hz,1h),8.19(d,j=6.8hz,1h),8.14(s,1h),7.47(s,1h),7.41(d,j=7.3hz,1h),7.37
–
7.27(m,3h),7.23(d,j=5.4hz,1h),4.32(t,j=6hz,2h),2.87(s,3h),2.71(t,j=6hz,2h),2.27(s,6h).
[0274]
步骤2:6-氯-4-(2-(二甲基氨基)乙氧基)-n
1-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)苯-1,3-二胺的合成
[0275]
将化合物n-(2-氯-4-(2-(二甲基氨基)乙氧基)-5-硝基苯基)-4-(1-甲基-1h-吲哚-3-基)嘧啶-2-胺(100mg,0.21mmol),铁粉(60mg,1.07mmol)和氯化铵(92mg,1.71mmol)加入反应瓶中,然后加入etoh/h2o=4/1(8ml)溶液,回流反应2个小时,冷却,用硅藻土过滤,用二氯甲烷洗,用二氯甲烷萃取,无水硫酸钠干燥,浓缩得到目标化合物(80mg,收率:85.5%)。
[0276]
步骤3:n-(4-氯-2-(2-(二甲基氨基)乙氧基)-5-((4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)氨基)苯基)丙烯酰胺的合成
[0277]
将丙烯酰氯(17mg,0.18mmol)在二氯甲烷(1ml)中的溶液逐滴滴加到在冰水浴中冷却的6-氯-4-(2-(二甲基氨基)乙氧基)-n1-(4-(1-甲基-1h-吲哚-3-基)嘧啶-2-基)苯-1,3-二胺(80mg,0.18mmol)和dipea(29mg,0.22mmol)在二氯甲烷(5ml)中的经搅拌混合物中。反应30分钟后,用二氯甲烷稀释,用饱和碳酸氢钠洗涤,水相用二氯甲烷萃取两次,合并有机相,无水硫酸钠干燥,浓缩,柱层析分离得到目标化合物(27mg,收率:37.05%)。1h nmr
70℃,滴加二异丁基氢化铝的甲苯溶液(1.0m,15.6ml,15.6mmol)。反应液在搅拌的同时,在3小时内缓慢升至-20℃。滴加甲醇淬灭反应。加入饱和酒石酸钾钠水溶液至固体全溶。分液,有机相用饱和食盐水(20ml)洗,用无水硫酸钠干燥,浓缩。所得残余物经柱层析分离得到淡黄色固体。(2.3g,10.2mmol,收率:78%)。ms(esi)m/z:222.3[m+h].
[0297]
步骤3:(5-溴吡咯[1,2-b]哒嗪-7-基)甲醇的合成
[0298]
将5-溴吡咯[1,2-b]哒嗪-7-甲醛(2.3g,10.2mmol)的四氢呋喃(50ml)溶液在冰水浴中冷却,加入硼氢化钠(456mg,12.0mmol),搅拌反应1小时。滴加稀盐酸(1m)并搅拌20分钟。过滤并收集滤液,向滤液中加入乙酸乙酯(100ml)和饱和碳酸氢钠水溶液(100ml)萃取,分液后,有机相用饱和食盐水(30ml)洗,用无水硫酸钠干燥,浓缩得到白色固体直接用于下一步。(2.3g,10.1mmol,粗产率:99%)。ms(esi)m/z:227.1[m+h].
[0299]
步骤4:5-溴-7-甲基吡咯[1,2-b]哒嗪的合成
[0300]
室温下,向(5-溴吡咯[1,2-b]哒嗪-7-基)甲醇(2.3g,10.1mmol)的无水二氯甲烷(50ml)溶液中加入三乙基硅烷(1.91g,12.0mmol)和三氟乙酸(5.9ml,80mmol),搅拌反应4小时。反应完毕后,旋蒸除去大部分溶剂。用二氯甲烷(50ml)和饱和碳酸氢钠水溶液(50ml)萃取残余物。分液后,用二氯甲烷(20ml)萃取水相。合并有机相,用饱和食盐水(20ml)洗,用无水硫酸钠干燥,浓缩,柱层析分离得到淡黄色固体。(1.0g,4.74mmol,收率:47%)。ms(esi)m/z:211.2[m+h].
[0301]
步骤5:(7-甲基吡咯[1,2-b]哒嗪-5-基)硼酸的合成
[0302]
在-78℃冷浴中,向5-溴-7-甲基吡咯[1,2-b]哒嗪(2.0g,9.48mmol)的四氢呋喃(50ml)溶液中滴加正丁基锂(2.5m正己烷溶液,4.4ml,11mmol)。反应溶液在-78℃下搅拌20分钟,加入异丙醇频哪醇硼酸酯(2.6g,14mmol)。反应液在1小时内缓慢升至室温。加入水(50ml)和乙酸乙酯(50ml)萃取,分液后,有机相用饱和食盐水(20ml)洗,用无水硫酸钠干燥,浓缩,柱层析分离得到类白色固体。(0.94g,3.6mmol,收率:38%)。
[0303]
步骤6:2-氯-4-(7-甲基吡咯[1,2-b]哒嗪-5-基)嘧啶-5-羧酸异丙酯的合成
[0304]
在氮气氛围下,向(7-甲基吡咯[1,2-b]哒嗪-5-基)硼酸(0.94g,3.6mmol)、2,4-二氯嘧啶-5-羧酸异丙酯(0.87g,3.7mmol)、碳酸钠(0.687g,6.48mmol)、1,4-二氧六环(30ml)和水(7ml)的混合物中加入双三苯基膦二氯化钯(0.253g,0.36mmol),置换氮气,加热反应至80℃搅拌反应15小时。冷却至室温,加入乙酸乙酯(70ml)和水(50ml)萃取、分液,有机相用饱和食盐水(20ml)洗,用无水硫酸钠干燥,浓缩,柱层析分离得到白色固体。(255mg,0.77mmol,收率:21%)。ms(esi)m/z:331.2[m+h].
[0305]
步骤6至步骤10:异丙基2-((5-丙烯酰胺基-2-氯-4-((2-(二甲氨基)乙基)(甲基)氨基)苯基)氨基)-4-(7-甲基吡咯[1,2-b]哒嗪-5-基)嘧啶-5-羧酸酯的合成
[0306]
使用实施例17的合成中步骤2至步骤5的方法,得到白色固体。(15.1mg,0.0255mmol,四步总收率:3.3%)。1h nmr(400mhz,dmso)δ10.30(s,1h),9.39(s,1h),9.12(d,j=7.0hz,1h),8.65(d,j=9.0hz,2h),7.98(s,1h),7.46(s,1h),7.17(t,j=7.5hz,1h),6.59(s,1h),6.43(dd,j=16.9,10.1hz,1h),6.27(d,j=16.7hz,1h),5.81(d,j=10.5hz,1h),5.06(dd,j=12.3,6.2hz,1h),3.84(m,3h),2.86(m,2h),2.73(s,3h),2.36(m,2h),2.22(s,6h),1.17(d,j=6.2hz,6h).ms(esi)m/z:591.4[m+h].
[0307]
细胞活性实验
[0308]
1.细胞:nci-h1975、pc-9和a431,均来自中国科学院上海细胞库。
[0309]
2.试剂:hyclone dmem高糖培养基,rpmi 1640培养基,mem培养基,tryple,mtt(5mg/ml),dmso,dpbs。
[0310]
3.仪器:37℃,5%co2培养箱,utrao酶标仪,生物安全柜,细胞计数板,奥特光学显微镜。
[0311]
4.实验耗材:96孔板货号:3599,96孔圆底配药板。
[0312]
nci-h1975细胞的活性测试实验步骤:
[0313]
1.铺板:将处于对数生长期的细胞用tryple消化,新鲜培养基终止,对细胞进行计数,用新鲜培养基将细胞浓度调整到11111个/ml,每孔加90μl,其他边缘用无菌dpbs填充。
[0314]
2.于37℃,5%co2培养箱中孵育24小时,让细胞铺满孔底50%左右。
[0315]
3.实验组配药:将药物用dmso溶解,配成20mmol/l储液,再用dmso将其进行稀释,制成2mmol/l,依次稀释3倍,8个浓度梯度,得到200
×
的化合物梯度溶液,取10μl梯度化合物溶液加到190μlμl rpmi1640培养基中,得到10
×
梯度化合物溶液,取10μl10
×
化合物溶液加到90μl 96孔细胞培养板中,每个梯度三个重复,化合物在96孔细胞培养板中的浓度梯度为0.05080526nm、1.524158nm、4.572474nm、13.717420nm、41.152260nm、123.456800nm、370.370400nm、1111.111000nm、3333.333000nm、10000.000000nm,每孔100μl,dmso终浓度为0.5%。
[0316]
对照组,含与实验组相同体积的溶剂,用完全培养基稀释,每孔100μl。
[0317]
4.于37℃下在5%co2培养箱中孵育72h。
[0318]
5.72h后,每孔加入20μl mtt溶液(5mg/ml),继续培养4h。
[0319]
6.终止培养,小心吸去孔内的培养液。
[0320]
7.调零孔,实验组,对照组每孔加入150μl二甲基亚砜(dmso),在酶标仪中速震荡10s,结晶物充分溶解,492nm波长处测其吸光值。
[0321]
化合物1-16的ic
50
值如表1所示。
[0322]
pc-9细胞的活性测试实验步骤:
[0323]
1.铺板:将处于对数生长期的细胞用tryple消化,新鲜培养基终止,对细胞进行计数,用新鲜培养基将细胞浓度调整到11111个/ml,每孔加90μl,其他边缘用无菌dpbs填充。
[0324]
2.于37℃,5%co2培养箱中孵育24小时,让细胞铺满孔底50%左右。
[0325]
3.实验组配药:将药物用dmso溶解,配成20mmol/l储液,再用dmso将其进行稀释,制成2mmol/l,依次稀释3倍,8个浓度梯度,得到200
×
的化合物梯度溶液,取10μl梯度化合物溶液加到190μl rpmi1640培养基中,得到10
×
梯度化合物溶液,取10μl10
×
化合物溶液加到90μl 96孔细胞培养板中,每个梯度三个重复,化合物在96孔细胞培养板中的浓度梯度为0.05080526nm、1.524158nm、4.572474nm、13.717420nm、41.152260nm、123.456800nm、370.370400nm、1111.111000nm、3333.333000nm、10000.000000nm,每孔100μl,dmso终浓度为0.5%。
[0326]
对照组,含与实验组相同体积的溶剂,用完全培养基稀释,每孔100μl。
[0327]
4.于37℃下在5%co2培养箱中孵育72h。
[0328]
5.72h后,每孔加入20μlmtt溶液(5mg/ml),继续培养4h。
[0329]
6.终止培养,小心吸去孔内的培养液。
[0330]
7.调零孔,实验组,对照组每孔加入150μl二甲基亚砜(dmso),在酶标仪中速震荡10s,结晶物充分溶解,492nm波长处测其吸光值。
[0331]
化合物1-16的ic
50
值如表1所示。
[0332]
a431细胞的活性测试实验步骤:
[0333]
1.铺板:将处于对数生长期的细胞用tryple消化,新鲜培养基终止,对细胞进行计数,用新鲜培养基将细胞浓度调整到11111个/ml,每孔加90μl,其他边缘用无菌dpbs填充。
[0334]
2.于37℃,5%co2培养箱中孵育24小时,让细胞铺满孔底50%左右。
[0335]
3.实验组配药。将药物用dmso溶解,配成20mmol/l储液,再用dmso将其进行稀释,制成2mmol/l,依次稀释3倍,8个浓度梯度,得到200
×
的化合物梯度溶液,取10μl梯度化合物溶液加到190μl rpmi1640培养基中,得到10
×
梯度化合物溶液,取10μl10
×
化合物溶液加到90μl96孔细胞培养板中,每个梯度三个重复,化合物在96孔细胞培养板中的浓度梯度为0.05080526nm、1.524158nm、4.572474nm、13.717420nm、41.152260nm、123.456800nm、370.370400nm、1111.111000nm、3333.333000nm、10000.000000nm,每孔100μl,dmso终浓度为0.5%。
[0336]
对照组,含与实验组相同体积的溶剂,用完全培养基稀释,每孔100μl。
[0337]
4.于37℃下在5%co2培养箱中孵育72h。
[0338]
5.72h后,每孔加入20μl mtt溶液(5mg/ml),继续培养4h。
[0339]
6.终止培养,小心吸去孔内的培养液。
[0340]
7.调零孔,实验组,对照组每孔加入150μl二甲基亚砜(dmso),在酶标仪中速震荡10s,结晶物充分溶解,492nm波长处测其吸光值。
[0341]
化合物1-17的ic
50
值如表1所示:
[0342]
表1化合物1-17的细胞活性检测实验结果
[0343]
[0344][0345]
‑‑
表示未作检测利用ctg方法评价化合物17对2株exon20插入细胞株的细胞增殖的影响:
[0346]
细胞培养:
[0347]
细胞系细胞系类型生长特点完全培养基ba/f3-egfr-v769_d770insasv小鼠原b细胞悬浮rpmi-1640+10%fbsba/f3-erbb2-a775_g776insyvma小鼠原b细胞悬浮rpmi-1640+10%fbs
[0348]
实验试剂耗材
[0349]
材料供应商货号rpmi1640hyclonesh30809.01fetal bovine serum(fbs)gibco10099-141phosphate buffered saline(pbs)solarbiop1020-500dmsosigmad8418-1lcelltiter glo assay kitpromegag7573white 96-cell culture plate上海晶安生物科技有限公司j09601
[0350]
实验仪器设备
[0351][0352]
细胞增殖实验:
[0353]
所有细胞株于37℃,5%co2条件下培养于完全培养基。
[0354]
收获处于对数生长期的细胞并采用血小板计数器进行细胞计数。用台盼蓝排斥法检测细胞活力,确保细胞活力在90%以上。使用完全培养基调整细胞密度,随后接种于96孔细胞培养板,每孔接种90μl,共3000个细胞。将96孔板中的细胞置于37℃、5%co2条件下培养。配制10倍药物溶液,检测最高浓度为1μm,9个浓度,3.16倍稀释,然后转移连续稀释化合物各10μl至96孔细胞板的相应实验孔中,每个药物浓度设置三个复孔。将已加药的96孔板中的细胞置于37℃、5%co2条件下继续培养72小时,之后进行ctg分析。融化ctg试剂并平衡细胞板至室温30分钟。每孔加入等体积的ctg溶液。
[0355]
在定轨摇床上振动5分钟使细胞裂解。将细胞板放置于室温20分钟以稳定冷光信号。读取冷光值,收集数据。使用graphpad prism 7.0软件分析数据,利用非线性s曲线回归来拟合数据得出剂量-效应曲线,并由此计算ic50值。细胞存活率(%)=(lum待测药-lum培养液对照)/(lum细胞对照-lum培养液对照)
×
100%.
[0356]
受试化合物抗细胞增殖数据结果:
[0357][0358]
评价化合物在icr小鼠口服给药后的血脑屏障通透率实验
[0359]
实验动物:雄性icr小鼠,购于昭衍新药研究中心。
[0360]
实验动物饲养室的环境条件:实验动物均饲养于恒温恒湿的独立通风盒内,饲养室温度24~26℃,湿度37~51%,10-20次/小时换气,昼夜明暗交替时间12h/12h;持续供给钴60放射灭菌鼠全价颗粒饲料,不限量自由摄取,饮用自来水(高压蒸汽灭菌后使用),饮水瓶不间断供水,自由摄取。饲养鼠盒是聚碳酸脂鼠盒,无病原微生物,规格为325mm
×
210mm
×
180mm;垫料是玉米芯,每盒3只动物。
[0361]
组别n给药组剂量(mg/kg)给药方式给药周期血浆和脑收取时间121化合物110p.o.单次给药15min,30min,1h,2h,4h,8h,24h221化合物610p.o.单次给药15min,30min,1h,2h,4h,8h,24h321化合物810p.o.单次给药15min,30min,1h,2h,4h,8h,24h421化合物1210p.o.单次给药15min,30min,1h,2h,4h,8h,24h
[0362]
注:1、n:动物只数;给药体积为10ul/g;
[0363]
2、给药和样品收取时间:每个时间点3只动物,共7个时间点,每个化合物21只动物。
[0364]
样品采集:
[0365]
单次给药后按照既定的时间点,分别在给药后15min、30min、1hr、2hr、4hr、8hr、24hr收集全血及脑。每只动物眼眶静脉丛采血后,收集约200μl全血于含edta的采血管中,并置于冰上,4000转/分离心20分钟,分离血浆于1.5ml的ep管中。取完血将动物安乐死后迅速摘取鼠脑,取脑后用冰水将脑组织上的残留血液清洗干净,用干医用纱布吸干脑组织上的残留水,称重后,立即冷冻保存,脑和血浆样本均存储于-80℃待测。
[0366]
血浆样品预处理:
[0367]
血浆样品:50μl血浆样品加至96孔板
→
添加200μl乙腈(含260ng/ml内标)
→
涡旋
→
以4000rpm离心20分钟
→
将150μl上清液转移至96孔板并与100μl水混合
→
涡旋10分钟
→
将10.0μl注入lc-ms/ms。
[0368]
脑样本预处理:
[0369]
脑样本:使用组织溶解器将脑样本用3倍的水匀浆,将频率设置为60hz,摇动时间60秒,每次均化60秒,直到获得均匀的匀质。将50μl脑匀浆样品加入96孔板
→
添加200μl乙腈(含260ng/ml内标)
→
涡旋
→
以4000rpm离心20分钟
→
将150μl上清液转移至96孔板并与100μl水混合
→
涡旋10分钟
→
将10.0μl注入lc-ms/ms。
[0370]
应用lc-ms/ms进样分析,实验所得参数均使用winnonlin7.0非房室模型进行计算。
[0371]
化合物1的b/p值为16.3,具有较好的透过血脑屏障能力。化合物1、5、8和12的时间浓度曲线分别参见图1至图4。
[0372]
体内药效实验
[0373]
动物:balb/c裸鼠,雌性,6-8周,重约18-20g,购自北京华阜康。
[0374]
每只裸鼠右侧皮下接种20-30mm3瘤块(nc-h1975模型),待肿瘤体积长到一定体积,分为两组,肿瘤平均约465mm3,开始给与对照0.5%hpmc/0.2%tween 80和化合物1、6、8、12(5mg/kg)处理,每周测量三次肿瘤体积,称重,给药17天,实验结束,测量肿瘤体积,小鼠称重,取出肿瘤称瘤重,记录实验数据,计算肿瘤抑制率和瘤重抑制率。
[0375]
化合物1具有较好的肿瘤抑制率。
[0376][0377][0378]
动物:scid beige小鼠,雄性,6-8周,重约17-20g,购自北京维通利华。每只鼠右侧皮下接种1x107个pc-9细胞,待肿瘤体积长到约220mm3,分为两组,开始给与对照0.5%hpmc/0.2%tween 80和化合物1、17(5mg/kg)处理,每周测量两次肿瘤体积,称重,给药15天,实验结束,小鼠称重,测量肿瘤体积,记录实验数据,计算肿瘤抑制率。
[0379]
化合物1和17具有较好的肿瘤抑制率。
[0380]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1