用以预防或治疗肾脏疾病的活性组分的候选物质的筛选装置和筛选方法与流程
用以预防或治疗肾脏疾病的活性组分的候选物质的筛选装置和筛选方法
1.本技术是基于申请号201780033224.4、申请日为2017年3月28日、发明名称“用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性组分的候选物质的筛选方法”的中国发明专利申请的分案申请。
技术领域
2.本发明涉及用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法和装置。本发明还涉及一种程序,该程序使计算机执行用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的功能。此外,本发明涉及用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的装置和程序。本发明还涉及用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官的每一个中疾病的存在和/或所述疾病的阶段的装置和程序。
背景技术:
3.疾病包括处于能够被可逆治疗的状态的那些疾病以及处于不能被可逆治疗的状态的那些疾病,即处于不可逆状态的疾病。在可逆状态期间异常的早期检测和治疗或预防这种状态的出现对于健康保持是非常必要的。即使在可逆状态下,疾病的早期检测直接导致较温和的治疗、较短的治疗期和较好的预后健康。在心脏病、脑疾病、癌症和糖尿病中,众所周知的是一个器官或组织中的异常导致其他器官的疾病状态(通常称为“并发症”)。在这些疾病中,必须尽可能早地预防一个器官或组织中的异常引起其他器官或组织的疾病。
4.在包括人类在内的所有动物中,各个器官和组织形成功能网络而不是作为单独的部分,并且实现个体水平的质量控制。通过遍布全身的血管网络输送内分泌因子(例如激素)以及通过神经网络协助调节器官功能是“器官间串扰系统(inter-organ cross-talk system)”的典型示例,并且系统化为生理学或内分泌学。
5.同时,全世界需要透析或肾移植的末期肾病(eskd)患者的数量一直在增加。在1990年至2000年的十年间,eskd患者的数量从430000增加到1065000,并且在2008年进一步增加到至少约1650000(非专利文献1)。慢性肾病(ckd)发展为eskd。然而,在被称为“沉默器官”的肾脏中,即使发生肾脏损伤,其状况也不太可能出现在临床数据等中。因此,在慢性肾病发病之前肾功能减退的早期检测是困难的。现有技术文献非专利文献
6.非专利文献1:lysaght mj:j am soc nephrol.2002年1月;13 suppl 1;s37-40。
技术实现要素:
发明解决的技术问题
7.ckd由于各种疾病(例如糖尿病、高血压等与生活方式有关的疾病;和尿路感染,尿路梗阻,肾小球肾炎,肾脏血管疾病(血流障碍),镇痛药引起的药物性肾病等泌尿系统疾病)而发展。因此,在肾功能已经降低后,首先进行这种原发疾病的治疗,以减缓肾功能减退的进展。此外,进行例如血压控制或饮食限制的治疗以减缓ckd的进展。此外,例如,当ckd进展时,针对对与慢性肾病相关的异常骨代谢,使用磷结合剂等进行药物治疗。
8.然而,目前没有阻止肾功能减退的进展的基础治疗药物。
9.本发明的一个目的是提供用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法和装置。本发明的另一个目的是提供一种药物组合物,用于抑制肾功能减退的进展或改善减退的肾功能,以及预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病。
10.本发明的另一个目的是提供用于在尽可能早的时间从肾脏以外的一个器官的细胞或组织中检测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的装置和程序。更具体地,本发明的另一个目的是从来自肾脏以外的一个或多个器官的器官间串扰指示剂,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段。本发明的又一个目的是从选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的状态,预测肾脏以外的一个或多个器官中的每一个中的疾病的存在和/或所述疾病的阶段。解决问题的方案
11.本发明人进行了广泛的研究,发现某些肾功能预测标记物蛋白质的表达在肾病的动物模型中增加。发明人发现,通过抑制这种肾功能预测标记物蛋白质的功能,可以抑制肾功能减退的进展,或者可以改善减退的肾功能。本发明人进一步发现,测试物质是否可以是用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质,可以通过观察这种肾功能预测标记物蛋白质在已经施用该测试物质的受试者中的表达或功能上的变化来筛选。
12.本发明人还关注于一种用于实现上述目的器官间串扰系统。本发明人进行了广泛的研究,发现可以提供一种装置和程序,用于从肾脏以外的器官的状态诊断选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的状态,以及用于通过使用该器官间串扰系统预测未来状态。
13.本发明基于这些发现而完成,并且包括以下实施方式。
14.项目1.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,所述装置包括以下计算工具:第一测量值获取工具,用于获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和确定工具,用于基于由所述第一测量值获取工具获取的所述测量值确定所述测试物质是所述活性成分的候选物质。
15.项目2.根据项目1所述的装置,还包括:第二测量值获取工具,用于获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和测量值比较工具,用于将所述经测试物质处理的试样的测量值与所述未经处理的试样的测量值进行比较,其中,所述确定工具基于由所述测量值比较工具获取的比较结果,确定所述测试物质是所述活性成分的候选物质。
16.项目3.根据项目1或2所述的装置,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
17.项目4.一种筛选程序,当由计算机执行时,使所述计算机进行以下处理以筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质:第一测量值获取处理,获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和确定处理,基于由所述第一测量值获取处理获取的所述测量值确定所述测试物质是所述活性成分的候选物质。
18.项目5.根据项目4所述的筛选程序,其中,所述程序还使所述计算机执行以下处理:第二测量值获取处理,获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和测量值比较处理,将所述经测试物质处理的试样的测量值与所述未经处理的试样的测量值进行比较,在所述确定处理中,基于由所述测量值比较处理获取的比较结果,确定所述测试物质是所述活性成分的候选物质。
19.项目6.根据项目4或5所述的筛选程序,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
20.项目7.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,所述方法包括以下步骤:(i)获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试
样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和(ii)基于步骤(i)中获取的所述测量值确定所述测试物质是所述活性成分的候选物质。
21.项目8.根据项目7所述的方法,在步骤(i)和(ii)之间还包括,将步骤(i)中获取的所述经测试物质处理的试样的测量值与从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值进行比较的步骤。
22.项目9.根据项目7或8所述的方法,在步骤(i)之前,包括以下步骤:(i)用所述测试物质处理所述受试者(不包括人)、测试组织或测试细胞;(ii)从步骤(i)中经所述测试物质处理的所述受试者、测试组织或测试细胞采集所述试样;和(iii)从步骤(ii)中获取的所述试样中采集所述蛋白质和/或所述mrna。
23.项目10.根据项目7-9中任一项所述的方法,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
24.项目11.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,所述方法包括以下步骤:(a)检测从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质和/或所述蛋白质的mrna;和(b)基于步骤(a)中获取的结果确定所述测试物质是所述活性成分的候选物质。
25.项目12.根据项目11所述的方法,在步骤(a)和(b)之间还包括将步骤(a)中获取的所述经测试物质处理的试样的检测结果与从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的对应的肾功能预测标记物蛋白质和/或所述蛋白质的mrna的检测结果进行比较的步骤。
26.项目13.根据项目11或12所述的方法,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
27.项目14.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,所述装置包括以下计算工具:第一评价结果获取工具,用于获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功
能的评价结果;和确定工具,用于基于由所述第一评价结果获取工具获取的所述评价结果确定所述测试物质是所述活性成分的候选物质。
28.项目15.根据项目14所述的装置,还包括:第二评价结果获取工具,用于获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的功能的评价结果;和评价结果比较工具,用于将所述经测试物质处理的试样的评价结果与所述未经处理的试样的评价结果进行比较,其中,所述确定工具基于所述评价结果比较工具获取的比较结果确定所述测试物质是所述活性成分的候选物质。
29.项目16.根据项目14或15所述的装置,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
30.项目17.一种筛选程序,当由计算机执行时,使所述计算机进行以下处理以筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质:第一评价结果获取处理,获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能的评价结果;和确定处理,基于所述第一评价结果获取处理获取的所述评价结果确定所述测试物质是所述活性成分的候选物质。
31.项目18.根据项目17所述的筛选程序,其中,所述程序还使所述计算机执行以下处理:第二评价结果获取处理,获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的功能的评价结果;和评价结果比较处理,将所述经测试物质处理的试样的评价结果与所述未经处理的试样的评价结果进行比较;在所述确定处理中,基于所述评价结果比较处理获取的比较结果确定所述测试物质是所述活性成分的候选物质。
32.项目19.根据项目17或18所述的筛选程序,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
33.项目20.
一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,所述方法包括以下步骤:(i)评价从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能;和(ii)基于步骤(i)中获取的评价结果确定所述测试物质是所述活性成分的候选物质。
34.项目21.根据项目20所述的方法,在步骤(i)和(ii)之间还包括将步骤(i)中获取的所述经测试物质处理的试样的评价结果与从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的对应的肾功能预测标记物蛋白质的功能的评价结果进行比较的步骤。
35.项目22.根据项目20或21所述的方法,在步骤(i)之前包括以下步骤:(i)用所述测试物质处理所述受试者(不包括人)、测试组织或测试细胞;和(ii)从步骤(i)中经所述测试物质处理的所述受试者、测试组织或测试细胞采集所述试样。
36.项目23.根据项目20-22中任一项所述的方法,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
37.项目24.一种用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的装置,所述装置包括以下计算工具:受试者数据获取工具,用于获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;模式相似度计算工具,用于通过将由所述受试者数据获取工具获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算在所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和预测工具,用于通过使用由所述模式相似度计算工具所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段;其中,所述受试者的数据是所述器官间串扰指示剂的模式,所述模式表示除所述受试者的肾脏以外的器官中的所述器官间串扰指示剂的量和与肾脏中没有疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的关系,并且所述标准数据1包括所述器官间串扰指示剂的模式,每个所述模式来自患有选自
由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。
38.项目24-1.根据项目24所述的装置,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
39.项目25.一种预测程序,当由计算机执行时,使所述计算机执行以下处理以预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段:受试者数据获取处理,获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;模式相似度计算处理,通过将由所述受试者数据获取处理获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算在所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中,所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和预测处理,通过使用由模式相似度计算处理所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的存在和/或所述疾病的阶段;其中,所述受试者的数据是所述器官间串扰指示剂的模式,所述模式表示除所述受试者的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的关系,并且,所述标准数据1包括所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照中的肾脏以外的所述器官中的所述器官间串扰指示剂的量和与肾脏中没有疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。
40.项目25-1.根据项目25所述的预测程序,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
41.项目26.一种用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的方法,所述方法包括以下步骤:
(1)获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;(2)通过将步骤(1)中获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和(3)当从步骤(2)中所计算的所述器官间串扰指示剂的模式的相似度确定两种模式相似时,确定所述受试者具有与标准数据1相对应的疾病和/或处于与标准数据1相对应的疾病的阶段;其中,所述受试者的数据是所述器官间串扰指示剂的模式,所述模式表示除所述受试者的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的关系,并且所述标准数据1包括所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的所述器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。
42.项目26-1.根据项目26所述的方法,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
43.项目27.一种用于获取用以预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的关于器官间串扰指示剂的模式的相似度的信息的方法,所述方法包括以下步骤:(1)获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;和(2)通过将步骤(1)中获取的所述受试者的数据与对应的器官间串扰指示剂的预定标准数据1进行比较,计算所述受试者的数据与所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,并且获取关于所述相似度的信息;其中,所述受试者的数据是所述器官间串扰指示剂的模式,该模式表示所述受试者的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应器官间串扰指示剂的量之间的关系,和所述标准数据1包括所述器官间串扰指示剂的模式,每个所述模式来自患有选自
由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的所述器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。
44.项目27-1.根据项目27所述的方法,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
45.项目28.一种用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官的每一个中疾病的存在和/或所述疾病的阶段的装置,所述装置包括以下计算工具:阶段信息获取工具,用于获取关于所述受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;阶段信息检验工具,用于相对于标准数据2检验由所述阶段信息获取工具获取的关于所述阶段的信息;模式提取工具,用于基于由所述阶段信息检验工具获取的结果,提取所述受试者的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和预测工具,用于通过使用由所述模式提取工具所获取的所述器官间串扰指示剂的模式作为量度预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段;其中所述标准数据2包括预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。
46.项目28-1.根据项目28所述的装置,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
47.项目29.一种预测程序,当由计算机执行时,使所述计算机执行以下处理以预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中的疾病的存在和/或所述疾病的阶段:阶段信息获取处理,获取关于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;阶段信息比较处理,相对于标准数据2检验由所述阶段信息获取处理获取的关于所述阶段的信息;
模式提取处理,基于由所述阶段信息比较处理获取的结果,提取所述受试者中的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和预测处理,通过使用由所述模式提取处理所获取的所述器官间串扰指示剂的模式作为量度,预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段;其中所述标准数据2包括预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。
48.项目29-1.根据项目29所述的预测程序,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
49.项目30.一种用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段的方法,所述方法包括以下步骤:(i)从所述受试者的诊断结果获取关于所述受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;(ii)相对于标准数据2检验步骤(i)中获取的关于所述阶段的信息;(iii)基于在步骤(ii)中获取的检验结果,从所述标准数据2确定处于对应于关于所述阶段的信息的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的标准数据α,以及从所述标准数据α提取所述受试者中肾脏以外的一个或多个器官中的每一个中的对应于所述受试者中的阶段的器官间串扰指示剂的模式;(iv)相对于关于在疾病和/或所述疾病的阶段中的器官间串扰指示剂的已知信息检验步骤(iii)中提取的所述器官间串扰指示剂的模式,以及确定与所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式相对应的除了肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段;和(v)进一步确定在步骤(iv)中确定的肾脏以外的所述一个或多个器官中的每一个中的所述疾病是所述受试者可能正患有的疾病,和/或确定在步骤(iv)中确定的肾脏以外的所述一个或多个器官中的每一个中的所述疾病的阶段是所述受试者正患有的疾病的阶段,其中所述标准数据2包括预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与在肾脏中没有疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的预定关系。
50.项目30-1.根据项目30所述的方法,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
51.项目31.一种用于获取用以预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官的每一个中疾病的存在和/或所述疾病的阶段的信息的方法,该方法包括以下步骤:(i)从所述受试者的诊断结果中获取关于所述受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;(ii)相对于标准数据2检验关于步骤(i)中获取的所述阶段的信息;(iii)基于步骤(ii)中获取的检验结果,从所述标准数据2,确定处于对应于关于所述阶段的信息的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的标准数据α,以及从所述标准数据α,提取对应于所述受试者的肾脏以外的一个或多个器官的每一个中的所述受试者的阶段的器官间串扰指示剂的模式;和(iv')针对关于疾病和/或所述疾病的阶段中的器官间串扰指示剂的已知信息,检验步骤(iii)中提取的所述器官间串扰指示剂的模式,并且获取关于所述受试者中的肾脏以外的所述一个或多个器官中的每一个中的所述器官间串扰指示剂的模式所对应的肾脏以外的所述一个或多个器官中的每一个中的疾病的存在和/或所述疾病的阶段的信息,其中所述标准数据2包括预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与肾脏中没有疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。
52.项目31-1.根据项目31所述的方法,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
53.项目32.一种用于生成器官间串扰指示剂的模式的标准数据的方法,所述标准数据用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段,所述方法包括以下步骤:针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;确定所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢
性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的所述阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定;和将所述器官间串扰指示剂的模式与选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的对应阶段相关联。
54.项目32-1.根据项目32所述的方法,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。
55.项目33.一种用于生成器官间串扰指示剂的模式的标准数据的方法,所述标准数据用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个疾病的存在和/或所述疾病的阶段,所述方法包括以下步骤:针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;和确定针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定。
56.项目33-1.根据项目33所述的方法,其中,所述器官间串扰指示剂是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。发明的有益效果
57.根据本发明的一个实施方式,可提供用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法。
58.此外,根据本发明的一个实施方式(反向器官(reverse iorgans)),除了肾脏以外的器官的状态的细微变化与肾脏中的细微变化相关联,以捕获整个肾脏或肾脏组织中的细微变化,因此本发明可以比常规诊断方法更早地检测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病。此外,评价多个器官或组织中的这种相关性的装置或程序的使用使得可以通过诊断一个器官或组织来诊断多个器官或组织,从而显著提高诊断效
率。根据本发明的一个实施方式(正向器官(forward iorgans)),从通过使用常规诊断方法已经确认具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的肾脏的状态而推断出通过使用常规测试还不能被诊断为具有异常的器官的状态;因此,可以较早地检测出由选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病引起的其他器官或组织中的异常,以及可以预防或治疗二级和三级疾病(如肾衰竭、肝病、和癌症转移)。
附图说明
59.图1是根据本发明第一实施方式的系统100的概图。图2是示出根据本发明第一实施方式的系统100的硬件配置的框图。图3是示出根据本发明第一实施方式的筛选装置1的功能的框图。图4是示出由根据本发明第一实施方式的筛选装置1执行的数据处理流程以执行筛选方法的流程图。图5是根据本发明第二实施方式的系统110的概图。图6是示出根据本发明第二实施方式的系统110的硬件配置的框图。图7是示出根据本发明第二实施方式的筛选装置2的功能的框图。图8是表示根据本发明第二实施方式的筛选装置2执行的数据处理流程以执行筛选方法的流程图。图9示意性地示出根据本发明的reverse iorgans的轮廓。图10示意性地示出根据本发明的reverse iorgans的轮廓。图11示意性地示出根据本发明的forward iorgans的轮廓。图12示意性地示出根据本发明的forward iorgans的轮廓。图13是根据本发明第三实施方式的系统120的概图。图14是示出根据本发明第三实施方式的系统120的硬件配置的框图。图15是示出根据本发明第三实施方式的预测装置6的功能的框图。图16是示出根据本发明第三实施方式的预测装置6执行的数据处理流程以执行预测方法的流程图。图17是根据本发明第四实施方式的系统130的概图。图18是示出根据本发明第四实施方式的系统130的硬件配置的框图。图19是示出根据本发明第四实施方式的预测装置7的功能的框图。图20是示出根据本发明第四实施方式的预测装置7执行的数据处理流程以执行预测方法的流程图。图21是通过例如rna序列可以被检测到的小鼠中的基因列表。在图21中,“行号”表示列表中的行编号,“基因名称”表示在美国国家生物技术信息中心(ncbi)登记的基因名称,以及“参考序列号id”表示ncbi登记的参考序列id号。“染色体位置”表示以mm10登记的染色体位点。图22:检查其表达水平的基因如下进行分类。其中ckd/sham大于1或小于1的基因被分类为组2,其中ckd/sham大于1.5或小于0.67的基因被分类为组3,其中ckd/sham大于2或者小于0.5的基因被分类为组4,并且其中ckd/sham大于5或小于0.2的基因被分类为组5。
在图22中,“行号”表示列表中的行编号,“组”表示基于ckd/sham值分类的每个组的组编号,“基因名称”表示用ncbi登记的基因名称,“人基因id”表示在ncbi登记的对应于该基因名称的人基因编号,以及“更新”表示ncbi中人基因id的更新日期。在“子组”中,“v-1”表示组5的基因中的基因,其中ckd/sham大于5;以及“v-2”表示组5的基因中的基因,其中ckd/sham小于0.2。“iv-1”表示组4的基因中的基因,其中ckd/sham大于2且未包括在组5中;并且“iv-2”表示组4的基因中的基因,其中ckd/sham小于0.5并且未包括在组5中。“iii-1”表示组3中的基因中的基因,其中ckd/sham大于1.5并且不包括在组4或组5中;并且“iii-2”表示组3中的基因中的基因,其中ckd/sham小于0.67且不包括在组4或组5中。“ii-1”表示组2中的基因中的基因,其中ckd/sham大于1且不包括在组3-5中的任一组中,并且“ii-2”表示组2的基因中的基因,其中ckd/sham小于1且不包括在组3至5中的任一组中。没有组号的基因是ckd/sham为1的组。图23示出sham》1且ckd/sham》5的基因、sham《1且ckd》10的基因、以及sham》10且ckd/sham《0.3的基因在初期阶段和中期阶段的表达水平。图24示出用于获取oscar基因突变小鼠的基于crispr/cas9的突变位点和ssodn序列。图24a示出oscar-grna1的突变位点和ssodn序列。图24b示出oscar-grna2的突变位点和ssodn序列。图24c示出获取的小鼠中的oscar的表型。图25示出在unx/hpi模型小鼠(在sham组中低磷含量的饮食)中开始高磷含量的饮食后1周(e)、4周(m)和8周(l)的颅骨中的火山图。图26a示出每种组织中oscar基因表达的deseq分析结果。图26b示出通过qrt-pcr检验的unx/hpi模型小鼠和假手术小鼠(sham mice)在e,m和l阶段时oscar mrna的表达结果。图26c示出通过qrt-pcr确认的肾脏中的oscar基因的表达结果。在这些图中,***表示p《0.001,以及n.s.表示没有显著差异。图27示出通过qrt-pcr确认的颅骨中fgf23基因的表达结果。在该图中,**表示p《0.01,以及***表示p《0.001。图28a示出在从正常饮食转换为低磷含量的饮食或高磷含量的饮食后1天、3天、1周和4周时颅骨中oscar基因的表达。图28b示出在从正常饮食转换为低磷含量饮食或高磷含量饮食后1天、3天、1周和4周时颅骨中fgf23基因的表达。在这些图中,*表示p《0.05,**表示p《0.01,***表示p《0.001,和n.s.表示没有显著差异。图29示出fgf23在正常小鼠和喂食高磷含量的饮食的oscar基因突变小鼠的骨中fgf23的表达。**表示p《0.01。图30示出颅骨中fgf23的qrt-pcr结果。hp4w表示高磷含量的饮食开始后4周的小鼠,lp4w表示低磷含量的饮食开始4周后的小鼠(对照组)。soscar表示施用可溶性人oscar-fc融合蛋白的小鼠,ns表示施用生理盐水代替可溶性人oscar-fc融合蛋白的小鼠。图31示出腮腺中prp基因的qrt-pcr结果。hp4w表示高磷含量的饮食开始后4周的小鼠,lp4w表示低磷含量的饮食开始4周后的小鼠(对照组)。soscar表示施用可溶性人oscar-fc融合蛋白的小鼠,ns表示施用生理盐水代替可溶性人oscar-fc融合蛋白的小鼠。图32示出血浆中fgf23的elisa测量结果。hp4w表示高磷含量的饮食开始后4周的小鼠,lp4w表示低磷含量的饮食开始4周后的小鼠(对照组)。soscar表示施用可溶性人oscar-fc融合蛋白的小鼠,ns表示施用生理盐水代替可溶性人oscar-fc融合蛋白的小鼠。
wt(12w)表示喂食正常饮食的12周龄雄性野生型小鼠。图33示出血浆中肌酸酐的浓度。hp4w表示高磷含量的饮食开始后4周的小鼠,lp4w表示低磷含量的饮食开始4周后的小鼠(对照组)。wt(12w)表示12周龄雄性野生型小鼠。图34示出肾脏中fgg基因的qrt-pcr结果。hp4w表示高磷含量的饮食开始后4周的小鼠,lp4w表示低磷含量的饮食开始4周后的小鼠(对照组)。soscar表示施用可溶性人oscar-fc融合蛋白的小鼠,ns表示施用生理盐水代替可溶性人oscar-fc融合蛋白的小鼠。
具体实施方式
60.i.筛选1.术语解释首先解释本说明书、权利要求和摘要中关于发明所使用的术语,该发明涉及用于筛选预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法和装置,以及使计算机执行用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的功能的程序。与该“i.筛选”部分中使用的一些术语相同的术语用在下文描述的“ii.器官”部分中;但是,除非另有说明,否则涉及在说明书、权利要求书和摘要中使用的“i.筛选”中所描述的发明的术语与该部分中的定义一致。该“i.筛选”部分中所用的术语的定义以及下文描述的“ii.器官”中所用的术语的定义彼此独立,除非提到了单独的部分。
61.如本文所用的“肾功能减退”是指,在人的情况下,一种状况,其中例如下表1-1至1-3中所示的至少一种肾病标记物落在阈值范围之外。
62.表1-1
63.表1-2
64.表1-3
65.如本文所用的“慢性肾病”是指:根据“用于诊断和治疗慢性肾病的临床实践指南(2012)”(日本肾病学会编辑),当受试者是人时,肾损伤的病症(例如:包括微量白蛋白尿等的尿异常、异常尿沉渣、如单肾和多囊肾疾病等的成像异常、如血清肌酸酐升高等的肾功能减退、如由于肾小管损伤而导致的低钾血症等的电解质异常、如肾活检等的组织病理学检查中的异常)或肾功能减退(即,低于60ml/min/1.73m2的估算gfr(肾小球滤过率))持续3个月或更长时间。
66.这里,估算的gfr(egfr)可以使用来自下表2中所示的血清肌酸酐值的估算公式(egfrcreat)来计算。基于血清胱抑素c的估算公式(egfrcys)可以应用于肌肉量极低的人,例如下肢截肢者。
67.表2*对18岁或更大年龄的人进行该肾功能的评价。
68.例如,在蛋白质被用作指标的情况下,当在3个月或更早之前的尿测试结果和最近的尿测试结果指示受试者具有0.15g/gcr或更高的持续尿蛋白水平时,这种情况可以诊断为慢性肾病。当受试者患有糖尿病并且3个月或更早之前的蛋白尿测试结果和最近的白蛋白尿测试指示受试者具有30mg/gcr或更高的持续尿白蛋白水平时,这样的情况可以被诊断为慢性肾病。
69.对于儿童,血清肌酸酐(cr)的阈值可以通过用于日本儿童的酶法来确定,并且用于评价具有肾功能异常的儿童。例如,2岁以上11岁以下的儿童的egfr(%)可由下面的等式1表示。等式1egfr(%)=(0.3
×
身高(m)/受试者的血清cr值)
×
100在非人哺乳动物(例如猫和狗)的情况下,从例如平均每日水摄入量或尿比重可以预测非人类哺乳动物是否患有慢性肾病。
70.慢性肾病的严重程度可以基于例如下文表3中人的情况来确定(表3是“用于诊断和治疗慢性肾病的临床实践指南(2012)”中的表2)。
71.表3
通过其中结合了原发病、gfr类别和蛋白尿类别的阶段来评价严重程度关于ckd的严重性,相对于阶段随着阶段以和的次序增加,死亡风险、晚期肾病、心血管病列亡增加。
72.如本文所用的“肾衰竭”包括在上述“慢性肾病”中。例如,在人的情况下,“肾衰竭”是指在慢性肾病中egfr小于45ml/min/1.73m2,优选小于30ml/min/1.73m2,更优选小于15ml/min/1.73m2的状况。
73.如本文所用的“个体”不受特别限制,包括人和非人哺乳动物。非人哺乳动物的示例包括牛、马、绵羊、山羊、猪、狗、猫、兔、猴等。人、猫和狗是优选的。个体的年龄或性别没有限制。
[0074]“受试者”是待施用测试物质的个体,并且优选地排除人。受试者优选是具有肾功能减退或其他肾病的病史的个体。可以是受试者的个体优选地具有症状,例如多尿、口渴、饮水量增加、胃液过多、呕吐、血尿和全身不适。此外,可以是受试者的个体包括根据已知的诊断方法(例如医学问诊、尿测试、血液生化测试、肾脏诊断成像或肾活检、疾病动物模型等)怀疑患有肾损伤或慢性肾病的个体。
[0075]
如本文所用的“测试组织”是指待施用测试物质的组织。例如,测试组织是体外活组织,例如,从可以是受试者的个体采集并在体外培养的组织。组织可以是整个器官或器官的一部分。
[0076]
如本文所用的“测试细胞”是指待施用测试物质的细胞。例如,测试细胞是体外活细胞,例如,从可以是受试者的个体采集并在体外培养的细胞。细胞可以是其传代能力受限的细胞,例如原代培养细胞;或者可以是其传代能力得以维持的所谓的培养细胞。这些细胞可以是通过基因工程制备的细胞。
[0077]
本文所用的“试样”包括来自上述受试者的细胞、组织(肾上腺、大动脉、脑、肺、胰腺、下垂体、皮肤、颅骨、骨骼肌、脾、睾丸、甲状腺、肾、结肠、眼球、心脏、肝脏、颌下腺、胸腺、脂肪组织、胃、空肠、回肠等)、体液(汗液、皮肤分泌物、泪液、唾液、脊髓液、腹水、胸腔积液)、尿、血样等。作为试样,脂肪组织、皮肤、发根、唾液腺(腮腺、颌下腺和舌下腺,优选颌下腺)、汗液、皮肤分泌物、泪液、唾液、尿和血样是优选的,尿、唾液、腮腺、血样、脂肪组织、发根、皮肤、皮肤分泌物和汗液是更优选的。
[0078]
此外,“试样”可以包括测试组织本身、测试组织的一部分、测试细胞本身、测试细胞的一部分、以及测试组织或测试细胞的培养上清液。
[0079]
在下文描述“2.用于获取每个测量值的方法”部分中,当获取肾功能预测标记物蛋白质的测量值时,该试样优选为血样或体液。在同一部分中,当获取肾功能预测标记物蛋白质的mrna的测量值时,试样优选为组织、血样或体液。
[0080]
如本文所用的“血样”包括从受试者采集的血液(全血),或由血液制备的血清、血浆等。当获取肾功能预测标记物蛋白质的测量值时,血样更优选为血清或血浆,甚至更优选为血清。当获取肾功能预测标记物蛋白质的mrna的测量值时,优选使用全血。用于采集血浆的抗凝血剂的类型没有特别限制。用于测量的受试者的血样的类型和用于确定预定阈值的血样的类型可以相同或不同,并且优选地是相同的。当血浆用作血样时,优选的是,使用与受试者的血浆所使用的抗凝血剂相同的抗凝血剂所采集的血液,制备用于确定预定阈值的血浆。
[0081]
此外,试样可以是新鲜试样,或者可以是保存试样。当保存试样时,可将试样在室温环境、冷藏环境或冷冻环境下保存;并且冷冻保存是优选的。
[0082]
如本文所用的“测试物质”是指待评价是否是活性成分的候选物质的物质,并且没有特别限制。示例包括化合物、蛋白质、肽、核酸、脂类、碳水化合物、糖脂、糖蛋白、金属等。施用测试物质的方法没有特别限制。例如,当将测试物质施用到测试细胞或测试组织时,可以将测试物质以1pg/ml至1mg/ml的量施用到细胞或组织的培养基。在是受试者的情况下,可以以每天1ng/kg至1g/kg的量向受试者施用测试物质。从测试物质的施用到试样的采集的时段没有特别限制,只要获取测试物质的效果即可。
[0083]
此外,从经测试物质处理的受试者、测试组织或测试细胞采集的试样可以在本说明书中称为“经测试物质处理的试样”。另外,从未经测试物质处理的受试者、测试组织或测试细胞采集的试样在本说明书中可称为“未经处理的试样”。
[0084]“健康个体”没有特别限制。优选地,健康个体是人或非人哺乳动物,其在术语“个体”的解释中进行了描述,并且在生化测试、血液测试、尿测试、血清测试、生理测试等中未显示异常数据。健康个体的年龄和性别没有特别限制。
[0085]
如本文所用的“肾功能预测标记物”包括选自由图21(“组1”)中所示基因组成的组中的至少一种。更具体地,肾功能预测标记物包括选自由图22中所示组2的基因组成的组中的至少一种,优选地选自由图22中所示组3的基因组成的组中的至少一种,更优选地选自由
图22中所示选自组4的基因组成的组中的至少一种,甚至更优选地选自由图22中所示组5的基因组成的组中的至少一种。最优选地,肾功能预测标记物是选自由图23中所示组6的基因组成的组中的至少一种,特别是选自由富脯氨酸蛋白(prh1,prp2,prb1,prpmp5)、防御素(defa和defb)、aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、纤维蛋白原(fga、fgb和fgg)和hamp/hepcidin组成的组中的至少一种。此外,这些组还可以包括个体基因的剪接变体。
[0086]
作为肾功能预测标记物蛋白质和试样的组合的具体示例,在prp的情况下,优选使用唾液和/或唾液腺(优选腮腺)作为试样,并且当肾功能预测标记物是防御素和/或hamp2时,优选使用脂肪组织、发根、皮肤、皮肤分泌物和/或汗液作为试样。
[0087]
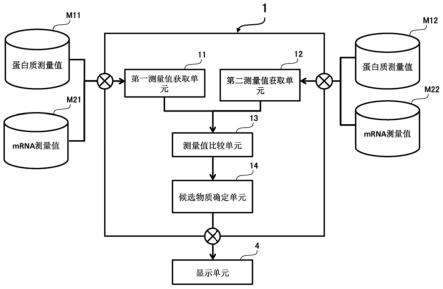
特别地,皮肤优选作为用于获取defb8的测量值的试样;胃、骨骼肌或睾丸优选作为用于获取defa24的测量值的试样;脂肪组织优选作为用于获取defb1、defb10、defb12、defb14、defb15、defb18、defb19、defb2、defb20、defb21、defb22、defb23、defb25、defb26、defb28、defb29、defb30、defb35、defb37、defb39、defb41、defb42、defb43、defb45、defb47、和/或defb48的测量值的试样;颅骨优选作为用于获取oscar测量值的试样;唾液、唾液腺或腮腺优选作为用于获取prb1、prh1、prp2、和/或prpmp5的测量值的试样;颅骨、肾脏和/或心脏优选作为用于获取spp1的测量值的试样;肾脏、唾液腺(优选腮腺)优选作为用于获取dnase1的测量值的试样;大动脉优选作为用于获取slc7a8的测量值的试样;甲状腺优选作为用于获取anpep测量值的试样;肾脏或肝脏优选作为用于获取slco1a1的测量值的试样;肾上腺、大动脉、肺、下垂体、皮肤、颅骨、骨骼肌、脾、甲状腺、肾、心脏、和/或脂肪组织优选作为用于获取aplnr的测量值的试样;当获取fga、fgb和fgg的测量值时,优选肾脏、血样、和/或尿。
[0088]“选自由肾功能预测标记物组成的组中的至少一种蛋白质的测量值”是指一种值,其反映了选自由肾功能预测标记物组成的组中的至少一种蛋白质的量或浓度。当测量值用“量”指示时,其可以以摩尔为基础或以质量为基础表达;但是,优选指示以质量为基础的量。当该值以“浓度”表达时,它可以是试样的摩尔浓度或每恒定体积的质量比(质量/体积),优选质量/体积比。反映量或浓度的值可以是上述值或信号(例如荧光或发光)的强度。
[0089]“选自由肾功能预测标记物组成的组中的至少一种mrna的测量值”可以由存在于一定量试样中的肾功能预测标记物mrna的拷贝数(绝对量)表示;或者可以是反映相对于管家基因(例如β2-微球蛋白mrna、gapdh mrna、maea mrna或β-肌动蛋白mrna)的表达水平的相对表达水平的值。该测量值还可以由信号(例如荧光或冷光)的强度表示。
[0090]“肾功能预测标记物抗体”不受限制,只要该抗体与选自由上述肾功能预测标记物组成的组中的至少一种蛋白质特异性结合即可;以及可以使用通过用至少一种选自由肾功能预测标记物或其一部分作为抗原而使非人动物免疫而获取的多克隆抗体、单克隆抗体及其片段(例如,fab、f(ab)2等)中的任一种。另外,免疫球蛋白类和亚类没有特别限制。此外,肾功能预测标记物抗体可以是嵌合抗体。此外,肾功能预测标记物抗体可以是scfv等。
[0091]
用作用于制备肾功能预测标记物抗体的抗原的肾功能预测标记物蛋白质的示例包括选自由上述肾功能预测标记物组成的组中的至少一种蛋白质的全部或一部分。
[0092]
本文所用的“用于肾功能预测标记物mrna检测的核酸”不受限制,只要其含有与选自由上述肾功能预测标记物组成的组中的至少一种mrna或者该mrna的逆转录产物特异性
杂交的序列。用于检测的核酸可以是dna或rna,以及用于检测的核酸中包含的核苷酸可以是天然存在的核苷酸或人工合成的核苷酸。
[0093]
用于检测的核酸的长度没有特别限制。当用于检测的核酸用作例如微阵列中的捕获探针时,与靶标核酸杂交的序列长度优选为约100mer,更优选约60mer,甚至更优选约20mer至30mer。捕获探针可以用例如已知的寡核苷酸合成器生产。捕获探针可含有不与靶标核酸杂交的序列。
[0094]
当用于检测的核酸是用于pcr反应的引物时,与靶标核酸杂交的序列的长度优选为约50mer,更优选约30mer,甚至更优选约15-25mer。引物可以用例如已知的寡核苷酸合成器生产。引物可含有不与靶标核酸杂交的序列。引物可以用荧光染料等标记。
[0095]
除了引物之外,在pcr反应期间分解的用于定量的探针也可以用于rt-pcr中pcr产物的实时定量。用于定量的探针不受限制,只要其与靶标核酸杂交即可。用于定量的探针优选是长度约5至20mer的含有与靶标核酸杂交的序列的核酸。此外,优选的是,用于定量的探针在一端用荧光染料标记,在另一端用荧光染料的猝灭剂标记。
[0096]
2.用于获取各个测量值的方法本说明书中用于获取选自由肾功能预测标记物组成的组中的至少一种蛋白质的测量值和选自由肾功能预测标记物组成的组中的至少一种mrna的测量值的方法不受限制,只要可以获取测量值即可。例如,它们可以根据下述方法获取。
[0097]
2-1.用于测量肾功能预测标记物蛋白质的方法当测量选自由肾功能预测标记物组成的组中的至少一种蛋白质的测量值(下文中可以简称为本说明书中的“肾功能预测标记物蛋白质的测量值”)时,使用在“1.术语解释”部分中所描述的肾功能预测标记物抗体的测量方法可以用在该过程中以获取测量值。已知的elisa方法等可以用作用于获取肾功能预测标记物蛋白质的测量值的测量方法。
[0098]
在该实施方式中,用于抗原捕获的肾功能预测标记物抗体可以预先固定在固相(例如,微板、荧光珠或磁珠)上,并且在固定的肾功能预测标记物抗体和试样中的肾功能预测标记物蛋白质之间可以形成复合物。通过用本领域已知的方法,通过检测固定在固相上的复合物或在固相上形成的复合物,可以测量包含在试样中的肾功能预测标记物蛋白质的量或浓度。在该实施方式中,可以预先形成用于抗原捕获的肾功能预测标记物抗体和试样中的肾功能预测标记物蛋白质之间的复合物,然后将其固定在固相上。
[0099]
将用于抗原捕获的肾功能预测标记物抗体固定在固相上的方法没有特别限制。通过使用已知方法,可以将肾功能预测标记物抗体直接固定或在其间插入另一种物质来间接固定。直接接合的示例包括物理吸附等。优选地,例如,免疫板可以用于将肾功能预测标记物抗体直接物理接合到微板上。
[0100]
固相的形状没有特别限制。示例包括微板、微管、试管、珠等。固相的材料没有特别限制。例如,聚苯乙烯、聚丙烯等可用于微板、微管、试管等。在是珠的情况下,可以使用聚苯乙烯xmap(注册商标)珠(luminex)、magplex(注册商标)微球(luminex)等。
[0101]
在形成复合物之后,该方法可包括洗涤固相的操作。在洗涤中,例如,可以使用含有表面活性剂等的pbs。
[0102]
在该方法中,通过使用由标记物质标记的用于检测的肾功能预测标记物抗体,或使用未标记的肾功能预测标记物抗体、用标记物质标记且能够结合未标记的肾功能预测标
记物抗体的抗免疫球蛋白抗体等,可以检测复合物。优选的是,使用标记的用于检测的肾功能预测标记物抗体。还优选的是,用于检测的肾功能预测标记物抗体的肾功能预测标记物蛋白质中的表位不同于用于抗原捕获的肾功能预测标记物抗体的肾功能预测标记物蛋白质中的表位。
[0103]
用于检测的肾功能预测标记物抗体或标记的抗免疫球蛋白抗体所用的标记物质没有特别限制,只要标记物质能够生成可检测信号即可。示例包括荧光物质、放射性同位素、酶等。酶的示例包括碱性磷酸酶、过氧化物酶等。荧光物质的示例包括荧光染料,例如异硫氰酸荧光素(fitc)、罗丹明和alexa fluor(注册商标)、荧光蛋白(例如gfp)等。放射性同位素的示例包括
125
i、
14
c、
32
p等。其中,优选碱性磷酸酶或过氧化物酶作为标记物质。
[0104]
用于检测的肾功能预测标记物抗体通过用本领域已知的标记方法用上述标记物质标记肾功能预测标记物抗体而获取。替代地,可以使用市售的标记试剂盒等进行这种标记。对于标记的免疫球蛋白抗体,可以使用与标记物肾功能预测标记物抗体相同的方法,或者可以使用市售产品。
[0105]
在该方法中,通过检测由复合物中包含的标记的肾功能预测标记物抗体的标记物质所生成的信号,可以获取试样中包含的肾功能预测标记物的测量值。这里,“检测信号”包括定性地检测信号的是否存在、定量地检测信号强度以及半定量地检测信号强度。这种半定量检测意味着以阶段(例如“无信号生成”、“弱”、“中等”和“强”)指示信号强度。在该步骤中,优选的是定量或半定量地检测信号强度。
[0106]
可以使用已知方法作为用于检测信号的方法。在该方法中,可以根据源自上述标记物质的信号类型适当地选择测量方法。例如,当标记物质是酶时,通过使用已知装置(例如发光计或分光光度计)测量由酶与底物反应生成的信号(例如光或颜色),可以进行信号的检测。
[0107]
根据酶的种类从已知的底物中可以适当地选择酶的底物。例如,当碱性磷酸酶用作酶时,底物的示例包括化学发光底物,例如cdp-star(注册商标)(4-氯-3-(甲氧基螺[1,2-二氧杂环丁烷-3,2'-(5'-氯)三环[3.3.1.1
3,7
]癸烷]-4-基)苯基磷酸二钠)和显色底物(如5-溴-4-氯-3-吲哚基磷酸(bcip)、5-溴-6-氯-3-吲哚基磷酸二钠和对硝基苯基磷酸)。当标记物质是过氧化物酶时,底物的示例包括四甲基联苯胺(tmb)等。
[0108]
当标记物质是放射性同位素时,可以使用已知装置(例如闪烁计数器)测量信号(即辐射)。当标记物质是荧光物质时,可以使用已知装置(例如荧光微板读数器或luminex(注册商标)系统(luminex))测量信号(即荧光)。可以根据使用的荧光物质的类型适当地确定激发波长和荧光波长。
[0109]
信号的检测结果可以用作肾功能预测标记物蛋白质的测量值。例如,当定量检测信号强度时,信号强度的测量值本身或从信号强度的测量值计算的值可以用作肾功能预测标记物蛋白质的测量值。
[0110]
2-2.用于测量肾功能预测标记物mrna的方法可以使用已知测量方法,例如微阵列方法、rna-seq分析方法或定量rt-pcr方法,以获取选自由肾功能预测标记物组成的组中的至少一种mrna的测量值(在本说明书的下文中可以缩写为“肾功能预测标记物mrna的测量值”)。作为用于微阵列方法的探针,可以合成和使用一种选择的探针或已知的探针;或者可以使用市售的微阵列芯片。
[0111]
在该方法中,可以使用从试样中提取的总rna和mrna中的任何一种。用于总rna和mrna提取的试样优选在从个体采集后立即进行rna提取;或者在从个体采集后立即冷冻(优选在-196℃或更低的气氛下(在液氮中快速冷却)),并在-80℃或更低温度下储存直至rna提取。
[0112]
从试样中提取总rna和mrna的方法没有特别限制,可以使用已知的提取方法。
[0113]
根据已知方法可以进行通过微阵列方法的定量。肾功能预测标记物mrna的表达水平可以表达为相对于管家基因的表达水平的相对表达水平;或者表达为例如荧光染料的信号强度的测量值。
[0114]
rt-pcr定量通过以下来进行:使用从试样中提取的总rna或mrna作为模板进行逆转录反应,并通过使用肾功能预测标记物mrna的特定引物通过实时pcr方法等以获取的cdna作为模板进行分析。在这种情况下,肾功能预测标记物mrna的表达水平可以表达为相对于管家基因的表达水平的相对表达水平,或表达为例如荧光染料的信号强度的测量值。
[0115]
在rna-seq分析方法中,从试样中提取的mrna被片段化,使用这些片段作为模板通过逆转录反应合成cdna,并制备文库。通过使用下一代测序仪确定每个文库中包含的每个片段的核苷酸序列,将获取的信息映射到参考基因序列,并且将mrna的表达水平表达为rpkm(每百万中每千碱基对读数,reads per kilobase per million)。rpkm可以表达为例如热图中的信号强度。
[0116]
信号的检测结果可以用作肾功能预测标记物mrna的表达水平。例如,当定量检测信号强度时,信号强度的测量值本身或根据信号强度的测量值计算的值可以用作肾功能预测标记物mrna的表达水平。
[0117]
由信号强度的测量值计算出的值的示例包括:通过从信号强度的测量值中减去阴性对照样品的信号强度的测量值而获取的值;通过将信号强度的测量值除以阳性对照样品的信号强度的测量值而获取的值;它们的组合;等等。阴性对照样品的示例包括健康受试者的试样等。阳性对照样品的示例包括含有在预定表达水平的肾功能预测标记物mrna的试样。片。
[0118]
3.肾功能预测标记物蛋白质的功能的评价在本发明中,用于评价肾功能预测标记物蛋白质的功能的方法没有特别限制,只要可以评价肾功能预测标记物蛋白质的功能即可。如本文所用的“肾功能预测标记物蛋白质的功能”是肾功能预测标记物蛋白质的初始功能。例如,当肾功能预测标记物蛋白质是受体时,该功能是当其配体结合到肾功能预测标记物蛋白质时激活,将激活的信号传递给蛋白质或蛋白质所属的信号通路下游的化学介体,并在受体控制下通过信号通路作用于细胞等的功能。当肾功能预测标记物蛋白质是配体时,该功能是激活与配体结合的受体的功能。
[0119]
用于评价肾功能预测标记物蛋白质的功能的方法的示例是这样的方法,其中检测到:是否存在例如肾功能预测标记物蛋白质所属的信号通路中下游的蛋白质的磷酸化或去磷酸化;位于下游的蛋白质表达水平的增加或减少;位于下游的蛋白质的转录调节区的激活或失活;等等。例如,蛋白质磷酸化的是否存在可以通过已知方法检测,例如western blotting法。例如,可以通过已知方法检测蛋白质表达水平的增加或降低,例如elisa方法、western blotting方法、定量rt-pcr方法或rna-seq方法。此外,可以通过报道基因试验来检测转录调节区的激活或失活。报道基因的示例包括萤火虫荧光素酶、海肾荧光素酶、gfp
(绿色荧光蛋白质)、β-半乳糖苷酶等。可以根据已知方法进行报道基因试验。
[0120]
作为用于评价肾功能预测标记物蛋白质的功能的另一种方法,通过测量肾功能预测标记物蛋白质所属的信号通路下游的化学介体(例如,三磷酸肌醇、camp、cgmp、ca
2+
)的量,可以评价肾功能预测标记物蛋白质的功能。可以根据已知方法测量这种化学介体。
[0121]
通过使用elisa方法、western blotting方法、定量rt-pcr方法、rna-seq方法、报道基因试验获取的检测结果以及化学介体的测量结果作为肾功能预测标记物蛋白质的功能的评价结果。评价结果可以是定量数据、半定量信息(例如“高”和“低”)、或定性数据(例如“存在”和“不存在”)。
[0122]
4.用于筛选的系统配置在本发明中,使用在上文“i.2.用于获取每个测量值的方法”中获取的测量值来执行下文描述的“i.5.筛选1”。此外,在本发明中,使用在上文“i.3.肾功能预测标记物蛋白质的功能的评价”中获取的评价结果来执行下文描述的“i.6.筛选2”。首先,描述用于执行这些过程的系统配置。
[0123]
图1是根据本发明第一实施方式的用于执行筛选1的系统100的概图。图2是示出系统100的硬件配置的框图。作为一个实施方式,系统100包括筛选装置1、输入单元3、显示单元4、以及装置5a或装置5b。
[0124]
筛选装置1包括例如通用个人计算机,并且包括用于执行下文描述的数据处理的cpu 101,用作数据处理的工作区的存储器102,用于存储处理的数据的存储单元103,用于在单元之间传输数据的总线104,以及用于在筛选装置和外部装置之间执行数据输入和输出的接口单元105(下文中称为“i/f单元”)。输入单元3和显示单元4连接到筛选装置1。输入单元3包括例如键盘;显示单元4包括例如液晶显示器。输入单元3和显示单元4可以集成并实现为具有触摸面板的显示器。筛选装置1不需要是单一装置;cpu101、存储器102、存储单元103等可以位于单独的位置并且经由网络连接。筛选装置也可以是省略输入单元3和显示单元4的装置,并且不需要操作员。
[0125]
筛选装置1、装置5a或装置5b也不一定位于一个位置,并且可以配置成使得位于单独的位置的装置通过网络彼此通信地连接。
[0126]
在下面的说明中,除非另有说明,由筛选装置1执行的处理表示基于存储在图2所示的存储单元103或存储器102中的筛选程序,由筛选装置1的cpu 101执行的处理。cpu 101将必要数据(例如正在处理的中间数据)临时存储在用作工作区的存储器102中,并且适当地将长时间存储的数据(例如计算结果)存储在存储单元103中。
[0127]
装置5a是用于测量蛋白质的量或浓度的装置,并且包括样品放置区域51、反应单元52和检测单元53。将设置于样品放置区域51中的从受试者采集的试样分配到微板并在微板中培养,微板被置于反应单元52中并在其上固定有用于抗原捕获的肾功能预测标记物抗体。如果需要,去除未反应的抗原。此后,将检测抗体分配到微板中,然后培养。如果需要,去除未反应的抗原,并将用于检测检测抗体的底物分配到微板中。将微板转移到检测单元53,并测量通过与底物反应所生成的信号。装置5a的另一个实施方式是用于通过微阵列分析测量mrna的表达水平的装置。将设置在样品放置区域51中的逆转录反应产物分配到设置在反应单元52中的微阵列芯片中,然后进行杂交。在洗涤微阵列芯片后,将其转移到检测单元53,并测量信号。
[0128]
此外,装置5a的另一个实施方式是用于通过rt-pcr测量mrna表达水平的装置。将设置在样品放置区域51中的逆转录反应产物分配到设置在反应单元52中的微管中,随后将用于定量pcr的试剂分配到微管中。在反应单元52中进行pcr反应的同时,通过检测单元53检测管中的信号。
[0129]
装置5b是用于通过rna-seq方法测量mrna表达水平的装置,并且包括序列分析单元54。在序列分析单元54中设置进行rna-seq反应的样品,并在序列分析单元54中进行核苷酸序列的分析。
[0130]
装置5a或5b通过有线连接或无线连接连接到筛选装置1。装置5a a/d转换蛋白质的测量值或mrna的测量值,并将其作为数字数据发送到筛选装置1。类似地,装置5b a/d转换mrna的测量值,并将其作为数字数据发送到筛选装置1。因此,筛选装置1可以获取蛋白质的测量值或mrna的测量值作为可以计算的数字数据。
[0131]
图5是根据本发明第二实施方式的用于执行筛选2的系统110的概图。图6是示出系统110的硬件配置的框图。作为一个实施方式,系统110包括筛选装置2、输入单元3、显示单元4、装置5a、装置5b或装置5c。
[0132]
筛选装置2包括例如通用个人计算机,并且包括用于执行下文描述的数据处理的cpu 101、用作数据处理的工作区的存储器102、用于存储处理数据的存储单元103、用于在单元之间传输数据的总线104以及用于在筛选装置和外部装置之间执行数据输入和输出的接口单元105(下文称为“i/f单元”)。输入单元3和显示单元4连接到筛选装置2。输入单元3包括例如键盘;显示单元4包括例如液晶显示器。输入单元3和显示单元4可以集成并实现为具有触控面板的显示器。筛选装置2不需要是单一装置,并且cpu101、存储器102、存储单元103等可以位于单独的位置并且经由网络连接。筛选装置也可以是省略输入单元3和显示单元4的装置,并且不需要操作员。
[0133]
筛选装置2和装置5a、装置5b或装置5c也不一定位于同一个位置,并且可以配置成使得位于单独的位置的装置通过网络彼此通信地连接。
[0134]
在下面的说明中,除非另有说明,由筛选装置2执行的处理表示基于存储在图6中所示的存储单元103或存储器102中的程序,由筛选装置2的cpu 101执行的处理。cpu 101将必要数据(例如正在处理的中间数据)临时存储在用作工作区的存储器102中,并且适当地将长时间存储的数据(例如计算结果)存储在存储单元103中。
[0135]
装置5a是用于测量蛋白质的量或浓度的装置,并且包括样品放置区域51、反应单元52和检测单元53。将置于样品放置区域51中的从受试者采集的试样分配到微板并在微板中培养,在微板被置于反应单元52中并在其上固定有用于抗原捕获的肾功能预测标记物抗体。如果需要,去除未反应的抗原。此后,将检测抗体分配到微板中,然后培养。如果需要,去除未反应的抗原,并将用于检测检测抗体的底物分配到微板中。将微板转移到检测单元53,并测量通过与底物反应所生成的信号。装置5a的另一个实施方式是用于通过微阵列分析测量mrna的表达水平的装置。将设置在样品放置区域51中的逆转录反应产物分配到反应单元52中的微阵列芯片组中,然后进行杂交。在洗涤微阵列芯片后,将其转移到检测单元53,并测量信号。
[0136]
此外,装置5a的另一个实施方式是用于通过rt-pcr测量mrna的表达水平的装置。将设置在样品放置区域51中的逆转录反应产物分配到设置在反应单元52中的微管中,随后
将用于定量pcr的试剂分配到微管中。在反应单元52中进行pcr反应的同时,管中的信号通过检测单元53来检测。此外,装置5a的另一个实施方式是用于测量化学介体的装置。将设置在样品放置区域51中的细胞裂解液分配到设置在反应单元52中的微管中,随后将用于测量化学介体的试剂分配到微管中。管中的信号通过检测单元53来检测。
[0137]
装置5b是用于通过rna-seq方法测量mrna的表达水平的装置,并且包括序列分析单元54。进行rna-seq反应的试样设置在序列分析单元54中,并在序列分析单元54中进行核苷酸序列的分析。
[0138]
装置5c的一个实施方式是用于检测例如western blotting中的信号的装置。例如,当通过使用wester blotting方法等评价肾功能预测标记物蛋白质的功能时,在装置5c的检测单元55中设置用于检测的膜,并测量化学发光强度或荧光强度。装置5c的另一个实施方式是用于在报道基因试验中检测报道基因的表达强度的装置。用于报道基因分析的细胞裂解液设置在装置5c的检测单元55中,并且将底物的液体分配到其中。此后,测量化学发光强度。
[0139]
装置5a、5b或5c通过有线连接或无线连接而连接到筛选装置2。装置5a a/d转换蛋白质的检测结果、mrna的检测结果或化学介体的测量结果,并将其作为数字数据发送到筛选装置2。装置5b a/d转换mrna的检测结果,并将其作为数字数据发送到筛选装置2。装置5c a/d转换western blotting等中的信号的测量结果或报道基因试验等的测量结果,并将其作为数字数据发送到筛选装置2。因此,筛选装置2可以获取蛋白质的检测结果、mrna的检测结果、化学介体的测量结果、western blotting中信号的测量结果或报道基因试验的测量结果,作为关于可以计算的肾功能预测标记物蛋白质的功能的评价结果的数字数据。
[0140]
5.筛选15-1.概要在该实施方式中,通过使用在从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值,确定了测试物质是用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质。通过进行上述“i.2.用于获取每个测量值的方法”,获取经测试物质处理的试样的测量值。更具体地,该实施方式包括以下步骤:(i)获取从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和(ii)基于步骤(i)中获取的所述测量值确定所述测试物质是所述活性成分的候选物质。在这种情况下,当经测试物质处理的试样中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值接近健康个体中的对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值时,可以确定测试物质是活性成分的候选物质。
[0141]
这里,可以以通过实际执行“i.2.用于获取每个测量值的方法”获取测量值的方式或者以允许下文描述的预测装置等获取已经获取的测量值的方式来执行步骤(i)。另外,步骤(i)和步骤(ii)不一定在同一组织中连续执行。例如,可以将在步骤(i)中获取的测量值
发送到第三方组织以执行步骤(ii)和后续处理。
[0142]
此外,在该实施方式中,通过将经测试物质处理的试样的测量值与从未经测试物质处理的受试者、测试组织或测试细胞所采集的试样(未经处理的试样)中肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值进行比较,可以确定测试物质是用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质。通过执行上述“i.2.用于获取每个测量值的方法”获取未经处理的试样的测量值。更具体地,该实施方式在步骤(i)和(ii)之间可以包括,将步骤(i)中获取的经测试物质处理的试样的测量值与从未经所述测试物质处理的受试者、测试组织或测试细胞采集的试样(未经处理的试样)中的对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值进行比较的步骤。在这种情况下,当经测试物质处理的试样中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值指示比在未经处理的试样中的对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值具有更加改善的结果时,可以确定测试物质是活性成分的候选物质。
[0143]
这里,例如,在从具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集试样以及肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值随着肾功能的减退而增加的情况下,当相互比较时,如果经测试物质处理的试样中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值低于未经处理的试样中的对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值,可以确定通过测试物质已经改善选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。在这种情况下,对测量值的降低程度没有特别限制。当经测试物质处理的试样的测量值为例如未经处理的试样的测量值的85%或更低,优选70%或更低,更优选50%或更低时,可以确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。
[0144]
在从具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集试样以及肾功能预测标记物蛋白质的测量值和/或蛋白质的mrna的测量值随着肾功能的减退而降低的情况下,当进行相互比较时,如果经测试物质处理的试样中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值高于未经处理的试样中的对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值,可以确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。在这种情况下,对测量值的升高程度没有特别限制。当经测试物质处理的试样的测量值是例如未经处理的试样的测量值的115%或更大、优选130%或更大、更优选150%或更大时,可以确定测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。
[0145]
此外,筛选1可以在步骤(i)之前包括以下步骤:(i)用所述测试物质处理所述受试者、测试组织或测试细胞;(ii)从步骤(i)中经测试物质处理的所述受试者、测试组织或测试细胞采集所述试样;和(iii)从步骤(ii)中获取的所述试样中采集所述蛋白质和/或所述mrna。例如,可以将步骤(ii)中采集的试样发送给第三方组织以执行步骤(iii)和随后的步骤。另外,步骤(iii)和步骤(i)也不一定在同一组织中连续进行。例如,可以将步骤(iii)中采集的蛋白质和/或mrna发送给第三方组织以执行步骤(iii)之后的步骤。
[0146]
5-2.筛选装置本发明包括作为第一实施方式的用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,该装置包括以下计算工具:第一测量值获取工具,用于获取从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和确定工具,用于基于由所述第一测量值获取工具获取的所述测量值确定所述测试物质是所述活性成分的候选物质。
[0147]
优选地,上述筛选装置还包括:第二测量值获取工具,用于获取从未经所述测试物质处理的受试者、测试组织或测试细胞采集的试样(未经处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和比较工具,用于将所述经测试物质处理的试样的测量值与所述未经处理的试样的测量值进行比较,其中,所述确定工具基于由所述测量值比较工具获取的比较结果,确定所述测试物质是所述活性成分的候选物质。确定方法与下文描述的“i.5-4.筛选方法”部分中的描述一致。
[0148]
在该实施方式中,通过包括筛选装置1作为上述筛选装置的系统100(图1和2)可以筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质。
[0149]
图3是示出根据该实施方式的筛选装置1的功能的框图。筛选装置1包括第一测量值获取单元11、第二测量值获取单元12、测量值比较单元13和候选物质确定单元14。第二测量值获取单元12可以是可选的。通过将根据本发明的筛选程序安装在图2中所示的筛选装置1的存储单元103或存储器102中并使cpu 101执行筛选程序,可以实现这些功能块。由此,筛选装置1执行下文描述的“i.5-4.筛选方法”部分中描述的筛选方法。权利要求中提及的第一测量值获取工具、第二测量值获取工具、测量值比较工具和确定工具分别对应于如图3所示的第一测量值获取单元11、第二测量值获取单元12、测量值比较单元13和候选物质确定单元14。
[0150]
换句话说,筛选装置1是用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,该装置由cpu 101执行以下计算功能:第一测量值获取功能,获取从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和确定功能,基于由所述第一测量值获取功能获取的所述测量值确定所述测试物质是所述活性成分的候选物质。
[0151]
优选地,筛选装置1通过cpu 101进一步执行以下功能:第二测量值获取功能,获取从未经所述测试物质处理的受试者、测试组织或测试
细胞采集的试样(未经处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和比较功能,将所述经测试物质处理的试样的测量值与所述未经处理的试样的测量值进行比较,其中基于由所述测量值比较功能获取的比较结果,所述确定功能确定所述测试物质是所述活性成分的候选物质。
[0152]
在该实施方式中,将经测试物质处理的试样中的肾功能预测标记物蛋白质的测量值m11从装置5a放入筛选装置1中,并将所述蛋白质的mrna的测量值m21从装置5a或5b放入筛选装置1中。类似地,未经处理的试样中的肾功能预测标记物蛋白质的测量值m12也从装置5a放入筛选装置1中,并且蛋白质的mrna的测量值m22也从装置5a或5b放入筛选装置1中。
[0153]
经测试物质处理的试样和未经处理的试样中的肾功能预测标记物蛋白质的测量值m11和m12以及蛋白质的mrna的测量值m21和m22也可以从第三方组织(未示出)经由网络放入筛选装置1中。
[0154]
此外,功能块,即第一测量值获取单元11、第二测量值获取单元12、测量值比较单元13和候选物质确定单元14不一定由单一cpu执行,并且可以由多个cpu以分布式方式处理。例如,这些功能块可以被配置成使得第一测量值获取单元11和第二测量值获取单元12的功能由第一计算机的cpu执行,并且使得测量值比较单元13和候选物质确定单元14的功能由第二计算机(即另一计算机)的cpu执行。
[0155]
5-3.筛选程序为了执行下面图4中的步骤s11至s17的处理,根据本发明第一实施方式的筛选装置1将根据本实施方式的筛选程序预先以例如可执行格式(例如,可以通过使用编译器从编程语言转换来生成程序的形式)存储在存储单元103中。筛选装置1使用存储在存储单元103中的筛选程序来执行处理。
[0156]
具体地,根据本发明第一实施方式的筛选程序是一种筛选程序,当由计算机执行时,使计算机进行以下处理以筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质:第一测量值获取处理,获取从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和确定处理,基于由所述第一测量值获取处理获取的所述测量值确定所述测试物质是所述活性成分的候选物质。
[0157]
优选地,筛选程序还使计算机进行第二测量值获取处理,该第二测量值获取处理获取从受试者、测试组织或测试细胞处采集的未经所述测试物质处理的试样(未经处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;并且,在确定处理中,通过将由第一测量值获取处理所获取的测量值与通过第二测量值获取处理所获取的测量值进行比较,确定测试物质是活性成分的候选物质。确定方法与在下文描述的“i.5-4筛选方法”部分的描述一致。
[0158]
在该实施方式中,如图2所示,筛选程序存储在计算机可读的非暂时性有形存储介质109(例如cd-rom)中,并且从存储介质109安装在筛选装置1中;替代地,筛选装置1可以连
接到因特网(未示出)以通过因特网下载筛选程序的程序代码。
[0159]
5-4.筛选方法根据本发明第一实施方式的筛选装置1执行根据本发明第一实施方式的筛选方法。根据本发明第一实施方式的筛选方法包括筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,该方法包括以下步骤:(i)获取从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和(ii)根据步骤(i)中获取的所述测量值确定所述测试物质是所述活性成分的候选物质。
[0160]
优选地,上述筛选方法在步骤(i)和(ii)之间还包括,将步骤(i)中获取的经测试物质处理的试样的测量值与从受试者、测试组织或测试细胞处采集的未经所述测试物质处理的试样(未经处理的试样)中对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值进行比较的步骤。
[0161]
图4是示出由根据本发明第一实施方式的筛选装置1执行的用于实施筛选方法的数据处理流程的流程图。步骤s11、s12和s13分别由图3所示的第一测量值获取单元11、第二测量值获取单元12和测量值比较单元13执行。步骤s14至s17由图3所示的候选物质确定单元14来执行。
[0162]
在步骤s11中,第一测量值获取单元11获取经测试物质处理的试样中蛋白质的测量值m11和/或mrna的测量值m21。
[0163]
在步骤s12中,第二测量值获取单元12获取未经处理的试样中蛋白质的测量值m12和/或mrna的测量值m22。
[0164]
在步骤s13中,测量值比较单元13将在步骤s11中获取的经测试物质处理的试样的测量值与在步骤s12中获取的未经处理的试样的测量值进行比较。比较结果输出到候选物质确定单元14。
[0165]
候选物质确定单元14基于由测量值比较单元13获取的比较结果,确定测试物质是活性成分的候选物质。更具体地,当比较结果表示改善的结果时(步骤s14中的“是”),在步骤s15中,候选物质确定单元14确定测试物质是活性成分的候选物质。
[0166]
更具体地,在从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集经测试物质处理的试样以及肾功能预测标记物蛋白质和/或所述蛋白质的mrna的测量值随着肾功能的减退而增加的情况下,当通过将m11除以m12获取的值或通过将m21除以m22获取的值为例如0.85或更小、优选为0.7、更优选为0.5或更小时,测量值比较单元13确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病,并且输出疾病已经得到改善的比较结果。当比较结果指示疾病已经改善时,候选物质确定单元14确定测试物质是活性成分的候选物质。在从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集经测试物质处理的试样以及肾功能预测标记物蛋白质和/或所述蛋白质的mrna的测量值随着肾功能的减退而降低的情况下,当通过将m11除以m12获取的值或通过将m21除以m22获取的值为例如1.15
或更大、优选1.3或更大、更优选1.5或更大时,测量值比较单元13确定通过测试物质改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病,并输出疾病已经得到改善的比较结果。当确定选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病尚未被测试物质改善时,测量值比较单元13输出疾病还尚未改善的比较结果。当比较结果指示疾病已经改善时,候选物质确定单元14确定测试物质是活性成分的候选物质。
[0167]
在步骤s16中,候选物质确定单元14输出在步骤s15中确定的结果。在该实施方式中,活性成分的候选物质显示在显示单元4上,并且确定结果存储在筛选装置1中的存储单元103中。确定结果可以显示在通过互联网连接到筛选装置1的外部计算机终端的显示单元(例如,第三方组织(未示出)中的计算机终端的显示单元)上,而不是将确定结果显示在显示单元4上。
[0168]
在步骤s14中,当比较结果指示疾病尚未改善时,处理继续进行步骤s17,并且候选物质确定单元14确定测试物质不是活性成分。在这种情况下,测试物质不是活性成分的结果可以显示在显示单元4上。
[0169]
6.筛选26-1.概要在该实施方式中,使用通过进行上述“i.3.肾功能预测标记物蛋白质的功能的评价”部分中描述的方法所获取的经测试物质处理的试样中的肾功能预测标记物蛋白质的功能的评价结果,确定了测试物质是用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质。更具体地,该实施方式包括以下步骤:(i)评价从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能;和(ii)基于步骤(i)中获取的评价结果确定所述测试物质是所述活性成分的候选物质。在这种情况下,当经测试物质处理的试样中的肾功能预测标记物蛋白质的功能的评价结果接近健康个体中对应的肾功能预测标记物蛋白质的功能的评价结果时,可以确定测试物质是活性成分的候选物质。
[0170]
这里,步骤(i)可以以通过实际执行“i.3.肾功能预测标记物蛋白质的功能的评价”获取评价结果的方式或者以允许下文描述的预测装置等可以获取已经获取的评价结果的方式来执行。另外,步骤(i)和确定步骤(ii)不一定在同一组织中连续进行。例如,可以将步骤(i)中获取的评价结果发送给第三方组织以执行步骤(ii)和后续处理。
[0171]
此外,在该实施方式中,可以将上述评价结果与通过上述“i.3.肾功能预测标记物蛋白质的功能的评价”部分中描述的方法所获取的未经处理的试样中的肾功能预测标记物蛋白质的功能的评价结果进行比较,并且可以确定测试物质是用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质。更具体地,该实施方式在步骤(i)和(ii)之间还包括,将步骤(i)中获取的所述经测试物质处理的试样的评价结果与未经处理的试样中的对应肾功能预测标记物蛋白质的功能的评价结果进行比较的步骤。在这种情况下,当经测试物质处理的试样的肾功能预测标记物蛋白质的功能的评价结果指示比未经处理的试样的对应肾功能预测标记物蛋白质的功能的评价结果更加改善时,可以确定测试物质是活性成分的候选物质。
[0172]
例如,在从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾
病的受试者中采集试样以及肾功能预测标记物蛋白质的功能随着肾功能减退而被激活的情况下,当经测试物质处理的试样中的肾功能预测标记物蛋白质的功能的评价结果指示比未经处理的试样中对应肾功能预测标记物蛋白质的功能的评价结果具有更低的结果(当相互比较时)时,可以确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。在这种情况下,对评价结果的降低程度没有特别限制。当经测试物质处理的试样的测量值为例如未经处理的试样的评价结果的85%或更小、优选70%或更小、更优选50%或更小时,可以确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。
[0173]
在从具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集试样以及肾功能预测标记物蛋白质的功能随着肾功能的减退而被抑制的情况下,当经测试物质处理的试样中的肾功能预测标记物蛋白质的功能的评价结果指示比未经处理的试样中对应的肾功能预测标记物蛋白质的功能的评价结果具有更高的结果(当相互比较时)时,可以确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。在这种情况下,评价结果升高的程度没有特别限制。当经测试物质处理的试样的测量值为例如未经处理的试样的评价结果的115%或更大、优选130%或更大、更优选150%或更大时,可以确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病。
[0174]
此外,筛选2可以在步骤(i)之前包括以下步骤:(i)用所述测试物质处理所述受试者、测试组织或测试细胞;和(ii)在步骤(i)之后从所述受试者、测试组织或测试细胞采集所述试样。在这种情况下,步骤(i)和步骤(i)不一定在同一组织中连续进行。例如,可以将步骤(ii)中采集的试样发送给第三方组织以执行步骤(i)和后续处理。
[0175]
6-2.筛选装置本发明包括作为第二实施方式的用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,该装置包括以下计算工具:第一评价结果获取工具,用于获取从受试者、测试组织或经测试物质处理的测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能的评价结果;和确定工具,用于基于由所述第一评价结果获取工具获取的所述评价结果确定所述测试物质是所述活性成分的候选物质。
[0176]
优选地,该筛选装置还包括:第二评价结果获取工具,用于获取从未经测试物质处理的受试者、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的功能的评价结果;和比较工具,用于将经所述经测试物质处理的试样的评价结果与所述未经处理的试样的评价结果进行比较,其中,所述确定工具基于所述评价结果比较工具获取的比较结果确定所述测试物质是所述活性成分的候选物质。确定方法与下文描述的“i.6-4.筛选方法”部分的描述一致。
[0177]
在该实施方式中,通过包括上述筛选装置2的系统110(图5和6)可筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质。
[0178]
图7是示出根据本发明第二实施方式的筛选装置2的功能的框图。筛选装置2包括第一评价结果获取单元21、第二评价结果获取单元22、评价结果比较单元23和候选物质确定单元24。第二评价结果获取单元22可以是可选的。通过将根据本发明的筛选程序安装在图6所示的筛选装置2的存储单元103或存储器102中并使cpu 101执行筛选程序来实现这些功能块。由此,筛选装置2执行下文描述的“i.6-4.筛选方法”中描述的筛选方法。权利要求中提及的第一评价结果获取工具、第二评价结果获取工具、评价结果比较工具和确定工具分别对应于如图7所示的第一评价结果获取单元21、第二评价结果获取单元22、评价结果比较单元23和候选物质确定单元24。
[0179]
换句话说,筛选装置2是用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,该装置由cpu 101执行以下计算功能:第一评价结果获取功能,用于获取从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能的评价结果;和确定功能,基于由所述第一评价结果获取功能获取的所述评价结果确定所述测试物质是所述活性成分的候选物质。
[0180]
优选地,筛选装置2还通过cpu 101执行以下功能:第二评价结果获取功能,用于获取从未经测试物质处理的受试者、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的功能的评价结果;和比较功能,用于将经所述测试物质处理的试样的评价结果与所述未经处理的试样的评价结果进行比较,其中,所述确定功能基于所述评价结果比较功能获取的比较结果确定所述测试物质是所述活性成分的候选物质。确定方法与下文描述的“i.6-4.筛选方法”部分中的描述一致。
[0181]
在该实施方式中,将经测试物质处理的试样中的肾功能预测标记物蛋白质的功能的评价结果m31从装置5a、5b或5c放入筛选装置2中。类似地,未经处理的试样中的肾功能预测标记物蛋白质的评价结果m32也从装置5a、5b或5c放入筛选装置2中。
[0182]
经测试物质处理的试样中的肾功能预测标记物蛋白质的功能的评价结果m31和未经处理的试样中的肾功能预测标记物蛋白质的功能的评价结果m32也可以经由网络从第三方组织(未示出)放入筛选装置中。
[0183]
此外,功能块(即第一评价结果获取单元21、第二评价结果获取单元22、评价结果比较单元23和候选物质确定单元24)不一定由单一cpu执行,并且可以由多个cpu以分布式方式处理。例如,这些功能块可以被配置成使得第一评价结果获取单元21和第二评价结果获取单元22的功能由第一计算机的cpu执行,并且使得评价结果比较单元23和候选物质确定单元24的功能由第二计算机(即另一计算机)的cpu执行。
[0184]
6-3.筛选程序为了执行下面图8中的步骤s21至s27的处理,根据本发明第二实施方式的筛选装置2预先以例如可执行格式(例如,可以通过使用编译器从编程语言转换来生成程序的形式)将根据本实施方式的筛选程序存储在存储单元103中。筛选装置2使用存储在存储单元103中的筛选程序来执行处理。
[0185]
具体地,根据本发明第二实施方式的筛选程序是一种筛选程序,当由计算机执行时,使计算机进行以下处理以筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质:第一评价结果获取处理,获取从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能的评价结果;和确定处理,基于通过所述第一评价结果获取处理获取的所述评价结果确定所述测试物质是所述活性成分的候选物质。
[0186]
优选地,筛选程序还使所述计算机执行以下处理:第二评价结果获取处理,获取从未经测试物质处理的受试者、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的功能的评价结果;比较处理,将经所述测试物质处理的试样的评价结果与所述未经处理的试样的评价结果进行比较;并且在所述确定处理中,基于通过所述评价结果比较处理获取的比较结果确定所述测试物质是所述活性成分的候选物质。确定方法与下文描述的“i.6-4筛选方法”部分中的描述一致。
[0187]
在该实施方式中,如图6所示,筛选程序存储在计算机可读的非暂时性有形存储介质109(例如cd-rom)中,并且从存储介质109安装在筛选装置2中;替代地,筛选装置2可以连接到因特网(未示出)以通过因特网下载筛选程序的程序代码。
[0188]
6-4.筛选方法根据本发明第二实施方式的筛选装置2执行根据本发明第二实施方式的筛选方法。根据本发明第二实施方式的筛选方法包括一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,所述方法包括以下步骤:(i)评价从经测试物质处理的受试者、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能;和(ii)基于步骤(i)中获取的评价结果确定所述测试物质是所述活性成分的候选物质。
[0189]
优选地,筛选方法在步骤(i)和(ii)之间还包括,将步骤(i)中获取的所述经测试物质处理的试样的评价结果与从未经测试物质处理的受试者、测试组织或测试细胞采集的试样(未经处理的试样)中的对应肾功能预测标记物蛋白质的功能的评价结果进行比较的步骤。
[0190]
图8是表示由根据本发明第二实施方式的筛选装置2执行的用于执行上述方法的数据处理流程的流程图。步骤s21、s22和s23分别由图7所示的第一评价结果获取单元21、第二评价结果获取单元22和评价结果比较单元23执行。步骤s24至s27由图7所示的候选物质
确定单元24执行。
[0191]
在步骤s21中,第一评价结果获取单元21获取经测试物质处理的试样中的蛋白质的功能的评价结果m31。
[0192]
在步骤s22中,第二评价结果获取单元22获取未经处理的试样中的蛋白质的功能的评价结果m32。
[0193]
在步骤s23中,评价结果比较单元23将在步骤s21中获取的经测试物质处理的试样的评价结果与在步骤s22中获取的未经处理的试样的评价结果进行比较。比较结果输出到候选物质确定单元24。
[0194]
候选物质确定单元24基于由评价结果比较单元23获取的比较结果确定活性成分的候选物质。具体地,当比较结果指示改善的结果时(步骤s24中的“是”),在步骤s25中,候选物质确定单元24确定测试物质是活性成分的候选物质。
[0195]
更具体地,在从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集经测试物质处理的试样以及肾功能预测标记物蛋白质随着肾功能的减退而被激活的情况下,当通过将m31除以m32获取的值是例如0.85或更小、优选0.7或更小、更优选0.5或更小时,评价结果比较单元23确定通过测试物质已经改善选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病,并输出疾病已经得到改善的比较结果。当比较结果指示疾病已经改善时,候选物质确定单元24确定测试物质是活性成分的候选物质。在从具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集经测试物质处理的试样以及肾功能预测标记物蛋白质的功能随着肾功能减退而被抑制的情况下,当m31除以m32获取的值为例如1.15或更大、优选1.3或更大、更优选1.5或更大时,评价结果比较单元23确定通过测试物质已经改善了选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病,并输出疾病已经得到改善的比较结果。当确定选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病尚未被测试物质改善时,评价结果比较单元23输出疾病还尚未改善的比较结果。当比较结果指示改善的结果时,候选物质确定单元24确定测试物质是活性成分的候选物质。
[0196]
在步骤s26中,候选物质确定单元24输出在步骤s25中确定的结果。在该实施方式中,确定结果显示在显示单元4上,并存储在筛选装置2中的存储单元103中。确定结果可以显示在通过互联网连接到筛选装置2的外部计算机终端的显示单元(例如,第三方组织中的计算机终端的显示单元)上,而不是将确定结果显示在显示单元4上。
[0197]
在步骤s24中,当比较结果指示疾病尚未改善时,处理继续进行步骤s27,并且候选物质确定单元24确定测试物质不是活性成分。在这种情况下,测试物质不是活性成分的结果可以显示在显示单元4上。
[0198]
7.筛选3本发明还包括第三筛选方法。该实施方式是用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,该方法包括检测在经测试物质处理的试样中的肾功能预测标记物蛋白质和/或所述蛋白质的mrna的步骤(a)。使用上述“i.1.术语解释”部分中描述的“肾功能预测标记物抗体”,例如通过已知的蛋白质检测方法(例如western blotting法或elisa方法)可以进行肾功能预测标记物蛋白质的检测。使用上述“i.1.术语解释”部分中描述的“用于肾功能预测标记物mrna
检测的核酸”,例如通过已知方法(例如,微阵列方法或rt-pcr)可以进行“肾功能预测标记物mrna的检测。
[0199]
检测结果可以通过目视观察来获取,或者可以作为吸光度、荧光强度或发光强度而获取。
[0200]
该实施方式可包括基于在检测步骤中获取的结果,确定测试物质是活性成分的候选物质的步骤(b)。在该步骤中,例如,在从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集试样以及肾功能预测标记物蛋白质是表达随着肾功能的减退而增加的蛋白质的情况下,当未检测到肾脏功能预测标记物蛋白质和/或所述蛋白质的mrna时,或者甚至在经测试物质处理的试样中检测到的肾脏功能预测标记物蛋白质和/或所述蛋白质的mrna非常少时,可以确定测试物质是活性成分的候选物质。在从具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集试样以及肾功能预测标记物蛋白质是表达随着肾功能的减退而减少的蛋白质的情况下,当检测到经测试物质处理的试样中的肾功能预测标记物蛋白质和/或该蛋白质的mrna的量大于未经处理的试样中对应的肾功能预测标记物蛋白质和/或所述蛋白质的mrna的量时,可以确定测试物质是活性成分的候选物质。
[0201]
此外,在该实施方式中,可以将经测试物质处理的试样中的肾功能预测标记物蛋白质和/或所述蛋白质的mrna的检测结果与未经处理的试样中的对应蛋白质和/或mrna的检测结果进行比较,并且可以确定测试物质是活性成分的候选物质。更具体地,该实施方式可以在步骤(a)和步骤(b)之间包括将步骤(a)中获取的经测试物质处理的试样的检测结果与未经处理的试样中的对应的肾功能预测标记物蛋白质和/或所述蛋白质的mrna的检测结果进行比较的步骤。例如,在从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集试样以及肾功能预测标记物蛋白质和/或所述蛋白质的mrna的表达随着肾功能的减退而增加的情况下,当在未经处理的试样中检测到该蛋白质,以及当在经测试物质处理的试样中未检测到对应的蛋白质和/或mrna、或者其表达在经测试物质处理的试样中降低时,可以确定测试物质是活性成分的候选物质。在从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中采集试样以及肾功能预测标记物蛋白质和/或所述蛋白质的mrna的表达随着肾功能的减退而降低的情况下,当在经测试物质处理的试样中检测到的蛋白质和/或mrna的量大于未经处理的试样中肾脏功能预测标记物蛋白质和/或所述蛋白质的mrna的量时,可以确定测试物质是活性成分的候选物质。在经测试物质处理的试样中的肾功能预测标记物蛋白质和/或所述蛋白质的mrna的检测结果与未经处理的试样中对应蛋白质和/或mrna的检测结果之间的比较中,它们之间的差异可以是可以在视觉上检测到的差异。
[0202]
该实施方式可包括在步骤(a)之前的以下步骤:(a)用测试物质处理受试者、测试组织或测试细胞;(b)从步骤(a)中已经施用测试物质的受试者、测试组织或测试细胞中采集试样;(c)从步骤(b)中获取的试样中采集蛋白质或mrna。
[0203]
8.筛选4当oscar(为肾功能预测标记物蛋白质)的功能性表达被抑制时,在摄入高磷含量的饮食时抑制了fgf23的表达的诱导。因此,在上述筛选1至筛选3中,当肾功能预测标记物蛋白质为oscar时,“筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组
中的至少一种疾病的活性成分的候选物质”也可以解读为“筛选能够抑制fgf23的功能性表达的候选物质”。
[0204]
9.生物标记物本发明涉及一种方法,该方法使用肾功能预测标记物蛋白质和/或肾功能预测标记物蛋白质的mrna作为生物标记物,用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质。这里,“肾功能预测标记物”的定义与“1.术语解释”中的描述一致。
[0205]
选自由图22中所示基因编码的蛋白质的任何一种蛋白质或选自由图23中所示基因编码的mrna的任何一种mrna可用作筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的生物标记物。
[0206]
此外,作为另一个实施方式,选自由图22中所示基因编码的蛋白质的至少两种蛋白质的组合或者选自由图23中所示基因编码的mrna的蛋白质的至少两种mrna的组合可以被用作筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的生物标记物。
[0207]
这些生物标记物包含在每个试样中。
[0208]
ii.iorgans该实施方式涉及基于称为“iorgans(器官间串扰)技术”的新方法的两种被称为“reverse iorgans”和“forward iorgans”的新的疾病确定方法。在该方法中,构建了来自于特定器官以外的器官的基因表达、代谢等的量的变化的综合数据库,并且这些变化与受试者中特定器官的功能和组织的功能和组织学变化相关联。通过使用综合数据库来实现疾病确定。“iorgans”是通过使用一个器官的状态与一个或多个其他器官的状态之间的相互关系作为量度来诊断、预防和/或治疗疾病的技术。
[0209]
图9和10示意性地示出根据本发明的reverse iorgans的轮廓。
[0210]
reverse iorgans是从关于例如在相同的时点从相同的受试者采集的特定器官以外的每个器官中的基因表达的模式的信息预测受试者中的特定疾病的方法。通过该方法可以预测特定潜在疾病的存在或特定器官的状态。在图9所示的示例中,从关于例如在另一器官(例如,脂肪组织或细胞)中的基因表达的模式的信息,预测特定器官(例如,肾脏)中的疾病(例如,选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病)。结合图10描述了reverse iorgans的预测方法的概要,假设例如其他器官是脂肪组织,并且特定器官中的疾病是选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病。图10中所示的a到f表示器官间串扰指示剂。
[0211]
首先,针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段,预先采集脂肪组织中基因表达的模式(即,器官间串扰指示剂的模式)作为每个阶段的标准数据;并准备一组标准数据。图10(a)示出标准数据的示例。图10(a)的标准数据示出器官间串扰指示剂的模式,即肾脏状态的每个阶段的脂肪组织中的a至f(选自正常状态、肾功能减退、慢性肾病和肾衰竭)。在肾功能减退、慢性肾病或肾衰竭的器官间串扰指示剂的模式中,灰色示出的器官间串扰指示剂的项目表示示出相对于正常无变化的器官间串扰指示剂的项目,用阴影线表示的器官间串扰指示剂的项目表示示出相对于正常有变化的器官间串扰指示剂的项目。
[0212]
接下来,从受试者采集脂肪组织,脂肪组织中的器官间串扰指示剂的模式被确定并被用作受试者的数据(例如,图10(b))。随后,将标准数据和来自脂肪组织的受试者的数据相互比较,并计算模式之间的相似度。当标准数据中存在与受试者数据类似的模式时,可以预测与标准数据中的相似模式相关的肾脏状态是受试者正承受的肾脏状态(选自肾功能减退、慢性肾病和肾衰竭中的疾病阶段)。在图10所示的示例中,(b)中所示的受试者数据的模式类似于标准数据中从顶部开始的第二模式。从顶部开始的第二模式是当肾脏处于肾功能减退状态时获取的模式。因此可以预测受试者的肾脏处于肾功能减退的状态。
[0213]
图11和12示意性地示出根据本发明的forward iorgans的轮廓。
[0214]
forward iorgans是一种方法,其中在通过使用常规测试等确定受试者的肾脏中选自肾功能减退、慢性肾病和肾衰竭中的一个疾病阶段之后,将选自肾功能减退、慢性肾病和肾衰竭中的那个疾病阶段与关于其他器官中的器官间串扰指示剂的预定数据进行比较以确定来自除受试者的肾脏以外的每个器官的基因表达的模式等;并且,基于此,预测在肾脏以外的每个器官中疾病(包括并发症)的存在或疾病的阶段。通过针对先前报道的关于肾脏以外的每个器官中的疾病中的基因表达的信息检验来自受试者肾脏以外的每个器官的基因表达的模式等,可以预测肾脏以外的每个器官中疾病(包括并发症)的存在或疾病的阶段。在图11的示例中,通过使用常规测试等预先识别选自肾功能减退、慢性肾病和肾衰竭中的一个疾病阶段,以及从选自肾功能减退、慢性肾病和肾衰竭中的一个疾病阶段预测肾脏以外的器官(例如,大脑)的状态。以这种情况为例,结合图12描述forward iorgans的预测方法的概要。
[0215]
首先,从例如血清等的生化测试的结果,确定受试者中肾脏的状态是选自肾功能减退、慢性肾病和肾衰竭中的一个疾病阶段的信息。接下来,针对储存用于选自肾功能减退、慢性肾病和肾衰竭中的一个疾病阶段的包括肾脏的器官中的基因表达模式等(器官间串扰指示剂的模式)(例如,图12(a)),检验受试者的阶段,由此从图12(a)的数据提取对应于受试者的阶段(肾功能减退的状态)的器官间串扰指示剂的模式(图12(b))。此外,从图12(b)的模式中提取来自大脑的器官间串扰指示剂的模式(图12(c))。通过这个程序,可以推断出来自大脑的器官间串扰指示剂的模式(图12(c))是来自处于受试者中处于所述阶段的大脑的器官间串扰指示剂的模式。基于推断的以所述模式示出的器官间串扰指示剂,可以从先前报道的关于疾病和并发症的信息预测大脑的状态。
[0216]
1.术语解释首先解释了与iorgans相关的关于本说明书、权利要求书和关于发明的摘要中所用的术语。除非另有说明,否则本说明书、权利要求书和摘要中使用的术语均符合本部分中的定义。与上述“i.筛选”部分中使用的一些术语相同的术语用在该“ii.iorgans”中;但是,除非另有说明,否则在说明书、权利要求书和摘要中所用的“ii.iorgans”中描述的发明相关的术语均符合本部分中的定义。除非提及单独的部分,否则上述“i.筛选”部分中使用的术语的定义和在该部分“ii.iorgans”中所用的术语的定义彼此独立。
[0217]
如本文所用的“个体”不受特别限制。示例包括哺乳动物,例如人、小鼠、大鼠、狗、猫、兔、牛、马、山羊、绵羊、猪、鸟类(例如鸡)等。个体优选是哺乳动物,例如人、小鼠、狗、猫、牛、马或猪,更优选人、小鼠、狗、猫等,甚至更优选人或小鼠,最优选人。此外,术语“个体”包括具有疾病的个体和没有疾病的个体。对个体的年龄或性别(男性或女性)没有限制;然而,
个体优选是与下文描述的受试者相同的物种、相同的年龄和/或相同的性别。
[0218]
此外,术语“个体”还包括妊娠的个体。
[0219]
对于人,本发明中个体的年龄可分为以下年龄组:未满7岁的年龄,7岁以上但未满15岁的年龄,15岁以上但未满30岁的年龄,30岁以上但未满60岁的年龄,60岁以上的年龄。本发明中的年龄没有特别限制,优选为15岁以上但未满30岁的年龄,30岁以上但未满60岁的年龄,60岁以上的年龄,更优选30岁或以上但未满60岁的年龄,或60岁以上的年龄。对于小鼠,年龄可分为以下年龄组:未满6周龄的年龄,6周龄以上但未满24周龄的年龄,24周龄以上但未满48周龄的年龄,以及48周龄以上的年龄。
[0220]
这里,具有选自下文所述的由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的个体被称为“阳性对照”,并且没有下文所述的由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的个体被称为“阴性对照”。
[0221]
在本发明中,“组织”是指具有相似功能和类似形状的细胞的集合。
[0222]
如本文所用的“器官”是指受试者中具有某种独立形式和特定功能的组织集合。具体示例包括:循环系统的器官(例如心脏,动脉,静脉和淋巴管),呼吸系统的器官(例如鼻腔,鼻旁窦,喉,气管,支气管和肺),消化系统的器官(例如嘴唇,颊区,腭,牙齿,牙龈,舌,唾液腺,咽,食道,胃,十二指肠,空肠,回肠,盲肠,阑尾,升结肠,横结肠,乙状结肠,直肠,肛门,肝脏,胆囊,胆管,胆道,胰腺和胰管),泌尿系统的器官(例如尿道,膀胱,输尿管和肾脏),神经系统的器官(例如大脑,小脑,中脑,脑干,脊髓,周围神经和自主神经),女性生殖系统的器官(例如卵巢,输卵管,子宫和阴道),乳房,男性生殖系统的器官(例如阴茎,前列腺,睾丸,附睾,和输精管),内分泌系统的器官(例如下丘脑,下垂体,松果体,甲状腺,甲状旁腺和肾上腺),皮肤系统的器官(例如皮肤,头发和指甲),造血系统的器官(例如外周血,骨髓和脾脏),免疫系统的器官(例如淋巴结,扁桃体和胸腺),骨骼和软组织器官(例如骨骼,软骨,骨骼肌,结缔组织,韧带,肌腱,横膈膜,腹膜,胸膜和脂肪组织),以及感觉器官系统的器官(例如眼球,眼睑,泪腺,外耳,中耳,内耳和耳蜗)。本发明中组织的优选示例包括心脏、大脑、肺、肾脏、脂肪组织、肝脏、骨骼肌、睾丸、脾脏、胸腺、骨髓、胰腺等的组织。更优选的组织示例包括心脏、大脑、肺、肾脏、脂肪组织、肝脏、骨骼肌、脾脏、骨髓、胰腺等的组织。
[0223]
此外,在使用妊娠个体(优选除人以外的个体)作为受试者的情况下,本发明中的术语“器官”可包括胚胎的全身或上述胚胎的器官。
[0224]
在本发明中,可以使用体液(例如血清,血浆,尿液,脊髓液,腹水,胸腔积液,唾液,胃液,胰液,胆汁和乳汁,特别优选血浆)代替以上所描述的器官。
[0225]
如本文所用的“器官间串扰指示剂”是存在于活生物体中的至少一种体内因子(或分子),并且充当表示活生物体中器官通过器官到器官通信(即,器官间串扰)的状态的量度。换句话说,器官间串扰指示剂是具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的个体中,根据是否存在疾病,可以经历源自每个器官的细胞或组织、和/或体液的中变化的体内物质。可用作器官间串扰指示剂的体内物质的示例包括:核酸;碳水化合物;脂质;糖蛋白;糖脂;脂蛋白;氨基酸,肽;蛋白质;多酚;趋化因子;选自由上述物质的代谢终产物、上述物质的中间代谢物以及用于上述物质的一种或多种代谢途径的起始物质组成的组中的至少一种代谢物;金属离子;等等。优选的示例是核酸。
[0226]
在本发明中,核酸优选为rna,例如mrna、非编码rna或微rna,更优选为mrna。rna优选为选自由可以在源自上述器官的细胞或组织中表达的mrna、非编码rna或微rna组成的组中的至少一种rna,更优选地,其中rna可以是通过rna-seq等检测得到的图21中列出的基因表达的rna(在本文中也称为“组1”)。其中,优选具有polya序列的rna。更具体地,rna是选自由图22中列出的组2的基因表达的rna组成的组中的至少一种rna,或者存在于上述个体中的选自由组2的直系同源物表达的rna组成的组中的至少一种rna。更优选地,rna是选自由图22中列出的组3的基因表达的rna组成的组中的至少一种rna,或者存在于上述个体中的选自由组3的直系同源物表达的rna组成的组中的至少一种rna。更优选地,rna是选自由图22中列出的组4的基因表达的rna组成的组中的至少一种rna,或者存在于上述个体中的选自由组4的直系同源物表达的rna组成的组中的至少一种rna。更优选地,rna是选自由图22中列出的组5的基因表达的rna组成的组中的至少一种rna,或者存在于上述个体中的选自由组5的直系同源物表达的rna组成的组中的至少一种rna。更优选地,rna是选自由图23中列出的组6的基因表达的rna组成的组中的至少一种rna,或者存在于上述个体中的选自由组6的直系同源物表达的rna组成的组中的至少一种rna。特别优选地,rna是选自由富脯氨酸蛋白(prh1,prp2,prb1,prpmp5)、防御素(defa和defb)、aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、纤维蛋白原和hamp/hepcidin组成的组中的至少一种基因表达的mrna,或者是存在于上述个体中的这些基因的直系同源物表达的rna。在其中不存在对应于图22或23中描述的基因的直系同源物的个体中,直系同源物被排除在分析之外。更优选的是,非编码rna和微rna(它们的ncbi参考序列id以“nr”开始)被排除在除小鼠之外的个体中的分析之外。对应于组2至6的人直系同源物是由图22中列出的人基因id指示的基因表达的rna。
[0227]
如本文所使用的“一种器官间串扰指示剂的量”或“多种器官间串扰指示剂的量”可以表示为定量值(或定量水平),或者如下半定量地表示:例如,“增加”,“没有变化”和“减少”。“一种器官间串扰指示剂的量”或“多种器官间串扰指示剂的量”可以是器官间串扰指示剂的测量值。
[0228]
在本发明中,术语“肾功能减退”、“慢性肾病”和“肾衰竭”的定义与上述“i.筛选,1.术语解释”部分中的定义一致。
[0229]
如本文所用的“标准数据1”是每个器官中的器官间串扰指示剂的数据,其用作预测受试者中选自肾功能减退、慢性肾病和肾衰歇中的至少一种疾病的存在和/或所述疾病的阶段的量度。更具体地,标准数据1是一组器官间串扰指示剂的模式,每个模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系;并且优选一组器官间串扰指示剂的模式,每个模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定比率。更优选地,器官间串扰指示剂的量是至少一种基因的表达水平,并且器官间串扰指示剂的模式是至少一种基因的一组
表达模式。此外,代替一组标准数据1,可以使用相关性映射(标准数据1-映射)。通过对每种疾病或每个阶段确定器官之间的器官间串扰指示剂的模式的相关性,使用来自多个器官的一组标准数据1,生成相关性映射(标准数据1-映射)。下文描述用于生成相关性映射的方法。
[0230]
这里使用的“标准数据2”是每个器官中的器官间串扰指示剂的数据,其用作预测患有选自肾功能减退、慢性肾病和肾衰歇中的至少一种疾病的受试者中肾脏以外的一个或多个器官中的每一个中的疾病的存在和/或疾病的阶段的量度。更具体地,标准数据2是预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的一组模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照中的肾脏以外的器官中的器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。优选地,标准数据2是预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段的器官间串扰指示剂的一组模式,每个模式来自通过阳性对照中的肾脏以外的器官中的器官间串扰指示剂的量除以阴性对照中的与肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量所获取的值。更优选地,器官间串扰指示剂的量是至少一种基因的表达水平,并且器官间串扰指示剂的模式是至少一种基因的一组表达模式。
[0231]
针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段;针对每个器官或体液;并且,如有必要,针对每个性别和/或每个年龄组,获取标准数据1或2。可以建立一组标准数据1或一组标准数据2的数据库。器官间串扰指示剂的每种模式与关于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的对应阶段的信息以及对应的器官或体液相关联。数据库可以存储在存储介质或存储装置中。
[0232]
术语“模式”包括,例如,器官间串扰指示剂的是否存在,器官间串扰指示剂的量,或者器官间串扰指示剂的量随时间的变化;以及器官间串扰指示剂数量和器官间串扰指示剂的量随时间的变化的组合。优选地,对于每个阶段,该模式包括器官间串扰指示剂的是否存在,器官间串扰指示剂的量,或者器官间串扰指示剂的量随时间的变化,以及器官间串扰指示剂数量和器官间串扰指示剂数量随时间的变化的组合。优选地,该模式包括来自至少一个基因的rna的表达的是否存在,来自至少一个基因的rna的表达水平,或来自至少一个基因的rna的表达水平随时间的变化;以及来自至少一个基因的rna的表达水平和来自至少一个基因的rna的表达水平随时间的变化的组合。
[0233]
以上的标准数据1、标准数据2、一组标准数据1或一组标准数据2的集群被称为“数据库”。基于例如关于选自由慢性肾病和肾衰竭组成的组中的一个疾病的阶段的信息和/或每种器官或体液的名称,可以从数据库中检索和提取标准数据1、标准数据2、一组标准数据1或一组标准数据2的的器官间串扰指示剂的对应模式。
[0234]“受试者”是应用根据本发明的预测方法的受试者,并且优选是与用于获取上述标准数据1或2的那些个体相对应的物种。例如,如果用于获取标准数据的个体是小鼠,则可以选择小鼠、大鼠、人等作为受试者。受试者的年龄和性别没有特别限制,并且受试者可以与用于获取标准数据1或2的个体是相同的年龄组和/或相同性别。
[0235]
这里使用的“受试者的数据”或“受试者数据”是来自从受试者采集的器官的全部或部分的器官间串扰指示剂的数据,并且该模式与关于受试者和器官的对应信息相关联。更具体地,受试者的数据或受试者数据是器官间串扰指示剂的模式,其表示除受试者的肾脏以外的器官中的器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的关系。受试者的数据或受试者数据优选地是器官间串扰指示剂的模式,其表示除受试者的肾脏以外的器官中的器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的比率。更优选地,器官间串扰指示剂的量是来自至少一种基因的rna的表达水平,并且器官间串扰指示剂的模式是至少一种基因的表达模式。
[0236]
如本文所用的“金标准”是通过已知的测试方法和/或诊断方法已经确定具有或不具有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的一个个体或多个个体。术语“金标准”也包括健康的个体。
[0237]
这里使用的“相似度”表示当将受试者的数据与标准数据进行比较时或者当将受试者数据x与标准数据y进行比较时,器官间串扰指示剂的模式相似的程度。更具体地,相似度可以是通过视觉确定,或通过统计分析等确定。用于计算相似度的统计分析的示例包括z-分数、spearman的成对相关、kullback-leibler发散、主成分分析(pca)等。
[0238]
例如,当使用spearman成对相关计算ρ值时,可以如下确定:当ρ值为1时,可以确定受试者的数据与标准数据1相同;当ρ值大于0.4且小于1,优选大于0.65且小于1,更优选大于0.75且小于1,甚至更优选大于0.85且小于1时,可以确定受试者的数据与标准数据1相似;另一方面,当ρ值为0.8或更小,优选为0.65或更小,更优选为0.40或更小时,可以确定受试者的数据与标准数据1不相似。
[0239]
例如,当使用z-分数计算z值时,可以如下确定:当z值为0时,可以确定受试者的数据与标准数据1相同;当z值落在0
±
0.5的范围(不包括0)内,优选在0
±
0.4的范围(不包括0)内,更优选在0
±
0.3的范围(不包括0)内,甚至更优选在0
±
0.15的范围(不包括0)内时,可以确定受试者的数据与标准数据1相似;另一方面,当z值落在0
±
0.15的范围之外,优选在0
±
0.3的范围之外,更优选在0
±
0.4的范围之外,甚至更优选在0
±
0.5的范围之外时,可以确定受试者的数据与标准数据1不相似。
[0240]
此外,当检验的器官间串扰指示剂的项目的至少50%,优选地至少70%,更优选地至少80%,甚至更优选地至少90%在标准数据1和受试者的数据之间相同或相似时,可以确定标准数据1中的模式类似于受试者数据中的模式。另一方面,当检验的器官间串扰指示剂的项目的至少50%,优选地至少70%,更优选地至少80%,甚至更优选地至少90%在标准数据1和受试者的数据之间不相同或不相似时,可以确定标准数据1中的模式与受试者的数据中的模式不相似。
[0241]
标准数据1-映射如下进行确定。当确定标准数据1-映射时,针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段采集多个器官;以及确定来自器官的器官间串扰指示剂的模式(例如,当器官间串扰指示剂是rna时,表达rna的基因按照器官之间一致的特定顺序列出)。使用例如spearman等级相关在器官的模式之间计算相
关性系数,并且生成器官之间的映射。
[0242]
更具体地,例如,疾病模型i中器官m和器官l之间的器官间串扰指示剂j的模式的相关系数由r
ijml
表示。
[0243]
疾病模型i的个体数量由n表示。
[0244]
在这种情况下,疾病模型i的器官m和器官l之间的相关系数可以由概率模型p(下面的等式)表示。公式1其中r
iml
是n个相关系数r
ijml
的平均值,σ
iml2
是相关系数r
ijml
的样品方差。受试者的数据与标准数据1-映射之间的比较、受试者数据x与标准数据y2-映射之间的比较、以及受试者数据x与标准数据y3-映射之间的比较可以使用贝叶斯推论、机器学习方法等来进行。例如,获取受试者中多个器官的器官间串扰指示剂的模式,并且以与上述相同的方式在受试者(从其获取了受试者的数据或者受试者数据x)中的器官之间确定器官间串扰指示剂的模式的相关系数。获取的值由以下表示:{r
′
ml
}
m,l∈(采集的器官)
在这种情况下,使用以下公式2可以计算相对于每个模型i的相关的似然性li{r
′
ml
}
m,l∈(采集的器官)
:公式2
[0245]
针对每个模型i计算似然性,并且具有最高似然性的模型i可以推断为受试者的状态。
[0246]
当待比较的器官的数量是三个或更多时,在器官中的每两个之间确定疾病模型和受试者之间的似然性,并且确定所计算的似然性的乘积。具有最高乘积的模型i可以被推断为受试者的状态。
[0247]
当执行受试者的数据与标准数据1-映射之间的比较时,使用哪个器官间串扰指示剂不受特别限制。例如,优选使用其中阳性对照和阴性对照之间的差异大的器官间串扰指示剂。更具体地,例如,当器官间串扰指示剂是rna时,其是其中阳性对照和阴性对照之间的比率大于1.5或小于0.65,优选大于2或小于0.5,更优选大于5或小于0.2的rna。
[0248]
例如,可以使用计算程序用计算机来执行上述统计分析。在这种情况下,下文描述的根据本发明的预测程序可以包括用于执行统计分析的统计分析程序的程序代码,或者市售的统计分析软件可以用作统计分析程序。例如,使用市售的统计分析软件,例如statflex ver.6(artech株式会社,大阪,日本)或ibm spss statistics(日本ibm株式会社),可以进行分析。
[0249]
这里使用的“一个或多个”包括一种的情况和多种的情况。术语“多”没有特别限制,只要其意指两个或更多个,并且优选地指三个或更多个,更优选五个或更多个,甚至更
优选十个或更多个。此外,在本说明书中,单数名词的使用可以包括复数。
[0250]
2.用于采集和存储用于提取器官间串扰指示剂的细胞或组织的方法,以及用于提取和测量器官间串扰指示剂的方法本发明中使用的器官间串扰指示剂的提取所用的细胞或组织的采集方法及其储存方法没有特别限制,根据器官间串扰指示剂的类型,根据已知方法可以采集和储存细胞或组织。用于提取本发明中使用的器官间串扰指示剂的方法也没有特别限制,并且可以根据已知方法根据器官间串扰指示剂的类型来提取器官间串扰指示剂。用于测量本发明中的器官间串扰指示剂的方法不受特别限制,只要可以测量器官间串扰指示剂的量即可。
[0251]
提取器官间串扰指示剂所用的细胞或组织不受特别限制。示例包括通过例如穿刺、活组织检验或手术从受试者采集的细胞、组织等。(采集的细胞或组织也称为“试样”。)细胞或组织可以是例如采集后的新鲜材料或冷冻保存的材料。
[0252]
在该实施方式中,对于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段,可以从源自怀疑患有疾病的肾脏的细胞或组织以及肾脏以外的一个或多个器官的细胞或组织获取器官间串扰指示剂。另外,器官间串扰指示剂可以来自未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的个体中的对应细胞或组织。
[0253]
采集细胞、组织或体液的时间可以根据疾病的阶段适当地选择,例如以下时间:在选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病发作之前(正常状态);在选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病发作时;在选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病发作后1个月、6个月、1年、2年、3年、5年或10年;等等。
[0254]
当rna用作器官间串扰指示剂时,优选的是,在采集细胞或组织后立即从细胞或组织中提取rna;或者,在采集细胞或组织后立即用液氮等冷冻细胞或组织,然后运输和储存细胞或组织。
[0255]
提取rna的方法没有特别限制,可以使用已知的方法提取rna。如果需要,可以使用例如oligo dt探针纯化rna。必要时,cdna可以通过逆转录反应从提取的或纯化的rna来合成,并用于测量。rna的定性或定量测量(包括半定量测量)可以通过已知方法进行,例如使用微阵列的方法,其可以综合分析基因表达;或其中通过rna-seq进行分析的方法,其确定细胞中rna的绝对量。作为综合和定量分析,rna-seq是优选的。
[0256]
可以使用已知方法分析通过rna-seq等获取的数据。例如,当用illumina hiseq(illumina,inc.)等分析数据时,可以通过以下方法处理输出数据:(1)从输出的初始分析数据获取核苷酸序列的文本数据(图像数据)(基本调用);(2)使用预定的过滤来选择数据,例如通过使用例如chastity(过滤)的计算公式从数据中去除由重叠的簇引起的低荧光纯度簇;(3)基于为每个样品提供的索引序列信息(特定核苷酸序列信息)对样品数据进行分类。
[0257]
从rna-seq测序仪获取的数据文件(fastq格式等)被上传到例如galaxy(https://usegalaxy.org/)上。此后,使用例如bowtie2(http://bowtie-bio.sourceforge.net/bowtie2/index.shtml)进行分析以将每个序列映射到小鼠基因组映射信息mm9或mm10。使用例如cufflinks(http://cole-trapnell-lab.github.io/cufflinks/)分析使用bowtie2
等获取的bam文件,以计算每个基因的fpkm(rpkm)。在获取的fpkm数据中,小于1的所有fpkm值都被视为0;使用python计算成对相关(ρ=1-(6σd2)/(n
3-n),并使用mev生成热图。还可以在视觉上分析fpkm值。
[0258]
必要时,也可以通过实时pcr等确认表达。另外,mrna表达水平可以根据需要通过管家基因(例如gapdh,β2-微球蛋白(β2m)或maea)的表达水平而被归一化,并表示为相对表达水平。
[0259]
通过上述方法获取的表达水平可以存储在装置的存储单元中,或者与该装置不同的具有存储单元的装置中,作为用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段、每个器官或体液、个体的每种类型、个体的每个年龄组、和/或个体的每个性别的器官间串扰指示剂的模式。
[0260]
3.reverse iorgans3-1.概要在该实施方式中,从来自除受试者肾脏以外的一个或多个器官中的每一个的器官间串扰指示剂的模式预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或疾病的阶段。具体地,通过执行以上ii.2.部分中描述的测量方法获取关于肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的受试者的数据,其中所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;将受试者的数据与对应于受试者数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,并计算受试者的数据和标准数据1之间的器官间串扰指示剂的模式的相似度,其中所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;并且通过使用相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或疾病的阶段。具体地,该实施方式包括以下步骤:(1)获取关于受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的受试者的数据,该器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;(2)通过将步骤(1)中获取的受试者的数据与对应于受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算受试者的数据和标准数据1之间的器官间串扰指示剂的模式的相似度,更具体地,通过相对于存储在预定的标准数据1中的一个或多个器官的名称检验在步骤(1)中获取的受试者的数据所源自的所述一个或多个器官的名称,并且将受试者的数据中的器官间串扰指示剂的模式和来自与受试者的数据所源自的所述一个或多个器官的每一个相同的器官的标准数据1中的对应的器官间串扰指示剂的模式进行比较,计算器官间串扰指示剂的模式的相似度,其中所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;(3)当从步骤(2)中所计算的所述器官间串扰指示剂的模式的相似度确定两种模式相似时,确定所述受试者具有与标准数据1相对应的疾病和/或处于与标准数据1相对应的疾病的阶段。
[0261]
步骤(1)可以以这样的方式执行:通过实际执行ii.2.部分中描述的测量方法,获取受试者的数据,或者,步骤(1)以这样的方式执行:已经获取的受试者的数据被进一步放入下文描述的预测装置等中。根据以上“ii.1.术语解释”部分中描述的方法可以执行步骤
(2)中的用于计算标准数据1和受试者的数据之间的相似度的方法,以及步骤(3)中的用于确定标准数据1和受试者数据是否相似的方法。这里,步骤(1)和步骤(2)不一定在同一组织中连续进行。例如,可以将在步骤(1)中获取的受试者的数据发送到第三方组织以执行步骤(2)和随后的步骤。
[0262]
此外,该实施方式还可以包括在步骤(1)之前的以下步骤:(i)从源自受试者的肾脏以外的一个或多个器官中的每一个的细胞或组织中提取器官间串扰指示剂;(ii)测量步骤(i)中提取的器官间串扰指示剂的量。在这种情况下,步骤(i)和步骤(ii)不一定连续进行。例如,可以将在步骤(i)中获取的器官间串扰指示剂发送到第三方组织以执行步骤(ii)。步骤(ii)和步骤(1)也不一定连续进行。可以将在步骤(ii)中获取的器官间串扰指示剂的测量结果发送到第三方组织以执行步骤(1)和后续步骤。
[0263]
这里,用于计算标准数据1和受试者的数据之间的相似度的方法,以及用于确定标准数据1和受试者的数据是否相似的方法如上面的“ii.iorgans,1.术语解释”部分中所述。
[0264]
作为另一个实施方式,该实施方式还包括一种用于获取关于器官间串扰指示剂的模式的相似度的信息以预测受试者中选自由肾功能减退、慢性肾病和肾脏组成的组中的至少一种疾病的存在和/或疾病的阶段的方法,该方法包括上述步骤(1)和(2),以及从步骤(2)获取信息的步骤。
[0265]
预测方法还可以包括从存储一组标准数据1的存储装置8(图13)获取一组标准数据1的步骤,或者从存储一组标准数据1的存储装置8获取一套或多套标准数据1的步骤。
[0266]
3-2.系统配置图13是根据本发明第三实施方式的系统120的概图。图14是示出系统120的硬件配置的框图。系统120包括输入单元3、显示单元4、装置5b和预测装置6。
[0267]
预测装置6包括例如通用个人计算机;并且包括用于执行下文描述的数据处理的cpu 101,用作数据处理的工作区的存储器102,用于存储所处理的数据的存储单元103,用于在单元之间传输数据的总线104,以及用于在预测装置和外部装置之间执行数据输入和输出的接口单元105(下文中称为“i/f单元”)。输入单元3和显示单元4连接到预测装置6。输入单元3包括例如键盘;显示单元4包括例如液晶显示器。输入单元3和显示单元4可以集成并实施为具有触控面板的显示器。预测装置6不需要是单一装置;cpu 101、存储器102、存储单元103等可以位于分开的位置,并且经由网络连接。预测装置也可以是省略输入单元3和显示单元4的装置,并且不需要操作员。
[0268]
预测装置6和装置5b也不一定位于一个位置,并且可以配置成使得位于分开的位置的装置经由网络可通信地连接到彼此。
[0269]
在下面的说明中,除非另有说明,由预测装置6执行的处理是指由预测装置6的cpu 101基于预测程序执行的处理。cpu 101将必要数据(例如正在处理的中间数据)暂时存储在用作工作区的存储器102中,并且适当地将长时间存储的数据(例如计算结果)存储在存储单元103中。
[0270]
装置5b是用于通过rna-seq方法测量mrna的表达水平的装置,并且包括序列分析单元54。在序列分析单元54中设置经受rna-seq反应的样品,并在序列分析单元54中执行核苷酸序列的分析。
[0271]
装置5b通过有线连接或无线连接连接到预测装置6。装置5b a/d转换mrna的测量
值并将其作为数字数据发送到预测装置6。因此,预测装置6可以获取mrna的测量值作为可以计算的数字数据。在该实施方式中,来自装置5b的数字数据被称为“关于器官间串扰指示剂的受试者的数据”,或者简称为“受试者的数据”。
[0272]
如上所述,系统120的输入单元3、显示单元4、装置5b和预测装置6中的每一个的硬件配置可以与图1所示的系统100的输入单元3、显示单元4、装置5b和筛选装置1中的每一个的硬件配置相同;或者,可以与图5所示的系统110的输入单元3、显示单元4、装置5b和筛选装置2中的每一个的硬件配置相同。
[0273]
系统120还可以包括存储标准数据1或一组标准数据1的存储装置8,存储装置8经由网络连接到预测装置。网络9例如是通信介质,例如因特网、虚拟私人网络(vpn)、广域网(wan)或公共交换电话网(pstn),并且不受限制,只要它能够进行存储装置8和预测装置6之间的通信即可。具体地,系统120可以是用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中肾脏以外的一个或多个器官中的每一个中疾病的存在和/或疾病的阶段的预测系统,该系统包括存储标准数据1或一组标准数据1的存储装置8和下文描述的预测装置6。
[0274]
3-3.预测装置本发明包括作为第三实施方式的用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的装置,所述装置包括以下计算工具:受试者数据获取工具,用于获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;模式相似度计算工具,用于通过将由所述受试者数据获取工具获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官中的一个或多个器官中的标准数据1进行比较,计算在所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和预测工具,用于通过使用由比较工具所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段。
[0275]
这里,用于计算标准数据1和受试者的数据之间的相似度的方法,以及用于确定标准数据1和受试者的数据是否相似的方法如上面的“ii.iorgans,1.术语解释”部分中所述。
[0276]
在该实施方式中,通过包括作为上述预测装置的预测装置6的系统120(图13和14)可预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或疾病的阶段。
[0277]
图15是示出根据本发明第三实施方式的预测装置6的功能的框图。预测装置6包括受试者数据获取单元61、模式相似度计算单元62和预测单元63。这些功能块通过将根据本发明的预测程序安装在预测装置6的存储单元103或存储器102中并使cpu 101执行该程序来实施。利用这种结构,预测装置6执行在下文描述的“ii.iorgans,3-5.预测方法”部分中
的预测方法。权利要求中提及的受试者数据获取工具、模式相似度计算工具和预测工具分别对应于图15中所示的受试者数据获取单元61、模式相似度计算单元62和预测单元63。
[0278]
换句话说,预测装置6是用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的装置,所述装置通过cpu101执行以下计算功能:受试者数据获取功能,用于获取关于肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;模式相似度计算功能,用于通过将由所述受试者数据获取功能获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算在所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和预测功能,用于通过使用由模式相似度计算功能所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的存在和/或所述疾病的阶段。
[0279]
预测装置还可以包括:用于从存储所述一组标准数据1的存储装置8获取一组标准数据1的功能,或者用于从存储所述一组标准数据1的存储装置8获取一套或多套标准数据1的功能。
[0280]
在该实施方式中,在装置5b中测量的器官间串扰指示剂的受试者数据m4从装置5b被放入预测装置6中。标准数据1(d1)存储在预测装置6的外部,并经由例如因特网放入预测装置6中。
[0281]
受试者数据m4可以经由网络从第三方组织(未示出)放入预测装置6中。受试者数据m4和标准数据d1可以预先存储在预测装置6的存储单元103或存储器102中。
[0282]
此外,功能块(即,受试者数据获取单元61、模式相似度计算单元62和预测单元63)不一定由单一cpu执行,并且可以由多个cpu以分布式处理。例如,这些功能块可以被配置成使得受试者数据获取单元61的功能由第一计算机的cpu执行,并且使得模式相似度计算单元62和预测单元63的功能由第二台计算机的cpu(即另一台计算机)执行。
[0283]
3-4.预测程序为了执行下文图16中的步骤s31至s36的处理,预测装置6预先将根据本发明的预测程序例如以可执行格式(例如,其中通过使用编译器从编程语言转换来生成程序的形式)存储在存储单元103中。预测装置6使用存储在存储单元103中的预测程序来执行处理。
[0284]
具体地,根据本发明第三实施方式的预测程序是一种预测程序,当由计算机执行时,使所述计算机执行以下处理以预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段:获取处理,获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;
模式相似度计算处理,通过将由所述受试者数据获取处理获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算在所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和预测处理,通过使用由模式比较处理所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的存在和/或所述疾病的阶段。
[0285]
预测程序还可以包括从存储一组标准数据1的存储装置8获取一组标准数据1的处理,或者从存储一组标准数据1的存储装置8获取一套或多套标准数据1的处理。
[0286]
在该实施方式中,如图14所示,预测程序存储在计算机可读的非暂时性有形存储介质109(例如cd-rom)中,并从存储介质109安装到预测装置6;替代地,预测装置6可以连接到互联网(未示出),以通过互联网下载预测程序的程序代码。为了使计算机执行上述计算处理,根据本发明的预测程序可以链接到存储在存储单元103或存储器102中的另一程序。例如,预测程序可以链接到在以上“ii.iorgans,1.术语解释”部分中提及的统计分析软件,并且模式相似度计算处理可以使用统计分析软件进行。
[0287]
3-5.预测方法根据本发明第三实施方式的预测装置6执行根据本发明第三实施方式的预测方法。根据本发明第三实施方式的预测方法是用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的方法,所述方法包括以下步骤:通过将关于受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂(该器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织)的受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算受试者的数据和标准数据1之间的器官间串扰指示剂的模式的相似度,其中标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和通过使用由所述模式相似度计算步骤中所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段。
[0288]
预测方法还可以包括从存储一组标准数据1的存储装置8获取一组标准数据1的步骤,或者从存储一组标准数据1的存储装置8获取一套或多套标准数据1的步骤。
[0289]
图16是示出通过根据本发明第三实施方式的预测装置6执行数据处理流程以执行上述预测方法的流程图。图16中所示的步骤s31至s36的处理由图15所示的受试者数据获取单元61、模式相似度计算单元62和预测单元63执行。
[0290]
在步骤s31中,受试者数据获取单元61获取受试者数据m4。受试者数据m4是除了受试者的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式,该器官间串
扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织,并从装置5b传输到预测装置6。
[0291]
在步骤s32中,模式相似度计算单元62将获取的受试者数据m4与标准数据1(d1)进行比较,并计算器官间串扰指示剂的模式的相似度。具体地,模式相似度计算单元62选择与受试者数据m4所源自的所述一个或多个器官中的每一个的名称相对应的标准数据1(d1),将所选择的标准数据1(d1)的模式与受试者数据m4的模式进行比较,并计算它们之间的相似度。用于计算相似度的方法和用于确定模式是否相似的方法如上文的“ii.iorgans,1.术语解释”部分中所述。在如上文“ii.iorgans,3-4.预测程序”部分中描述的预测程序可以包括用于使预测装置6的cpu 101通过模式相似度计算单元62执行计算处理的程序的程序代码;或者,例如,可以链接到上文“ii.iorgans,1.术语解释”中提到的统计分析软件以使cpu 101使用统计分析软件由模式相似度计算单元62执行计算处理。
[0292]
在步骤s34中,通过使用步骤s32中获取的相似度作为量度,预测单元63预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的存在和/或所述疾病的阶段。具体地,当从相似度确定模式相似时(步骤33中的“是”),预测单元63在步骤s34中确定:受试者具有对应于类似于受试者数据m4的标准数据1(d1)的模式的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病,和/或受试者处于对应于标准数据1的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阶段。
[0293]
当从在步骤s32中获取的相似度确定模式不相似时(步骤33中的“否”),预测单元63在步骤s36中确定:受试者没有对应于标准数据1的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病,和/或受试者未处于对应于标准数据1的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阶段。
[0294]
在步骤s35中,预测单元63输出在步骤s34中确定的结果作为预测结果数据。在该实施方式中,预测结果显示在显示单元4上,并且预测结果数据存储在预测装置6中的存储单元103中。预测结果可以显示在经由互联网连接到预测装置6的外部计算机终端的显示单元上,例如,第三方组织中的计算机终端的显示单元,而不是将预测结果显示在显示单元4上。
[0295]
4.forward iorgans4-1.概要在该实施方式中,预测了患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中疾病的存在和/或疾病的阶段。具体地,基于关于从受试者的诊断结果获取的受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息,预测了患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中疾病的存在和/或疾病的阶段。该实施方式包括以下步骤:(i)从所述受试者的诊断结果获取关于所述受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;(ii)相对于标准数据2检验步骤(i)中获取的关于所述阶段的信息;(iii)基于在步骤(ii)中获取的检验结果,从所述标准数据2确定处于对应于关于所述阶段的信息的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的标准数据α,以及从所述标准数据α提取对应于所述受试者中的阶段的所述受
试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;(iv)相对于关于在疾病和/或所述疾病的阶段中的器官间串扰指示剂的已知信息检验步骤(iii)中提取的所述器官间串扰指示剂的模式,以及确定与所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式相对应的除了肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段;和(v)进一步确定在步骤(iv)中确定的肾脏以外的所述一个或多个器官中的每一个中的所述疾病是所述受试者可能正患有的疾病,和/或确定在步骤(iv)中确定的肾脏以外的所述一个或多个器官中的每一个中的所述疾病的阶段是所述受试者正患有的疾病的阶段。
[0296]
在步骤(i)中,受试者的诊断结果不受限制,只要其由例如内科医师基于例如测试结果或医学访谈得出即可。诊断结果可以是从例如纸质图表获取的信息;或者可以是从例如电子图表中提取的电子数据。在步骤(i)中,基于受试者的诊断结果,获取关于受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阶段的信息,作为例如口头信息、书面或数字信息。也就是说,关于受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息是关于受试者处于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的哪个阶段的信息。
[0297]
例如,在相对于步骤(ii)中的标准数据2而检验步骤(i)中获取的关于阶段的信息时,检验阶段的名称是否与从分配到标准数据2中的器官间串扰指示剂的每个模式的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的名称相匹配。检验可以在视觉上进行;或者可以例如在数据库软件(例如,microsoft(注册商标)excel(微软公司)或microsoft(注册商标)access(微软公司))上使用软件的搜索功能、过滤功能等进行。
[0298]
在步骤(iii)中,基于步骤(ii)中的检验结果提取了与受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的名称相关联的器官间串扰指示剂的模式。提取的一组器官间串扰指示剂的模式被确定为标准数据α。此外,肾脏以外的至少一个器官选自与标准数据α中包含的器官间串扰指示剂的对应模式相关联的器官的名称,并且提取在至少一种所选择的器官中的器官间串扰指示剂的模式。可以在视觉上进行肾脏以外的至少一个器官的选择以及至少一个所选择的器官中的器官间串扰指示剂的模式的提取;或者可以在上述数据库软件上使用软件的搜索功能、过滤功能等进行。
[0299]
在步骤(iv)中,计算和确定了在至少一个所选择的器官中的器官间串扰指示剂的所提取的模式与关于存储在关于疾病的已知的信息的数据库(例如,dpc数据库(由日本厚生劳动省提供),pubmed(由国家生物技术信息中心提供),embase(由elsevier提供)或cochrane库(cochrane),以下也被称为“疾病信息数据库”)中的疾病和/或疾病的阶段中的器官间串扰指示剂的信息之间的相似度。随后,提取了疾病的名称或疾病的阶段的名称,其存储在疾病信息数据库中的器官间串扰指示剂的模式被确定为完全或部分地类似于至少一个所选择的器官中的器官间串扰指示剂的模式。根据上述“ii.iorgans,1.术语解释”部分中描述的用于确定相似度的方法,可以确定至少一个所选择的器官中的器官间串扰指示剂的模式是否类似于已知信息。然后可以确定所提取的疾病存在于肾脏以外的所选择的器官中,或者可以确定除了肾脏以外的所选择的器官处于所提取的疾病的阶段。在该确定过程中,可以将至少一个所选择的器官中的器官间串扰指示剂的模式与关于健康个体中的所
述器官间串扰指示剂的已知信息进行比较,以确定器官是正常的。
[0300]
在步骤(v)中,进一步确定在步骤(iv)中确定的肾脏以外的所选择的器官中的疾病是受试者可能正患有的疾病,和/或在步骤(iv)中所确定的疾病的阶段是受试者正患有的疾病的阶段。当在步骤(iv)中确定多种疾病时,可以确定:显示出与所选择的器官中的器官间串扰指示剂的模式相比具有高相似度的疾病是受试者可能正患有的疾病。当在步骤(iv)中确定疾病的多个阶段时,可以确定:显示出与所选择的器官中的器官间串扰指示剂的模式相比具有高相似度的疾病的阶段是受试者可能正患有的疾病的阶段。
[0301]
此外,该实施方式还可以是用于获取信息以预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段的方法,该方法包括上述步骤(i)至(iii);并且代替上述步骤(iv)进一步包括步骤(iv'):针对关于疾病和/或疾病的阶段的器官间串扰指示剂的已知信息,检验在步骤(iii)中提取的器官间串扰指示剂的模式,并且获取关于对应于受试者中肾脏以外的一个或多个器官的每一个中的器官间串扰指示剂的模式的肾脏以外的所述一个或多个器官中的每一个中的疾病的存在和/或疾病的阶段的信息。针对关于疾病和/或疾病的阶段中的器官间串扰指示剂的已知信息检验提取的器官间串扰指示剂的模式与上述步骤(iv)一致。
[0302]
上述预测方法还可以包括从存储一组标准数据2的存储装置10(图17)获取一组标准数据2的步骤,或者从存储一组标准数据2的存储装置10获取一套或多套标准数据2的步骤。
[0303]
4-2.系统配置图17是根据本发明第四实施方式的系统130的概图,图18是示出系统130的硬件配置的框图。系统130包括输入单元3、显示单元4和预测装置7。
[0304]
预测装置7包括例如通用个人计算机;并且包括用于执行下文描述的数据处理的cpu 101,用作数据处理的工作区的存储器102,用于存储所处理的数据的存储单元103,用于在单元之间传输数据的总线104,以及用于在预测装置和外部装置之间执行数据输入和输出的接口单元105(下文中被称为“i/f单元”)。输入单元3和显示单元4连接到预测装置7。输入单元3包括例如键盘,并且显示单元4包括例如液晶显示器。输入单元3和显示单元4可以集成并实施为具有触控面板的显示器。预测装置7不需要是单一装置;cpu 101,存储器102,存储单元103等可以位于分开的位置,并且经由网络连接。预测装置7还可以是省略输入单元3和显示单元4并且不需要操作员的装置。
[0305]
在下面的说明中,由预测装置7执行的处理是指基于预测程序由预测装置7的cpu 101执行的处理,除非另有说明。cpu 101将必要数据(例如正在处理的中间数据)暂时存储在用作工作区的存储器102中,并且适当地将长时间存储的数据(例如计算结果)存储在存储单元103中。
[0306]
如上所述,系统130的输入单元3、显示单元4和预测装置7中的每一个的硬件配置可以与图1所示的系统100的输入单元3、显示单元4和筛选装置1中的每一个的硬件配置相同;或者,可以与图5所示的系统110的输入单元3、显示单元4和筛选装置2中的每一个的硬件配置相同。
[0307]
系统130还可以包括存储标准数据2或一组标准数据2的存储装置10,存储装置10
经由网络连接到预测装置。网络9例如是通信介质,例如因特网、虚拟私人网络(vpn)、广域网(wan)或公共交换电话网(pstn),并且不受限制,只要它能够进行存储装置10和预测装置7之间的通信即可。具体地,系统130可以是用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中的疾病的存在和/或疾病的阶段的预测系统,该系统包括存储标准数据2或一组标准数据2的存储装置10和下文描述的预测装置7。
[0308]
4-3.预测装置本发明包括作为第四实施方式的用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官的每一个中疾病的存在和/或所述疾病的阶段的装置,所述装置包括以下计算工具:阶段信息获取工具,用于获取关于受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;检验工具,用于相对于标准数据2检验由所述阶段信息获取工具获取的关于所述阶段的信息;模式提取工具,用于基于由所述阶段信息检验工具获取的结果,提取所述受试者的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和预测工具,用于通过使用由所述模式提取工具所获取的所述器官间串扰指示剂的模式作为量度预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段。
[0309]
预测装置还可以包括用于从存储一组标准数据2的存储装置10获取一组标准数据2的功能,或者用于从存储一组标准数据2的存储装置10获取一套或多套标准数据2的功能。
[0310]
在该实施方式中,通过包括作为上述预测装置的预测装置7的系统130(图17和18)可以预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段。
[0311]
图19是示出根据本发明第四实施方式的预测装置7的功能的框图。预测装置7包括阶段信息获取单元71、阶段信息检验单元72、模式提取单元73和预测单元74。这些功能块通过将根据本发明的预测程序安装在预测装置7的存储单元103或存储器102并使cpu 101执行该程序来实施。利用这种结构,预测装置7执行在下文描述的“ii.iorgans,4-5.预测方法”部分中描述的预测方法。权利要求中提及的阶段信息获取工具、阶段信息检验工具、模式提取工具和预测工具分别对应于如图19所示的阶段信息获取单元71、阶段信息检验单元72、模式提取单元73和预测单元74。
[0312]
换句话说,预测装置7是用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官的每一个中疾病的存在和/或所述疾病的阶段的装置,所述装置由cpu 101执行以下计算功能:阶段信息获取功能,用于获取关于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;检验功能,用于相对于标准数据2检验由所述阶段信息获取功能获取的关于所述阶段的信息;模式提取功能,用于基于由所述阶段信息检验功能获取的结果,提取所述受试者
的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和预测功能,用于通过使用由所述模式提取功能所获取的所述器官间串扰指示剂的模式作为量度预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段。
[0313]
在该实施方式中,标准数据2(d1)和疾病信息数据库d2存储在预测装置7的外部,并且经由例如因特网被放入预测装置7中。
[0314]
标准数据2(d1)和疾病信息数据库d2可以预先存储在预测装置7的存储单元103或存储器102中。
[0315]
此外,功能块(即阶段信息获取单元71,阶段信息检验单元72,模式提取单元73和预测单元74)不一定由单一cpu执行,并且可以由多个cpu以分布式处理。例如,可以配置这些功能块,使得阶段信息获取单元71的功能由第一计算机的cpu执行;并且,阶段信息检验单元72、模式提取单元73和预测单元74的功能由第二计算机(即另一计算机)的cpu执行。
[0316]
4-4.预测程序此外,为了执行下文描述的图20中的步骤s41至s49,预测装置7预先将根据本发明的预测程序例如以可执行格式存储在存储单元103中。预测装置7使用存储在存储单元103中的预测程序执行处理。
[0317]
具体地,根据本发明第四实施方式的预测程序是一种预测程序,当由计算机执行时,使所述计算机执行以下处理以预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中的疾病的存在和/或所述疾病的阶段:阶段信息获取处理,获取关于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;阶段信息检验处理,相对于标准数据2检验由所述阶段信息获取处理获取的关于所述阶段的信息;模式提取处理,基于由所述阶段信息检验处理获取的结果,提取所述受试者中的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和预测处理,通过使用由所述模式提取处理所获取的所述器官间串扰指示剂的模式作为量度,预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段。
[0318]
预测程序还可以包括从存储一组标准数据2的存储装置10获取一组标准数据2的处理,或者从存储一组标准数据2的存储装置10获取两套或更多套标准数据2的处理。
[0319]
在该实施方式中,如图18所示,预测程序存储在计算机可读的非暂时性有形存储介质109(例如cd-rom)中,并从存储介质109安装到预测装置7;替代地,预测装置7可以连接到因特网(未示出)以通过因特网下载预测程序的程序代码。为了使计算机执行上述计算处理,根据本发明的预测程序可以链接到存储在存储单元103或存储器102中的另一程序。例如,预测程序可以链接到在上述“ii.iorgans,4-1.概要”部分中提及的市售的数据库软件,阶段信息检验处理和模式提取处理可以使用该数据库软件来执行。
[0320]
4-5.预测方法根据本发明第四实施方式的预测装置7执行根据本发明第四实施方式的预测方
法。根据本发明第四实施方式的预测方法是用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官的每一个中疾病的存在和/或所述疾病的阶段的方法,该方法包括以下步骤:获取关于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;相对于标准数据2检验由阶段信息获取处理获取的关于所述阶段的信息;基于由阶段信息检验步骤获取的结果,提取所述受试者的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和通过使用由模式提取处理所获取的所述器官间串扰指示剂的模式作为量度预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段。
[0321]
预测方法还可以包括从存储一组标准数据2的存储装置10获取一组标准数据2的步骤,或者从存储一组标准数据2的存储装置10获取一套或多套标准数据2的步骤。
[0322]
图20是示出根据本发明第四实施方式的预测装置7执行数据处理流程以执行上述预测方法的流程图。图20中所示的步骤s41至s49的处理由图19中所示的阶段信息获取单元71、阶段信息检验单元72、模式提取单元73和预测单元74执行。
[0323]
在步骤s41中,阶段信息获取单元71获取阶段信息。阶段信息是关于受试者处于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的哪个阶段的信息。阶段信息获取单元71通过例如输入单元3的操作来获取阶段信息。获取阶段信息的方式不限于此,并且阶段信息可以从电子图表或通过任何方法(例如外部数据通信)存储在预测装置7的存储单元103中。
[0324]
在步骤s42中,阶段信息检验单元72相对于标准数据2(d1)检验阶段信息。随后,在步骤s43中,基于步骤s42中获取的检验结果,模式提取单元73从标准数据2中确定处于对应于所述阶段信息的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阶段的标准数据α;以及从标准数据α中提取受试者中肾脏以外的一个或多个器官中的每一个中对应于受试者中的阶段的器官间串扰指示剂的模式。可以从输入单元3输入除了待提取的肾脏以外的一个或多个器官的名称。提取的具体过程与上文的“ii.iorgans,4-1.概要”部分中的描述一致。上文的“ii.iorgans,4-4.预测程序”部分中描述的预测程序可以包括用于使预测装置7的cpu 101通过阶段信息检验单元72和模式提取单元73执行计算处理的程序的程序代码;或者,例如,可以链接到上文提及市售数据库软件,以使cpu 101使用数据库软件由阶段信息检验单元72和模式提取单元73执行计算处理。
[0325]
在步骤s44中,预测单元74适当地访问在预测装置7的外部下载或存储器102或存储单元103中下载的疾病信息数据库d2;以及计算并确定在步骤s43中提取的所述一个或多个器官中的每一个中的器官间串扰指示剂的模式与关于存储在疾病信息数据库中的器官间串扰指示剂的信息之间的相似度。在步骤s46中,确定在肾脏以外的器官中存在被确定为具有与器官中的器官间串扰指示剂的模式完全或部分相似的模式的疾病(在步骤s45中的“是”);或者确定肾脏以外的器官处于被确定为具有与器官中的器官间串扰指示剂的模式完全或部分相似的模式的疾病的阶段(在步骤s45中的“是”)。在步骤s47中,预测受试者患有步骤s46中确定的疾病,或者受试者处于步骤s46中确定的疾病的阶段。上述“ii.iorgans,4-4.预测程序”部分中描述的预测程序可以包括用于使预测装置7的cpu 101
通过预测单元74执行计算处理的程序的程序代码;或者,例如,可以链接到上述“ii.iorgans,1.术语解释”部分中描述的统计分析软件以使cpu 101使用统计分析软件通过预测单元74执行计算处理。
[0326]
在步骤s48中,预测单元74输出在步骤s47中预测的结果。在该实施方式中,预测结果显示在显示单元4上,并且预测结果存储在预测装置7中的存储单元103中。代替将预测结果显示在显示单元4上,预测结果可以经由互联网显示在连接到预测装置7的外部计算机终端的显示单元上,例如,第三方组织中的计算机终端的显示单元。
[0327]
当在步骤s45中从步骤s44的结果确定模式不相似时(步骤s45中的“否”),预测单元74在步骤s49中确定不存在类似的模式。
[0328]
每个步骤的具体过程与上述“ii.iorgans,4-1.概要”中的描述一致。
[0329]
5.标准数据的生成,和标准数据5-1.标准数据的生成本发明涉及一种用于生成在以上的“3.reverse iorgans”中使用的标准数据1的方法,以及生成在以上的“4.forward iorgans”中使用的的标准数据2的方法。
[0330]
用于生成标准数据的方法是一种用于生成器官间串扰指示剂的模式的标准数据的方法,所述标准数据用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段,所述方法包括以下步骤:针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;确定所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的所述阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定;和将所述器官间串扰指示剂的模式与选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的对应阶段相关联。
[0331]
具体地,用于生成标准数据1的过程是在如下文描述的实施例中的过程。
[0332]
首先,从阴性对照和处于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段的阳性对照的肾脏以外的一个或多个器官(例如,脂肪)采集细胞或组织,并提取器官间串扰指示剂。然后识别并量化所提取的器官间串扰指示剂。
[0333]
接下来,确定器官间串扰指示剂的模式,每个模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照的肾脏以外的器官中的器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系(比率)来确定。所确定的器官间串扰指示剂的模式与选自由肾功能减退、慢性
肾病和肾衰竭组成的组中的至少一种疾病相关联;并且存储在例如存储装置中作为标准数据1或一组标准数据1。此外,该标准数据1或一组标准数据1可以存储在外部服务器中。
[0334]
此外,本发明包括用于生成标准数据2的方法。
[0335]
用于生成标准数据的方法是一种用于生成器官间串扰指示剂的模式的标准数据2的方法,所述标准数据2用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个疾病的存在和/或所述疾病的阶段,所述方法包括以下步骤:针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;和确定针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定。具体地,用于生成标准数据2的过程是在下文描述的实施例中描述的过程。
[0336]
首先,从由阴性对照和患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照所采集的肾脏以外的一个或多个器官采集细胞或组织,并且提取器官间串扰指示剂。然后识别并量化所提取的器官间串扰指示剂。
[0337]
接下来,针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段,确定器官间串扰指示剂的模式,每个模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定。针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的每个阶段所确定的这种器官间串扰指示剂的模式存储在例如存储装置中作为标准数据2或者一组标准数据2。此外,该标准数据2或一组标准数据2可以存储在外部服务器中。
[0338]
5-2.标准数据本发明包括通过上述方法生成的标准数据1或一组标准数据1。
[0339]
标准数据1是器官间串扰指示剂的模式的标准数据,用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段,该标准数据由以下步骤生成:针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或
组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;确定所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的所述阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定;和将所述器官间串扰指示剂的模式与选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的对应阶段相关联。
[0340]
所生成的标准数据1或一组标准数据1可以存储在预测装置6的存储单元103或存储器102中。替代地,生成的标准数据1可以存储在本地连接到预测装置6的存储装置中或者存储在外部存储装置中,例如可由预测装置6经由网络访问的服务器的存储装置。
[0341]
此外,本发明包括通过上述方法生成的标准数据2或一组标准数据2。
[0342]
标准数据2是器官间串扰指示剂的模式的标准数据,用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段,该标准数据由以下步骤生成:针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;和确定针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定。
[0343]
所生成的标准数据2或一组标准数据2可以存储在预测装置7的存储单元103或存储器102中。替代地,所生成的标准数据2或一组标准数据2可以存储在本地连接到预测装置7的存储装置中或者存储在外部存储装置中,例如可由预测装置7经由网络可访问的服务器的存储装置。
[0344]
6.治疗方法r-iorgans和f-iorgans还可包括用于治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的方法。根据已知方法可以执行用于治疗疾病的方法。当确定受试者具有肾功能减退时,首先,可以治疗引起肾功能减退的临床状态,以减缓肾功能减退的进展。这些临床状态的示例包括:与生活方式有关的疾病,例如糖尿病和高血压;泌尿系
统疾病,如尿路感染、尿路梗阻、肾小球肾炎、肾脏血管疾病(血流障碍)、以及由于镇痛药引起的药物诱导性肾病;等等。此外,可以进行例如血压控制或饮食限制的治疗以减缓慢性肾病的进展。此外,当慢性肾病进展时,可以使用例如磷结合剂对与慢性肾病相关的异常骨代谢进行药物治疗等。此外,如果需要,可以进行透析等。
[0345]
此外,在选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的治疗中,oscar蛋白质的拮抗剂可用作治疗中的活性成分。拮抗剂的示例包括oscar蛋白质的可溶性受体。可溶性受体包含oscar蛋白质中配体结合区的氨基酸序列。可溶性受体还可以包含例如免疫球蛋白的fc部分或合成高分子聚乙二醇(peg)等作为除oscar蛋白质中配体结合区的氨基酸序列之外的分子。在人的情况下,这种可溶性受体的示例是以np_996554.2(seq id no:1)表示的可溶性受体,其能够抑制oscar蛋白质的活化。在人的情况下,代替seq id no:1表示的氨基酸序列,可溶性受体包含以seq id no:1表示的氨基酸序列的第1至第228个氨基酸的序列中的至少第1至第220个氨基酸的序列,优选第1至第228个氨基酸的序列。可溶性受体可以包含与seq id no:1所示氨基酸序列的第1至第228个氨基酸的序列具有至少70%、优选至少80%、更优选至少85%、甚至更优选至少90%、甚至更优选95%同源的氨基酸序列。可溶性受体优选为,例如,包含含有以seq id no:2表示的氨基酸序列的肽的可溶性受体;或除了一至三个氨基酸被取代、删除或插入外具有与该肽的氨基酸序列相同的氨基酸序列的肽,该氨基酸序列能够抑制人oscar的活化。在小鼠的情况下,这种可溶性受体的示例是以np_783440.1(seq id no:3)表示的可溶性受体,其能够抑制oscar的活化。可溶性受体包含以seq id no:3表示的氨基酸序列的第1至第235个氨基酸的序列中的至少第1至第225个氨基酸的序列,优选第1至第235个氨基酸的序列。代替seq id no:3表示的氨基酸序列,可溶性受体可以包含与以seq id no:3表示的氨基酸序列的第1至第235个氨基酸的序列具有至少70%、优选至少80%、更优选至少85%、甚至更优选至少90%、甚至更优选95%同源的氨基酸序列。可溶性受体优选为,包含含有以seq id no:4表示的氨基酸序列的肽的可溶性受体;或除了一至三个氨基酸被取代、删除或插入外具有与该肽的氨基酸序列相同的氨基酸序列的肽,该氨基酸序列能够抑制小鼠oscar的活化。
[0346]
当全身施用时,拮抗剂可以以每千克成人体重0.01至1000毫克/天的量施用。
[0347]
当局部施用时,拮抗剂可以每cm2靶标组织0.01至100mg的量施用。
[0348]
拮抗剂可以通过将其与药学上可接受的载体或添加剂组合来制备。
[0349]
实施例下文参考实施例更详细地描述本发明。然而,本发明不应解释为限于这些实施例。
[0350]
实验实施例1:慢性肾病的模型小鼠的建立通过在单侧肾切除术后对小鼠喂食高磷含量的饮食来获取慢性肾病的模型小鼠。作为对照,在假手术后通过对它们喂食正常饮食来获取小鼠。1.单侧肾切除术在通过腹腔内施用阿佛丁(250mg/kg)麻醉小鼠(c57bl/6,8周龄,雄性)后,从背部切开皮肤。将右肾动脉和静脉以及输尿管结扎。在结扎的远侧切割后,移除右肾,并闭合切口。对照小鼠进行假手术。在假手术中,暴露右肾动脉和静脉以及输尿管,并且在没有结扎的情况下闭合切口。为了等小鼠从手术应激中完全恢复,向小鼠喂食正常饮食(含有0.35%的无机磷)4周。
[0351]
2.磷超负荷从手术结束后4周(12周龄)开始,对单侧肾切除的小鼠喂养高磷含量的饮食(含有2.0%无机磷)(以下也称为“肾病组”)。对假手术小鼠喂养正常饮食(含有0.35%无机磷)(下文也称为“假组”)。
[0352]
通过修改hu mc等人描述的方法(j am soc nephrol 22,124-136,2011)获取慢性肾病的模型小鼠。在hu m.c.等的方法中,在上述第1项中,在单侧肾切除术时,剩余的肾(左肾)进行缺血-再灌注损伤。然而,在该修改中,未进行缺血-再灌注。
[0353]
实验实施例2:ckd评价1.高磷含量的饮食开始后4周(16周龄)在肾脏组织学观察中,在苏木精-伊红(he)染色中观察到近端小管细胞对嗜酸性染料(伊红)的可染性降低,指示线粒体发生了一些变化。在肾间质中未发现明显的纤维化;然而,观察到轻微程度的炎性细胞浸润。
[0354]
在生理观察中,观察到尿蛋白的增加;然而,未观察到血肌酸酐或磷的增加或肌酸酐清除率的降低。
[0355]
在通过下文描述的rna-seq分析进行的基因表达观察中,观察到纤维化标记物(collagen-1,tgf-1)和炎症标记物(il-1,mcp-1)的表达增强。
[0356]
2.高磷含量的饮食开始后8周(20周龄)在肾脏的组织学观察中,观察到肾间质中的纤维化和细胞浸润,即肾纤维化。在生理观察中,观察到尿蛋白增加以及血肌酸酐、磷和fgf23增加;然而,肌酸酐清除率大幅增加,指示所谓的超滤(hyperfiltration)状态。
[0357]
3.高磷含量的饮食开始后12周(24周龄)在高磷含量的饮食开始后12周,在高磷含量的饮食开始后8周观察到的上述发现进一步发展。在一些示例中,在肾的皮质-髓质连接处及其周围观察到钙化。然而,老鼠都没有死亡。
[0358]
实施例1:通过r-iorgans观察器官间串扰1.各个器官的采集在高磷含量的饮食(在假组中的正常饮食)开始后1周(初期阶段:e)和4周(中期阶段:m)采集器官或组织(胰腺、颅骨、脑、下垂体(pg)、肾、肾上腺(ag)、肝、脾、胸腺、心脏、肺、颌下腺(sg)、甲状腺(tg)、大动脉、骨骼肌(肌肉,sm)、皮肤、睾丸、脂肪、眼睛、胃、空肠、回肠和结肠)。
[0359]
待采集器官和组织的动物从解剖前一天空腹过夜,并在没有麻醉的情况下通过颈脱位安乐死,并采集器官和组织。在测量所采集的器官和组织的湿重后,将器官和组织在液氮中快速冷冻并在-80℃储存。
[0360]
2.rna的分析(1)从各个组织提取rna将每种冷冻保存的组织在trizol试剂(life technologies)中用cell destroyer ps1000(pro sense,inc.)或pt 10-35 6t polytron匀浆器(kineatica)单独均化。在室温下培养5分钟以分离蛋白质后,每ml的trizol加入0.2ml氯仿,并盖上管。随后,将混合物剧烈涡旋15秒。涡旋后,将混合物在室温下培养3分钟,并在4℃下以12000g离心分离15分钟,
并将含rna的水层采集在新管。向采集的水层中加入等量的70%乙醇并混合。然后,将700μl混合物施加到每个rneasy mini柱(qiagen),并根据rneasy mini试剂盒(qiagen)标准方案采集纯化的rna。通过1%琼脂糖电泳和nanodrop评价每种采集的rna的品质和浓度。
[0361]
(2)获取rna-seq数据使用上述样品通过macrogen日本株式会社按以下步骤获取rna-seq数据。
[0362]
i.品质检验基于以下项目进行样品的品质测试。
·
使用agilent 2200 tapestation系统进行浓度测量和品质检验
[0363]
ii.样品的制备使用500至1000ng的通过品质测试的各个总rna样品作为模板,使用illumina的truseq rna样品制备试剂盒以如下方式根据标准方案制备用于测序的文库。(a)使用oligo-dt珠,纯化poly(a)-rna(b)poly(a)-rna片段化(c)逆转录第二链cdna合成(d)末端修复和3'a添加(e)接头连接(adapter ligation)注意:接头包含用于标识试样的索引标签。(f)pcr扩增(g)使用ampure xp珠,纯化和去除低分子量物质(《200bp)
[0364]
iii.使用下一代测序仪获取数据使用illumina hiseq 4000下一代测序仪通过根据paried-end法读取100个碱基,获取核苷酸序列数据。
[0365]
(3)rna-seq数据的分析(3-1)使用下一代测序仪获取的输出数据的分析对输出数据进行以下信息处理。i.碱基调用:从输出的初始分析数据(图像数据)获取核苷酸序列的文本数据。ii.过滤:通过预定过滤进行读取数据的选择。iii.基于索引序列的分类:基于索引信息对样品数据进行分类。
[0366]
(3-2)输出数据的二次分析使用illumina hiseq获取的数据文件(fastq格式)上传到下载到本地服务器的galaxy(https://usegalaxy.org/)。此后,使用bowtie2(http://bowtie-bio.sourceforge.net/bowtie2/index.shtml)进行分析以将每个序列映射到小鼠基因组图谱信息mm10。使用cufflinks(http://cole-trapnell-lab.github.io/cufflinks/)分析使用bowtie2所获取的bam文件以计算每个基因的fpkm(rpkm)。
[0367]
(3-3)结果通过将每个基因的rna表达水平(fpkm值)除以假组的小鼠中对应rna的表达水平(fpkm值)而计算数值(下文中也称为“ckd/sham”)。其中ckd/sham大于1或小于1的基因被分类为组2,其中ckd/sham大于1.5或小于0.67的基因被分类为组3,其中ckd/sham大于2或者小于0.5的基因被分类为组4,并且其中ckd/sham大于5或小于0.2的基因被分类为组5(图
22)。所有小于1的fpkm值均被视为“1”。图23列出了其中sham》1且ckd/sham》5的基因,sham《1且ckd》10的基因以及sham》10且ckd/sham《0.3的基因。特别地,图23的基因被认为最能反映肾功能的状态。
[0368]
从上述结果,从图22和图23中列出的基因表达的蛋白质或mrna被认为优选用作预测肾功能的标记物。此外,从图22和23中列出的基因表达的蛋白质或mrna被认为优选用作iorgans技术中的器官间串扰指示剂。实施例2:每种疾病中器官间串扰指示剂的模式相似度的比较为了说明根据r-iorgans的理论,从慢性肾病的模型小鼠中在每个阶段所采集的每个器官的细胞或组织所获取的器官间串扰指示剂的模式可以预测慢性肾病的存在和阶段,对疾病(例如心肌梗塞)的每个阶段确定个体器官中图22中所示的组5的rna的表达的模式之间的相关系数。通过修改spearman等级相关法和z-分数法确定相关系数。
[0369]
基于两个器官之间的器官间串扰指示剂的模式的相关系数来计算相似度。
[0370]
1.spearman等级相关通过使用分析软件r的函数cor(method=“spearman”)进行计算。表4-1至4-8示出结果。
[0379]
表4-1至4-8示出,在同一器官中,当疾病不同时,ρ值小于0.55。在相同器官和相同疾病的情况下,当阶段不同时,ρ值小于0.75。换句话说,可以认为,当在标准数据1和受试者
的数据之间获取的ρ值为0.55或更大时,可以确定受试者的数据指示与对应于标准数据1的疾病相同的疾病;当在标准数据1和受试者的数据之间获取的ρ值为0.75或更大时,可以确定受试者的数据指示与对应于标准数据1的阶段相同的阶段。
[0380]
2.z-分数法的应用将受试者的数据中每个基因的表达量除以标准数据中对应基因的表达量,并将获取的值由log2缩放。所缩放的值由xi(i=1,...,基因数)表示。关于值xi,确定所有分析的基因的平均值μ和方差σ。
[0381]
这里,基因i的z-分数zi由下式表示。等式3
[0382]
这是一个指示基因i的缩放值xi距离所有分析基因的平均值有多远的量化值。这里,该值指示与所有分析的基因相比,基因i在表达中表现出多少特异性变化。该值越接近0,基因呈现表达的特异性变化越小。该值越远离0,基因呈现表达的特异性变化越大。通过取缩放值zi的中值(z'),可以量化基因呈现表达上特异性变化的程度。
[0383]
为了分析,使用r描述了用于计算等式1的脚本。表5-1至5-8示出结果。
[0392]
表5-1至5-8示出,在同一器官中,当疾病不同时,zi值的绝对值大。
[0393]
参考实施例1
实验实施例i.oscar基因突变小鼠的建立1.grna和cas9表达载体的构建设计grna序列(oscar-grna1和oscar-grna2),并使用optimized crispr设计工具合成编码grna序列的寡dna(可在麻省理工学院网站的zhang lab(http://crispr.mit.edu/)上公开获取)。这些序列中包含的oscar基因靶标序列是以下序列:oscar-grna1中的acagctggagtatcagcgac(seq id no:5)和oscar-grna2中的gctcacagagagtcgacagc(seq id no:6),其存在于oscar基因的外显子1中。将它们分别插入是cas9表达载体(px330-oscar-grna1和px330-oscar-grna2)的px330-u6-chimeric_bb-cbh-hspcas9。确定获取的载体中grna插入位点的核苷酸序列以确认grna按设计插入。另外,单独合成单链寡脱氧核苷酸(ssodn)以包括各自的oscar基因靶标序列。设计供体寡dna区域使得终止密码子位于紧接在预定oscar-grna1切割位点的丝氨酸(serine)编码序列的下游,并且位于紧接在预定oscar-grna2切割位点的亮氨酸(leucine)编码序列的下游(图24a和图24b)。用于oscar-grna1的ssodn:gccaaggatccacacacaggggagggacagctcacagagagtcgacagctggagtatcagcctcagaagaactcgtcaagaagtcacgacaggaccatggtgggcactctccgtggagctgaggaaaaggttgaccctgccttttt(seq id no:7)用于oscar-grna2的ssodn:atagccctcagcccagccaaggatccacacacaggggagggacagctcacagagagtcgacctcagaagaactcgtcaagaagtcacagctggagtatcagcgacaggaccatggtgggcactctccgtggagctgaggaaaaggt(seq id no:8)
[0394]
2.oscar基因突变小鼠的建立将px330-oscar-grna1和px330-oscar-grna2与对应的ssodn一起分别注射到c57bl/6n slc受精卵中。将注射后的受精卵注射到假孕icr雌性小鼠的输卵管中。通过pcr(对于引物,参见表6)和直接测序法确认f0小鼠的基因型。通过使f0小鼠交配而获取f1小鼠。
[0395]
使用表6中所示的引物,通过直接测序和高分辨率熔解(hrm)分析来确定每只小鼠的基因型。
[0396]
图24c示出获取的突变小鼠的基因型序列。
[0397]
实验实施例ii.疾病模型小鼠的建立1.unx/hpi模型小鼠的建立通过在单侧肾切除术后向小鼠喂食高磷含量的饮食,获取unx/hpi小鼠(单侧肾切除术-摄入高磷含量饮食的小鼠)。作为对照,通过在假手术后喂食低磷含量的饮食来获取小鼠。
[0398]
1-1.单侧肾切除术通过腹腔内施用阿佛丁(250mg/kg)麻醉小鼠(c57bl/6j,8周龄,雄性)后,从背部切开皮肤。右肾动脉和静脉以及输尿管被结扎。在结扎的远侧切割后,右肾被摘除,并闭合切口。对照小鼠进行假手术。在假手术中,暴露右肾动脉、静脉以及输尿管,并且在没有结扎的情况下闭合切口。为了等待小鼠完全从手术应激中恢复,向小鼠喂食含0.54%无机磷的
正常饮食(ce-2,日本clea)4周。
[0399]
1-2.磷超负荷和组织的采集手术完成后4周(12周龄),以其中含有2%无机磷的高磷含量的饮食(td.10662,orientalbioservice,inc.)饲养单侧肾切除小鼠(以下也称为“肾病组”)。以其中含有0.35%无机磷的低磷含量的饮食(td.10662变型,orientalbioservice,inc.)饲养假手术小鼠(下文中也称为“假组”)。
[0400]
通过修改hu m.c.等人描述的方法(j am soc nephrol 22,124-136,2011)获取慢性肾病的模型小鼠。在hu m.c.等的方法中,在上述第1项中,在单侧肾切除术时,剩余的肾(左肾)进行缺血-再灌注损伤。然而,在该修改中,未进行缺血-再灌注。在具有高磷含量的饮食(在假组中具有低磷含量的饮食)开始后1周(e)、4周(m)和8周(l)采集组织。
[0401]
在麻醉下从眼眶采集血液后,通过颈脱位对从其采集组织的动物实施安乐死,并采集器官和组织(骨髓、脑、皮肤、心脏、肾脏、肝脏、肺、胰腺、骨骼肌、脾脏、睾丸、胸腺、脂肪、结肠、胃、肾上腺、大动脉、眼睛、回肠、空肠、下垂体、颅骨、唾液腺和甲状腺)。在测量所采集的器官和组织的湿重后,将器官和组织在液氮中快速冷冻并在-80℃储存。
[0402]
2.磷超负荷小鼠模型的建立2-1.磷超负荷wt小鼠(c57bl/6n,7周龄,雄性)或oscar基因突变小鼠(7-16周龄,雄性/雌性)喂食含0.54%无机磷正常饮食(ce-2,日本clea)持续一周。此后,对小鼠喂养作为特殊的磷饮食的高磷含量的饮食(其中含有2%的无机磷(td.10662,orientalbioservice公司))或低磷含量的饮食(其中含有0.35%的无机磷(td.10662变型,orientalbioservice公司))。
[0403]
2-2.组织的采集在将特殊的磷饮食喂食给wt小鼠(8周龄)开始时、开始之后的1天、3天、1周(9周龄)和4周(12周龄)时,采集颅骨。在oscar基因突变小鼠中,在特殊磷饮食开始之后的1周,采集颅骨。在通过腹腔内施用阿佛丁麻醉(250mg/kg)后,通过颈脱位使待采集组织的动物安乐死,并采集组织。在测量采集的组织的重量后,将组织在液氮中快速冷冻,并在-80℃下储存。
[0404]
实验实施例iii.每个组织中的基因表达的分析1.从每个组织进行rna的提取将每种冷冻保存的组织在trizol试剂(thermo fisher scientific,ma,usa)中用pt10-35gt polytron均化器(kinematica,luzern,switzerland)在15000r.p.m.下单独均化10分钟;或者用研钵和研杵在液氮中研磨,干燥,然后在trizol试剂(thermo fisher scientific,ma,usa)中用pt10-35gt polytron均化器(kinematica,luzern,switzerland)在15000r.p.m.下均化10分钟;或者使用不同尺寸(1.5mm直径
×
50,3mm直径
×
5,5mm直径
×
2)的氧化锆珠粒用cell destroyer ps1000或ps2000(bio medical science公司,东京,日本)在4260r.p.m.下在4℃下均化持续45秒。在室温下培养5分钟以分离蛋白质后,每ml的trizol加入0.2ml氯仿,并盖上管。随后,将混合物剧烈涡旋15秒。涡旋后,将混合物在室温下培养3分钟,并在4℃下以12000g离心分离15分钟,并将含rna的水层采集在新管中。向采集的水层中加入等量的70%乙醇并混合。然后,将700μl混合物施加到每个rneasy mini柱(qiagen),并根据rneasy mini试剂盒(qiagen)标准方案采集纯化的rna。通过使用
nanodrop(thermo fisher scientific,ma,usa)评价每种采集的rna的品质和浓度。
[0405]
2.rna表达的分析(rna-seq)(1)获取rna-seq数据使用上述样品通过以下步骤获取rna-seq数据。
[0406]
a.品质检验基于以下项目进行样品的品质测试。
·
使用nanodrop(分光光度计)进行浓度测量
·
使用agilent 2100生物分析仪进行浓度测量和品质检验
[0407]
b.样品的制备用sureselect strand-specific rna库制备试剂盒以下列方式制备用于hiseq下一代测序仪的库。i.使用oligo(dt)磁珠从总rna中采集poly(a)+rna(mrna)ii.rna的片段化iii.cdna的合成iv.双链cdna的合成v.末端修复,磷酸化,a尾添加vi.带索引的接头的连接vii.13个循环的pcrviii.用磁珠纯化
[0408]
c.使用下一代测序仪获取数据使用hiseq 2500或4000下一代测序仪(illumina)以下列方式进行测序。i.添加测序试剂试剂:truseq pe cluster kit v3-cbot-hs(1个流式细胞(1flowcell))《pe-401-3001》(illumina)试剂:truseq sbs kit v3-hs(200个循环)《fc-401-3001》(illumina)ii.单碱基延伸反应iii.去除未反应的碱基iv.掺入荧光信号v.去除保护基团和荧光重复该循环(例如,循环2,循环3,...),并且这些步骤进行至100个循环。vi.对于相反的链(读数2),将i至v进行至100个循环。
[0409]
(2)rna-seq数据的分析(2)-1使用下一代测序仪获取的输出数据的分析对输出数据进行以下信息处理。i.碱基调用:从输出的初始分析数据(图像数据)获取核苷酸序列的文本数据。ii.过滤:通过预定过滤进行读取数据的选择。iii.基于索引序列的分类:基于索引信息对样品数据进行分类。
[0410]
(2)-2.输出数据的二次分析使用illumina hiseq 2500或4000获取的数据文件(fastq格式)上传到下载到本
地服务器的galaxy(https://usegalaxy.org/)。此后,使用bowtie2(http://bowtie-bio.sourceforge.net/bowtie2/index.shtml)进行分析以将每个序列映射到小鼠基因组图谱信息mm10。使用cufflinks(http://cole-trapnell-lab.github.io/cufflinks/)分析使用bowtie2所获取的bam文件以计算基因的fpkm(rpkm)。也就是说,在该分析中,分析在各个组织中表达的所有rna。
[0411]
3.qrt-pcr将从各组织获取的1μg的总rna用作cdna合成的模板,并根据superscript iii first-strand synthesis supermix(life technologies)的标准方案使用oligo dt20引物来合成cdna。用te缓冲液(10mm tris-hcl,ph 8.0,0.1mm edta)将合成的cdna稀释20倍后,根据lightcycler 480sybr green i master(roche,basel,switzerland)的标准方案用lightcycler 480 ii(roche)进行实时pcr,以及测量了cp值。通过将对于每个基因获取的cp值和作为参考基因的β2-微球蛋白(b2m)的cp值进行比较来定量每个基因对于参考基因的相对表达水平。实时pcr中使用的引物对如表6所示。所有引物均使用primer-blast(ncbi)来设计。
[0412]
表6
[0413]
4.差异表达基因的分析为了提取差异表达的基因,通过使用htseq-count(参数:-r是pos,-s是no)对由bowtie2映射的序列数据中每个转录物的注释读数的数目进行计数。通过deseq2(love,m.i.,huber,w.&anders,s.;genome biology 15,550,doi:10.1186/s13059-014-0550-8(2014))以默认设置分析所获取的结果。在e-unx/hpi与e-/m-/l-sham(n=3),m-unx/hpi与e-/m-/l-sham(n=3),以及l-unx/hpi与e-/m-/l-sham(n=3)中比较表达差异。使用r package“topgo”进行基因本体(go)富集分析。在基因本体(go)富集分析中,deseq2分析结果为1或更高且p值小于0.05的情况被定义为“log2(倍数变化)”。
[0414]
5.统计分析
在统计分析中,进行学生t检验(student’t test)或单向方差分析,然后通过tukey-kramer检验确定显著差异。将p值小于0.05的情况定义为显著(*p《0.05,**p《0.01,***p《0.001)。在散点图中,平均值由水平线表示。
[0415]
6.结果图25示出具有高磷含量的饮食开始后1周(e-unx/hpi)、4周(m-unx/hpi)和8周(l-unx/hpi)的颅骨中的火山图。将deseq分析后的各mrna绘制成小点,并用大点表示oscar。与假手术小鼠(lpi)中的oscar基因的表达相比,在e-unx/hpi、m-unx/hpi和l-unx/hpi处的unx/hpi模型小鼠(hpi)中oscar基因的表达增加。图26a示出每种组织中oscar基因表达的deseq分析结果。在e-,m-和l-的unx/hpi模型的颅骨中oscar基因显示出高表达。通过qrt-pcr(n=8至9)证实了该结果。结果表明,与假手术小鼠(lpi)中的oscar基因的表达相比,在e-unx/hpi、m-unx/hpi和l-unx/hpi的unx/hpi模型小鼠(hpi)中颅骨中oscar基因的表达增加(图26b)。在deseq分析中,oscar基因在肾脏中的表达略有增加;然而,通过qrt-pcr确认没有观察到显著差异(图26c)。
[0416]
fgf23是肾病中甲状旁腺、骨骼和肾脏之间器官间串扰的主调节因子。与假手术小鼠(lpi)中的fgf23基因的表达相比,e-unx/hpi、m-unx/hpi和l-unx/hpi的unx/hpi模型小鼠(hpi)中颅骨中fgf23基因的表达增加(图27)。
[0417]
接下来,在小鼠的饲料从正常饮食转换到低磷含量的饮食或具有高磷含量的饮食后,检测在颅骨中oscar基因和fgf23基因随时间的表达。图28a示出在转换到具有低磷含量的饮食或具有高磷含量的饮食后1天、3天、1周和4周时颅骨中oscar基因的表达。图28b示出转换到具有低磷含量的饮食或具有高磷含量的饮食后1天、3天、1周和4周时颅骨中fgf23基因的表达。在转换为具有高磷含量的饮食后第1天时在颅骨中oscar基因和fgf23基因的表达已经增加。因为在学生t检验中p值较低,所以oscar基因的表达比fgf23基因的表达更强烈地增加。在饲料从正常饮食转换为低磷含量的饮食后,oscar基因的表达水平显著降低,而fgf23基因的表达水平没有变化。在转换到具有高磷含量的饮食后3天达到峰值后,oscar基因的表达显示出逐渐停止增加的趋势。相反,随着高磷含量的饮食期延长,fgf23基因的表达逐渐增加。这些结果表明,与fgf23的表达相比,oscar基因的表达更强烈、更敏感地反映了磷的摄入量。
[0418]
此外,检测了骨中oscar的表达增加对骨中fgf23表达的影响。将上述项目i.中获取的oscar基因突变小鼠喂食具有高磷含量的饮食,并通过qrt-pcr检测骨中fgf23的表达。结果表明,如图29所示,即使喂食具有高磷含量的饮食,在oscar基因突变小鼠的骨中fgf23的表达也没有增加。
[0419]
上述结果表明oscar上调了fgf23的表达途径。这指示抑制oscar的功能表达性能够抑制fgf23的功能性表达,并且进一步指示抑制oscar的功能性表达使得能够控制与fgf23相关的疾病。参考实施例2:可溶性人oscar-fc融合蛋白的制备在动物细胞中表达含有编码可溶性人oscar-fc融合蛋白的核苷酸序列的表达质粒,从而制备seq id no:2所示的可溶性人oscar-fc融合蛋白。该蛋白质的制备外包给proteinexpress株式会社(千叶,日本)。
[0420]
《人oscar-人igg1的氨基酸序列》
malvlilqlltlwplchtditpsvaiivppasyhpkpwlgaqpatvvtpgvnvtlrcrapqpawrfglfkpgeiapllfrdvsselaeffleevtpaqggsyrccyrrpdwgpgvwsqpsdvlellvteelprpslvalpgpvvgpganvslrcagrlrnmsfvlyregvaaplqyrhsaqpwadftllgarapgtyscyyhtpsapyvlsqrsevlviswegegpearpasdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsreemtknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgk*(seq id no:2)(下划线表示铰链区。铰链区的上游表示人oscar的序列,铰链区的下游表示人igg1序列。)
[0421]
1.细胞的制备将freestyle 293-f细胞在freestyle 293表达培养基(invitrogen)中传代培养。在以下条件下使用500ml烧瓶进行传代培养:振荡速度为120r.p.m.,二氧化碳浓度为8%,温度为37℃(170ml的培养基)。在转染前一天将细胞稀释至6
×
105个细胞/ml至总量1l并培养24小时。培养后,将细胞数调整为1
×
106个细胞/ml,这些细胞用于转染。
[0422]
2.表达测试将2.1ml的293fectin转染试剂(invitrogen)加入预热至37℃的30ml optipro sfm(invitrogen)中,从而制备试剂溶液。类似地,将1mg的含有具有以下序列的kozak-hoscar-higg1-intronxbai的pcdna3(invitrogen)加入到30ml optipro sfm中,从而制备dna溶液。将制备的试剂溶液和dna溶液在室温下培养5分钟。将5分钟后的试剂溶液和dna溶液混合以制备转染溶液。将转染溶液在室温下培养20分钟,并加入到调节用于转染的培养基中,然后在转染开始后第1天、第2天和第3天取样。然后在第4天终止培养。将获取的试样离心分离成上清液和沉淀物。通过sds-page和westernblotting法确认蛋白质表达。
[0423]
《kozak-hoscar-higg1-intronxbai》aagcttgccaccatggccctcgtgcttatcctccaacttctcacgctttggcctctgtgccacaccgacattactccgtctgttgcgataattgtccctcccgcctcttatcaccctaaaccttggctgggcgcacagccagctactgtggttactcctggggtgaacgtaacactgcgctgccgtgctcctcagcccgcctggagatttgggttgtttaagcccggagagatagcaccactgctgtttcgggatgtgtcctcagagctggctgagttcttcctggaagaggtcactcctgcccaaggaggcagctatcggtgctgttataggcggccggattggggacccggcgtttggtcccaaccatctgatgtgctcgaactgcttgtgacagaagagctgcccagacctagcttggtagccttgcccggtcctgtcgtcggacctggtgccaatgtttctcttcgatgtgccggaaggctgcgcaatatgtcctttgtactgtatagggagggagtagccgcacctctgcagtataggcatagcgctcagccctgggcggattttactctgcttggtgccagagcacccgggacctattcctgctactaccacactccttccgcaccctacgtcctgtcacagagatcagaagtgctcgtgatctcctgggagggagaaggcccagaagccgacaaaactcacacatgcccaccgtgcccaggtaagccagcccaggcctcgccctccagctcaaggcgggacaggtgccctagagtagcctgcatccagggacaggccccagccgggtgctgacacgtccacctccatctcttcctcagcacctgaactcctggggggaccgtcagtcttcctcttccccccaaaacccaaggacaccctcatgatctcccggacccctgaggtcacatgcgtggtggtggacgtgagccacgaagaccctgaggtcaagttcaactggtacgtggacggcgtggaggtgcataatgccaagacaaagccgcgggaggagcagtacaacagcacgtaccgtgtggtcagcgtcctcaccgtcctgcaccaggactggctgaatggcaaggagtacaagtgcaaggtctccaacaaagccctcccagcccccatcgagaaaaccatctccaaagccaaaggtgggacccgtggggtgcgagggccacatggac
agaggccggctcggcccaccctctgccctgagagtgactgctgtaccaacctctgtccctacagggcagccccgagaaccacaggtgtacaccctgcccccatcccgggatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggcttctatcccagcgacatcgccgtggagtgggagagcaatgggcagccggagaacaactacaagaccacgcctcccgtgctggactccgacggctccttcttcctctacagcaagctcaccgtggacaagagcaggtggcagcaggggaacgtcttctcatgctccgtgatgcatgaggctctgcacaaccactacacgcagaagagcctctccctgtctccgggtaaatgatctaga(seq id no:20)
[0424]
3.使用bipo resin protein a(10ml)进行纯化将培养上清液(1l)装载到bipo resin protein a(10ml)上以纯化靶标蛋白质。用pbs洗涤后,使用100mm的柠檬酸缓冲液(ph 2.5)(5ml
×
5)进行靶标蛋白质的洗脱。用1m的tris-hcl(ph9.0)中和洗脱液。纯化后,通过sds-page和western blotting确认每个洗脱级分中蛋白质的纯度。结果证实了洗脱级分中的靶标蛋白质的带。采集含有靶标蛋白质的级分,然后将缓冲液交换到pbs中(总量:50ml)。由此,获取1mg/ml的可溶性人oscar-fc融合蛋白。实施例2:向hp模型小鼠施用可溶性人oscar-fc融合蛋白的实验通过向小鼠喂食高磷含量的饮食获取hp小鼠(高磷含量的饮食摄入的小鼠)。每周向该模型施用可溶性人oscar-fc融合蛋白。
[0425]
1.磷超负荷通过向小鼠(c57bl/6n,8周龄,雄性)喂食含有2%无机磷的饮食(td.10662,orientalbioservice公司)作为特殊磷饮食,获取摄入高磷含量的饮食的小鼠。向低磷含量的饮食的小鼠(lp)喂食含有0.35%无机磷的低磷含量的饮食(td.10662变型,orientalbioservice公司)。
[0426]
2.可溶性人oscar-fc融合蛋白的施用和组织的采集从高磷含量的饮食开始日期(第0周)到第4周,每周一次腹腔内施用可溶性人oscar-fc融合蛋白(10mg/kg),即总共五次。在该实验中,将生理盐水施用到对照组。在第4周完成腹腔内施用(即第五次腹腔内施用)后次日,采集组织。在三溴乙醇麻醉(250mg/kg)下,在将血液从眼眶采集到edta补充管中后,通过颈椎脱位对待采集组织的动物实施安乐死,并且采集器官和组织(颅骨,脑,下垂体,腮腺,甲状腺,心脏,肺,胰腺,肾脏,肾上腺,肝脏,脾脏,胸腺,大动脉,股骨肌,皮肤,睾丸,脂肪组织,胃,空肠,回肠,结肠和骨髓细胞)。在测量采集的器官和组织的湿重后,将器官和组织在液氮中快速冷冻并在-80℃下储存。将采集的血液在室温下以1200g离心分离10分钟。离心分离后,采集上清血浆并在-80℃下储存。
[0427]
3.每个组织中的基因表达的分析和血液成分的测量3-1.从每个组织进行rna的提取将每种冷冻保存的组织在trizol试剂(life technologies)中用pt10-35gt polytron均化器(kinematica,luzern,switzerland)在15000r.p.m.下单独均化10分钟,或者使用cell destroyer ps1000或ps2000(bio medical science,东京,日本)使用不同尺寸的氧化锆珠(直径1.5mm
×
50,3mm直径
×
5,5mm直径
×
2)在4260r.p.m.下在在4℃下均化持续45秒。在室温下培养5分钟以分离蛋白质后,每1ml trizol加入0.2ml氯仿,并盖上管。随后,将混合物剧烈涡旋15秒。涡旋后,将混合物在室温下培养3分钟,并在4℃下以12000g离心分离15分钟,并将含rna的水层采集在新管中。向采集的水层中加入等量的70%乙醇并
混合。然后,将700μl混合物施加到每个rneasy mini柱(qiagen),并根据rneasy mini试剂盒(qiagen)标准方案采集纯化的rna。通过使用nanodrop(thermo fisher scientific,ma,usa)评价每种采集的rna的品质和浓度。
[0428]
3-2.qrt-pcr将从各组织获取的0.5至1μg的总rna用作cdna合成的模板,并根据superscript iii first-strand synthesis supermix(life technologies)的标准方案使用oligo dt20引物来合成cdna。用te缓冲液(10mm tris-hcl,ph 8.0,0.1mm edta)将合成的cdna稀释20倍后,根据lightcycler 480sybr green i master(roche,basel,switzerland)的标准方案用lightcycler 480ii(roche)进行实时pcr,以及测量了cp值。通过将对于每个基因获取的cp值和作为参考基因的maea的cp值进行比较,定量每个基因对于参考基因的相对表达水平。实时pcr中使用的引物对如表7所示。所有引物均使用primer-blast(ncbi)设计。
[0429]
表7
[0430]
4.用elisa法测量血浆中fgf23的浓度使用由kainos laboratories公司(tcy4000)销售的elisa试剂盒测量血浆中fgf23的浓度。将在冰箱中冷冻保存的血浆样品在冰上解冻,未稀释的样品或用试剂盒提供的标准溶液1(fgf-23 0pg/ml,0μg/ml)稀释5倍的样品用于测量。
[0431]
将50μl稀释的样品或用于校准曲线的样品添加到随试剂盒提供的elisa板的每个孔中。将板密封,然后搅拌并在室温下培养2小时。2小时后,吸出每个孔中的样品并丢弃。然后向每个孔中加入300μl随试剂盒提供的洗涤溶液,然后去除洗涤溶液。该操作进行四次。彻底去除洗涤溶液后,向各孔中加入100μl随试剂盒提供的酶标记抗体溶液(fgf-23结合物(conjugate)),将板密封,然后在室温下搅拌并培养1小时。1小时后,吸出每个孔中的样品并丢弃。然后将300μl随试剂盒提供的洗涤溶液加入每个孔中,然后去除洗涤溶液。该操作进行四次。在彻底去除洗涤溶液后,向每个孔中加入100μl随试剂盒提供的底物溶液(substrate),并将板在室温下在阴凉处静置30分钟。此后,向每个孔中加入100μl随试剂盒提供的反应终止溶液(终止溶液),然后温和摇动。然后用吸光度微板读数器(multiskan go,thermo fisher scientific inc.)测量450nm处的吸光度。通过从试剂盒提供的重组fgf23的测量结果制备校准曲线来计算血浆中fgf23的浓度。
[0432]
5.统计分析在统计分析中,进行学生t检验或单向方差分析,然后通过tukey-kramer检验确定显著差异。p值小于0.05的情况定义为显著的。
[0433]
6.结果在下文中,在附图中,hp4w表示在具有高磷含量的饮食开始后4周的小鼠,并且
lp4w表示在低磷含量的饮食开始后4周的小鼠(对照组)。soscar表示施用可溶性人oscar-fc融合蛋白的小鼠,ns表示施用生理盐水代替可溶性人oscar-fc融合蛋白的小鼠。wt(12w)表示喂食正常饮食的12周龄雄性野生型小鼠。
[0434]
图30示出颅骨中fgf23的qrt-pcr结果。图31示出腮腺中prp基因的qrt-pcr结果。fgf23是肾病中甲状旁腺、骨骼和肾脏之间器官间串扰的主调节因子。颅骨中fgf23的表达是由高磷含量的饮食诱导的。然而,通过施用可溶性人oscar-fc融合蛋白抑制了fgf23的表达(图30)(n=5至6)。maea基因的表达被归一化,并进行显著性检验。结果显示施用soscar的hp与未施用soscar的hp之间存在显著差异(p=0.026)。在腮腺中通过施用可溶性人oscar-fc融合蛋白抑制了prp基因(prb1,prh1,prp2和prpmp5)的表达,该prp基因的表达由高磷含量的饮食诱导(图31)(n=5到6)。从上文可以看出,通过将可溶性人oscar-fc融合蛋白施用到磷超负荷的模型小鼠持续4周,抑制了肾衰竭初期阶段标记物fgf23基因(颅骨)和prp基因(腮腺)的表达。
[0435]
图32示出血浆中fgf23的elisa测量结果。在hp中,血浆中fgf23的浓度高于lp4w和wt(12w)中fgf23的浓度。通过向hp施用可溶性人oscar-fc融合蛋白,fgf23(血液中的肾衰竭初期阶段标记物)的浓度增加在统计学上显著受到抑制(p=0.049)。
[0436]
如下文所述,在喂食高磷含量的饮食的oscar基因突变小鼠的1周模型的骨中的qrt-pcr分析显示肾衰竭初期阶段标记物fgf23基因的表达的增加被显著抑制。在该实验中,从磷超负荷的初期阶段开始,具有抑制配体结合到oscar的效果的可溶性人oscar-fc融合蛋白的施用抑制了骨骼中fgf23基因(其深刻关联在诸如慢性肾病的临床状态中)的表达;并进一步抑制了血浆中fgf23的浓度的增加。这表明施用可溶性人oscar-fc融合蛋白作为改善由过量磷状态引起的临床状态(例如肾损伤)的新型治疗方法的潜力。
[0437]
参考实施例3:血浆中肌酸酐的测量对小鼠(c57bl/6n,8周龄,雄性)喂食其中含有2%的无机磷的高磷含量的饮食(td.10662,orientalbioservice,inc.)或其中含有0.35%无机磷的低磷含量的饮食(td.10662变型,orientalbioservice,inc.)作为特殊磷饮食持续4周。此后,采集血浆样品(lp4w,hp4w)并冷冻保存。从12周龄雄性小鼠(c57bl/6n)采集血浆样品(wt(12w)),并冷冻保存。对8周龄雄性小鼠(c57bl/6n)进行单侧肾切除术,并且在适应4周后,向小鼠喂食具有高磷含量的饮食4周。此后,采集血浆样品(unx/hp4w)并冷冻保存。通过酶法使用100μl的每种样品测量血浆中的肌酸酐值。
[0438]
图33示出每种磷超负荷模型中血浆中的肌酸酐值。在hp4w模型和unx/hp4w模型中,作为肾衰竭的血液标记物的肌酸酐的量没有增加。因此,认为:可溶性人oscar-fc融合蛋白可用于抑制肾功能的减退。还认为图22和23中所示的肾功能预测标记物可以比血液中肌酸酐的量增加更早地检测到肾功能的减退。因此,认为当肌酸酐的量尚未增加时以及当图22和图23中所示的肾功能预测标记物增加或降低时的阶段通过施用可溶性人oscar-fc融合蛋白,可以在初期阶段阶段抑制肾功能减退。
[0439]
参考实施例4:肾脏中纤维蛋白原的表达为了评价可溶性oscar-fc融合蛋白对肾功能的影响,在参考实施例2的hp4w_ns、hp4w_soscar和lp4w的肾脏中证实了肾功能标记物的表达。在肾脏中,通过施用可溶性oscar-fc融合蛋白显著抑制fgg基因(其是由高磷含量
的饮食诱导其表达的纤维蛋白原基因)的表达(图34)(p=0.00071;n=5至6)。已报道纤维蛋白原基因作为肾功能标记物和治疗靶标。这表明,通过施用可溶性oscar-fc融合蛋白,可以预防或治疗与高磷状态相关联的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病。
[0440]
本发明涉及以下的技术方案1.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,所述装置包括以下计算工具:第一测量值获取工具,用于获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和确定工具,用于基于由所述第一测量值获取工具获取的所述测量值确定所述测试物质是所述活性成分的候选物质。2.根据项1所述的装置,还包括:第二测量值获取工具,用于获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和测量值比较工具,用于将所述经测试物质处理的试样的测量值与所述未经处理的试样的测量值进行比较,其中,所述确定工具基于由所述测量值比较工具获取的比较结果,确定所述测试物质是所述活性成分的候选物质。3.根据项1或2所述的装置,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。4.一种筛选程序,当由计算机执行时,使所述计算机进行以下处理以筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质:第一测量值获取处理,获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和确定处理,基于由所述第一测量值获取处理获取的所述测量值确定所述测试物质是所述活性成分的候选物质。5.根据项4所述的筛选程序,其中,所述程序还使所述计算机执行以下处理:第二测量值获取处理,获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和测量值比较处理,将所述经测试物质处理的试样的测量值与所述未经处理的试样的测量值进行比较,在所述确定处理中,基于由所述测量值比较处理获取的比较结果,确定所述测试物质是所述活性成分的候选物质。
6.根据项4或5所述的筛选程序,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。7.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,所述方法包括以下步骤:(i)获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值;和(ii)基于步骤(i)中获取的所述测量值确定所述测试物质是所述活性成分的候选物质。8.根据项7所述的方法,在步骤(i)和(ii)之间还包括,将步骤(i)中获取的所述经测试物质处理的试样的测量值与从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的对应的肾功能预测标记物蛋白质的测量值和/或所述蛋白质的mrna的测量值进行比较的步骤。9.根据项7或8所述的方法,在步骤(i)之前,包括以下步骤:(i)用所述测试物质处理所述受试者(不包括人)、测试组织或测试细胞;(ii)从步骤(i)中经所述测试物质处理的所述受试者、测试组织或测试细胞采集所述试样;和(iii)从步骤(ii)中获取的所述试样中采集所述蛋白质和/或所述mrna。10.根据项7-9中任一项所述的方法,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。11.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,所述方法包括以下步骤:(a)检测从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质和/或所述蛋白质的mrna;和(b)基于步骤(a)中获取的结果确定所述测试物质是所述活性成分的候选物质。12.根据项11所述的方法,在步骤(a)和(b)之间还包括,将步骤(a)中获取的所述经测试物质处理的试样的检测结果与从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的对应的肾功能预测标记物蛋白质和/或所述蛋白质的mrna的检测结果进行比较的步骤。13.根据项11或12所述的方法,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。14.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的装置,所述装置包括以下计算工具:第一评价结果获取工具,用于获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能的评价结果;和
确定工具,用于基于由所述第一评价结果获取工具获取的所述评价结果确定所述测试物质是所述活性成分的候选物质。15.根据项14所述的装置,还包括:第二评价结果获取工具,用于获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的功能的评价结果;和评价结果比较工具,用于将所述经测试物质处理的试样的评价结果与所述未经处理的试样的评价结果进行比较,其中,所述确定工具基于所述评价结果比较工具获取的比较结果确定所述测试物质是所述活性成分的候选物质。16.根据项14或15所述的装置,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。17.一种筛选程序,当由计算机执行时,使所述计算机进行以下处理以筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质:第一评价结果获取处理,获取从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能的评价结果;和确定处理,基于所述第一评价结果获取处理获取的所述评价结果确定所述测试物质是所述活性成分的候选物质。18.根据项17所述的筛选程序,其中,所述程序还使所述计算机执行以下处理:第二评价结果获取处理,获取从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的所述肾功能预测标记物蛋白质的功能的评价结果;和评价结果比较处理,将所述经测试物质处理的试样的评价结果与所述未经处理的试样的评价结果进行比较;在所述确定处理中,基于所述评价结果比较处理获取的比较结果确定所述测试物质是所述活性成分的候选物质。19.根据项17或18所述的筛选程序,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。20.一种用于筛选用以预防或治疗选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的活性成分的候选物质的方法,所述方法包括以下步骤:(i)评价从经测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(经测试物质处理的试样)中的肾功能预测标记物蛋白质的功能;和(ii)基于步骤(i)中获取的评价结果确定所述测试物质是所述活性成分的候选物质。21.根据项20所述的方法,在步骤(i)和(ii)之间还包括,将步骤(i)中获取的所述
经测试物质处理的试样的评价结果与从未经所述测试物质处理的受试者(不包括人)、测试组织或测试细胞采集的试样(未经处理的试样)中的对应的肾功能预测标记物蛋白质的功能的评价结果进行比较的步骤。22.根据项20或21所述的方法,在步骤(i)之前包括以下步骤:(i)用所述测试物质处理所述受试者(不包括人)、测试组织或测试细胞;和(ii)从步骤(i)中经所述测试物质处理的所述受试者、测试组织或测试细胞采集所述试样。23.根据项20-22中任一项所述的方法,其中,所述肾功能预测标记物蛋白质是选自由aplnr、spp1、dnase1、slco1a1、anpep、slc7a8、oscar、富脯氨酸蛋白、防御素、纤维蛋白原、和hamp/hepcidin组成的组中的至少一种。24.一种用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的装置,所述装置包括以下计算工具:受试者数据获取工具,用于获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;模式相似度计算工具,用于通过将由所述受试者数据获取工具获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算在所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中,所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和预测工具,用于通过使用由所述模式相似度计算工具所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段;其中,所述受试者的数据是所述器官间串扰指示剂的模式,所述模式表示除所述受试者的肾脏以外的器官中的所述器官间串扰指示剂的量和与肾脏中没有疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的关系,并且所述标准数据1包括所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。25.一种预测程序,当由计算机执行时,使所述计算机执行以下处理以预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段:获取处理,获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;模式相似度计算处理,通过将由所述受试者数据获取处理获取的所述受试者的数
据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算在所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中,所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和预测处理,通过使用由模式相似度计算处理所计算的所述器官间串扰指示剂的模式的相似度作为量度,预测选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的存在和/或所述疾病的阶段;其中,所述受试者的数据是所述器官间串扰指示剂的模式,所述模式表示除所述受试者的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的关系,并且所述标准数据1包括所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照中的肾脏以外的所述器官中的所述器官间串扰指示剂的量和与肾脏中没有疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。26.一种用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段的方法,所述方法包括以下步骤:(1)获取关于所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的所述受试者的数据,所述器官间串扰指示剂来自源自所述一个或多个器官中的每一个的细胞或组织;(2)通过将步骤(1)中获取的所述受试者的数据与对应于所述受试者的数据所源自的所述一个或多个器官的一个或多个器官中的标准数据1进行比较,计算所述受试者的数据和所述标准数据1之间的所述器官间串扰指示剂的模式的相似度,其中,所述标准数据1是从预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病中的每一种或者预定用于所述疾病的每一个阶段的一组标准数据1中提取的;和(3)当从步骤(2)中所计算的所述器官间串扰指示剂的模式的相似度确定两种模式相似时,确定所述受试者具有与标准数据1相对应的疾病和/或处于与标准数据1相对应的疾病的阶段;其中,所述受试者的数据是所述器官间串扰指示剂的模式,所述模式表示除所述受试者的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的关系,并且所述标准数据1包括所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的所述器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。27.一种用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少
一种疾病的受试者中的肾脏以外的一个或多个器官的每一个中疾病的存在和/或所述疾病的阶段的装置,所述装置包括以下计算工具:阶段信息获取工具,用于获取关于所述受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;检验工具,用于相对于标准数据2检验由所述阶段信息获取工具获取的关于所述阶段的信息;模式提取工具,用于基于由所述阶段信息检验工具获取的结果,提取所述受试者的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和预测工具,用于通过使用由所述模式提取工具所获取的所述器官间串扰指示剂的模式作为量度预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段;其中,所述标准数据2包括预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。28.一种预测程序,当由计算机执行时,使所述计算机执行以下处理以预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中的疾病的存在和/或所述疾病的阶段:阶段信息获取处理,获取关于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;阶段信息比较处理,相对于标准数据2检验由所述阶段信息获取处理获取的关于所述阶段的信息;模式提取处理,基于由所述阶段信息比较处理获取的结果,提取所述受试者中的肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式;和预测处理,通过使用由所述模式提取处理所获取的所述器官间串扰指示剂的模式作为量度,预测肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段;其中,所述标准数据2包括预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中对应的器官间串扰指示剂的量之间的预定关系。29.一种用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段的方法,所述方法包括以下步骤:(i)从所述受试者的诊断结果获取关于所述受试者中选自由肾功能减退、慢性肾
病和肾衰竭组成的组中的所述至少一种疾病的阶段的信息;(ii)相对于标准数据2检验步骤(i)中获取的关于所述阶段的信息;(iii)基于在步骤(ii)中获取的检验结果,从所述标准数据2确定处于对应于关于所述阶段的信息的选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阶段的标准数据α,以及从所述标准数据α提取所述受试者中肾脏以外的一个或多个器官中的每一个中的对应于所述受试者中的阶段的器官间串扰指示剂的模式;(iv)相对于关于在疾病和/或所述疾病的阶段中的器官间串扰指示剂的已知信息检验步骤(iii)中提取的所述器官间串扰指示剂的模式,以及确定与所述受试者中肾脏以外的一个或多个器官中的每一个中的器官间串扰指示剂的模式相对应的除了肾脏以外的所述一个或多个器官中的每一个中疾病的存在和/或所述疾病的阶段;和(v)进一步确定在步骤(iv)中确定的肾脏以外的所述一个或多个器官中的每一个中的所述疾病是所述受试者可能正患有的疾病,和/或确定在步骤(iv)中确定的肾脏以外的所述一个或多个器官中的每一个中的所述疾病的阶段是所述受试者正患有的疾病的阶段,其中,所述标准数据2包括预定用于选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式来自患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与在肾脏中没有疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的预定关系。30.一种用于生成器官间串扰指示剂的模式的标准数据的方法,所述标准数据用于预测受试者中选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的存在和/或所述疾病的阶段,所述方法包括以下步骤:针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;确定所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的所述阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定;和将所述器官间串扰指示剂的模式与选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的对应阶段相关联。31.一种用于生成器官间串扰指示剂的模式的标准数据的方法,所述标准数据用于预测患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的至少一种疾病的受试者中的肾脏以外的一个或多个器官中的每一个疾病的存在和/或所述疾病的阶段,所述方法包括以下步骤:
针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段,从自金标准的阳性对照中的肾脏以外的一个或多个器官中的每一个采集的细胞或组织提取器官间串扰指示剂;从自金标准的阴性对照中的肾脏以外的所述一个或多个器官中的每一个采集的细胞或组织中提取所述器官间串扰指示剂;识别和量化所述器官间串扰指示剂;和确定针对选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的每个阶段的所述器官间串扰指示剂的模式,每个所述模式从患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阳性对照中的肾脏以外的器官中的所述器官间串扰指示剂的量和与未患有选自由肾功能减退、慢性肾病和肾衰竭组成的组中的所述至少一种疾病的阴性对照中的肾脏以外的所述器官相同的器官中的对应的器官间串扰指示剂的量之间的关系来确定。
[0441]
附图标记说明1,2
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
筛选装置3
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
输入单元4
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
显示单元5a
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
装置5b
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
装置5c
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
装置6,7
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
预测装置11
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一测量值获取单元12
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二测量值获取单元13
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
测量值比较单元14
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
候选物质确定单元21
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第一评价结果获取单元22
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
第二评价结果获取单元23
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
评价结果比较单元24
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
候选物质确定单元52
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
反应/电泳单元53
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
检测单元61
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
受试者数据获取单元62
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
模式相似度计算单元63
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
预测单元71
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
阶段信息获取单元72
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
阶段信息检验单元73
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
模式提取单元74
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
预测单元100,110,120,130
ꢀꢀꢀꢀꢀꢀꢀꢀꢀ
系统101
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
cpu
102
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
存储器103
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
存储单元104
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
总线105
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
接口单元109
ꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀꢀ
存储介质
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1