一种与花生白种皮紧密连锁的分子标记AhyWptc及其应用的制作方法
一种与花生白种皮紧密连锁的分子标记ahywptc及其应用
技术领域
1.本发明涉及农业生物技术领域,特别是涉及一种与花生白种皮紧密连锁的分子标记ahywptc及其应用。
背景技术:
2.花生是我国重要的油料和经济作物,是植物油脂和蛋白的重要来源。花生中富含脂肪酸、蛋白质、氨基酸、膳食纤维、维生素e和矿物质(钙、铁、锌、硒)等微量元素,同时还含有大量的生理活性物质如白藜芦醇和酚类物质等,花生具有较高的氧化稳定性,适用于食品和工业应用(张智猛等,2009)。花生的种皮颜色以粉红色和红色为主,白种皮的花生品种较少。白皮花生榨出油呈浅黄色透明,经加温处理颜色不变,不需脱色处理。这一特性能够提高花生油品质,降低生产成本,对花生食品加工有重要意义(庄建伟,1998)。近年来,由于种皮颜色的特殊性及花生食品加工业生产成本等原因,白皮花生的市场需求日益增加。然而,现有的白皮花生品种较少,而且丰产性还不够理想,难以大面积种植与推广。因此,提高白皮花生的产量是满足市场需求的根本途径。
3.花生种皮由珠被发育而来,与其他性状相比,花生种皮颜色需要在隔代才能显现出来,例如,粉红种皮做母本与白皮花生做父本进行杂交,f1代的种皮是粉红色的,f2代的种皮是淡粉(双亲中间型)的,f3代的种皮才会出现性状分离。这一特性极大的限制了采用传统育种手段培育白色种皮花生。分子标记辅助育种以基因型的鉴定为主,对于白种皮性状来说,可以通过切去种子的一部分子叶,检测子叶的基因型来提前确定下一代收获材料的种皮颜色,能够缩短白花生新品种的育种周期,大大提高育种效率。
4.国内外关于花生白种皮遗传的研究相对较少。早期文献中,花生白色种皮颜色被发现由两组隐性基因控制(higgins,1940;hammons,1963)。1988年,norden等人在佛罗里达州的一个种子田中发现两个白籽珍珠“early runner”花生品系(per-4和per-5),随后利用这两个作为亲本与带有彩色种皮的花生材料杂交,f2外种皮世代(f3胚世代)以3白:1粉红或红色的比例分离,认为这种白色种皮来源是由单基因控制的,在所研究的品系中,白色种皮性状显性于粉红色和红色。
5.以上研究为花生白种皮基因型的鉴定及分子育种奠定了基础,由于之前开发的标记与白色种皮颜色性状连锁性不高等原因,造成这些标记难以准确便捷的应用到花生遗传和分子育种研究中。
技术实现要素:
6.本发明的目的是提供一种与花生白种皮紧密连锁的分子标记ahywptc及其应用,以解决上述现有技术存在的问题,该分子标记能够通过基因型的鉴定,提前一代鉴定白色种皮花生。
7.为实现上述目的,本发明提供了如下方案:
8.本发明提供一种与花生白种皮紧密连锁的分子标记ahywptc,所述分子标记
ahywptc的特异性引物对为seq id no:1所示的正向引物和seq id no:2所示的反向引物。
9.本发明还提供一种利用权利要求1所述的分子标记ahywptc鉴定白种皮花生的方法,包括以下步骤:
10.(1)提取花生子叶组织dna;
11.(2)采用所述的特异性引物对对步骤(1)提取的dna进行pcr扩增;
12.(3)对步骤(2)得到的扩增产物进行非变性聚丙烯酰胺凝胶电泳检测,若出现210bp大小的特征条带,则判定待测花生材料下代种子为白种皮。
13.进一步地,在步骤(2)中,扩增体系为:dna模板1μl,正向引物和反向引物各1μl,2
×
ng pcr mastermix 10μl,加水至20μl。
14.进一步地,在步骤(2)中,扩增反应程序为:预变性94℃5min;94℃30s,55℃30s,72℃30s,35个循环;72℃延伸7min。
15.进一步地,在步骤(3)中,所述非变性聚丙烯酰胺凝胶的配方为:40%丙烯酰胺18ml、5
×
tbe 18ml、h2o 54ml、20%过硫酸铵800μl和temed 80μl。
16.本发明还提供一种鉴定白种皮花生的试剂盒,包含所述的引物对。
17.本发明还提供上述的分子标记ahywptc在花生育种中的应用。
18.进一步地,所述应用为鉴定白色种皮花生。
19.本发明公开了以下技术效果:
20.本发明提供了一种可以鉴定白种皮花生的分子标记ahywptc,利用本发明提供的标记,可以通过检测子叶的dna提前确定下一代收获材料的种皮颜色,提高育种效率。此外,花生是异源四倍体,a和b亚基因组等位基因高度同源,很多标记难以有效的区分a和b亚基因组,而本发明的分子标记是通过多次科学的实验和摸索后筛选出来的,结果可靠,可信度高。
21.本发明还提供一种利用分子标记ahywptc鉴定白种皮花生的方法,该方法技术简单易操作,采用简单的分子标记,通过pcr扩增和聚丙烯酰胺凝胶电泳即可实现鉴定,另外,仪器简单易操作,仪器精准度不需太高,采用常规实验的常规仪器均可操作,更加易于被人们接受。
22.本发明还提供分子标记ahywptc的应用,通过该分子标记可以将其应用到分子育种及改良花生品种中,从而可以大大缩短育种时间,提高育种效率,可以在更短的时间内获取更多更优异的花生种质资源。
附图说明
23.为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
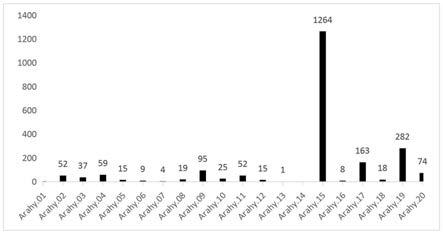
24.图1为与白色花生种皮相关候选snps位点在染色体上的分布图;
25.图2为在f2后代中对分子标记ahywptc进行验证图;
26.图3为花生种子的取样及取样后花生种子的发芽试验图,其中a为白色与粉红色种皮完整种子图;b为切除部分组织后的种子图;c为完整种子发芽图;d为切除部分组织后的
种子发芽图。
具体实施方式
27.现详细说明本发明的多种示例性实施方式,该详细说明不应认为是对本发明的限制,而应理解为是对本发明的某些方面、特性和实施方案的更详细的描述。
28.应理解本发明中所述的术语仅仅是为描述特别的实施方式,并非用于限制本发明。另外,对于本发明中的数值范围,应理解为还具体公开了该范围的上限和下限之间的每个中间值。在任何陈述值或陈述范围内的中间值,以及任何其他陈述值或在所述范围内的中间值之间的每个较小的范围也包括在本发明内。这些较小范围的上限和下限可独立地包括或排除在范围内。
29.除非另有说明,否则本文使用的所有技术和科学术语具有本发明所述领域的常规技术人员通常理解的相同含义。虽然本发明仅描述了优选的方法和材料,但是在本发明的实施或测试中也可以使用与本文所述相似或等同的任何方法和材料。本说明书中提到的所有文献通过引用并入,用以公开和描述与所述文献相关的方法和/或材料。在与任何并入的文献冲突时,以本说明书的内容为准。
30.在不背离本发明的范围或精神的情况下,可对本发明说明书的具体实施方式做多种改进和变化,这对本领域技术人员而言是显而易见的。由本发明的说明书得到的其他实施方式对技术人员而言是显而易见得的。本发明说明书和实施例仅是示例性的。
31.关于本文中所使用的“包含”、“包括”、“具有”、“含有”等等,均为开放性的用语,即意指包含但不限于。
32.实施例1控制花生白种皮颜色基因的定位及与花生白色种皮紧密连锁的分子标记ahywptc的设计
33.为了定位控制花生白种皮颜色基因,发明人前期利用白种皮花生品种(母本)与粉红种皮花生品种(父本)杂交,构建了分离群体fz(fz001
×
jh8)。发现收获的杂交f1种子均为白色,与母本颜色一致,符合“种皮是珠被发育成种皮、种皮颜色与母体基因型一致”的遗传规律,也就是说f2代植株展现出的性状分离,在f3代的种皮中才能展现。如表1所示,遗传分析表明花生的种皮颜色是由单基因控制的。
34.表1群体构建和遗传分析
[0035][0036]
利用bsa-seq的方法对ft群体的白色种皮极端材料混池、粉红色种皮极端材料混池、父本济花8、母本fz001分别进行了全基因组重测序,总的测序量为260gb,在亲本之间总
共检测到了262680个高质量snp位点,覆盖了花生20条染色体。经过生物信息学分析,筛选出2192个可能与花生白色种皮颜色相关的候选snp位点。其中有1264个(57.66%)的snp位于15号染色体上(如图1所示);在花生15号染色体上,候选snp位点主要位于两个区域,其中大约1/2的关联snp位点位于chr15:143.4-153.4mb的区域内。
[0037]
对候选区间的全基因组序列进行扫描,在候选区间发现ssr位点85个,通过primer 5软件,设计了这些ssr位点的引物。通过在不同群体的后代材料中进行筛选,发现其中一个引物对(如表2所示)与花生白种皮性状紧密连锁,而且在不同群体中具有一致性和稳定性的结果(如图2所示),我们将该标记命名为ahywptc。
[0038]
表2
[0039]
引物序列(5'-3')正向引物caagtcagaataaaaaaattagcct(seq id no:1)反向引物tacaaatggttgattcttctagaag(seq id no:2)
[0040]
实施例2利用分子标记ahywptc快速培育高产白种皮花生新品种
[0041]
2.1实验对象
[0042]
fz001花生品种的种皮颜色为白色,g06-g花生品种的种皮颜色为粉色,是美国的高产主栽花生品种之一。以g06-g作为研究对象,对其进行遗传改良,在保持其高产性状的同时将其种皮颜色改良为白色。
[0043]
2.2实验步骤
[0044]
(1)杂交
[0045]
以粉皮花生g06-g为母本,白皮花生fz001为父本,进行杂交。
[0046]
杂交方法具体如下:在花生初花期,开的花朵较少,为了使一个组合的杂交时间相对集中,将母本g06-g开的花摘掉;在母本开花的盛花期开始去雄,一般是每天五点以后将母本桔黄色未开放花蕾内的雄蕊去掉。花朵有一枚较大的旗瓣、两枚翼瓣和一枚较硬的龙骨瓣组成,用左手的拇指和中指轻轻捏住花蕾的基部,右手持镊子轻轻将花朵由外到内轻轻拨开,用镊子一次或多次将8个雄蕊和花药轻轻剔除,不要损伤雌蕊的柱头,再用手指将龙骨瓣还原,并插上标记以便统计数目。第二天早晨6-7点对去雄的花朵进行人工授粉;授粉前先采集父本fz001的花,然后,用镊子将父本花的花粉挤出,授粉时,用镊子蘸取花粉,将花粉涂抹到母本的柱头上。
[0047]
(2)杂交f1真伪的鉴定
[0048]
利用分子标记ahywptc对收获的杂交f1代的真伪进行鉴定,方法如下:
[0049]
取材:收取母本植株生长的所有荚果晾干后,剥去壳后对种子进行编号,之后利用刀片轻轻切去部分种皮,刮取部分子叶组织(大约30mg左右),放入2ml离心管中,管中需放入磁珠,进行dna的提取。之后将所有花生种子放到冷库中进行保存,待检测后将真种子种到大田中。通过实验,证明花生种子在切除部分组织后,发芽率不受影响(如图3所示)。
[0050]
(3)dna提取
[0051]
用改良后的ctab法对花生组织进行基因组dna提取。具体方法如下:
[0052]
a.分别取花生子叶组织和一颗钢珠一起放于2ml的离心管中,标记好后将其放入液氮中冷冻,之后将离心管放入预冷的研磨仪中进行研磨。
[0053]
b.拿出离心管,迅速打开盖子,加入600μl 65℃预热的2
×
ctab(含rnase),轻轻摇
匀;
[0054]
c.放入65℃水浴锅中水浴25min,期间缓慢颠倒混匀3-5次;
[0055]
d.冷却后加入750μl的氯仿:异戊醇(24:1),上下颠倒2-3min,使其充分混匀,直至溶液呈乳状浊液,室温静置10min。
[0056]
e.12000rpm室温离心10min后,用移液器轻轻地吸取上清液,转入含有600μl预冷的异丙醇的离心管内,轻轻颠倒混匀30s,直到出现dna白色絮状沉淀,将其置于-20℃放30min;
[0057]
f.12000rpm离心10min,弃上清,防止dna沉淀倒出,之后向沉淀中加入500μl-20℃预冷的75%乙醇洗沉淀2~3次;
[0058]
g.12000rpm离心10min,倒掉液体,留下dna沉淀,室内晾干;
[0059]
h.向离心管中加入50μl ddh2o,室温放置过夜至dna完全溶解,-20℃保存、备用。
[0060]
(4)pcr扩增
[0061]
利用ahywptc的正向引物(如seq id no:1所示)和反向引物(如seq id no:2所示)对亲本及所有的f1杂种进行分子标记检测,根据电泳结果,包含父本和母本特异条带的伪真的杂交种。
[0062]
pcr扩增反应体系如表3所示:
[0063]
表3 20μlpcr扩增反应体系
[0064][0065][0066]
pcr扩增反应条件:预变性94℃5min;94℃30s,55℃30s,72℃30s,35个循环;72℃延伸7min。
[0067]
(5)pcr扩增产物采用8%非变性聚丙烯酰胺凝胶(acr:bis=39:1)电泳检测。
[0068]
其中,电泳缓冲体系为1
×
tbe(90mm tris-borate ph 8.3,2mm edta),160v电泳3.5h左右。
[0069]
90ml的8%非变性聚丙烯酰胺凝胶配制如表4所示:
[0070]
表4 8%非变性聚丙烯酰胺凝胶配制
[0071][0072]
非变性聚丙烯酰胺凝胶电泳方法如下:
[0073]
a.立板取2对1.5mm规格玻璃板洗净晾干后对齐,放至封胶板上,用夹子夹紧。
[0074]
b.封底每块胶10ml封底液(10ml的聚丙烯酰胺凝胶、10μl的temed和250μl的20%的过硫酸铵的溶液配制而成),将封底液从玻璃上方缓缓倒入底部,等待凝固。
[0075]
c.灌胶每块玻璃板需40ml凝胶液,配方同封底液相同,将其缓缓倒入玻璃板中间,防止此过程中产生气泡。
[0076]
d.插梳子灌胶后需将梳子快速插入胶中,梳子不可插的太深。待胶凝后,轻轻拔下梳子,将玻璃板上的残胶冲洗干净,放入电泳槽上,并灌入1
×
tbe直至胶孔上方1cm左右。
[0077]
e.点样每个胶孔中加入3μl样品,并做好标记以便区分。
[0078]
f.跑胶接通电源,使用240v电压预电泳5min,待样品跑出胶孔后将电压调至160v,跑胶4h。
[0079]
银染检测,方法如下:
[0080]
a.0.1%硝酸银溶液500ml染色15-20min;
[0081]
b.去离子水快速漂洗15sec左右;
[0082]
c.显影液(500ml去离子水+10g naoh+0.25g na2co3,750μl甲醛现用现加)显色,不断摇动,直至dna条带清晰可见;
[0083]
d.去离子水漂洗;
[0084]
e.扫描照相。
[0085]
2.3后代的筛选
[0086]
采用常规育种结合分子标记筛选的育种方案,每年有两季,整个周期大约需要三年加代。具体为:利用g06-g作为母本(轮回),真杂种f1作为父本进行杂交,杂交的方法同上,对收获的bc1f1再次利用ahywptc分子标记进行检测,保留具有父本特异条带的后代,dna提取及分子标记检测的方法同上。通过连续进行4次回交和筛选,即可得到bc4f1代,然后进行自交后,选择纯合的后代,进行考种和品种登记。
[0087]
与传统方法相比,本发明筛选效率更高,利用本发明提供的标记结合回交选择的方法,可以大大提高育种效率,在3年左右时间内实现白花生的品种培育。
[0088]
由于花生种皮颜色要在隔代才能显现。因此,通过肉眼筛选和培育白花生存在很大的盲目性,而本发明采用分子标记筛选的方法进行鉴定,可以大大缩短筛选时间,为利用分子育种手段快速培育优异新品种打下基础。
[0089]
以上所述的实施例仅是对本发明的优选方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明权利要求书确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1