一种固体发酵豆粕制备大豆苷元的方法
1.本发明涉及固体发酵豆粕制备大豆苷元的方法,该方法使用含有豆粕的固体培养基培养链霉菌,制备大豆苷元。
背景技术:
2.大豆苷元(daidzein)是大豆的重要的活性物质,也是大豆异黄酮的主要组分,具有广泛的生物学活性,研究证明其主要功效有:显著抗肿瘤、降低酒精依赖度、抑制白血病细胞和黑色素瘤细胞生长;扩张血管并降低血压;减慢心率降低心肌耗氧、防止骨质疏松。如雌激素样作用、抗氧化、调节细胞周期等,其营养生理功能日益受到重视并被广泛研究。大豆苷元主要与葡萄糖基相结合以大豆苷的形式存在,而大豆苷元的存在形式对其生物活性和生物利用度有着显著的影响。研究表明,大豆苷元比大豆苷具有更好的吸收率,将大豆苷转化为大豆苷元能显著提高其吸收效率和生物利用度,体外实验也表明,大豆苷元比大豆苷具有更好的雌激素样生物活性。大豆中95%-99%的大豆苷元都是以苷的形式存在,大豆苷元含量很少,使得大豆苷元的制备比较困难。
3.目前,工业上主要采用化学酸水解发生产大豆苷元,但化学提取方法污染较为严重、溶剂提取率低和结合型大豆苷元不稳定等特点,因而如何以较为低廉的成本、污染较低的方法生产大豆苷元成为大豆苷元生产工艺该进的重要方向。豆粕是大豆的主要加工副产物,近年来豆粕产量呈上升趋势,2020年约为7840万吨。但豆粕多用于饲料加工,为了扩大和开发植物资源,对豆粕的深加工利用越来越重视。为了开发一种经济有效的大豆苷元生产方法,提高豆粕的附加值,通过自身筛选获得一株砖红链霉菌,能够将豆粕中高含量的大豆苷元转化为染料木素,显著提高豆粕中大豆苷元的含量。
技术实现要素:
4.本发明所要解决的技术问题是如何通过固体发酵高效地制备大豆苷元,即如何提高固体发酵制备大豆苷元的得率。
5.为了解决以上技术问题,本发明提供了制备大豆苷元的方法。
6.本发明提供的制备大豆苷元的方法,包括使用含有豆粕的固体培养基培养砖红链霉菌,得到大豆苷元;所述砖红链霉菌为cgmcc no.21851。
7.上述方法中,所述固体培养基由淀粉、nacl、豆粕和水组成。上述方法中,所述淀粉为玉米淀粉。
8.所述固体培养基组成配比为:50-150重量份豆粕:0.5-2.5重量份淀粉:0.2-1.0重量份nacl:60-150重量份的水,其中豆粕目数为4-24目。
9.所述培养基组成配比为:100重量份豆粕:1.5重量份淀粉:0.3重量份nacl:100重量份的水,其中豆粕目数为14目。所述培养基中的水可为蒸馏水。
10.上述方法中,所述培养的培养条件可为接种2%-8%的种子培养基,19-39℃、培养1-14天。
11.上述方法中,所述培养条件具体可为接种5%的种子培养基,29℃、培养9天。接种量均以体积百分比计算。
12.为了解决以上技术问题,本法提供可以用于生产大豆苷元的培养基。
13.本发明所提供的用于生产大豆苷元的培养基为上述固体培养。
14.为了解决以上技术问题,本发明提供了用于生产大豆苷元的固体发酵条件为上述固体发酵条件。
15.为了解决以上技术问题,本发明提供了砖红链霉菌的应用。
16.本发明所提供的砖红链霉菌的应用为砖红链霉菌在固体发酵生产大豆苷元中的应用,所述砖红链霉菌为cgmcc no.21851。
17.为了对固体发酵培养基和发酵条件进行优化,得到可以产业化的固体发酵培养基和最佳固体发酵条件。本发明运用正交设计试验,对培养基因素和发酵条件进行优化,得到了大豆苷元得率高的固体发酵砖红链霉菌制备大豆苷元的方法。实验证明,采用本发明的固体发酵培养基,在29℃、固体发酵砖红链霉菌cgmcc no.21851 9天,大豆苷元的含量可从17.62mg/kg增加到369.56mg/kg,含量提高约21倍。本发明可用于生产大豆苷元,为大豆苷元的生产制备提供了新方法、途径,同时提高了大豆副产物豆粕的综合利用和附加值。
附图说明
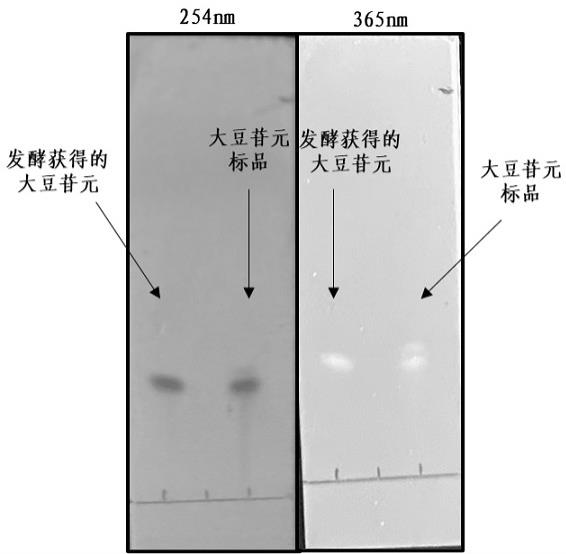
18.图1实施例1中砖红链霉菌cgmcc no.21851发酵制备得到的大豆苷元的hplc图;图2 大豆苷元标准品的hplc图;图3实施例1中砖红链霉菌cgmcc no.21851发酵制备得到的大豆苷元和大豆苷元标准品的tlc图;图4实施例1中砖红链霉菌cgmcc no.21851发酵制备得到的染料木素1h-nmr核磁谱图;图5实施例1中砖红链霉菌cgmcc no.21851发酵制备得到的染料木素13c-nmr核磁谱图。
具体实施方式
19.以下实施例用于说明本发明,但不用来限制本发明的范围。
20.以下实施例中所使用的实验方法如无特殊说明,均为常规方法。
21.以下实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
22.以下实施例中使用的砖红链霉菌cgmcc no.21851已于于2021年3月1日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏编号为cgmcc no.21851,分类命名为砖红链霉菌(streptomyces lateritius)。菌株信息参见cn113215066a,并将其全部信息引入本技术。
23.实施例1: 固体发酵砖红链霉菌制备大豆苷元1、配制所用培养基yim38琼脂培养基:葡萄糖(glucose)4 g /l,酵母浸粉(yeast extract)4 g/l,麦芽浸粉(malt extract)5 g/l, 维生素b(b-vitamins)1 g/l,氯化钠(trace salt)1 g/l,
琼脂粉(agar)20.0 g,ph 7.2,121℃条件下灭菌15min,得到yim38琼脂培养基。
24.种子培养基:葡萄糖(glucose)4 g /l,酵母浸粉(yeast extract)4 g/l,麦芽浸粉(malt extract)5 g/l, 维生素b(b-vitamins)1 g/l,氯化钠(trace salt)1 g/l,ph 7.2,121℃条件下灭菌15min,得到yim38培养基。
25.固体发酵培养基:豆粕100g,玉米淀粉1.5g,nacl的含量为0.3g,100ml蒸馏水。121℃灭菌30min,得到固体发酵培养基。其中,豆粕为粉碎后过12目筛得到的粒状物,常温密封保存备用。
26.2、利用砖红链霉菌cgmcc no.21851固体发酵制备大豆苷元将砖红链霉菌cgmcc no.21851悬浮液均匀涂布于yim38培养基上,于29℃生化培养箱中培养7天,无菌环境下用接种环刮下接种到已灭菌装有50ml的yim39培养基的250ml三角瓶中,于29℃、200rpm的恒温震荡器中培养24h得到砖红链霉菌cgmcc no.21851种子培养基。将砖红链霉菌cgmcc no.21851种子培养基以8%(v/m)的接种量接种到已灭菌装有50g豆粕培养基的500ml三角瓶中,于29℃的生化培养箱中培养12天,得到砖红链霉菌cgmcc no.21851发酵培养基。
27.3、测定大豆苷元的含量3.1 发酵培养基的预处理将发酵培养基经80℃下干燥至恒重后,将发酵培养基粉碎至60目,用乙酸乙酯超声浸提3次,合并提取液,减压悬蒸提取液得到乙酸乙酯浸膏。
28.3.2 发酵培养基中大豆苷元的制备及结构鉴定乙酸乙酯浸膏经硅胶柱柱层析纯化后,采用乙腈-水体积比35:75为流动相,用制备型hplc制备得到单体化合物,即为大豆苷元。图1的砖红链霉菌cgmcc no.21851发酵得到的大豆苷元的hplc结果和图2大豆苷元标准品的hplc结果可以看出式i化合物和大豆苷元标品保留时间相同;图3的tlc结果显示,式i化合物和大豆苷元位置相同;结合1h谱、13c谱及质谱数据(图4、图5),确定了本发明式i的分子量为270,分子式为c
15h10
o4,它们的结构如式(i)所示。
29.式i3.3 发酵培养基中大豆苷元的含量测定利用hplc法测定发酵培养基中大豆苷元的含量。将大豆苷元标品用甲醇定容后,根据标准品的保留时间和标准曲线测定大豆苷元含量。具体方法如下:将相同重量空白培养基和加入砖红链霉菌cgmcc no.21851发酵培养基获得的大豆苷元纯品,经甲醇溶解后过0.22μm滤膜,进行hplc分析,计算大豆苷元的含量:大豆质量(mg)/豆粕质量。取染料木素标准品,用甲醇溶解定容,进行hplc制作标准曲线。hplc色谱条件如下:agilent 1100,配有elsd检测器和chemstation色谱工作站;xdb-c18色谱柱(250
×
4.6mm,5μm);用5-95%乙腈-水溶液进行洗脱50min,流速1ml/min,进样量10μl。结果表明,空白培养基大豆苷元的含量
为17.06mg/kg,发酵培养基中大豆苷元的含量为347.68mg/kg,大豆苷元含量升高约21倍。
30.实施例2: 固体发酵砖红链霉菌制备大豆苷元固体培养基的优化以砖红链霉菌cgmcc no.21851为实验菌株,以大豆苷元的含量为指标,通过微生物介导的生物转化,运用正交分析法,对豆粕目数,及每100g豆粕对应的水分含量、淀粉含量和nacl含量作为考虑因素,设计4因素3水平的正交实验,研究固体发酵砖红链霉菌制备大豆苷元的最优培养基配方(表1)。实验数据表明,水分含量和豆粕目数对固体发酵砖红链霉菌制备大豆苷元具有显著影响,nacl对固体发酵砖红链霉菌制备大豆苷元影响最小,最优培养基配方为豆粕目数为14目,100g豆粕及水、淀粉和nacl的含量分别为100ml,1.5g,0.3g(表2)。
31.表1 培养基成分正交设计实验的因素水平表2 培养基成分正交设计实验结果实施例3:固体发酵砖红链霉菌制备大豆苷元固体培养条件的优化 固体发酵砖红链霉菌cgmcc no.21851制备大豆苷元培养条件的优化上述实施案例1采用的固体发酵培养基的培养条件是通过以下优化实验得到。以大豆苷元的含量为标准,分别考察接种量、培养时间和培养温度对固体发酵砖红链霉菌cgmcc no.21851制备大豆苷元的影响(表3)。表3的正交实验结果表明,各影响因素的主次关系为:培养周期》培养时间》接种量。结合实验结果,最优的培养条件为5%的接种量,29℃培养9天。
32.表3培养条件正交设计实验的因素水平表4 培养条件正交设计实验结果。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1