一种同时检测BVDV和BEV的试剂盒及其应用
一种同时检测bvdv和bev的试剂盒及其应用
技术领域
1.本发明属于生物技术领域,具体涉及一种病毒检测试剂盒的技术领域,更具体的涉及一种同时检测牛病毒性腹泻病毒和牛肠道病毒的试剂盒与应用的技术领域。
技术背景
2.牛病毒性腹泻病毒(bovine viral diarrheavirus,bvdv),属于黄病毒科(flaviviridae)、瘟病毒属(pestivirus),是一种有囊膜的单股正链rna病毒,电镜下观察可见病毒颗粒呈球形,直径约25-30nm。bvdv是1946年在美国最早被发现,后来在英国的牛场也出现了bvdv。我国学者李佑民于1980年从流产胎牛的脾脏中成功分离并鉴定出bvdv,随着我国养牛业快速发展,该病分布广泛,新疆、山东、内蒙古、北京、黑龙江等地均有该病发生的报道。该病毒主要通过持续感染导致肠细胞原发性损伤、易感动物共感染和在隐窝肠细胞中复制、病变两种方式引起犊牛腹泻。还可通过胎盘传播,引发胚胎死亡、流产、免疫耐受、出生缺陷、新生犊牛羸弱。牛病毒性腹泻病症传染性极强,感染该病的宿主范围也愈加广泛,大部分偶蹄家畜均会感染。这种病症的危害状况极为严重,一旦爆发,难以控制和彻底消灭,严重影响畜牧业发展。
3.牛肠道病毒(bovine enterovirus,bev)属于小rna病毒科、肠道病毒属,是一种无囊膜的单股正链rna病毒。自1959年由美国学者moll和davis首次分离到bev以来,许多国家和地区也报道了该病的暴发与流行。李英利等于2011年首次在我国一腹泻犊牛体内分离到1株f种肠道病毒。bev传播的方式主要为粪-口途径传播,也可通过飞沫传播,病毒在呼吸道或消化道进行复制,再通过粪便排毒,病毒可在环境中存活3-4个月。bev的临床症状广泛,包括肠道感染(高发病率、腹泻和中度死亡率),呼吸道疾病(咳嗽、发热和呼吸困难),生殖障碍(流产、死产、新生儿死亡)和不孕,bev还可引起牛的隐性感染,并随感染犊牛粪便排出体外。bev呈世界性流行,在我国属于新发病,目前已遍布多个省市,但相关bev的检测方法匮乏。
4.传统的检测方法有酶联免疫吸附试验(elisa)、病毒的分离鉴定、免疫荧光技术(ifa)等,但是这些方法存在着操作复杂、耗时过长、特异性差、灵敏度低等问题。目前针对上述病毒的检测常用聚合酶链式反应(polymerase chain reaction,pcr)、实时荧光定量pcr(quantitative real-time pcr,qpcr)等方法。但pcr需通过凝胶分析检测结果,灵敏度低,且无法定量;qpcr在定量时需依赖标准曲线,而标准曲线的质量易受到引物和探针浓度、dna纯度以及标准品等因素的影响,导致其准确度达不到绝对定量的要求,对混合感染和低病毒载量的临床样本无法有效检出。
技术实现要素:
5.针对目前致犊牛腹泻的主要病毒危害养牛业和现有检测方法不足的问题,本发明旨在提供一种具有灵敏度高、特异性好、准确度和精确度高,可实现精确定量,能够同时检测出bvdv和bev的检测试剂盒。通过应用该试剂盒能够实现便利、快速、高效、灵敏、痕量、特
异、绝对定量的对bvdv和bev进行检测的方法,该试剂盒为后续对这两种病毒的预防、早期诊断、及时防控和净化具有重要意义。
6.为了实现以上目的,本发明采用的技术方案如下:
7.本技术提供一种用于同时检测bvdv和bev的试剂盒,所述试剂盒中含有特异性引物和探针组合,包括以下2对特异性引物和2条特异探针,其核苷酸序列分别为:
8.bvdv上游引物:5
’‑
tcaggttaagatgtgctttggg-3’,
9.bvdv下游引物:5
’‑
cagggtagtcgtcagtggtt-3’,
10.bvdv探针:5
’‑
fam-tgccctcgtccacgtggcat-bhq1-3’;
11.bev上游引物:5
’‑
cgcaatggtcaagcacttct-3’,
12.bev下游引物:5
’‑
ggccatactaggcttctcgt-3’,
13.bev探针:5
’‑
hex-cgcccagcgtcgttacccgc-bhq1-3’。
14.所述试剂盒中包括(1)上述两套引物和探针;(2)2
×
ddpcr supermix forprobes;(3)rnase-free ddh2o;(4)待检测样品的cdna;(5)微滴生成油;(6)微滴发生卡;(7)微滴发生卡密封胶垫;(8)96孔pcr反应板;(9)热封箔膜。
15.更进一步的,本技术还提供了一种用于同时检测bvdv和bev的试剂盒的使用方法,包括以下步骤:
16.(1)提取待检样品的总rna,反转录为cdna;
17.(2)配置ddpcr反应体系,并加入待检样品的cdna;
18.(3)微滴的生成;
19.(4)微滴pcr扩增反应;
20.(5)反应结束后,机器读取荧光信号,自动计算目的基因含量;样品检测结果≥1copies/μl判断为阳性,样品检测结果<1copies/μl判断为阴性。
21.所述双重ddpcr反应总体系为20μl,其中包括:(1)2
×
ddpcr supermix forprobes 10μl;(2)两套上、下游引物分别加450nm;(3)两种探针分别加250nm;(4)待检cdna模板2μl;(5)rnase-free ddh2o补足至20μl。
22.所述微滴pcr扩增反应条件为:95℃预变性10min;94℃变性30s,58℃退火1min,40个循环;98℃10min;4℃终止反应,升降温速率2℃/s。
23.更进一步的,本技术还提供了一种同时检测bvdv和bev的试剂盒在同时检测bvdv和bev中的应用。
24.本技术还提供了一种同时检测bvdv和bev试剂盒的使用方法在同时检测bvdv和bev中的应用。
25.通过采用上述提供的技术方案,本发明获得以下有益效果∶
26.本发明针对bvdv和bev基因序列发明了特异性引物和探针,并且可以同时检测bvdv和bev;高灵敏度,可以对低丰度的目的基因进行检测,能够检测出现有技术中无法检测出的低丰度样本;能够直接定量,自动分析出结果,不依赖ct值,不用建立标准曲线;快速高效、操作简便、重复性好。通过应本技术提供的检测试剂盒,为有效防控bvdv和bev提供技术支持,能够促进犊牛腹泻病防治,对于养牛业具有巨大的潜在开发价值。
附图说明
27.图1所示为标准曲线。
28.其中图a为bvdv测定结果;图b为bev测定结果,以下附图均相同。
29.图2所示为特异性检测结果。
30.图3所示为ddpcr敏感性试验结果。
31.其中图a及图b中1-8中质粒浓度为1
×
106~1
×
10-1
copies/μl。
32.图4所示为ddpcr特异性试验结果。
33.图5所示为bvdv和bev双重ddpcr反应结果。
具体实施方式:
34.以下实施例用于进一步说明本发明的内容,但不应理解为对本发明的限制。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。
35.下述实施例中所使用的实验方法如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
36.实施例一:bvdv和bevqpcr和ddpcr检测引物和探针的设计与合成
37.本实施例根据genbank已发表的bvdv和bev基因组序列,针对基因保守区域进行适用于qpcr和ddpcr的特异性引物及相应的探针设计,由苏州金唯智生物科技有限公司进行合成。引物设计如下:
38.bvdv上游引物:5
’‑
tcaggttaagatgtgctttggg-3’,
39.bvdv下游引物:5
’‑
cagggtagtcgtcagtggtt-3’,
40.bvdv探针:5
’‑
fam-tgccctcgtccacgtggcat-bhq1-3’;
41.bev上游引物:5
’‑
cgcaatggtcaagcacttct-3’,
42.bev下游引物:5
’‑
ggccatactaggcttctcgt-3’,
43.bev探针:5
’‑
hex-cgcccagcgtcgttacccgc-bhq1-3’。
44.实施例二:bvdv和bev taqman探针荧光定量pcr方法的建立
45.使用天根生化科技(北京)有限公司的superreal荧光定量预混试剂(探针法)进行反应,设置bvdv和bev的反应总体系均为20μl,其中2
×
superreal premix 10μl,上、下游引物浓度为300nm,探针浓度为200nm,模板2μl,ddh2o补足至20μl。反应条件为:95℃预变性15min;95℃变性10s,58℃退火30s,共40个循环。在该条件的基础上,对引物浓度、探针浓度进行优化。
46.(1)引物浓度优化
47.分别选用bvdv和bev的质粒标准品浓度1
×
106copies/μl为模板,设定上、下游引物终浓度分别为200、300、400、500、600、700、800、900nm时进行taqman探针荧光定量pcr反应,确定最佳引物浓度。结果如表1所示:当bvdv和bev上、下游引物终浓度分别为300nm和200nm时,反应ct值最小。按照优先选取ct值最小、用量最省的原则,分别选择300nm和200nm为bvdv和bev的最佳引物浓度。
48.表1:引物浓度的优化
[0049][0050][0051]
(2)探针浓度优化
[0052]
分别选用bvdv和bev的质粒标准品浓度1
×
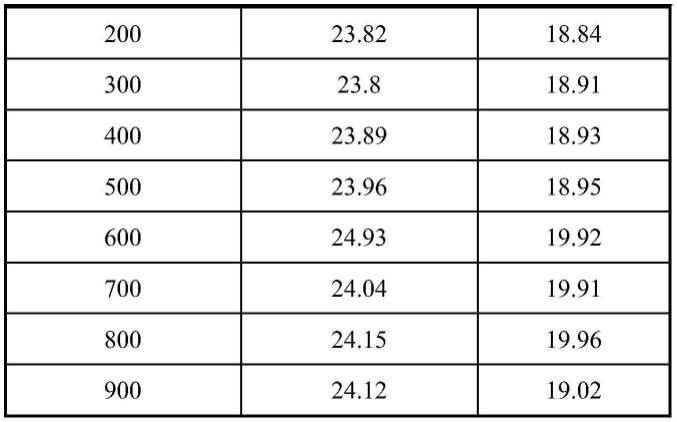
106copies/μl为模板,设定探针终浓度分别为150、200、250、300、350、400、450nm时进行taqman探针荧光定量pcr反应,确定最佳引物浓度。结果如表2所示:当bvdv和bev探针终浓度分别为500nm和400nm时,反应ct值最小。按照优先选取ct值最小的原则,分别选择500nm和400nm为bvdv和bev的最佳探针浓度。
[0053]
表2:探针浓度的优化
[0054]
探针浓度(nm)bvdv(ct值)bev(ct值)15023.818.9220023.8118.9725023.9318.9530023.8818.9635023.9718.9840023.8818.8345023.8718.9250023.6518.96
[0055]
(3)标准曲线的建立
[0056]
将初始浓度为1
×
10
10
copies/μl的bvdv和bev质粒标准品进行10倍梯度稀释(1
×
109~1
×
102copies/μl),进行qpcr反应,结果参见附图1各浓度范围的扩增曲线均具有良好的线性关系。bvdv的标准曲线的回归方程为y=-3.4148x+43.521,标准曲线相关系数(r2)为0.9997,扩增效率为96.27%。bev的标准曲线的回归方程为y=-3.3295x+42.281,标准曲线相关系数(r2)为0.9996,扩增效率为99.68%。
[0057]
(4)敏感性
[0058]
将bvdv和bev质粒标准品进行10倍稀释成8个梯度(1
×
109~1
×
102copies/μl),进行qpcr反应。结果如表3所示,bvdv质粒浓度为1000copies/μl时,ct值大于35,故该方法的检测下限为1000copies/μl;同理,bev检测下限为1000copies/μl。
[0059]
表3:敏感性
[0060]
拷贝数(copies/μl)bvdv(ct值)bev(ct值)1
×
10912.9512.261
×
10816.2715.991
×
10719.5218.771
×
10622.9322.161
×
10526.3125.611
×
10429.8328.891
×
10333.1532.411
×
10236.9735.66
[0061]
(5)特异性
[0062]
利用已优化的qpcr方法分别对bvdv和bev和h2o进行qpcr反应评估其特异性。结果参见附图2,仅当bvdv和bev为阳性对照时有扩增曲线,其他均无扩增曲线,说明该方法特异性良好。
[0063]
(6)重复性
[0064]
利用已优化的bvdv和bev qpcr方法评估重复性,对1
×
107~1
×
105copies/μl的质粒标准品进行批内和批间重复试验。结果如表4、表5所示,bvdv和bev的批内、批间重复试验变异系数均小于3%,表明本技术建立的bvdv和bev qpcr检测方法重复性和稳定性良好。
[0065]
表4:bvdv重复性
[0066][0067]
表5:bev重复性
[0068][0069][0070]
实施例三:bvdv和bev单重ddpcr方法的建立
[0071]
使用实施例1所述的引物组和探针,用已制备的bvdv和bev质粒标准品为模板,采用bio-rad qx200 ddpcr系统进行ddpcr反应,其包括以下步骤:
[0072]
(1)反应体系的配置:ddpcr实验采用bio-rad公司ddpcr
tm supermix forprobes试剂盒,使用上述设计合成的引物及探针,设置bvdv和bev单重ddpcr的反应总体系为20μl:(1)2
×
ddpcr supermix forprobes 10μl;(2)上、下游引物450nm;(3)探针250nm;(4)待检cdna模板2μl;(5)rnase-free ddh2o补足至20μl。体系配置完成后,充分混匀后短暂离心去除气泡。
[0073]
(2)微滴生成:将20μl样品反应体系加入已放入holder中的新dg8 cartridge中间一排的8个孔内,在dg8 cartridge最底下一排8个孔中各加入70μl微滴生成油(dg oil),盖上胶垫(gasket),将以上holder轻轻地平稳放置于微滴生成仪中,开始生成微滴;微滴生成于dg8 cartridge最上面一排孔内,小心缓慢的吸取40μl微滴液,转移到96孔板内;全部加完后用预热好的px1热封仪对96孔板进行封膜。
[0074]
(3)微滴pcr扩增:封好膜之后进行pcr反应,在pcr仪上完成。反应条件为:反应条件为:95℃预变性10min;94℃变性30s,58℃退火1min,40个循环;98℃10min;4℃终止反应,升降温速率2℃/s。4℃稳定1小时后,进行下一步实验。
[0075]
(4)微滴信号读取:将完成pcr扩增的96孔板放入plate holder中组装,轻轻地平稳放入微滴读取仪中;打开quantasoft软件,实验之前做一次flush system,按照96孔板中样品信息进行设置,设置完成后即可进行荧光信号采集,结束后机器会自动分析结果,人工核实后保存结果。
[0076]
实施例四:评估单重ddpcr的敏感性
[0077]
将bvdv和bev质粒标准品浓度稀释为1
×
106~1
×
10-1
copies/μl,基于实例三中的ddpcr反应体系和操作方法进行反应。结果参见附图3,所建立的bvdv ddpcr方法最低能检测到的浓度为0.64copies/μl;所建立的bev ddpcr方法最低能检测到的浓度为2.7copies/μl。
[0078]
实施例五:评估单重ddpcr的特异性
[0079]
基于实例三中的ddpcr反应体系和操作方法分别对bvdv、bev、bcov、brv和h2o进行
ddpcr反应评估其特异性。结果参见附图4,仅当bvdv和bev为阳性对照时能产生阳性液滴,其他均为阴性液滴,说明该方法特异性良好。
[0080]
实施例六:评估单重ddpcr的重复性
[0081]
基于实例三中的ddpcr反应体系和操作方法分别对bvdv和bev进行反应,同时重复3组,再分不同时段检测3次,计算拷贝数变异系数对bvdv和bev单重ddpcr方法批内和批间重复性进行评估。将bvdv质粒标准品稀释为5.02
×
105和5.02
×
106copies/μl两个浓度进行批内和批间重复性试验,结果如表6所示,bvdv批内、批间重复试验变异系数均小于3.96%。将bev质粒标准品稀释为1.52
×
105和1.52
×
106copies/μl两个浓度进行批内和批间重复性试验,结果如表7所示,bev批内、批间重复试验变异系数均小于1.3%。证明所建立的单重ddpcr方法具有良好的重复性。
[0082]
表6:bvdv ddpcr批内和批间重复性
[0083][0084]
表7:bev ddpcr批内和批间重复性
[0085][0086]
实施例七:bvdv和bev双重ddpcr方法的建立
[0087]
使用实施例一所设计的引物组和探针,用已制备的bvdv和bev质粒标准品为模板,基于实例三的ddpcr操作方法进行反应,双重ddpcr反应体系为:(1)2
×
ddpcr supermix forprobes 10μl;(2)两套上、下游引物分别加450nm;(3)两种探针分别加250nm;(4)待检cdna模板2μl;(5)rnase-free ddh2o补足至20μl。结果参见附图5,蓝色液滴代表bvdv的阳性液滴,绿色液滴代表bev的阳性液滴,橙色液滴代表bvdv和bev双阳性液滴。结果表明,本发明建立的bvdv和bev双重ddpcr反应体系可对bvdv或bev或bvdv和bev同时检出。
[0088]
实施例八:双重ddpcr临床样本的检测
[0089]
本发明所用的82份犊牛腹泻样品均采集自新疆乌鲁木齐和昌吉地区周边牛场。样品于-80℃保存。
[0090]
提取临床样本病毒总rna,反转录为cdna后,分别用qpcr和双重ddpcr方法进行检测。结果如表8所示,qpcr中,bvdv检出阳性样本12个,阳性率为14.63%;bev检出阳性样本2
个,阳性率为2.44%。ddpcr中,bvdv和bev双重ddpcr中检出bvdv阳性样本13个,阳性率为15.85%;bev检出阳性样本3个,阳性率为3.66%;bvdv和bev混合感染检出阳性样本1个,阳性率为1.22%。以上结果说明,ddpcr检测灵敏度更高,能够检测出痕量病毒样品,且操作更加简便,无需建立标准曲线就可以进行绝对定量。
[0091]
表8:临床样本检测结果
[0092][0093]
综上所述,本发明提供的一种基于微滴式数字pcr技术检测牛病毒性腹泻病毒和牛肠道病毒的引物、探针和方法,灵敏度高、重复性好,能精准检测、且高效便捷,结果可靠,可应用于临床上牛病毒性腹泻病毒和牛肠道病毒感染的检测,同时还能对牛病毒性腹泻病毒和牛肠道病毒进行绝对定量,有利于牛病毒性腹泻病毒和牛肠道病毒的监测和防控。
[0094]
如上所述,即可较好地实现本发明,上述的实施例仅仅是对本发明的优选实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,本领域普通技术人员对本发明的技术方案做出的各种改变和改进,均应落入本发明确定的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1