一株粘质沙雷氏菌及其在生产柚苷酶中的应用的制作方法
1.本发明属于微生物技术领域,具体涉及一株粘质沙雷氏菌及其在生产柚苷酶中的应用。
背景技术:
2.随着我国食品饮料加工行业的快速发展和人们对健康饮食品质要求的不断提高,橙汁等富含黄酮类化合物的饮品受到消费者广泛青睐,然而,橙汁中富含大量的橙皮苷、柚皮苷等黄酮类化合物,导致其苦味浓郁,严重影响口感和销量。一方面,柚苷酶主要含有两种酶,一种是α-l-鼠李糖苷酶,可使苦味的柚皮苷水解成鼠李糖和柚皮素-7-o葡萄糖苷,第二种是β-d-葡萄糖苷酶,它可使柚皮素-7-o葡萄糖苷水解成无味的柚皮素和葡萄糖。消除果汁中的苦味且改善其营养成分。经过该酶作用后的产物橙皮素或柚皮素等是生产高值甜味剂新橙皮苷二氢查尔酮的关键前体物质;另一方面,该酶不但可以用于脱苦橙汁,而且可以促进葡萄酒香气,消除橙汁中的橙皮苷、柚皮苷等晶体,提高柑橘类果汁的抗氧化活性。然而,目前天然游离的柚苷酶的稳定性不高,不能满足工业生产加工条件。
3.水解橙皮苷、柚皮苷等黄酮类化合物中的糖苷键主要有化学和生物两种方法,其中微生物酶技术克服了化学酸水解工艺的污染严重等缺陷,酶法脱苦具有专一性强、脱苦效果好、操作简单、脱苦条件温和、脱苦效果好,对果汁中其他营养成分及风味无破坏、酶法安全可靠等优点。因此,微生物酶法已成为目前国内外应用最广泛的果汁脱苦技术。
4.据文献报道,柚苷酶主要来源于天然真菌,如黑曲霉、青霉和米曲霉等,少量的柚苷酶来源于细菌和酵母菌,如木糖葡萄球菌、罗伦隐球酵母。其中不同来源的微生物产柚苷酶的酶学性质及酶的应用范围均存在差异。因此,筛选能够生产高活性及稳定柚苷酶的菌株具有重要的现实意义。
技术实现要素:
5.为解决相关问题,本发明的首要目的在于提供一株粘质沙雷氏菌。
6.本发明的另一目的在于提供上述粘质沙雷氏菌在生产柚苷酶中的应用。
7.本发明的再一目的在于提供一种具有柚苷酶活性的生物制剂。
8.为了实现上述发明目的,本发明采用以下技术方案:一株粘质沙雷氏菌,命名为粘质沙雷氏菌(serratia marcescens)c10,其于2022年1月19日保藏于广东省广州市越秀区先烈中路100号大院59号楼的广东省微生物菌种保藏中心(gdmcc),保藏编号为gdmcc no: 62223。
9.所述的粘质沙雷氏菌c10在生产柚苷酶中的应用。
10.进一步地,所述的柚苷酶由α-l-鼠李糖苷酶和β-d-葡萄糖苷酶组成。
11.一种利用所述的粘质沙雷氏菌c10生产柚苷酶的方法,通过分离纯化粘质沙雷氏菌c10的细胞破碎液实现;具体包括如下步骤:(1)将粘质沙雷氏菌c10接种于固体培养基培养,再接种于液体培养基培养,得到
发酵液;(2)离心分离发酵液,弃上清,重悬沉淀,进行超声破碎,得到细胞破碎液;(3)分离纯化细胞破碎液,得到柚苷酶。
12.进一步地,步骤(1)中所述的接种于固体培养基培养的条件为28~32℃、150~200 r/min培养1~3天;优选为30℃、180 r/min培养3天。
13.进一步地,步骤(1)中所述的固体培养基每100 ml含:柚皮苷 0.15~0.25 g、硫酸铵0.05~0.15 g、硫酸镁0.01~0.1 g、磷酸氢二钾0.05~0.15 g、氯化钙0.01~0.03 g、酵母0.02~0.04 g、牛肉膏0.02~0.04 g、琼脂粉 0.5~1.5 g、水余量;优选含:柚皮苷 0.2 g、硫酸铵 0.1 g、硫酸镁 0.05 g、磷酸氢二钾 0.1 g、氯化钙 0.02 g、酵母 0.03 g、牛肉膏 0.03 g,琼脂粉 1 g、水余量。
14.进一步地,步骤(1)中所述的接种于液体培养基培养的条件为28~32℃、150~200 r/min培养1~3天;优选为30℃、180 r/min培养1天。
15.进一步地,步骤(1)中所述的液体培养基每100 ml含:柚皮苷 0.15~0.25 g、硫酸铵0.05~0.15 g、硫酸镁0.01~0.1 g、磷酸氢二钾0.05~0.15 g、氯化钙0.01~0.03 g、酵母0.02~0.04 g、牛肉膏0.02~0.04 g、水余量;优选含:柚皮苷 0.2 g、硫酸铵 0.1 g、硫酸镁 0.05 g、磷酸氢二钾 0.1 g、氯化钙 0.02 g、酵母 0.03 g、牛肉膏 0.03 g、水余量。
16.进一步地,步骤(1)中所述的接种于液体培养基培养的接种量为1~2%。
17.进一步地,步骤(2)中所述的离心的条件为8000~12000 r/min、3~5℃离心8~12 min;优选为10000 r/min、4℃离心10 min。
18.进一步地,步骤(2)中所述的重悬所用的试剂为ph 8.0
±
0.5的pbs缓冲液,用量按沉淀:试剂=1 g : 5~15 ml计,优选为1 g : 10 ml。
19.进一步地,步骤(2)中所述的超声的条件为150~250 w,破碎2 s,停止2 s,时间10 min;优选为200 w,破碎2 s,停止2 s,时间10 min。
20.一种柚苷酶,通过上述方法制备得到。
21.一种具有柚苷酶活性的生物制剂,含有所述的粘质沙雷氏菌c10的菌体或细胞破碎液。
22.进一步地,所述的细胞破碎液通过上述方法的步骤(1)和步骤(2)制备得到。
23.所述的粘质沙雷氏菌c10、柚苷酶或具有柚苷酶活性的生物制剂在柑橘类果汁加工处理和/或黄酮类化合物生物转化中的应用。
24.进一步地,所述的黄酮类化合物包括橙皮苷、柚皮苷及其二氢查尔酮衍生物。
25.进一步地,所述的应用中包括如下步骤:将黄酮类化合物、粘质沙雷氏菌c10的细胞破碎液、柠檬酸缓冲液混合,45~55℃反应25~35 min后,95~100℃灭活8~12 min;优选为50℃反应30 min后,100℃灭活10 min。
26.进一步地,所述的柠檬酸缓冲液为45~55 mmol/l ph6
±
0.2的柠檬酸缓冲液;优选为50 mmol/l ph6的柠檬酸缓冲液。
27.进一步地,所述的黄酮类化合物、粘质沙雷氏菌c10的细胞破碎液、柠檬酸缓冲液的配比为4~6 mg : 1 ml : 1 ml;优选为5 mg : 1 ml : 1 ml。
28.本发明相对于现有技术具有如下的优点及效果:本发明菌株粘质沙雷氏菌c10能快速高效产柚苷酶,该菌株所产柚苷酶催化水解
柚皮苷及其二氢查尔酮等衍生物效率均达90%左右,所产柚苷酶活性及稳定性好。由此说明,粘质沙雷氏菌serratia marcescens c10所产柚苷酶有较好的果汁脱苦效果,能应用于各种不同柑橘类果汁的加工脱苦及风味改良,具有良好的应用前景。
附图说明
29.图1为粘质沙雷氏菌c10的菌落形态图。
30.图2为粘质沙雷氏菌c10显微镜下的细胞形态图。
31.图3为ρnp法标准曲线图。
32.图4为粗酶活性测定结果图。
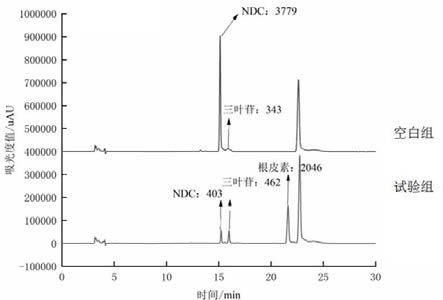
33.图5为粘质沙雷氏菌c10水解柚皮苷二氢查尔酮(ndc)的效果图。
具体实施方式
34.以下实施例是对本发明的进一步说明,但不是对本发明的限制。
35.实施例1:粘质沙雷氏菌serratia marcescens c10的分离和鉴定样品采集自广西桂林市三棱公司代代花种植基地(n25
°
41
′
29
″
;e110
°
35
′
44
″
)的土壤。取10 g发霉的土壤和柚子皮于50 ml的无菌水中,30℃ 180 r/min振荡半小时。然后取500 μl上清液于100 ml富集培养基。30℃ 180 r/min振荡3天。进行梯度稀释到10-5
,取10 μl涂布于平板上,30℃培养3天,用二甘醇碱液喷晒平板表面,菌落出现透明圈进行划线培养3天。最后将单菌落于液体培养基发酵培养3天,30℃ 180 r/min,进行后续甘油管保存,由此得到一株新菌株。培养基配方如下: 液体培养基(g/100ml): 柚皮苷 0.2、硫酸铵 0.1、硫酸镁 0.05、磷酸氢二钾 0.1、氯化钙 0.02、酵母 0.03、牛肉膏 0.03;固体培养基:(g/100ml):柚皮苷 0.2、硫酸铵 0.1、硫酸镁 0.05、磷酸氢二钾 0.1、氯化钙 0.02、酵母 0.03、牛肉膏 0.03、琼脂粉 1;121℃高温高压灭菌15 min。
36.形态特征分析:如图1和图2所示,该菌株在固体培养基上30℃培养3天,其菌落形态特征为:菌落呈米白色、边缘不规则,表面光滑、有光泽、扁平、中心不透明,菌落直径大小1~2.5 mm。细胞呈近球形短杆状;显微镜观察其细胞形态特征为:大小为0.5~1.0μm,周生鞭毛。
37.生理生化特征分析,如表1所示:
16s rdna序列分析:采用细菌基因组提取试剂盒提取菌株的基因组dna,用细菌16s rrna基因通用引物27f/1492r(27f:5
’‑
agagtttgatcatggctcag-3’( seq id no.2)、1492r:5
’‑ꢀ
tacggttaccttgttacgactt
ꢀ‑3’
( seq id no.3))扩增得到pcr产物并测序,其序列如seq id no.1所示,测序结果经blast比对分析,该菌株16s rdna 区与ncbi 数据库比对的结果中,与serratia marcescens 的相似性最高,匹配度达到99.86%。
38.基于以上分析结果,初步判断该菌株为粘质沙雷氏菌serratia marcescens,将该菌株命名为粘质沙雷氏菌(serratia marcescens)c10,并于2022年1月19日保藏于广东省广州市越秀区先烈中路100号大院59号楼的广东省微生物菌种保藏中心(gdmcc),保藏编号为: gdmcc no: 62223。
39.实施例2:粘质沙雷氏菌serratia marcescens c10产柚苷酶的确认及酶活力测定1. 粗酶液的制备取保存好的甘油菌接种于固体培养基上,30℃培养3天,再接种于液体培养基中,30℃、180r/min培养3天。取发酵液于10000 r/min、4℃离心10 min,弃上清液,加入10 ml 50 mm ph 8.0的pbs缓冲液,10000 r/min,4℃离心5 min,重复操作两次,弃上清液,最后按照1:10(g:ml)加入pbs缓冲液进行超声破碎。超声破碎条件:200 w,破碎2 s,停止2 s,时间10 min。
40.固体培养基(g/100 ml):柚皮苷 0.2、硫酸铵 0.1、硫酸镁 0.05、磷酸氢二钾 0.1、氯化钙 0.02、酵母 0.03、牛肉膏 0.03、琼脂粉 1;液体培养基(g/100 ml):柚皮苷 0.2、硫酸铵 0.1、硫酸镁 0.05、磷酸氢二钾 0.1、氯化钙 0.02、酵母 0.03、牛肉膏 0.03。
41.2.粗酶活的测定2.1 对硝基苯酚法(ρnp法)100 μl 1mm ρnpr/ρnpg+300 μl 50 mm ph 6柠檬酸缓冲溶液保温2 min后+100 μl粗酶液,50℃反应5min,加入500 μl 1m na2co3终止反应,在405 nm处测定吸光度值。
42.标准曲线如图3所示,酶活测定结果如图4所示,其中鼠李糖苷酶酶活的测定结果
为0.0068 u/ml,葡萄糖苷酶酶活的测定结果为0.117 u/ml。
43.实施例3:粘质沙雷氏菌serratia marcescensc10所产柚苷酶催化水解柚皮苷二氢查尔酮分析取实施例2制备的发酵液于10000 r/min,4℃离心10 min,弃上清液,加入10 ml 50 mm ph 8.0的pbs缓冲液,10000 r/min,4℃离心5 min,重复操作两次,弃上清液,最后按照1:10(g:ml)加入pbs缓冲液进行超声破碎。超声破碎条件: 200 w,破碎2 s,停止2 s,时间10 min。取2ml 0.25mg/ml柚皮苷二氢查尔酮+1ml50 mm ph6 柠檬酸缓冲液+1ml粗酶液,50℃水浴反应30min后,100℃水浴灭活10min。
44.高效液相检测hplc条件: 色谱柱为: wondassil c18分析柱(250 mm
ꢀ×
4.6 mm,5 μm)流动相a: 0.1%甲酸水,流动相b: 乙腈,速度为0.9ml/min,紫外检测波长: 283nm,柱温: 35℃,进样体积: 20 μl,洗脱程序: 0~1min 5%a;1~5min,75%a;5~15min60%a;15~25min50%a;25~30min85%a,速度为1.00 ml/min。计算转化率: 转化率=反应前柚皮苷二氢查尔酮含量(mg)/反应后柚皮苷二氢查尔酮总量(mg)
×
100%。结果如图5所示。
45.结果显示,粘质沙雷氏菌c10所产柚苷酶催化水解柚皮苷二氢查尔酮的效率高达89.3%。
46.实施例4:粘质沙雷氏菌serratia marcescens c10产柚苷酶条件优化3.1 培养条件的优化细菌的生长代谢主要包含三个阶段,第一个阶段是细菌快速生长繁殖,第二个阶段是细菌近乎停止生长繁殖转而进行目的蛋白表达的阶段,最后一个阶段则是由于环境的恶化,细菌菌体开始自溶裂解的阶段。我们筛选的菌株表达目的酶蛋白的最主要的时间是在细菌生长的第二阶段,所以我们对第二阶段的培养条件进行优化,希望得到最佳的发酵产酶条件,以获得比例更高的酶蛋白。分别对接种量、发酵温度、发酵时间等因素对目的蛋白表达形式的影响进行了探讨。
47.3.1.1接种量的优化将种子液按照0.5、1、1.5、2%接种于表达培养基中,180 rpm,30℃,过夜培养(24 h 左右),培养结束后4℃离心收集菌体,用预冷的pbs悬浮菌体,经超声波破碎后,在4℃和12000 rpm条件下离心15 min,收集上清液,沉淀用pbs重悬。分别对可溶性目的蛋白进行测定含量。
48.3.1.2 发酵温度的优化将1%种子液接种于表达培养基中,180 rpm,分别在20、25、30、35、40℃温度下,过夜培养(24 h 左右),培养结束后4℃离心收集菌体,用预冷的pbs悬浮菌体,经超声波破碎后,在4℃和12000 rpm条件下离心15 min,收集上清液,沉淀用pbs重悬。分别对可溶性目的蛋白进行测定含量。
49.3.1.3 发酵时间的优化将1%种子液接种于表达培养基中,180 rpm,30℃,分别培养6、8、10、12、14、16、18、20、22、24、26、28、30 h,培养结束后4℃离心收集菌体,用预冷的pbs悬浮菌体,经超声波破碎后,在4℃和12000 rpm条件下离心15 min,收集上清液,沉淀用pbs重悬。分别对可溶性目的蛋白进行测定含量。
50.以上实验结果表明,接种量为1%;发酵时间为24h;发酵温度为30℃时发酵产酶效
果最佳。
51.上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1