一种肺气血屏障损伤模型、其建立方法及其应用与流程
1.本发明属于医学用模型技术领域,具体涉及一种肺气血屏障损伤模型、其建立方法及其应用。
背景技术:
2.急性胰腺炎肺损伤(acute pancreatitis-associated lung injury,apali)是重症急性胰腺炎最常见且最严重的早期并发症,其发病机制复杂,治疗棘手,目前尚无有效治疗手段。apali发生及发展的最重要原因之一是失控的全身炎症反应诱发了肺气血屏障的破坏,而如何重建肺气血屏障是当前亟待解决的难题。
3.肺泡上皮细胞(alveolar epithelial cells,aec)及肺微血管内皮细胞(pulmonary microvascular endothelial cells,pmvec)的结构和功能是肺气血屏障功能的重要组成部分。前期研究及既往文献报道均表明了急性胰腺炎肺损伤发生时肺泡上皮细胞和肺微血管内皮细胞的完整性遭到了严重的破坏,因此现有技术多采用2d或3d细胞培养方式,通过观察肺泡上皮细胞和/或肺微血管内皮细胞变化评价急性胰腺炎肺损伤修复药物,而由于细胞实验不能重现肺气血屏障在损伤及修复过程中的基质结构变化,无法真实、全面的反应肺气血屏障在损伤及修复过程中状态,因此不适合作为探究肺气血屏障损伤或修复的具体机制或研究药物对肺气血屏障的影响的实验模型。
技术实现要素:
4.本发明的目的是提供一种肺气血屏障损伤模型、其建立方法及应用。
5.本发明的另一目的是提供一种用于修复肺气血屏障损伤的药物的评价方法。
6.本发明的再一目的是提供一种用于建立肺气血屏障损伤模型的培养模具。
7.为解决上述技术问题,本发明采用如下技术方案:
8.一种肺气血屏障损伤模型的建立方法,将精准肺切片置于含有脂多糖(lps)的培养基的培养模具中培养建立得所述的肺气血屏障损伤模型。
9.精准肺切片(precision-cut lung slices,pcls)相比单细胞培养或双细胞共培养能够保存相对完整且有活性的肺泡和毛细血管结构,拥有较完整的细胞和细胞间以及细胞与基质间的紧密连接结构。使用精准肺切片构建接近生理条件下肺气血屏障损伤的模型,可以重现肺气血屏障损伤及修复过程,能够更好地在组织层面上、蛋白水平上、基因水平上以及超微结构上反应肺气血屏障在损伤或修复过程及机制。
10.优选地,向所述的培养模具中连续地通入所述的含有脂多糖的培养基并使所述的含有脂多糖的培养基连续地从所述的培养模具中流出,以使所述的培养模具中所述的含有脂多糖的培养基的量保持恒定。采用连续培养方式能够有效缩短培养周期。
11.优选地,所述的脂多糖的终浓度为80~120ng/ml。例如80ng/ml、85ng/ml、90ng/ml、95ng/ml、100ng/ml、105ng/ml、110ng/ml、115ng/ml、120ng/ml。
12.优选地,所述的培养模具中的培养环境为5%co2,35~38℃,同时所述的培养环境
还需保持无菌条件,保证精准肺切片中细胞的活性。
13.优选地,所述的精准肺切片在所述的含有脂多糖的培养基中的培养时间为18~48h。例如18h、19h、20h、21h、22h、23h、24h、25h、26h、27h、28h、29h、30h、31h、32h、33h、34h、35h、36h、37h、38h、39h、40h、41h、42h、43h、44h、45h、46h、47h、48h。
14.培养过程中,可通过实时观察精准肺切片中细胞形态变化或检测培养基中的炎性因子以确认所述的肺气血屏障损伤模型构建成功。例如可通过elisa法检测培养基中主要炎性因子il6、tnf-α或il-1β中的一种或多种以确认肺损伤模型构建成功。
15.优选地,所述的精准肺切片的厚度为100~300μm。例如100μm、105μm、110μm、115μm、120μm、125μm、130μm。
16.优选地,所述的培养基为dmem培养基,所述的培养基中还含有50u/ml青霉素、50u/ml链霉素和10%胎牛血清。
17.优选地,所述的培养模具包括培养室和能够平铺固定所述的精准肺切片并使之浸没在培养基中的限位部件。为了保证建立的肺气血屏障损伤模型的效果,需要将精准肺切片在连续流动的培养基中培养,由于精准肺切片为薄片,需要保证其始终浸没在培养基中且保持平铺固定的状态,同时也便于实时观察其细胞形态以及超微结构变化。
18.根据一些实施方式,所述的培养模具包括具有能够容纳所述精准肺切片的容纳腔的培养室,所述的培养室的顶部设有能够打开和关闭的密封盖,所述的培养室的侧壁设有用于向所述容纳腔输入培养基的液体流入通道、用于将所述容纳腔内的培养基输出的液体流出通道、用于向所述容纳腔通入气体的气体流入通道和用于将所述容纳腔内的气体输出的气体流出通道。
19.具体地,优选所述的液体流入通道与所述的侧壁的连通处和所述的液体流出通道与所述的侧壁的连通处相对所述的培养室的轴心线对称设置;优选所述的气体流入通道与所述的侧壁的连通处和所述的气体流出通道与所述的侧壁的连通处相对所述的培养室的轴心线对称设置。
20.具体地,所述的液体流入通道与所述的侧壁的连通处和所述的液体流出通道与所述的侧壁的连通处位于所述的气体流入通道与所述的侧壁的连通处和所述的气体流出通道与所述的侧壁的连通处的下方。
21.具体地,所述的培养室内的培养基的液面高度小于所述的气体流入通道与所述的侧壁的连通处到所述的培养室的底部的距离;所述的培养室内的培养基的液面高度大于所述的液体流入通道与所述的侧壁的连通处到所述的培养室的底部的距离。
22.具体地,优选所述的液体流入通道与所述的侧壁的连通处和所述的液体流出通道与所述的侧壁的连通处距离所述的培养室的底部一段距离,能够尽量避免培养基流入、流出对精准肺切片的扰动。
23.具体地,所述的气体流出通道可以连接气体检测装置以及时反应培养室内的气体环境变化。
24.具体地,从所述的液体流出通道中收集的培养基用于elisa实验检测炎性因子。
25.进一步优选地,所述的培养模具还包括设置在所述容纳腔内的限位部件,所述的限位部件的底部设有多孔膜,所述的多孔膜与所述精准肺切片相接触且所述限位部件使所述精准肺切片平铺固定在所述多孔膜和所述容纳腔的底面之间。多孔膜能够阻碍细胞通过
而允许液体成分(培养基)自由流通。
26.再进一步优选地,所述限位部件与所述培养室相可拆卸地连接。
27.根据一些实施方式,所述的限位部件可拆卸地安装在所述的培养室的内部。
28.根据一些实施方式,所述的多孔膜和所述的容纳腔的底部之间存在400~600μm的间隙。
29.再进一步优选地,所述的限位部件包括侧壁,所述的侧壁的底部与所述的多孔膜相固定连接,所述的侧壁上设有开口,所述的侧壁的上端部上设有挂耳,所述容纳腔的侧壁上设有凸起,所述凸起与所述挂耳相配合以支撑所述限位部件。所述的侧壁上的开口不仅可以让培养基进入侧壁内,透过多孔膜保持精准肺切片浸没在培养基中,同时还有利于气体(5%co2的洁净空气)流动,保证培养效果。通过挂耳和凸起的配合,凸起提供限位部件向上的支持力,防止多孔膜和培养室底部对精准肺切片挤压而影响其细胞生长。
30.具体地,优选所述的容纳腔的底面为平面,其底面积为精准肺切片的2~3倍。
31.根据一些实施方式,所述容纳腔内培养基的液面高于所述的开口的底部且低于所述的侧壁的顶部,保持限位部件的侧壁内外的液面高度一致,限位部件的侧壁的顶部在培养基液面至上,方便其取出。
32.根据一些实施方式,所述的侧壁为透光透气材质。
33.根据一些实施方式,所述的侧壁的材质为聚二甲基硅氧烷。
34.优选地,所述的多孔膜的孔径小于等于3μm。
35.进一步优选地,所述的多孔膜的孔径为0.3~3μm,例如0.4μm、1μm、3μm。
36.根据一些实施方式,所述的精准肺切片静态附着在所述的多孔膜的表面形成复合体,所述的复合体浸没在培养基中。
37.根据一些实施方式,所述的培养基能够穿过所述的多孔膜,所述的精准肺切片的细胞不能穿过所述的多孔膜。
38.根据一些实施方式,所述的多孔膜为透明材质。
39.根据一些实施方式,所述的多孔膜为聚碳酸酯膜。
40.优选地,所述的培养室为透光不透气材质。
41.优选地,利用3d打印技术构建培养室。
42.进一步优选地,所述的培养模具还包括与所述的液体流入通道相连通的用于提供培养基进入所述的培养室中的微流泵。
43.进一步优选地,所述的培养模具还包括与所述的气体流入通道相连通的用于提供气体进入所述的培养室中的气泵。
44.具体地,所述的肺气血屏障损伤模型的建立方法包括以下步骤:
45.1)制备精准肺切片;
46.2)将精准配切片平铺置于培养室中,使用常规培养基培养;
47.3)将常规培养基更换为含有脂多糖的培养基继续培养。
48.进一步地,步骤2)中,将限位部件安装在培养室内,多孔膜和精准配切片接触,精准肺切片静态附着在所述的多孔膜的表面形成复合体,所述的复合体浸没在常规培养基中。
49.再进一步地,步骤2)中所述的常规培养基为dmem培养基。
50.进一步地,步骤1)包括:
51.(1)琼脂糖膨胀肺组织并取材;
52.(2)振动切片机将肺组织切割成精准肺切片;
53.(3)使用常规培养基培养精准肺切片。
54.同样的,步骤(3)中的常规培养基为dmem培养基。
55.根据一些实施方式中,所述的限位部件为transwell小室。
56.本发明还提供采用所述的建立方法建立的肺气血屏障损伤模型。
57.本发明还提供所述的肺气血屏障损伤修复模型在开发或筛选用于修复肺气血屏障损伤的药物中的应用。
58.本发明还提供一种用于修复肺气血屏障损伤的药物的评价方法,将所述的肺气血屏障损伤模型置于含有修复肺气血屏障损伤的药物的培养基中进行培养,检测所述的药物对肺气血屏障损伤的修复作用。
59.优选地,所述的培养的时间为18~30h。例如18h、19h、20h、21h、22h、23h、24h、25h、26h、27h、28h、29h、30h。
60.优选地,所述的检测包括观察所述的精准肺切片的细胞形态变化,和/或检测肺气血屏障损伤的相关蛋白标记物水平,和/或检测所述的精准肺切片的超微结构。
61.例如,使用延时成像技术实时动态观察脂多糖对肺气血屏障损伤及药物或活性成分对其的修复作用,或使用western blot(wb)、免疫荧光染色、qrt-pcr在蛋白水平和rna水平检测药物或活性成分对肺气血屏障的修复作用,或使用免疫组化检测紧密连接相关蛋白水平(zo-1或claudin-18)、透射电镜检测紧密连接的超微结构的变化。
62.根据一些实施方式,所述的用于肺气血屏障损伤修复的药物的活性成分为间充质干细胞外泌体。
63.优选地,所述的间充质干细胞外泌体的浓度为40~60ng/ml,进一步优选为45~55ng/ml。
64.具体地,所述的评价方法包括以下步骤:
65.1、制备精准肺切片;
66.2、将精准配切片平铺置于培养室中,使用常规培养基培养;
67.3、将常规培养基更换为含有脂多糖的培养基继续培养,通过elisa检测炎性因子il6、tnf-α或il-1β确认肺损伤模型构建成功;
68.4、将含有脂多糖的培养基更换为含有待评价的药物的培养基继续培养,检测所述的药物对肺气血屏障损伤的修复作用。
69.本发明还提供一种培养模具,包括一个或多个所述的肺气血屏障损伤模型的建立方法中的所述的培养模具。
70.具体地,多个培养模具具有一个共用的底座,每个培养模具的底部与底座固定连接。
71.本发明与现有技术相比具有如下优势:
72.本发明基于精准肺切片建立肺气血屏障损伤模型,消除了使用动物模型的种属差异以及细胞实验和2d、3d培养不能重现肺气血屏障基质结构的不足等问题,通过其不仅能够实时动态观察肺气血屏障损伤及修复过程,还可将其用于探究肺气血屏障损伤后药物修
复机制、用于开发或筛选用于修复肺气血屏障损伤的药物,并可为用于修复肺气血屏障损伤的药物提供一种更准确的评价方法。
附图说明
73.图1为精准肺切片制作示意图;
74.图2为一种实施方式下的培养模具的部分立体结构示意图;
75.图3为一种实施方式下的培养模具的部分俯视结构示意图;
76.图4为一种实施方式下的培养模具组装后的部分结构示意图;
77.图5为一种实施方式下的培养模具在使用状态下的部分结构示意图;
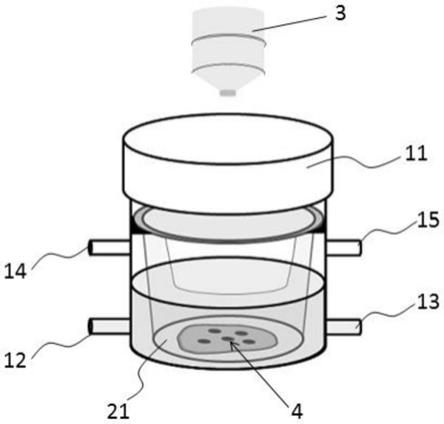
78.图6为骨髓间充质干细胞的鉴定结果图,a:显微镜下bmscs的形态特征。b~f:流式细胞术bmscs的免疫表型分析,cd29,cd44和cd90呈阳性,cd34和cd45呈阴性;
79.图7为骨髓间充质干细胞外泌体的鉴定结果图,a:透射电镜法鉴定提取的bmsc-exos的形态、大小;b:bmsc-exos平均粒径分析结果。c:western blot技术鉴定bmsc-exos的特异性分子(cd 9,cd 63);
80.图8为使用纳米颗粒分析仪qnano(izon)评估测量骨髓间充质干细胞外泌体(bmsc-exos)的大小和粒子数目结果图;
81.图9为原子力显微镜鉴定骨髓间充质干细胞外泌体(bmsc-exos)图片及粒径分布结果图;
82.图10为wb检测肺气血屏障损伤的相关蛋白标记物的结果图;
83.图11为精准肺切片he染色及电镜观察肺气血屏障超微结构图,
84.其中,1、培养室本体;11、密封盖;12、液体流入通道;13、液体流出通道;14、气体流入通道;15、气体流出通道;16、凸起;2、transwell小室;21、多孔膜;22、开口;23、挂耳;3、实时成像显微系统;4、精准肺切片。
具体实施方式
85.下面结合实施例对本发明作进一步描述。但本发明并不限于以下实施例。实施例中采用的实施条件可以根据具体使用的不同要求做进一步调整,未注明的实施条件为本行业中的常规条件。本发明各个实施方式中所涉及到的技术特征只要彼此之间未构成冲突就可以相互组合。
86.由于现有细胞实验无法重现肺气血屏障基质结构,无法重现肺气血屏障损伤及修复过程,能够更好地在组织层面上、蛋白水平上、基因水平上以及超微结构上反应肺气血屏障在损伤或修复过程及机制,发明人首次想到并提出了一种新的肺气血屏障损伤模型的建立方法以及用于修复肺气血屏障损伤的药物的评价方法,同时还设计了一种用于建立肺气血屏障损伤模型的培养模具。
87.具体地,所述的肺气血屏障损伤模型的建立方法为将精准肺切片置于含有脂多糖的培养基的培养模具中培养即可。
88.根据实施例,所述的培养模具包括培养室和能够平铺固定所述的精准肺切片并使之浸没在培养基中的限位部件。
89.具体地,所述的培养室的底部为平面,所述的培养室的顶部设有能够打开和关闭
的密封盖11,所述的培养室的侧壁设有用于输入培养基的液体流入通道12、用于培养基输出的液体流出通道13、用于气体通入的气体流入通道14和用于气体输出的气体流出通道15。所述的培养室为透光不透气的材质。
90.所述的限位部件可拆卸地安装在所述的培养室的内部,所述的限位部件设有多孔膜21,所述的多孔膜21能够将所述的精准肺切片4平铺固定在所述的培养室的底部并使所述的精准肺切片4浸没在培养基中。所述的限位部件还包括侧壁,所述的侧壁的底部与所述的多孔膜21固定连接,所述的侧壁上设有开口22,所述的侧壁上设有挂耳23,所述的培养室的内部设有用于搭接所述的挂耳23的凸起16。其中,所述的侧壁为透光透气材质,所述的多孔膜21为透明聚碳酸酯膜,所述的多孔膜21的孔径小于等于3μm,可直接使用现有的transwell小室2作为限位部件,transwell小室2的挂耳23(transwell小室2顶部边缘)可以搭接在培养室内的凸起16上。
91.所述的培养模具还包括与所述的液体流入通道12相连通的微流泵。所述的培养模具还包括与所述的气体流入通道14相连通的气泵。
92.优选地,可将多个所述的培养模具组合使用。
93.根据实施例,所述的肺气血屏障损伤模型的建立方法为:
94.1、制备精准肺切片;
95.2、将精准肺切片4平铺在培养室的底部,加入dmem培养基,放入transwell小室2,transwell小室2底部的多孔膜21与精准肺切片4接触,精准肺切片4附着到多孔膜21上,盖上培养室的密封盖11,静置一段时间,使精准肺切片4稳定地附着上多孔膜21上,然后连续通入dmem培养基,同时连续输出培养基,保持培养基的液面稳定,培养基的液面高于transwell小室2侧壁上的开口22的底部,低于transwell小室2的挂耳23(transwell小室2顶部边缘),同时连续通入含有5%co2的洁净空气,于37℃下培养构建精准肺切片4培养模型;
96.3、向精准肺切片4培养模型中连续通入含有脂多糖的dmem培养基,保持培养基液面恒定,于5%co2、35~38℃条件下,在含有脂多糖的dmem培养基中培养18~48小时,收集流出的培养液,用于检测其中主要炎性因子il-1β、tnf-α、il-6,确认肺气血屏障损伤模型构建成功。
97.根据实施例,用于修复肺气血屏障损伤的药物的评价方法为,向上述构建成功的肺气血屏障损伤模型中连续通入含有待评价的药物的dmem培养基,保持培养基液面恒定,于5%co2、35~38℃条件下,在含有待评价的药物的dmem培养基中继续培养18~30小时,检测所述的药物对肺气血屏障损伤的修复作用。
98.根据实施例,dmem培养基中还含有30~60u/ml青霉素、30~60u/ml链霉素和5~20%胎牛血清
99.根据实施例,精准肺切片4的厚度为100~300μm。
100.根据实施例,检测包括观察所述的精准肺切片4的细胞形态变化,检测肺气血屏障损伤的相关蛋白标记物水平以及检测精准肺切片4的超微结构变化。
101.下面结合具体实施例进一步阐述本发明的技术方案和技术效果。本发明所涉及的试剂均为市场购买。
102.以下实施例中,使用骨髓间充质干细胞外泌体修复肺气血屏障损伤模型,在其他
实施例中,可将骨髓间充质干细胞外泌体换成其他药物或其活性成分。
103.以下实施例中,所述的培养均在无菌条件下进行。
104.实施例1
105.精准肺切片4(pcls)制作,如图1所示,具体为:
106.(1)sd大鼠麻醉后,开腹剪断下腔静脉使肺部血液排出,暴露气管并在软骨带前侧做一个小切口,使小鼠灌胃针能通过。1ml注射器吸取37℃琼脂糖缓慢注入肺部,凝固后切除琼脂糖冲膨后的肺部,于冷pbs中保存。
107.(2)将琼脂糖冲膨后的鼠肺气管侧朝下,用胶水固定在金属注射器的柱塞上,修剪超出柱塞边缘的多余组织;向下移动柱塞,使金属注射器的两侧向上移动形成一个底部粘有肺的井,深度不超过几厘米。37℃琼脂糖倒入井中,冷却凝固后将注射器装入自动切片机,按以下设置切片肺组织:厚度:200μm,频率:100hz,刀的振幅:1.2mm,刀相对组织的角度为10
°
~15
°
,刀片的前进速度为3~12μm/s。
108.(3)精准肺切片4转移至含有50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基中,置于5%co2、饱和湿度37℃培养箱培养。
109.实施例2
110.肺气血屏障损伤模型的建立,如图2~5所示,具体为:
111.(1)培养模具包括4个可独自使用或同时使用的培养单元,每个培养单元分别包括培养室、限位部件、微流泵和气泵。
112.(2)培养室本体1呈圆柱形,底部为平面,底部内径约为40mm,培养室的高度约为20mm,培养室的顶部设有能够打开和关闭的密封盖11,培养室的侧壁设有用于输入培养基的液体流入通道12、用于培养基输出的液体流出通道13、用于气体通入的气体流入通道14和用于气体输出的气体流出通道15,液体流入通道12和液体流出通道13相对培养室的轴心线对称设置,气体流入通道14和气体流出通道15相对培养室的轴心线对称设置,液体流入通道12与微流泵相连通,液体流出通道13与废液池相连通,气体流入通道14与气泵相连通,气体流出通道15连接气体检测装置,培养室的材质为透光不透气的材质,培养室的内壁固设有凸起16,凸起16自培养室的内壁向培养室的轴线方向延伸约2.5mm。当然,在其他实施例中,可根据需要设计培养室的形状和规格等。
113.限位部件可拆卸地安装在培养室的内部,其包括侧壁和与侧壁的底部相固定连接的多孔膜21,其侧壁上设有开口22,其侧壁的顶部设有能够搭接在培养室的内壁上的凸起16上的挂耳23,该聚合物的原料组分为质量比为10:1的pdms单体与引发剂组成。在本实施例中,使用孔径为0.4μm的transwell小室2作为限位部件,transwell小室2的侧壁的材质为由质量比为10:1的pdms单体与引发剂制备的透光透气的pdms聚合物,选用的transwell小室2顶部内径约35mm。使用时,将transwell小室2的上边缘形成的挂耳23搭接在培养室的内壁上的凸起16上即可,此时transwell小室2在培养室内的位置被固定,不会受流动的培养基的影响,transwell小室2的底部距离培养室的底部约500μm,有利于肺切片完全浸润在培养基中。
114.(2)将培养模具灭菌处理,将精准肺切片4随培养基转移至培养室中,使精准肺切片4平铺在培养室的底部,放入transwell小室2,transwell小室2底部的多孔膜21与精准肺切片4接触,静置4h,精准肺切片4静态附着到transwell小室2底部的多孔膜21上(此过程中
可将微流泵、液体流入通道12和液体流出通道13关闭,气泵、气体流入通道14和气体流出通道15打开),然后打开微流泵、液体流入通道12和液体流出通道13,连续通入含有50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基,维持培养基的液面稳定(液面高于transwell小室2侧壁上的开口22,低于transwell小室2挂耳23),精准肺切片4稳定的附着在多孔膜21上,由此构建了精准肺切片4培养模型。本实施例中,transwell小室2的多孔膜21的孔径为0.4μm。
115.(2)通过微流泵和液体流入通道12向培养室中连续输入含有脂多糖(终浓度为100ng/ml)的培养基(含有50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基)刺激精准肺切片4,分别于脂多糖处理24h、48h时收集自液体流出通道13排出培养基进行测试。
116.(3)elisa法检测收集的培养基中主要炎性因子il-1β、tnf-α、il-6以确认肺气血屏障损伤模型构建成功。
117.实施例3
118.采用骨髓间充质干细胞外泌体(bone marrow mesenchymal stem cell
–
derived exosomes,bmsc-exos)修复肺气血屏障损伤模型:
119.(1)大鼠bmscs体外分离、培养、增殖及鉴定。
120.sd大鼠脱臼处死,75%酒精浸泡10min无菌条件下取双侧股骨、胫骨,pbs液反复冲洗,用无血清低糖dmem培养基冲洗骨髓腔,充分吹打均匀后,制成单细胞悬液,1500rpm离心5min,弃去上清,用pbs液重悬细胞,轻轻叠加到密度为1.073g/ml percoll分离液上部,2500rpm离心20min,吸取界面层的单个核细胞,pbs液稀释,1500rpm离心洗涤5min,共2次。用含10%胎牛血清的低糖dmem培养基重悬细胞,以1
×
106/ml的密度接种于培养瓶,置于5%co2、饱和湿度37℃培养箱培养。72h后首次换液,去掉未贴壁细胞,以后每3-4d换液一次。倒置显微镜每日观察细胞形态变化及生长情况,待贴壁细胞生长融合达80%~90%时,0.25%胰蛋白酶与0.02%edta(1:1)消化,按1:2比例传代培养,用流式细胞仪检测第3代bmscs,cd29、cd44、cd90同时阳性,cd34、cd45同时阴性(图6)。使用生长良好的第3代细胞进行后续实验。
121.(2)bmsc-exos的制备与鉴定。
122.bmsc-exos的制备:取上述生长良好的第3代bmscs接种于6个10cm培养皿中,用含10%无bmsc-exos的胎牛血清(将胎牛血清经超高速离心机120,000
×
g离心7h去除干扰,获得无bmsc-exos的血清)deme培养基继续培养,待贴壁细胞生长融合达90%时,bmscs数量约为2
×
106个/每皿,收集bmscs条件培养液,并于2000
×
g条件下离心30min以去除细胞及细胞碎片。将上清液转移至无菌管中,加入0.5倍体积的沉淀液(total exosome isolation regent,invitrogen),反复颠倒5次使其混匀。4℃过夜。10,000
×
g离心1h,弃去上清液,40μl pbs缓冲液重悬bmsc-exos,每10μl外泌体来源于3
×
106个bmscs,约24μg外泌体蛋白,-20℃保存、备用。
123.bmsc-exos的鉴定:
124.1)透射电镜:将bmsc-exos用pbs缓冲液稀释成5mg/ml的浓度,置于冰上保存以保证其完整性;在石蜡膜上滴一滴重悬后的pbs液,然后在每一滴顶端放置一个聚乙烯醇缩甲醛碳覆盖的镍网格(formvar carbon coated nickel grid),时间为30~60min,确保液体接触面为网格的碳涂层侧;滴3滴pbs液(30μl/滴)在石蜡膜上,冲洗网格后再放置到液滴
上,二者之间放入一张吸纸吸干液体,在白炽灯下烤干,在碳膜铜网上滴1滴1%磷钨酸,置于红外灯下5min至烘干,透射电镜下观察,结果见图7。
125.2)纳米颗粒分析仪qnano(izon)进行分析:取1μl标准颗粒,加专用buffer 1ml稀释1000倍;取5μl bmsc-exos,加pbs 45μl以稀释10倍,0.22μm滤器过滤,取30μl注入纳米颗粒分析仪样品室内,观测粒子运动的视频图像,经纳米颗粒示踪分析软件进行分析,得到粒子的大小和浓度,结果见图8。
126.3)原子力显微镜:使用原子力显微镜观察bmsc-exos,并用nanoscope analysis软件对获得的图像进行处理,结果见图9。
127.(3)骨髓间充质干细胞外泌体处理精准肺切片4,检测对肺气血屏障的修复作用。
128.1)将实验分为control组,lps组和lps+bmsc-exos组。
129.control组,采用上述精准肺切片4培养模型,始终通入含有50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基;
130.lps组,在上述精准肺切片4培养模型中,停止输入含有50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基,改为输入含有50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基继续培养24h;
131.lps+bmsc-exos组,在上述建立的肺气血屏障损伤模型中,停止输入含有脂多糖的培养基(含有100ng/ml脂多糖、50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基),改为输入含有骨髓间充质干细胞外泌体的培养基(含有50ng/ml骨髓间充质干细胞外泌体、50u/ml青霉素-链霉素和10%胎牛血清的dmem培养基)继续培养24h。
132.采用wb检测control组、lps组、lps+骨髓间充质干细胞外泌体组(lps+bmsc-exos组)三组最终流出的培养基中肺气血屏障损伤的相关蛋白标记物含量,结果见图10,图10结果显示:与control组相比,lps刺激后,二型肺泡上皮细胞标记物(spc),一型肺泡上皮细胞标记物(aqp5),细胞周期蛋白(cyclind1)显著降低;与lps组相比,lps+bmsc-exos处理后,spc,aqp5,cyclind1表达显著增加。
133.采用精准肺切片he染色及电镜观察肺气血屏障超微结构,结果见图11,图11显示:control组肺组织完整,未见组织充血及炎症细胞浸润;lps组肺泡及间质明显水肿,肺泡间隔增宽,局灶性肺不张,大量炎症细胞浸润,血管扩张伴充血出血;lps+bmsc-exos组肺组织充血水肿情况明显好转,炎性细胞浸润明显减轻。综上,电镜结果显示,lps+bmsc-exos有效的恢复了板层小体的结构。
134.以上对本发明做了详尽的描述,其目的在于让熟悉此领域技术的人士能够了解本发明的内容并加以实施,并不能以此限制本发明的保护范围,凡根据本发明的精神实质所作的等效变化或修饰,都应涵盖在本发明的保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1